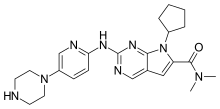
Ribociclib
 | |
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Kisqali |
| Otros nombres | Lee 011 |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a617008 |
| Datos de licencia |
|
| Vías de administración | Por la boca |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Biodisponibilidad | Desconocido |
| Unión de proteínas | ~70% |
| Metabolismo | Hígado ( CYP3A4 ) |
| Vida media de eliminación | 32,0 (29,7–54,7) horas |
| Excreción | 69% heces, 23% orina |
| Identificadores | |
| |
| Número CAS |
|
| Identificador de centro de PubChem |
|
| Banco de medicamentos |
|
| Araña química |
|
| UNIVERSIDAD |
|
| BARRIL |
|
| Química biológica |
|
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.234.566 |
| Datos químicos y físicos | |
| Fórmula | C23H30N8O |
| Masa molar | 434,548 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| |
Ribociclib , comercializado bajo la marca Kisqali , es un medicamento utilizado para el tratamiento de ciertos tipos de cáncer de mama . [4] Ribociclib es un inhibidor de la quinasa . [4] Fue desarrollado por Novartis y Astex Pharmaceuticals . [6]
Los efectos secundarios más comunes incluyen infecciones, niveles bajos de glóbulos blancos, dolor de cabeza, tos, náuseas, vómitos, diarrea, estreñimiento, cansancio, pérdida de cabello y sarpullido. [5]
Ribociclib fue aprobado para uso médico en los Estados Unidos en marzo de 2017, [7] [8] en la Unión Europea en agosto de 2017, [5] [9] y en el Reino Unido en febrero de 2021. [10] [11]
Usos médicos
En los Estados Unidos, está indicado para el tratamiento de adultos con cáncer de mama avanzado o metastásico con receptor hormonal (HR) positivo y receptor 2 del factor de crecimiento epidérmico humano (HER2) negativo, en combinación con un inhibidor de la aromatasa como terapia endocrina inicial; o fulvestrant como terapia endocrina inicial o después de la progresión de la enfermedad con terapia endocrina en mujeres posmenopáusicas o en hombres. [4] [7]
En la Unión Europea, está indicado para el tratamiento de mujeres con cáncer de mama localmente avanzado o metastásico, positivo para el receptor hormonal (HR), negativo para el receptor 2 del factor de crecimiento epidérmico humano (HER2), en combinación con un inhibidor de la aromatasa o fulvestrant como terapia endocrina inicial, o en mujeres que han recibido terapia endocrina previa. [5] En mujeres pre o perimenopáusicas, la terapia endocrina debe combinarse con un agonista de la hormona liberadora de hormona luteinizante (LHRH). [5]
En septiembre de 2024, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) aprobó el ribociclib con un inhibidor de la aromatasa para el tratamiento adyuvante de adultos con cáncer de mama en estadio II y III en etapa temprana con receptor hormonal (HR) positivo y receptor del factor de crecimiento epidérmico humano 2 (HER2) negativo con alto riesgo de recurrencia. [12] Además, la FDA también aprobó el paquete combinado de ribociclib y letrozol para la misma indicación. [12]
Efectos secundarios
Los efectos secundarios más frecuentes en los estudios fueron la disminución del recuento de células sanguíneas , principalmente neutropenia (en el 75% de los pacientes, en comparación con el 5% con placebo), pero también anemia (18% frente al 5%). Los trastornos gastrointestinales también fueron comunes, por ejemplo, náuseas (52% frente al 29%) y diarrea (35% frente al 22%), al igual que la alopecia (33% frente al 16%). El fármaco también aumenta el intervalo QT y las enzimas hepáticas ( alanina transaminasa , aspartato transaminasa ). [4] [9]
Los efectos secundarios más comunes incluyen infecciones, niveles bajos de glóbulos blancos, dolor de cabeza, tos, náuseas, vómitos, diarrea, estreñimiento, cansancio, pérdida de cabello y sarpullido. [5] Los efectos secundarios graves más comunes incluyen infecciones, niveles bajos de glóbulos rojos y blancos, vómitos, análisis de sangre anormales para la función hepática y niveles bajos de fosfato en la sangre (hipofosfatemia). [5]
Interacciones
Como el ribociclib se metaboliza principalmente por la enzima hepática CYP3A4 , los inhibidores de esta enzima aumentan sus concentraciones en el organismo y podrían potenciar los efectos secundarios y la toxicidad. Entre los ejemplos de dichos inhibidores se incluyen el ketoconazol y fármacos antimicóticos similares, el ritonavir , la claritromicina y el pomelo . Por el contrario, los fármacos que inducen el CYP3A4, como la rifampicina y la hierba de San Juan , pueden disminuir las concentraciones de ribociclib. [4] [9]
El propio ribociclib es un inhibidor moderado a fuerte del CYP3A4 y, por lo tanto, puede aumentar las concentraciones de otros fármacos que comparten este metabolismo, como se ha demostrado con el midazolam . También inhibe una serie de proteínas transportadoras y, por lo tanto, teóricamente podría interferir con el transporte de otros fármacos en el cuerpo. También podría amplificar la prolongación del intervalo QT de otros fármacos, como los antiarrítmicos , la claritromicina y el haloperidol . [4] [9]
Farmacología
Farmacodinamia
Se ha demostrado que las quinasas dependientes de ciclina (CDK) 4 y 6 son enzimas que promueven la división y multiplicación celular tanto en células normales como cancerosas. Muchas células cancerosas han mostrado anomalías que aumentan la actividad de las CDK, lo que conduce a la inactivación de ciertos genes supresores de tumores . [13] [14]
Cuando se utiliza en combinación con otros fármacos, como un inhibidor de ALK o MEK , se ha demostrado que el ribociclib tiene un efecto sinérgico, lo que da como resultado respuestas mejoradas. [15] [16] Nuevamente, esto es probablemente el resultado de una " intercomunicación " entre las vías de señalización. El simple bloqueo de una vía en la tumorigénesis del cáncer a veces puede dar como resultado una "compensación tumoral", donde el tumor compensa la vía de señalización bloqueada utilizando otras vías para sobrevivir. Al bloquear varias vías a la vez, se cree que el tumor es menos capaz de compensar, y a menudo se observa una mayor respuesta antitumoral. Se ha demostrado que el uso de ribociclib en combinación con otros agentes reduce el desarrollo de resistencia a estos agentes. [13]
Farmacocinética
No se ha determinado el porcentaje de ribociclib absorbido en el intestino. Los niveles plasmáticos más altos se alcanzan después de una a cuatro horas; y después de dosis repetidas, las concentraciones en estado estacionario se alcanzan después de aproximadamente ocho días. La ingesta de alimentos no tiene efecto sobre las tasas de absorción. Cuando está en el torrente sanguíneo, aproximadamente el 70% de ribociclib se une a las proteínas plasmáticas . [4] [9]
La sustancia se metaboliza principalmente por el CYP3A4 y posteriormente por varias enzimas de fase II , lo que da lugar a una gran cantidad de metabolitos. Los que tienen concentraciones plasmáticas más altas en humanos se denominan CCI284 (un producto de N - hidroxilación no especificado ), LEQ803 (el producto de N - desmetilación ) y M1 (un glucurónido ). Todos los metabolitos tienen una actividad clínica insignificante. [4] [9]
El ribociclib tiene una ligera tendencia a acumularse en el organismo. Se elimina con una semivida biológica media de 32 horas, principalmente (69%) a través de las heces, pero también (23%) a través de la orina. El fármaco inalterado representa el 17% de la sustancia en las heces y el 12% de la sustancia en la orina, siendo el resto metabolitos. [4] [9]
Química
El ribociclib se utiliza en forma de sal succinato . Es un polvo cristalino de color amarillo a marrón ligeramente higroscópico que es soluble en ácidos acuosos. [17]
Historia
Ribociclib demostró un beneficio clínico en la supervivencia general en los tres ensayos de fase III del programa clínico MONALEESA con diferentes parejas de terapia endocrina, independientemente del estado menopáusico o la línea de terapia. [18] La Sociedad Europea de Oncología Médica (ESMO) asignó la puntuación más alta en la "Escala de magnitud del beneficio clínico" para ribociclib. [19]
En el ensayo clínico relevante para la aprobación del fármaco, el ribociclib mejoró significativamente la supervivencia libre de progresión , es decir, el período de tiempo durante el cual el cáncer no empeoró. En el caso de los participantes que recibieron placebo más letrozol, la supervivencia libre de progresión fue de 16 meses en promedio, mientras que con ribociclib más letrozol, la supervivencia libre de progresión fue de 25 meses, según el análisis de enero de 2017. [9]
En octubre de 2024, el Comité de Medicamentos de Uso Humano de la Agencia Europea de Medicamentos recomendó un cambio en los términos de la autorización de comercialización de ribociclib para añadir el tratamiento adyuvante de personas con cáncer de mama en etapa temprana con receptor hormonal positivo/receptor 2 del factor de crecimiento epidérmico humano negativo, con alto riesgo de recurrencia de la enfermedad. [20] El titular de la autorización de comercialización es Novartis Europharm Limited. [20]
Referencias
- ^ "Medicamentos de prescripción: registro de nuevas entidades químicas en Australia, 2017". Administración de Productos Terapéuticos (TGA) . 21 de junio de 2022. Consultado el 9 de abril de 2023 .
- ^ "Medicamentos y productos biológicos de prescripción: resumen anual de la TGA 2017". Administración de Productos Terapéuticos (TGA) . 21 de junio de 2022. Consultado el 31 de marzo de 2024 .
- ^ "Resumen de la decisión reglamentaria sobre Kisqali". Health Canada . 2 de marzo de 2018 . Consultado el 8 de junio de 2024 .
- ^ abcdefghij «Kisqali-ribociclib comprimido recubierto con película». DailyMed . 4 de mayo de 2023 . Consultado el 9 de julio de 2023 .
- ^ abcdefg «EPAR de Kisqali». Agencia Europea de Medicamentos (EMA) . 31 de marzo de 2023. Consultado el 9 de julio de 2023 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ "Novartis LEE011 (ribociclib) obtuvo la revisión prioritaria de la FDA para el tratamiento de primera línea del cáncer de mama avanzado HR+/HER2-" (Nota de prensa). Novartis . 1 de noviembre de 2016. Archivado desde el original el 25 de septiembre de 2018 . Consultado el 27 de enero de 2017 .
- ^ ab "Comprimidos de Kisqali (ribociclib)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 28 de marzo de 2017. Consultado el 9 de julio de 2023 .
- ^ "La FDA autoriza el uso de Kisqali de Novartis como terapia combinada contra el cáncer de mama". Noticias sobre ingeniería genética y biotecnología . 14 de marzo de 2017. Consultado el 9 de julio de 2023 .
- ^ abcdefgh «Kisqali: EPAR – Información del producto» (PDF) . Agencia Europea de Medicamentos . 31 de agosto de 2017. Archivado desde el original (PDF) el 18 de junio de 2018 . Consultado el 8 de septiembre de 2017 .
- ^ "Miles de pacientes con cáncer de mama tendrán acceso rutinario a la combinación de medicamentos aprobada por NICE". NICE (Nota de prensa). Archivado desde el original el 15 de marzo de 2021 . Consultado el 8 de marzo de 2021 .
- ^ "Aprobado para su uso en el NHS un fármaco que prolonga la vida de pacientes con cáncer de mama incurable". The Guardian . 26 de febrero de 2021 . Consultado el 8 de marzo de 2021 .
- ^ ab "La FDA aprueba el ribociclib con un inhibidor de la aromatasa y el co-pack de ribociclib y letrozol para el cáncer de mama de alto riesgo en etapa temprana". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 17 de septiembre de 2024. Consultado el 15 de octubre de 2024 .
 Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público .
Este artículo incorpora texto de esta fuente, que se encuentra en el dominio público . - ^ ab Samson K (2014). "El inhibidor de CDK LEE011 muestra un potencial temprano en cánceres resistentes a fármacos". Oncology Times . 36 (3): 39–40. doi :10.1097/01.COT.0000444043.33304.c1.
- ^ Kim S, Loo A, Chopra R, Caponigro G, Huang A, Vora S, et al. (2014). "Resumen PR02: LEE011: Un inhibidor selectivo de moléculas pequeñas de la reactivación de CDK4/6 en el cáncer, biodisponible por vía oral". Molecular Cancer Therapeutics . 12 (11_Suplemento): PR02. doi :10.1158/1535-7163.TARG-13-PR02.
- ^ Sosman JA, Kittaneh M, Lolkema MP, Postow MA, Schwartz G, Franklin C, et al. (2014). "Un estudio de fase 1b/2 de LEE011 en combinación con binimetinib (MEK162) en pacientes con melanoma con mutación NRAS: actividad clínica temprana alentadora". Journal of Clinical Oncology . 32 (15 Suppl): 9009. doi :10.1200/jco.2014.32.15_suppl.9009. Archivado desde el original el 7 de octubre de 2015 . Consultado el 14 de enero de 2017 .
- ^ Wood AC, Krytska K, Ryles H, Sano R, Li N, King F, et al. (2014). "Resumen 1000: La combinación de inhibición de CDK4/6 y ALK demuestra una sinergia en el objetivo contra el neuroblastoma". Cancer Research . 74 (19 Suplemento): 1000. doi :10.1158/1538-7445.AM2014-1000.
- ^ "Kisqali: EPAR – Informe de evaluación pública" (PDF) . Agencia Europea de Medicamentos . 31 de agosto de 2017. Archivado desde el original (PDF) el 18 de junio de 2018 . Consultado el 8 de septiembre de 2017 .
- ^ Slamon DJ, Fasching PA, Hurvitz S, Chia S, Crown J, Martín M, et al. (mayo de 2023). "Fundamento y diseño del ensayo de NATALEE: un ensayo de fase III de ribociclib adyuvante + terapia endocrina frente a terapia endocrina sola en pacientes con cáncer de mama en etapa temprana HR+/HER2-". Avances terapéuticos en oncología médica . 15 : 17588359231178125. doi :10.1177/17588359231178125. PMC 10233570. PMID 37275963 .
- ^ "ESMO-Escala de magnitud del beneficio clínico". ESMO . Consultado el 19 de octubre de 2021 .
- ^ ab "Kisqali - dictamen sobre la modificación de la autorización de comercialización". Agencia Europea de Medicamentos (EMA) . 18 de octubre de 2024. Consultado el 22 de octubre de 2024 .
