Tomografía por emisión de positrones
| Tomografía por emisión de positrones | |
|---|---|
 Escáner PET cardíaco |
La tomografía por emisión de positrones ( PET ) [1] es una técnica de obtención de imágenes funcionales que utiliza sustancias radiactivas conocidas como radiotrazadores para visualizar y medir los cambios en los procesos metabólicos y en otras actividades fisiológicas , como el flujo sanguíneo , la composición química regional y la absorción. Se utilizan diferentes trazadores para diversos fines de obtención de imágenes, según el proceso objetivo dentro del cuerpo.
Por ejemplo:
- La fluorodesoxiglucosa ([ 18 F]FDG o FDG) se utiliza comúnmente para detectar el cáncer ;
- [ 18 F]El fluoruro de sodio (Na 18 F) se utiliza ampliamente para detectar la formación ósea;
- El oxígeno-15 ( 15 O) a veces se utiliza para medir el flujo sanguíneo.
La PET es una técnica de imagen común , una técnica de centellografía médica utilizada en medicina nuclear . Se inyecta un radiofármaco (un radioisótopo unido a un fármaco) en el cuerpo como trazador . Cuando el radiofármaco sufre una desintegración beta plus , se emite un positrón , y cuando el positrón interactúa con un electrón ordinario, las dos partículas se aniquilan y se emiten dos rayos gamma en direcciones opuestas. [2] Estos rayos gamma son detectados por dos cámaras gamma para formar una imagen tridimensional.
Los escáneres PET pueden incorporar un escáner de tomografía computarizada (TC) y se conocen como escáneres PET-TC . Las imágenes de la tomografía PET se pueden reconstruir utilizando una tomografía computarizada realizada con un escáner durante la misma sesión.
Una de las desventajas de un escáner PET es su alto costo inicial y los costos operativos continuos. [3]
Usos
La PET es una herramienta médica y de investigación que se utiliza en entornos preclínicos y clínicos. Se utiliza mucho en la obtención de imágenes de tumores y la búsqueda de metástasis en el campo de la oncología clínica , y para el diagnóstico clínico de ciertas enfermedades cerebrales difusas, como las que causan varios tipos de demencias . La PET es una valiosa herramienta de investigación para aprender y mejorar nuestro conocimiento del cerebro humano normal, la función cardíaca y apoyar el desarrollo de fármacos. La PET también se utiliza en estudios preclínicos con animales. Permite realizar investigaciones repetidas en los mismos sujetos a lo largo del tiempo, donde los sujetos pueden actuar como su propio control y reduce sustancialmente el número de animales necesarios para un estudio determinado. Este enfoque permite que los estudios de investigación reduzcan el tamaño de muestra necesario al tiempo que aumentan la calidad estadística de sus resultados. [ cita requerida ]
Los procesos fisiológicos provocan cambios anatómicos en el cuerpo. Dado que la PET es capaz de detectar procesos bioquímicos, así como la expresión de algunas proteínas, la PET puede proporcionar información a nivel molecular mucho antes de que se hagan visibles los cambios anatómicos. La exploración PET logra esto mediante el uso de sondas moleculares radiomarcadas que tienen diferentes tasas de captación según el tipo y la función del tejido involucrado. La captación regional del trazador en varias estructuras anatómicas se puede visualizar y cuantificar relativamente en términos del emisor de positrones inyectado dentro de una exploración PET. [ cita requerida ]
La mejor manera de obtener imágenes PET es utilizando un escáner PET dedicado. También es posible obtener imágenes PET utilizando una gammacámara convencional de dos cabezales equipada con un detector de coincidencia. La calidad de las imágenes PET con gammacámara es menor y las exploraciones tardan más en obtenerse. Sin embargo, este método permite una solución in situ de bajo costo para instituciones con baja demanda de exploraciones PET. Una alternativa sería derivar a estos pacientes a otro centro o confiar en la visita de un escáner móvil.
Los métodos alternativos de obtención de imágenes médicas incluyen la tomografía computarizada por emisión monofotónica (SPECT), la tomografía computarizada (TC), la resonancia magnética (RM) y la resonancia magnética funcional (RMf) y la ecografía . La SPECT es una técnica de obtención de imágenes similar a la PET que utiliza radioligandos para detectar moléculas en el cuerpo. La SPECT es menos costosa y proporciona una calidad de imagen inferior a la PET.
Oncología
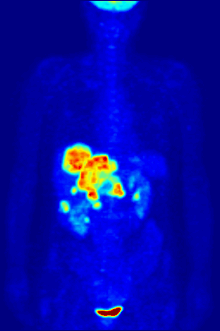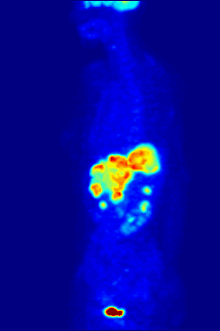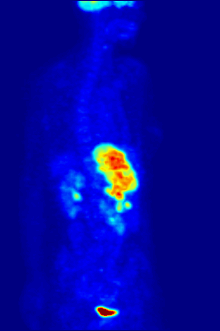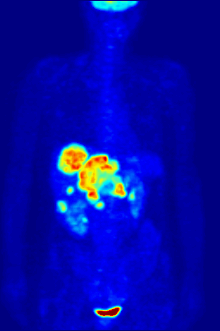
La tomografía por emisión de positrones (PET) con el radiotrazador [ 18F ]fluorodesoxiglucosa (FDG) se utiliza ampliamente en oncología clínica. La FDG es un análogo de la glucosa que es captado por las células que utilizan glucosa y fosforilado por la hexoquinasa (cuya forma mitocondrial está significativamente elevada en tumores malignos de rápido crecimiento ). [4] El atrapamiento metabólico de la molécula de glucosa radiactiva permite utilizar la tomografía por emisión de positrones. Las concentraciones del trazador FDG visualizado indican la actividad metabólica tisular, ya que corresponde a la captación regional de glucosa. La FDG se utiliza para explorar la posibilidad de que el cáncer se propague a otros sitios del cuerpo ( metástasis del cáncer ). Estas tomografías por emisión de positrones con FDG para detectar la metástasis del cáncer son las más comunes en la atención médica estándar (representan el 90% de las exploraciones actuales). El mismo trazador también se puede utilizar para el diagnóstico de tipos de demencia . Con menos frecuencia, se utilizan otros trazadores radiactivos , generalmente pero no siempre marcados con flúor-18 ( 18F ), para obtener imágenes de la concentración tisular de diferentes tipos de moléculas de interés dentro del cuerpo. [ cita requerida ]
Una dosis típica de FDG utilizada en una exploración oncológica tiene una dosis de radiación efectiva de 7,6 mSv . [5] Debido a que el grupo hidroxi que se reemplaza por flúor-18 para generar FDG es necesario para el siguiente paso en el metabolismo de la glucosa en todas las células, no se producen más reacciones en la FDG. Además, la mayoría de los tejidos (con la notable excepción del hígado y los riñones) no pueden eliminar el fosfato añadido por la hexoquinasa. Esto significa que la FDG queda atrapada en cualquier célula que la absorba hasta que se descompone, ya que los azúcares fosforilados , debido a su carga iónica, no pueden salir de la célula. Esto da como resultado un marcado radiactivo intenso de los tejidos con alta captación de glucosa, como el cerebro normal, el hígado, los riñones y la mayoría de los cánceres, que tienen una mayor captación de glucosa que la mayoría de los tejidos normales debido al efecto Warburg . Como resultado, la FDG-PET se puede utilizar para el diagnóstico, la estadificación y el seguimiento del tratamiento de los cánceres, en particular del linfoma de Hodgkin , [6] el linfoma no Hodgkin , [7] y el cáncer de pulmón . [8] [9] [10]
Una revisión de 2020 de la investigación sobre el uso de PET para el linfoma de Hodgkin encontró evidencia de que los hallazgos negativos en las exploraciones PET provisionales están relacionados con una mayor supervivencia general y supervivencia libre de progresión ; sin embargo, la certeza de la evidencia disponible fue moderada para la supervivencia y muy baja para la supervivencia libre de progresión. [11]
Se están introduciendo lentamente otros isótopos y radiotrazadores en la oncología para fines específicos. Por ejemplo,El metomidato marcado con 11 C (11C-metomidato) se ha utilizado para detectar tumores de origen adrenocortical . [12] [13] Además, la PET/CT con fluorodopa (FDOPA) (también llamada PET/CT con F-18-DOPA) ha demostrado ser una alternativa más sensible para encontrar y también localizar el feocromocitoma que la exploración con iobenguanina (MIBG). [14] [15] [16]
Neuroimagen
Neurología

La tomografía por emisión de positrones con oxígeno-15 mide indirectamente el flujo sanguíneo al cerebro. En este método, el aumento de la señal de radiactividad indica un aumento del flujo sanguíneo, que se supone que está relacionado con el aumento de la actividad cerebral. Debido a su vida media de 2 minutos , el oxígeno-15 debe ser conducido directamente desde un ciclotrón médico para tales usos, lo cual es difícil. [17]
La tomografía por emisión de positrones (PET) con FDG aprovecha el hecho de que el cerebro normalmente utiliza glucosa con rapidez. La PET con FDG estándar del cerebro mide el uso regional de glucosa y puede utilizarse en el diagnóstico neuropatológico.
Las patologías cerebrales como la enfermedad de Alzheimer (EA) reducen en gran medida el metabolismo cerebral tanto de la glucosa como del oxígeno en tándem. Por lo tanto, la PET con FDG del cerebro también se puede utilizar para diferenciar con éxito la enfermedad de Alzheimer de otros procesos demenciales, y también para realizar diagnósticos tempranos de la enfermedad de Alzheimer. La ventaja de la PET con FDG para estos usos es su disponibilidad mucho más amplia. Algunos trazadores radiactivos basados en flúor-18 utilizados para el Alzheimer incluyen florbetapir , flutemetamol , compuesto B de Pittsburgh (PiB) y florbetaben , que se utilizan para detectar placas de beta-amiloide , un biomarcador potencial para el Alzheimer en el cerebro. [18]
La obtención de imágenes PET con FDG también se puede utilizar para la localización del "foco convulsivo". Un foco convulsivo aparecerá como hipometabólico durante una exploración interictal. [19] Se han desarrollado varios radiotrazadores (es decir, radioligandos) para PET que son ligandos para subtipos específicos de neurorreceptores como [ 11 C] racloprida , [ 18 F] falyprida y [ 18 F] desmetoxifalyprida para los receptores de dopamina D 2 / D 3 ; [ 11 C] McN5652 y [ 11 C] DASB para los transportadores de serotonina ; [ 18 F] mefway para los receptores de serotonina 5HT 1A ; y [ 18 F] nifeno para los receptores nicotínicos de acetilcolina o sustratos enzimáticos (por ejemplo, 6- FDOPA para la enzima AADC ). Estos agentes permiten la visualización de grupos de neurorreceptores en el contexto de una pluralidad de enfermedades neuropsiquiátricas y neurológicas.
La PET también puede utilizarse para el diagnóstico de la esclerosis hipocampal , que causa epilepsia. La FDG y los trazadores menos comunes flumazenil y MPPF se han explorado para este propósito. [20] [21] Si la esclerosis es unilateral (hipocampo derecho o hipocampo izquierdo), la captación de FDG se puede comparar con el lado sano. Incluso si el diagnóstico es difícil con la RMN, se puede diagnosticar con PET. [22] [23]
El desarrollo de una serie de nuevas sondas para la obtención de imágenes PET in vivo no invasivas de neuroagregados en el cerebro humano ha acercado la obtención de imágenes de amiloide al uso clínico. Las primeras sondas de obtención de imágenes de amiloide incluyeron [ 18 F]FDDNP [24] desarrollado en la Universidad de California, Los Ángeles y el compuesto B de Pittsburgh (PiB) [25] desarrollado en la Universidad de Pittsburgh . Estas sondas permiten la visualización de placas amiloides en los cerebros de pacientes con Alzheimer y podrían ayudar a los médicos a realizar un diagnóstico clínico positivo de EA pre-mortem y ayudar en el desarrollo de nuevas terapias anti-amiloide. [ 11 C] polimetilpenteno (PMP) es un nuevo radiofármaco utilizado en la obtención de imágenes PET para determinar la actividad del sistema de neurotransmisores acetilcolinérgicos al actuar como sustrato para la acetilcolinesterasa . El examen post mortem de pacientes con EA ha mostrado niveles disminuidos de acetilcolinesterasa. [ 11 C]PMP se utiliza para mapear la actividad de la acetilcolinesterasa en el cerebro, lo que podría permitir diagnósticos premortem de EA y ayudar a monitorear los tratamientos para la EA. [26] Avid Radiopharmaceuticals ha desarrollado y comercializado un compuesto llamado florbetapir que utiliza el radionúclido flúor-18 de mayor duración para detectar placas amiloides mediante exploraciones PET. [27]
Neuropsicología o neurociencia cognitiva
Examinar los vínculos entre procesos o trastornos psicológicos específicos y la actividad cerebral.
Psiquiatría
Numerosos compuestos que se unen selectivamente a neurorreceptores de interés en psiquiatría biológica han sido radiomarcados con C-11 o F-18. Los radioligandos que se unen a los receptores de dopamina ( D 1 , [28] D 2 , [29] [30] transportador de recaptación), receptores de serotonina ( 5HT 1A , 5HT 2A , transportador de recaptación), receptores opioides ( mu y kappa ), receptores colinérgicos (nicotínicos y muscarínicos ) y otros sitios se han utilizado con éxito en estudios con sujetos humanos. Se han realizado estudios que examinan el estado de estos receptores en pacientes en comparación con controles sanos en esquizofrenia , abuso de sustancias , trastornos del estado de ánimo y otras condiciones psiquiátricas. [ cita requerida ]
Cirugía estereotáxica y radiocirugía
La PET también se puede utilizar en cirugía guiada por imágenes para el tratamiento de tumores intracraneales, malformaciones arteriovenosas y otras afecciones tratables quirúrgicamente. [31]
Cardiología
Estudio de cardiología , aterosclerosis y enfermedades vasculares: la PET con FDG puede ayudar a identificar el miocardio hibernado . Sin embargo, no está clara la relación coste-eficacia de la PET para esta función en comparación con la SPECT . La obtención de imágenes PET con FDG de la aterosclerosis para detectar pacientes con riesgo de accidente cerebrovascular también es factible. Además, puede ayudar a probar la eficacia de nuevas terapias contra la aterosclerosis. [32]
Enfermedades infecciosas
La obtención de imágenes de infecciones con tecnologías de imágenes moleculares puede mejorar el diagnóstico y el seguimiento del tratamiento. Clínicamente, la PET se ha utilizado ampliamente para obtener imágenes de infecciones bacterianas utilizando FDG para identificar la respuesta inflamatoria asociada a la infección. Se han desarrollado tres agentes de contraste PET diferentes para obtener imágenes de infecciones bacterianas in vivo: [ 18 F] maltosa , [33] [ 18 F] maltohexaosa y [ 18 F] 2-fluorodesoxi sorbitol (FDS). [34] El FDS tiene el beneficio adicional de poder dirigirse solo a Enterobacteriaceae .
Estudios de biodistribución
En los ensayos preclínicos, un nuevo fármaco puede marcarse con radioisótopos e inyectarse en animales. Estos estudios se denominan estudios de biodistribución. La información sobre la absorción, retención y eliminación del fármaco a lo largo del tiempo se puede obtener de forma rápida y económica en comparación con la técnica más antigua de matar y diseccionar a los animales. Habitualmente, la ocupación del fármaco en un supuesto sitio de acción se puede inferir indirectamente mediante estudios de competencia entre el fármaco no marcado y los compuestos marcados con radioisótopos para unirse con especificidad al sitio. De esta forma se puede utilizar un único radioligando para probar muchos candidatos potenciales a fármacos para el mismo objetivo. Una técnica relacionada implica la lectura con radioligandos que compiten con una sustancia endógena (de origen natural) en un receptor determinado para demostrar que un fármaco provoca la liberación de la sustancia natural. [35]
Imágenes de animales pequeños
Se ha construido un PET animal en miniatura que es lo suficientemente pequeño como para escanear una rata completamente consciente. [36] Este RatCAP (PET animal consciente de ratas) permite escanear animales sin los efectos desconcertantes de la anestesia . Los escáneres PET diseñados específicamente para obtener imágenes de roedores , a menudo denominados microPET, así como los escáneres para primates pequeños , se comercializan para investigación académica y farmacéutica. Los escáneres se basan en centelleadores microminiatura y fotodiodos de avalancha amplificados (APD) a través de un sistema que utiliza fotomultiplicadores de silicio de un solo chip . [1]
En 2018, la Facultad de Medicina Veterinaria de la UC Davis se convirtió en el primer centro veterinario en emplear un pequeño escáner PET clínico como escáner para el diagnóstico clínico (en lugar de para la investigación) de animales. Debido al costo, así como a la utilidad marginal de detectar metástasis de cáncer en animales de compañía (el uso principal de esta modalidad), se espera que la exploración PET veterinaria esté raramente disponible en el futuro inmediato. [ cita requerida ]
Imágenes musculoesqueléticas
La tomografía por emisión de positrones se ha utilizado para obtener imágenes de músculos y huesos. La FDG es el trazador más utilizado para obtener imágenes de músculos, y el NaF-F18 es el trazador más utilizado para obtener imágenes de huesos.
Musculatura
La PET es una técnica viable para estudiar los músculos esqueléticos durante el ejercicio. [37] Además, la PET puede proporcionar datos de activación muscular sobre músculos profundos (como el vasto intermedio y el glúteo menor ) en comparación con técnicas como la electromiografía , que solo se pueden utilizar en músculos superficiales directamente debajo de la piel. Sin embargo, una desventaja es que la PET no proporciona información temporal sobre la activación muscular porque debe medirse después de completar el ejercicio. Esto se debe al tiempo que tarda la FDG en acumularse en los músculos activados. [ cita requerida ]
Huesos
Junto con el fluoruro de sodio [ 18F ], la PET para la obtención de imágenes óseas se ha utilizado durante 60 años para medir el metabolismo óseo regional y el flujo sanguíneo mediante exploraciones estáticas y dinámicas. Recientemente, los investigadores han comenzado a utilizar también el fluoruro de sodio [ 18F ] para estudiar la metástasis ósea. [38]
Seguridad
La tomografía por emisión de positrones (PET) no es invasiva, pero implica exposición a radiación ionizante . [3] La FDG, que ahora es el radiotrazador estándar utilizado para la neuroimagen por PET y el tratamiento de pacientes con cáncer, [39] tiene una dosis de radiación efectiva de 14 mSv . [5]
La cantidad de radiación en FDG es similar a la dosis efectiva de pasar un año en la ciudad estadounidense de Denver, Colorado (12,4 mSv/año). [40] A modo de comparación, la dosis de radiación para otros procedimientos médicos varía de 0,02 mSv para una radiografía de tórax y 6,5-8 mSv para una tomografía computarizada de tórax. [41] [42] Las tripulaciones de aviones civiles promedio están expuestas a 3 mSv/año, [43] y el límite de dosis ocupacional de cuerpo entero para los trabajadores de energía nuclear en los EE. UU. es de 50 mSv/año. [44] Para la escala, consulte Órdenes de magnitud (radiación) .
En el caso de la tomografía por emisión de positrones (PET-CT), la exposición a la radiación puede ser considerable (alrededor de 23 a 26 mSv para una persona de 70 kg; es probable que la dosis sea mayor para pesos corporales más elevados). [45] [46]
Operación
Radionucleidos y radiotrazadores

| Isótopo | 11 C | 13 N | 15 O | 18 F | 68 Ga | 64 pies cúbicos | 52 Mn | 55 Compañía | 89 Zr | 82 rublos |
| Vida media | 20 minutos | 10 minutos | 2 minutos | 110 minutos | 67,81 minutos | 12,7 horas | 5,6 días | 17,5 horas | 78,4 horas [47] | 1,3 minutos |
Los radionúclidos se incorporan a compuestos que el cuerpo utiliza normalmente, como la glucosa (o análogos de la glucosa), el agua o el amoníaco , o a moléculas que se unen a receptores u otros sitios de acción de los fármacos. Estos compuestos marcados se conocen como radiotrazadores . La tecnología PET se puede utilizar para rastrear la vía biológica de cualquier compuesto en seres humanos vivos (y también en muchas otras especies), siempre que pueda marcarse radiactivamente con un isótopo PET. Por lo tanto, los procesos específicos que se pueden investigar con PET son prácticamente ilimitados y se siguen sintetizando radiotrazadores para nuevas moléculas y procesos objetivo. En el momento de escribir este artículo, ya hay docenas en uso clínico y cientos aplicados en investigación. En 2020, el radiotrazador más utilizado en la exploración PET clínica es el derivado de carbohidratos FDG. Este radiotrazador se utiliza en prácticamente todas las exploraciones oncológicas y en la mayoría de las exploraciones neurológicas, por lo que constituye la gran mayoría de los radiotrazadores (> 95 %) utilizados en la exploración PET y PET-CT.
Debido a la corta vida media de la mayoría de los radioisótopos emisores de positrones, los radiotrazadores se han producido tradicionalmente utilizando un ciclotrón en las proximidades de las instalaciones de obtención de imágenes PET. La vida media del flúor-18 es lo suficientemente larga como para que los radiotrazadores marcados con flúor-18 puedan fabricarse comercialmente en lugares externos y enviarse a centros de obtención de imágenes. Recientemente, se han comercializado generadores de rubidio-82 . [48] Estos contienen estroncio-82, que se desintegra por captura de electrones para producir rubidio-82, que emite positrones.
Se ha revisado el uso de isótopos de metales emisores de positrones en exploraciones PET, incluidos elementos no enumerados anteriormente, como los lantánidos. [49]
Inmuno-PET
El isótopo 89 Zr se ha aplicado al seguimiento y cuantificación de anticuerpos moleculares con cámaras PET (un método llamado "inmuno-PET"). [50] [51] [52]
La semivida biológica de los anticuerpos suele ser del orden de días; véase daclizumab y erenumab a modo de ejemplo. Para visualizar y cuantificar la distribución de dichos anticuerpos en el organismo, el isótopo PET 89 Zr es muy adecuado porque su semivida física coincide con la semivida biológica típica de los anticuerpos; véase la tabla anterior.
Emisión

Para realizar la exploración, se inyecta en el sujeto vivo (normalmente en la circulación sanguínea) un isótopo trazador radiactivo de corta duración . Cada átomo trazador se ha incorporado químicamente a una molécula biológicamente activa. Hay un período de espera mientras la molécula activa se concentra en los tejidos de interés. A continuación, se coloca al sujeto en el escáner de imágenes. La molécula que se utiliza con más frecuencia para este fin es la FDG, un azúcar, para la que el período de espera suele ser de una hora. Durante la exploración, se realiza un registro de la concentración tisular a medida que el trazador se desintegra.
A medida que el radioisótopo sufre una desintegración por emisión de positrones (también conocida como desintegración beta positiva ), emite un positrón, una antipartícula del electrón con carga opuesta. El positrón emitido viaja en el tejido una corta distancia (normalmente menos de 1 mm, pero depende del isótopo [53] ), durante la cual pierde energía cinética, hasta que desacelera hasta un punto en el que puede interactuar con un electrón. [54] El encuentro aniquila tanto el electrón como el positrón, produciendo un par de fotones de aniquilación ( gamma ) que se mueven en direcciones aproximadamente opuestas. Estos se detectan cuando alcanzan un centelleador en el dispositivo de escaneo, creando una ráfaga de luz que es detectada por tubos fotomultiplicadores o fotodiodos de avalancha de silicio (Si APD). La técnica depende de la detección simultánea o coincidente del par de fotones que se mueven en direcciones aproximadamente opuestas (estarían exactamente opuestos en su marco de centro de masa , pero el escáner no tiene forma de saberlo, y por eso tiene una ligera tolerancia de error de dirección incorporada). Los fotones que no llegan en "pares" temporales (es decir, dentro de una ventana temporal de unos pocos nanosegundos) se ignoran.
Localización del evento de aniquilación de positrones
La fracción más significativa de aniquilaciones electrón-positrón resulta en dos fotones gamma de 511 keV emitidos a casi 180 grados uno del otro. Por lo tanto, es posible localizar su fuente a lo largo de una línea recta de coincidencia (también llamada línea de respuesta o LOR ). En la práctica, la LOR tiene un ancho distinto de cero ya que los fotones emitidos no están exactamente separados por 180 grados. Si el tiempo de resolución de los detectores es menor de 500 picosegundos en lugar de aproximadamente 10 nanosegundos , es posible localizar el evento en un segmento de una cuerda , cuya longitud está determinada por la resolución de tiempo del detector. A medida que mejora la resolución de tiempo, la relación señal-ruido (SNR) de la imagen mejorará, requiriendo menos eventos para lograr la misma calidad de imagen. Esta tecnología aún no es común, pero está disponible en algunos sistemas nuevos. [55]
Reconstrucción de imágenes
Los datos brutos recopilados por un escáner PET son una lista de "eventos coincidentes" que representan la detección casi simultánea (normalmente, en un intervalo de 6 a 12 nanosegundos entre sí) de fotones de aniquilación por un par de detectores. Cada evento coincidente representa una línea en el espacio que conecta los dos detectores a lo largo de los cuales se produjo la emisión de positrones (es decir, la línea de respuesta (LOR)).
Las técnicas analíticas, como la reconstrucción de datos de tomografía computarizada (TC) y tomografía computarizada por emisión de fotón único (SPECT), se utilizan comúnmente, aunque el conjunto de datos recopilados en PET es mucho más pobre que el de la TC, por lo que las técnicas de reconstrucción son más difíciles. Los eventos de coincidencia se pueden agrupar en imágenes de proyección, llamadas sinogramas . Los sinogramas se clasifican por el ángulo de cada vista y la inclinación (para imágenes 3D). Las imágenes de sinogramas son análogas a las proyecciones capturadas por los escáneres de TC y se pueden reconstruir de manera similar. Las estadísticas de los datos obtenidos de este modo son mucho peores que las obtenidas a través de la tomografía de transmisión. Un conjunto de datos PET normal tiene millones de cuentas para toda la adquisición, mientras que la TC puede alcanzar unos pocos miles de millones de cuentas. Esto contribuye a que las imágenes PET parezcan "más ruidosas" que las de TC. Dos fuentes principales de ruido en PET son la dispersión (un par de fotones detectado, al menos uno de los cuales fue desviado de su camino original por la interacción con materia en el campo de visión, lo que llevó a que el par se asignara a un LOR incorrecto) y los eventos aleatorios (fotones originados a partir de dos eventos de aniquilación diferentes pero registrados incorrectamente como un par de coincidencia porque su llegada a sus respectivos detectores ocurrió dentro de una ventana de tiempo de coincidencia).
En la práctica, se requiere un preprocesamiento considerable de los datos: corrección de coincidencias aleatorias, estimación y resta de fotones dispersos , corrección del tiempo muerto del detector (después de la detección de un fotón, el detector debe "enfriarse" nuevamente) y corrección de la sensibilidad del detector (tanto para la sensibilidad inherente del detector como para los cambios en la sensibilidad debido al ángulo de incidencia).
La retroproyección filtrada (FBP) se ha utilizado con frecuencia para reconstruir imágenes a partir de las proyecciones. Este algoritmo tiene la ventaja de ser simple y de requerir pocos recursos informáticos. Las desventajas son que el ruido de disparo en los datos brutos es prominente en las imágenes reconstruidas y las áreas de alta absorción del trazador tienden a formar rayas en la imagen. Además, la FBP trata los datos de manera determinista: no tiene en cuenta la aleatoriedad inherente asociada con los datos PET, por lo que requiere todas las correcciones previas a la reconstrucción descritas anteriormente.
Enfoques estadísticos basados en la probabilidad : Los algoritmos iterativos de maximización de expectativas basados en la probabilidad [56] [57] , como el algoritmo Shepp–Vardi [58], son ahora el método preferido de reconstrucción. Estos algoritmos calculan una estimación de la distribución probable de los eventos de aniquilación que llevaron a los datos medidos, basándose en principios estadísticos. La ventaja es un mejor perfil de ruido y resistencia a los artefactos de vetas comunes con FBP, pero la desventaja es que se requieren mayores recursos informáticos. Otra ventaja de las técnicas de reconstrucción estadística de imágenes es que los efectos físicos que se necesitarían corregir previamente al utilizar un algoritmo de reconstrucción analítica, como fotones dispersos, coincidencias aleatorias, atenuación y tiempo muerto del detector, se pueden incorporar al modelo de probabilidad que se utiliza en la reconstrucción, lo que permite una reducción adicional del ruido. También se ha demostrado que la reconstrucción iterativa produce mejoras en la resolución de las imágenes reconstruidas, ya que se pueden incorporar modelos más sofisticados de la física del escáner al modelo de probabilidad que los utilizados por los métodos de reconstrucción analítica, lo que permite una mejor cuantificación de la distribución de la radiactividad. [59]
Las investigaciones han demostrado que los métodos bayesianos que implican una función de verosimilitud de Poisson y una probabilidad previa apropiada (por ejemplo, una previa de suavizado que conduce a una regularización de variación total o una distribución laplaciana que conduce a una regularización basada en en un wavelet u otro dominio), como a través del estimador de tamiz de Ulf Grenander [60] [61] o a través de los métodos de penalización de Bayes [62] [63] o a través del método de rugosidad de IJ Good [64] [65] pueden producir un rendimiento superior a los métodos basados en maximización de expectativas que implican una función de verosimilitud de Poisson pero no implican dicha previa. [66] [67] [68]
Corrección de atenuación : las imágenes PET cuantitativas requieren corrección de atenuación. [69] En estos sistemas, la corrección de atenuación se basa en un escaneo de transmisión utilizando una fuente de varilla giratoria de 68 Ge. [70]
Los escáneres de transmisión miden directamente los valores de atenuación a 511 keV. [71] La atenuación se produce cuando los fotones emitidos por el radiotrazador dentro del cuerpo son absorbidos por el tejido intermedio entre el detector y la emisión del fotón. Como los diferentes LOR deben atravesar diferentes espesores de tejido, los fotones se atenúan de forma diferencial. El resultado es que las estructuras profundas del cuerpo se reconstruyen como si tuvieran una absorción de trazador falsamente baja. Los escáneres contemporáneos pueden estimar la atenuación utilizando equipos de TC de rayos X integrados, en lugar de los equipos anteriores que ofrecían una forma rudimentaria de TC utilizando una fuente de rayos gamma ( emisores de positrones ) y los detectores PET.
Si bien las imágenes corregidas por atenuación son generalmente representaciones más fieles, el proceso de corrección en sí mismo es susceptible a artefactos significativos. Como resultado, tanto las imágenes corregidas como las no corregidas siempre se reconstruyen y se leen juntas.
Reconstrucción 2D/3D : los primeros escáneres PET tenían un solo anillo de detectores, por lo que la adquisición de datos y la reconstrucción posterior estaban restringidas a un solo plano transversal. Los escáneres más modernos ahora incluyen múltiples anillos, que forman esencialmente un cilindro de detectores.
Hay dos enfoques para reconstruir datos de dicho escáner:
- Tratar cada anillo como una entidad separada, de modo que solo se detecten las coincidencias dentro de un anillo, la imagen de cada anillo se puede reconstruir individualmente (reconstrucción 2D), o
- Permite detectar coincidencias entre anillos así como dentro de los mismos, para luego reconstruir todo el volumen en conjunto (3D).
Las técnicas 3D tienen una mayor sensibilidad (ya que se detectan y utilizan más coincidencias), por lo tanto, menos ruido, pero son más sensibles a los efectos de la dispersión y las coincidencias aleatorias, además de requerir mayores recursos informáticos. La aparición de detectores con una resolución temporal de subnanosegundos permite un mejor rechazo de las coincidencias aleatorias, lo que favorece la reconstrucción de imágenes 3D.
PET de tiempo de vuelo (TOF) : para los sistemas modernos con una resolución temporal más alta (aproximadamente 3 nanosegundos), se utiliza una técnica llamada "tiempo de vuelo" para mejorar el rendimiento general. La PET de tiempo de vuelo utiliza detectores de rayos gamma muy rápidos y un sistema de procesamiento de datos que puede determinar con mayor precisión la diferencia de tiempo entre la detección de los dos fotones. Es imposible localizar con exactitud el punto de origen del evento de aniquilación (actualmente dentro de los 10 cm). Por lo tanto, sigue siendo necesaria la reconstrucción de la imagen. La técnica TOF proporciona una mejora notable en la calidad de la imagen, especialmente en la relación señal-ruido.
Combinación de PET con TC o RMN
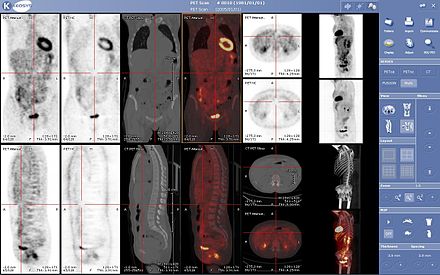

Las exploraciones PET se leen cada vez más junto con exploraciones CT o MRI, y la combinación ( corregistro ) proporciona información tanto anatómica como metabólica (es decir, cuál es la estructura y qué está haciendo bioquímicamente). Debido a que las imágenes PET son más útiles en combinación con imágenes anatómicas, como la TC, los escáneres PET modernos ahora están disponibles con escáneres CT de fila de detectores múltiples de alta gama integrados (PET-CT). Debido a que las dos exploraciones se pueden realizar en secuencia inmediata durante la misma sesión, sin que el paciente cambie de posición entre los dos tipos de exploraciones, los dos conjuntos de imágenes se registran con mayor precisión , de modo que las áreas de anomalía en las imágenes PET se pueden correlacionar más perfectamente con la anatomía en las imágenes de TC. Esto es muy útil para mostrar vistas detalladas de órganos o estructuras en movimiento con mayor variación anatómica, lo que es más común fuera del cerebro.
En abril de 2009, en el Instituto de Neurociencias y Biofísica de Jülich , se puso en funcionamiento el mayor dispositivo de resonancia magnética por emisión de positrones del mundo: un tomógrafo por resonancia magnética (MRT) de 9,4 teslas combinado con un PET. En la actualidad, sólo se pueden obtener imágenes de la cabeza y el cerebro con estas altas intensidades de campo magnético. [72]
Para la obtención de imágenes cerebrales, el registro de exploraciones por TC, RM y PET se puede lograr sin la necesidad de un escáner PET-TC o PET-RM integrado utilizando un dispositivo conocido como N-localizador . [31] [73] [74] [75]
Limitaciones
La minimización de la dosis de radiación al sujeto es una característica atractiva del uso de radionucleidos de vida corta. Además de su papel establecido como técnica de diagnóstico, la PET tiene un papel cada vez mayor como método para evaluar la respuesta a la terapia, en particular, la terapia del cáncer, [76] donde el riesgo para el paciente por la falta de conocimiento sobre el progreso de la enfermedad es mucho mayor que el riesgo de la radiación de prueba. Dado que los trazadores son radiactivos, las personas mayores [ dudoso – discutir ] y las embarazadas no pueden usarlo debido a los riesgos que plantea la radiación.
Las limitaciones al uso generalizado de la PET surgen de los altos costos de los ciclotrones necesarios para producir los radionucleidos de vida corta para la exploración PET y la necesidad de aparatos de síntesis química in situ especialmente adaptados para producir los radiofármacos después de la preparación de los radioisótopos. Las moléculas de radiotrazadores orgánicos que contendrán un radioisótopo emisor de positrones no se pueden sintetizar primero y luego preparar el radioisótopo dentro de ellas, porque el bombardeo con un ciclotrón para preparar el radioisótopo destruye cualquier portador orgánico para él. En lugar de eso, el isótopo debe prepararse primero y luego la química para preparar cualquier radiotrazador orgánico (como FDG) se realiza muy rápidamente, en el corto tiempo antes de que el isótopo se desintegra. Pocos hospitales y universidades son capaces de mantener tales sistemas, y la mayoría de las PET clínicas están respaldadas por proveedores externos de radiotrazadores que pueden abastecer a muchos sitios simultáneamente. Esta limitación restringe la PET clínica principalmente al uso de trazadores marcados con flúor-18, que tiene una vida media de 110 minutos y puede transportarse una distancia razonable antes de su uso, o al rubidio-82 (utilizado como cloruro de rubidio-82 ) con una vida media de 1,27 minutos, que se crea en un generador portátil y se utiliza para estudios de perfusión miocárdica . En los últimos años, algunos ciclotrones in situ con blindaje integrado y "laboratorios calientes" (laboratorios de química automatizados que pueden trabajar con radioisótopos) han comenzado a acompañar a las unidades PET en hospitales remotos. La presencia del pequeño ciclotrón in situ promete expandirse en el futuro a medida que los ciclotrones se reduzcan en respuesta al alto costo del transporte de isótopos a máquinas PET remotas. [77] En los últimos años, la escasez de exploraciones PET se ha aliviado en los EE. UU., ya que la implementación de radiofarmacias para suministrar radioisótopos ha crecido un 30% / año. [78]
Como la vida media del flúor-18 es de aproximadamente dos horas, la dosis preparada de un radiofármaco que contiene este radionúclido experimentará múltiples vidas medias de desintegración durante la jornada laboral. Esto requiere una recalibración frecuente de la dosis restante (determinación de la actividad por unidad de volumen) y una planificación cuidadosa con respecto a la programación de los pacientes.
Historia

El concepto de tomografía de emisión y transmisión fue introducido por David E. Kuhl , Luke Chapman y Roy Edwards a finales de la década de 1950. Su trabajo conduciría al diseño y construcción de varios instrumentos tomográficos en la Facultad de Medicina de la Universidad de Washington y más tarde en la Universidad de Pensilvania . [79] En las décadas de 1960 y 1970, Michel Ter-Pogossian , Michael E. Phelps , Edward J. Hoffman y otros desarrollaron aún más los instrumentos y técnicas de imágenes tomográficas en la Facultad de Medicina de la Universidad de Washington . [80] [81]
El trabajo de Gordon Brownell, Charles Burnham y sus colaboradores en el Hospital General de Massachusetts, que comenzó en la década de 1950, contribuyó significativamente al desarrollo de la tecnología PET e incluyó la primera demostración de radiación de aniquilación para la obtención de imágenes médicas. [82] Sus innovaciones, incluido el uso de tubos de luz y análisis volumétrico, han sido importantes en el desarrollo de la obtención de imágenes PET. En 1961, James Robertson y sus colaboradores en el Laboratorio Nacional de Brookhaven construyeron el primer escáner PET de un solo plano, apodado el "reductor de cabeza". [83]
Uno de los factores más responsables de la aceptación de la imagenología por positrones fue el desarrollo de radiofármacos. En particular, el desarrollo de la 2-fluorodesoxi-D-glucosa marcada (FDG, sintetizada por primera vez y descrita por dos científicos checos de la Universidad Charles de Praga en 1968) [84] por el grupo de Brookhaven bajo la dirección de Al Wolf y Joanna Fowler fue un factor importante en la expansión del alcance de la imagenología por PET. [85] El compuesto fue administrado por primera vez a dos voluntarios humanos normales por Abass Alavi en agosto de 1976 en la Universidad de Pensilvania. Las imágenes cerebrales obtenidas con un escáner nuclear ordinario (no PET) demostraron la concentración de FDG en ese órgano. Más tarde, la sustancia se utilizó en escáneres tomográficos de positrones dedicados, para dar lugar al procedimiento moderno.

La extensión lógica de la instrumentación de positrones fue un diseño que utilizaba dos matrices bidimensionales. PC-I fue el primer instrumento que utilizó este concepto y se diseñó en 1968, se completó en 1969 y se informó en 1972. Las primeras aplicaciones de PC-I en modo tomográfico, a diferencia del modo tomográfico computarizado, se informaron en 1970. [86] Pronto quedó claro para muchos de los involucrados en el desarrollo de PET que una matriz circular o cilíndrica de detectores era el siguiente paso lógico en la instrumentación PET. Aunque muchos investigadores adoptaron este enfoque, James Robertson [87] y Zang-Hee Cho [88] fueron los primeros en proponer un sistema de anillo que se ha convertido en el prototipo de la forma actual de PET. El primer escáner PET de matriz cilíndrica multicorte se completó en 1974 en el Instituto de Radiología Mallinckrodt por el grupo dirigido por Ter-Pogossian. [89]
El escáner PET-CT, atribuido a David Townsend y Ronald Nutt, fue nombrado por Time como el invento médico del año 2000. [90]
Costo
Esta sección necesita ser actualizada . ( Febrero de 2018 ) |
En agosto de 2008, Cancer Care Ontario informó que el costo incremental promedio actual para realizar una tomografía por emisión de positrones en la provincia es de 1.000 a 1.200 dólares canadienses por exploración. Esto incluye el costo del radiofármaco y un estipendio para el médico que lea la exploración. [91]
En Estados Unidos, se estima que una tomografía por emisión de positrones cuesta entre 1.500 y 5.000 dólares estadounidenses.
En Inglaterra, el costo de referencia del Servicio Nacional de Salud (2015-2016) para una tomografía por emisión de positrones (PET) para pacientes ambulatorios en adultos es de £798. [92]
En Australia, a partir de julio de 2018, la tarifa del Programa de Beneficios de Medicare para la PET con FDG de cuerpo entero varía entre A$ 953 y A$ 999, según la indicación de la exploración. [93]
Control de calidad
El rendimiento general de los sistemas PET se puede evaluar mediante herramientas de control de calidad como el fantasma de Jaszczak . [94]
Véase también
- Imágenes ópticas difusas
- Celda caliente (equipo utilizado para producir los radiofármacos utilizados en PET)
- Imágenes moleculares
Referencias
- ^ ab Bailey DL, Townsend DW, Valk PE, Maisy MN (2005). Tomografía por emisión de positrones: ciencias básicas. Secaucus, Nueva Jersey: Springer-Verlag. ISBN 978-1-85233-798-8.
- ^ "Medicina nuclear". hyperphysics.phy-astr.gsu.edu . Consultado el 11 de diciembre de 2022 .
- ^ ab Carlson N (22 de enero de 2012). Fisiología del comportamiento . Métodos y estrategias de investigación. Vol. 11.ª edición. Pearson. pág. 151. ISBN 978-0205239399.
- ^ Bustamante E, Pedersen P (1977). "Glucólisis aeróbica elevada de células de hepatoma de rata en cultivo: función de la hexoquinasa mitocondrial". Proc Natl Acad Sci USA . 74 (9): 3735–9. Bibcode :1977PNAS...74.3735B. doi : 10.1073/pnas.74.9.3735 . PMC 431708 . PMID 198801.
- ^ ab ARSAC – Notas de orientación sobre la administración clínica de radiofármacos y el uso de fuentes selladas (marzo de 2018, pág. 35)
- ^ Zaucha JM, Chauvie S, Zaucha R, Biggii A, Gallamini A (julio de 2019). "El papel de la PET/CT en el tratamiento moderno del linfoma de Hodgkin". Cancer Treatment Reviews . 77 : 44–56. doi :10.1016/j.ctrv.2019.06.002. PMID 31260900. S2CID 195772317.
- ^ McCarten KM, Nadel HR, Shulkin BL, Cho SY (octubre de 2019). "Imágenes para el diagnóstico, la estadificación y la evaluación de la respuesta del linfoma de Hodgkin y el linfoma no Hodgkin". Pediatric Radiology . 49 (11): 1545–1564. doi :10.1007/s00247-019-04529-8. PMID 31620854. S2CID 204707264.
- ^ Pauls S, Buck AK, Hohl K, Halter G, Hetzel M, Blumstein NM, et al. (2007). "Mejora de la estadificación T no invasiva en el cáncer de pulmón de células no pequeñas mediante PET/CT con 18 F-FDG integrada". Nuklearmedizin . 46 (1): 09–14. doi :10.1055/s-0037-1616618. ISSN 0029-5566. S2CID 21791308.
- ^ Steinert HC (2011). "PET y PET-CT del cáncer de pulmón". Tomografía por emisión de positrones . Métodos en biología molecular. Vol. 727. Humana Press. págs. 33–51. doi :10.1007/978-1-61779-062-1_3. ISBN 978-1-61779-061-4. Número de identificación personal 21331927.
- ^ Chao F, Zhang H (2012). "PET/CT en la estadificación del cáncer de pulmón de células no pequeñas". Journal of Biomedicine & Biotechnology . 2012 : 783739. doi : 10.1155/2012/783739 . PMC 3346692 . PMID 22577296.
- ^ Aldin A, Umlauff L, Estcourt LJ, Collins G, Moons KG, Engert A, et al. (Grupo Cochrane de Hematología) (enero de 2020). "Resultados provisionales de la TEP para el pronóstico en adultos con linfoma de Hodgkin: una revisión sistemática y un metanálisis de estudios de factores pronósticos". Base de datos Cochrane de revisiones sistemáticas . 1 (1): CD012643. doi : 10.1002/14651858.CD012643.pub3 . PMC 6984446. PMID 31930780 .
- ^ Khan TS, Sundin A, Juhlin C, Långström B, Bergström M, Eriksson B (marzo de 2003). "Imágenes PET con 11C-metomidato del cáncer adrenocortical". Revista Europea de Medicina Nuclear e Imágenes Moleculares . 30 (3): 403–10. doi :10.1007/s00259-002-1025-9. PMID 12634969. S2CID 23744095.
- ^ Minn H, Salonen A, Friberg J, Roivainen A, Viljanen T, Långsjö J, et al. (junio de 2004). "Imágenes de incidentalomas suprarrenales con PET utilizando (11) C-metomidato y (18) F-FDG". Revista de Medicina Nuclear . 45 (6): 972–9. PMID 15181132.
- ^ Pacak K, Eisenhofer G, Carrasquillo JA, Chen CC, Li ST, Goldstein DS (julio de 2001). "Tomografía por emisión de positrones (PET) con 6-[18F]fluorodopamina para la localización diagnóstica del feocromocitoma". Hipertensión . 38 (1): 6–8. doi : 10.1161/01.HYP.38.1.6 . PMID 11463751.
- ^ "Imagen del feocromocitoma: descripción general, radiografía, tomografía computarizada". 10 de agosto de 2017 – vía eMedicine.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Luster M, Karges W, Zeich K, Pauls S, Verburg FA, Dralle H, et al. (marzo de 2010). "Valor clínico de la tomografía por emisión de positrones/tomografía computarizada con 18 F-fluorodihidroxifenilalanina ( 18 F-DOPA PET/CT) para detectar feocromocitoma". Revista Europea de Medicina Nuclear e Imágenes Moleculares . 37 (3): 484–93. doi :10.1007/s00259-009-1294-7. PMID 19862519. S2CID 10147392.
- ^ Cherry, Simon R. (2012). Física en medicina nuclear (4.ª ed.). Filadelfia: Saunders. pág. 60. ISBN 9781416051985.
- ^ Anand, Keshav; Sabbagh, Marwan (enero de 2017). "Imágenes de amiloide: preparadas para su integración en la práctica médica". Neurotherapeutics . 14 (1): 54–61. doi : 10.1007/s13311-016-0474-y . PMC 5233621 . PMID 27571940.
- ^ Stanescu, Luana; Ishak, Gisele E.; Khanna, Paritosh C.; Biyyam, Deepa R.; Shaw, Dennis W.; Parisi, Marguerite T. (septiembre de 2013). "PET con FDG del cerebro en pacientes pediátricos: espectro de imágenes con correlación de imágenes por resonancia magnética". RadioGráficos . 33 (5): 1279-1303. doi : 10.1148/rg.335125152 . PMID 24025925.
- ^ la Fougère, C.; Rominger, A.; Förster, S.; Geisler, J.; Bartenstein, P. (mayo de 2009). "PET y SPECT en epilepsia: una revisión crítica". Epilepsia y comportamiento . 15 (1): 50–55. doi : 10.1016/j.yebeh.2009.02.025 . PMID 19236949.
- ^ Hodolic, Marina; Topakian, Raffi; Pichler, Robert (1 de septiembre de 2016). "Tomografía por emisión de positrones con 18 F-fluorodesoxiglucosa y 18 F-flumazenil en pacientes con epilepsia refractaria". Radiología y Oncología . 50 (3): 247–253. doi :10.1515/raon-2016-0032. PMC 5024661 . PMID 27679539.
- ^ Malmgren, K; Thom, M (septiembre de 2012). "Esclerosis hipocampal: orígenes y diagnóstico por imagen". Epilepsia . 53 (Supl. 4): 19–33. doi : 10.1111/j.1528-1167.2012.03610.x . PMID 22946718.
- ^ Cendes, Fernando (junio de 2013). "Neuroimagen en la investigación de pacientes con epilepsia". Continuum . 19 (3 Epilepsia): 623–642. doi :10.1212/01.CON.0000431379.29065.d3. PMC 10564042 . PMID 23739101. S2CID 19026991.
- ^ Agdeppa ED, Kepe V, Liu J, Flores-Torres S, Satyamurthy N, Petric A, et al. (diciembre de 2001). "Características de unión de los derivados radiofluorados de 6-dialquilamino-2-naftiletilideno como sondas de imágenes de tomografía por emisión de positrones para placas beta-amiloide en la enfermedad de Alzheimer". The Journal of Neuroscience . 21 (24): RC189. doi :10.1523/JNEUROSCI.21-24-j0004.2001. PMC 6763047 . PMID 11734604.
- ^ Mathis CA, Bacskai BJ, Kajdasz ST, McLellan ME, Frosch MP, Hyman BT, et al. (febrero de 2002). "Un derivado lipofílico de tioflavina-T para la obtención de imágenes de amiloide en el cerebro mediante tomografía por emisión de positrones (PET)". Bioorganic & Medicinal Chemistry Letters . 12 (3): 295–8. doi :10.1016/S0960-894X(01)00734-X. PMID 11814781.
- ^ Kuhl DE, Koeppe RA, Minoshima S, Snyder SE, Ficaro EP, Foster NL, et al. (marzo de 1999). "Mapeo in vivo de la actividad de la acetilcolinesterasa cerebral en el envejecimiento y la enfermedad de Alzheimer". Neurología . 52 (4): 691–9. doi :10.1212/wnl.52.4.691. PMID 10078712. S2CID 11057426.
- ^ Kolata, Gina . "Promise Seen for Detection of Alzheimer's", The New York Times , 23 de junio de 2010. Consultado el 23 de junio de 2010.
- ^ Catafau AM, Searle GE, Bullich S, Gunn RN, Rabiner EA, Herance R, et al. (mayo de 2010). "Obtención de imágenes de los receptores de dopamina D1 corticales mediante el uso de [11C]NNC112 y el bloqueo de los receptores 5-HT 2A con ketanserina". Journal of Cerebral Blood Flow and Metabolism . 30 (5): 985–93. doi :10.1038/jcbfm.2009.269. PMC 2949183 . PMID 20029452.
- ^ Mukherjee J, Christian BT, Dunigan KA, Shi B, Narayanan TK, Satter M, Mantil J (diciembre de 2002). "Imágenes cerebrales de 18 F-fallypride en voluntarios normales: análisis de sangre, distribución, estudios de prueba-reprueba y evaluación preliminar de la sensibilidad a los efectos del envejecimiento en los receptores de dopamina D-2/D-3". Synapse . 46 (3): 170–88. doi :10.1002/syn.10128. PMID 12325044. S2CID 24852944.
- ^ Buchsbaum MS, Christian BT, Lehrer DS, Narayanan TK, Shi B, Mantil J, et al. (julio de 2006). "Unión del receptor de dopamina D2/D3 con [F-18]fallypride en el tálamo y la corteza de pacientes con esquizofrenia". Schizophrenia Research . 85 (1–3): 232–44. doi :10.1016/j.schres.2006.03.042. PMID 16713185. S2CID 45446283.
- ^ ab Levivier M, Massager N, Wikler D, Lorenzoni J, Ruiz S, Devriendt D, et al. (julio de 2004). "Uso de imágenes PET estereotácticas en la planificación dosimétrica de la radiocirugía para tumores cerebrales: experiencia clínica y clasificación propuesta". Journal of Nuclear Medicine . 45 (7): 1146–54. PMID 15235060.
- ^ Rudd JH, Warburton EA, Fryer TD, Jones HA, Clark JC, Antoun N, et al. (junio de 2002). "Obtención de imágenes de la inflamación de la placa aterosclerótica con tomografía por emisión de positrones con [18F]-fluorodesoxiglucosa". Circulation . 105 (23): 2708–11. doi : 10.1161/01.CIR.0000020548.60110.76 . PMID 12057982.
- ^ Gowrishankar G, Namavari M, Jouannot EB, Hoehne A, Reeves R, Hardy J, Gambhir SS (2014). "Investigación de 6-[18F]-fluoromaltosa como un nuevo trazador PET para la obtención de imágenes de infecciones bacterianas". PLOS ONE . 9 (9): e107951. Bibcode :2014PLoSO...9j7951G. doi : 10.1371/journal.pone.0107951 . PMC 4171493 . PMID 25243851.
- ^ Weinstein EA, Ordonez AA, DeMarco VP, Murawski AM, Pokkali S, MacDonald EM, et al. (octubre de 2014). "Obtención de imágenes de la infección por enterobacterias in vivo con tomografía por emisión de positrones con 18F-fluorodesoxisorbitol". Science Translational Medicine . 6 (259): 259ra146. doi :10.1126/scitranslmed.3009815. PMC 4327834 . PMID 25338757.
- ^ Laruelle M (marzo de 2000). "Obtención de imágenes de la neurotransmisión sináptica con técnicas de competición de unión in vivo: una revisión crítica". Journal of Cerebral Blood Flow and Metabolism . 20 (3): 423–51. doi : 10.1097/00004647-200003000-00001 . PMID 10724107.
- ^ "Animal de compañía consciente de las ratas". Archivado desde el original el 5 de marzo de 2012.
- ^ Oi N, Iwaya T, Itoh M, Yamaguchi K, Tobimatsu Y, Fujimoto T (2003). "Imágenes FDG-PET de la actividad muscular de las extremidades inferiores durante la marcha a nivel". Journal of Orthopaedic Science . 8 (1): 55–61. doi :10.1007/s007760300009. PMID 12560887. S2CID 23698288.
- ^ Azad GK, Siddique M, Taylor B, Green A, O'Doherty J, Gariani J, et al. (marzo de 2019). "¿SUV PET/CT con 18F-fluoruro?". Journal of Nuclear Medicine . 60 (3): 322–327. doi :10.2967/jnumed.118.208710. PMC 6424232 . PMID 30042160.
- ^ Kelloff GJ, Hoffman JM, Johnson B, Scher HI, Siegel BA, Cheng EY, et al. (abril de 2005). "Progreso y promesa de la obtención de imágenes FDG-PET para el tratamiento de pacientes con cáncer y el desarrollo de fármacos oncológicos". Clinical Cancer Research . 11 (8): 2785–808. doi : 10.1158/1078-0432.CCR-04-2626 . PMID 15837727.
- ^ "Instituto de Ciencia y Seguridad Internacional". isis-online.org .
- ^ Manejo de pacientes, ICRP , 30 de octubre de 2009.
- ^ de Jong PA, Tiddens HA, Lequin MH, Robinson TE, Brody AS (mayo de 2008). "Estimación de la dosis de radiación de la TC en la fibrosis quística". Chest . 133 (5): 1289–91, respuesta del autor 1290–1. doi : 10.1378/chest.07-2840 . PMID 18460535.
- ^ "Capítulo 9 Exposición ocupacional a la radiación" (PDF) . Radiación, personas y medio ambiente . OIEA . págs. 39–42. Archivado desde el original (PDF) el 5 de julio de 2008.
- ^ "NRC: Información para trabajadores expuestos a radiación". www.nrc.gov . Consultado el 21 de junio de 2020 .
- ^ Brix G, Lechel U, Glatting G, Ziegler SI, Münzing W, Müller SP, Beyer T (abril de 2005). "Exposición a la radiación de pacientes sometidos a exámenes PET/CT de cuerpo entero de doble modalidad con 18 F-FDG". Revista de Medicina Nuclear . 46 (4): 608–13. PMID 15809483.
- ^ Wootton R, Doré C (noviembre de 1986). "La extracción de 18 F en hueso de conejo mediante un solo paso". Clinical Physics and Physiological Measurement . 7 (4): 333–43. Bibcode :1986CPPM....7..333W. doi :10.1088/0143-0815/7/4/003. PMID 3791879.
- ^ Dilworth JR, Pascu SI (abril de 2018). "La química de las imágenes PET con circonio-89". Chemical Society Reviews . 47 (8): 2554–2571. doi :10.1039/C7CS00014F. PMID 29557435.
- ^ Bracco Diagnostics, CardioGen-82 Archivado el 6 de septiembre de 2011 en Wayback Machine , 2000
- ^ Ahn, Shin Hye; Cosby, Alexia G.; Koller, Angus J.; Martin, Kirsten E.; Pandey, Apurva; Vaughn, Brett A.; Boros, Eszter (2021). "Capítulo 6. Radiometales para imágenes por tomografía por emisión de positrones (PET)". Iones metálicos en técnicas de bioimagen . Springer. págs. doi :10.1515/9783110685701-012. S2CID 233679785.
- ^ Heuveling, Derek A.; Visser, Gerard WM; Baclayón, Marian; Roos, Wouter H.; Wuite, Gijs JL; Hoekstra, Otto S.; Leemans, C. René; de Bree, Remco; van Dongen, Guus AMS (2011). "Linfogammagrafía PET/TC basada en albúmina nanocoloidal 89Zr para la detección del ganglio centinela en el cáncer de cabeza y cuello: resultados preclínicos" (PDF) . La Revista de Medicina Nuclear . 52 (10): 1580-1584. doi : 10.2967/jnumed.111.089557 . PMID 21890880. S2CID 21902223.
- ^ van Rij, Catharina M.; Sharkey, Robert M.; Goldenberg, David M.; Frielink, Cathelijne; Molkenboer, Janneke DM; Franssen, Gerben M.; van Weerden, Wietske M.; Oyen, Wim JG; Boerman, Otto C. (2011). "Imágenes del cáncer de próstata con inmuno-PET e Immuno-SPECT utilizando un anticuerpo monoclonal anti-EGP-1 radiomarcado". La Revista de Medicina Nuclear . 52 (10): 1601-1607. doi : 10.2967/jnumed.110.086520 . PMID 21865288.
- ^ Ruggiero, A.; Holland, JP; Hudolin, T.; Shenker, L.; Koulova, A.; Bander, NH; Lewis, JS; Grimm, J. (2011). "Dirigido al epítopo interno del antígeno de membrana específico de la próstata con inmuno-PET 89Zr-7E11". The Journal of Nuclear Medicine . 52 (10): 1608–15. doi :10.2967/jnumed.111.092098. PMC 3537833 . PMID 21908391.
- ^ Phelps ME (2006). PET: física, instrumentación y escáneres . Springer. pp. 8-10. ISBN 978-0-387-34946-6.
- ^ "Imágenes PET". GE Healthcare. Archivado desde el original el 4 de mayo de 2012.
- ^ "Invitación a cubrir: Los avances en la tecnología de "tiempo de vuelo" hacen que el nuevo escáner PET/CT de Penn sea el primero en el mundo". Universidad de Pensilvania. 15 de junio de 2006. Archivado desde el original el 28 de junio de 2006 . Consultado el 22 de febrero de 2010 .
- ^ Lange K, Carson R (abril de 1984). "Algoritmos de reconstrucción EM para tomografía de emisión y transmisión". Revista de tomografía asistida por computadora . 8 (2): 306–16. PMID 6608535.
- ^ Vardi Y, Shepp LA, Kaufman L (1985). "Un modelo estadístico para la tomografía por emisión de positrones". Revista de la Asociación Estadounidense de Estadística . 80 (389): 8–37. doi :10.1080/01621459.1985.10477119. S2CID 17836207.
- ^ Shepp LA, Vardi Y (1982). "Reconstrucción de máxima verosimilitud para tomografía por emisión". IEEE Transactions on Medical Imaging . 1 (2): 113–122. doi :10.1109/TMI.1982.4307558. PMID 18238264.
- ^ Qi J, Leahy RM (agosto de 2006). "Técnicas de reconstrucción iterativa en tomografía computarizada por emisión". Física en Medicina y Biología . 51 (15): R541-78. Bibcode :2006PMB....51R.541Q. doi :10.1088/0031-9155/51/15/R01. PMID 16861768. S2CID 40488776.
- ^ Snyder DL, Miller M (1985). "Sobre el uso del método de tamices para la tomografía por emisión de positrones". IEEE Transactions on Medical Imaging . NS-32(5) (5): 3864–3872. Bibcode :1985ITNS...32.3864S. doi :10.1109/TNS.1985.4334521. S2CID 2112617.
- ^ Geman S, McClure DE (1985). "Análisis de imágenes bayesiano: una aplicación a la tomografía por emisión de fotón único" (PDF) . Actas de Amererican Statistical Computing : 12–18.
- ^ Snyder DL, Miller MI, Thomas LJ, Politte DG (1987). "Artefactos de ruido y bordes en reconstrucciones de máxima verosimilitud para tomografía por emisión". IEEE Transactions on Medical Imaging . 6 (3): 228–38. doi :10.1109/tmi.1987.4307831. PMID 18244025. S2CID 30033603.
- ^ Green PJ (1990). "Reconstrucciones bayesianas a partir de datos de tomografía por emisión utilizando un algoritmo EM modificado" (PDF) . IEEE Transactions on Medical Imaging . 9 (1): 84–93. CiteSeerX 10.1.1.144.8671 . doi :10.1109/42.52985. PMID 18222753.
- ^ Miller MI, Snyder DL (1987). "El papel de la verosimilitud y la entropía en problemas de datos incompletos: aplicaciones para estimar intensidades de procesos puntuales y estimaciones de covarianza con restricciones de Toeplitz". Actas del IEEE . 5 (7): 892–907. doi :10.1109/PROC.1987.13825. S2CID 23733140.
- ^ Miller MI, Roysam B (abril de 1991). "Reconstrucción de imágenes bayesianas para tomografía de emisión que incorpora la rugosidad previa de Good en procesadores masivamente paralelos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 88 (8): 3223–7. Bibcode :1991PNAS...88.3223M. doi : 10.1073/pnas.88.8.3223 . PMC 51418 . PMID 2014243.
- ^ Willett R, Harmany Z, Marcia R (2010). "Reconstrucción de imágenes de Poisson con regularización de variación total". 17.ª Conferencia Internacional IEEE sobre Procesamiento de Imágenes . págs. 4177–4180. CiteSeerX 10.1.1.175.3149 . doi :10.1109/ICIP.2010.5649600. ISBN . 978-1-4244-7992-4.S2CID246589 .
- ^ Harmany Z, Marcia R, Willett R (2010). "Imágenes limitadas por fotones y regularizadas por dispersión". Simposio Internacional sobre Imágenes Biomédicas (ISBI) .
- ^ Willett R, Harmany Z, Marcia R (2010). Bouman CA, Pollak I, Wolfe PJ (eds.). "ESPIRAL fuera de la convexidad: algoritmos regularizados por escasez para imágenes limitadas por fotones". Imágenes electrónicas SPIE . Imágenes computacionales VIII. 7533 : 75330R. Código Bibliográfico : 2010SPIE.7533E..0RH. CiteSeerX 10.1.1.175.3054 . doi : 10.1117/12.850771. S2CID 7172003.
- ^ Huang SC, Hoffman EJ, Phelps ME, Kuhl DE (diciembre de 1979). "Cuantificación en tomografía computarizada por emisión de positrones: 2. Efectos de la corrección de atenuación inexacta". Journal of Computer Assisted Tomography . 3 (6): 804–14. doi :10.1097/00004728-197903060-00018. PMID 315970.
- ^ Navalpakkam BK, Braun H, Kuwert T, Quick HH (mayo de 2013). "Corrección de atenuación basada en resonancia magnética para imágenes híbridas PET/MR utilizando mapas de atenuación de valor continuo". Radiología de investigación . 48 (5): 323–332. doi :10.1097/rli.0b013e318283292f. PMID 23442772. S2CID 21553206.
- ^ Wagenknecht G, Kaiser HJ, Mottaghy FM, Herzog H (febrero de 2013). "MRI para corrección de atenuación en PET: métodos y desafíos". Magma . 26 (1): 99–113. doi :10.1007/s10334-012-0353-4. PMC 3572388 . PMID 23179594.
- ^ "Una mirada de cerca al cerebro". Centro de Investigación Jülich . 7 de marzo de 2014. Consultado el 14 de abril de 2015 .
- ^ Tse VC, Kalani MY, Adler JR (2015). "Técnicas de localización estereotáctica". En Chin LS, Regine WF (eds.). Principios y práctica de la radiocirugía estereotáctica . Nueva York: Springer. pág. 28.
- ^ Saleh H, Kassas B (2015). "Desarrollo de marcos estereotácticos para el tratamiento craneal". En Benedict SH, Schlesinger DJ, Goetsch SJ, Kavanagh BD (eds.). Radiocirugía estereotáctica y radioterapia corporal estereotáctica . Boca Raton: CRC Press. págs. 156-159.
- ^ Khan FR, Henderson JM (2013). "Técnicas quirúrgicas de estimulación cerebral profunda". En Lozano AM, Hallet M (eds.). Estimulación cerebral: Manual de neurología clínica . Vol. 116. Ámsterdam: Elsevier. págs. 28-30. doi :10.1016/B978-0-444-53497-2.00003-6. ISBN . 9780444534972. Número de identificación personal 24112882.
- ^ Young H, Baum R, Cremerius U, Herholz K, Hoekstra O, Lammertsma AA, et al. (diciembre de 1999). "Medición de la respuesta tumoral clínica y subclínica utilizando [ 18F ]-fluorodesoxiglucosa y tomografía por emisión de positrones: revisión y recomendaciones de la EORTC de 1999. Grupo de estudio PET de la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC)". Revista Europea del Cáncer . 35 (13): 1773–1782. doi :10.1016/S0959-8049(99)00229-4. PMID 10673991.
- ^ Fratt L (julio de 2003). «Tecnología». Imágenes médicas . Archivado desde el original el 20 de noviembre de 2008.
- ^ Phelps M (16 de enero de 2013). "Historia y descripción general de la PET" (PDF) . Crump Institute for Molecular Imaging. Archivado desde el original (PDF) el 18 de mayo de 2015.
- ^ "FERMI Michael e. Phelps, 1998 | Oficina de Ciencias del Departamento de Energía de Estados Unidos (SC)". 28 de diciembre de 2010.
- ^ Ter-Pogossian MM, Phelps ME, Hoffman EJ, Mullani NA (enero de 1975). "Un tomógrafo transaxial por emisión de positrones para imágenes nucleares (PETT)". Radiología . 114 (1): 89–98. doi :10.1148/114.1.89. OSTI 4251398. PMID 1208874.
- ^ Phelps ME, Hoffman EJ, Mullani NA, Ter-Pogossian MM (marzo de 1975). "Aplicación de la detección de coincidencia de aniquilación a la tomografía de reconstrucción transaxial". Revista de Medicina Nuclear . 16 (3): 210–24. PMID 1113170.
- ^ Sweet WH, Brownell GL (1953). "Localización de tumores cerebrales con emisores de positrones". Nucleonics . 11 : 40–45.
- ^ Un legado vital: Investigación biológica y medioambiental en la era atómica (informe). Departamento de Energía de Estados Unidos, Oficina de Investigación Biológica y Medioambiental. Septiembre de 2010. Págs. 25-26.
- ^ Pacák J, Točík Z, Černý M (1969). "Síntesis de 2-desoxi-2-fluoro-D-glucosa". Revista de la Sociedad Química D: Comunicaciones Químicas (2): 77. doi :10.1039/C29690000077
- ^ Ido T, Wan CN, Casella V, Fowler JS, Wolf AP, Reivich M, Kuhl DE (1978). "Análogos de 2-desoxi-D-glucosa marcados. 2-desoxi-2-fluoro-D-glucosa, 2-desoxi- 2 -fluoro-D-manosa y 14C-2-desoxi-2-fluoro-D-glucosa marcados con 18F". Revista de compuestos marcados y radiofármacos . 14 (2): 175–183. doi :10.1002/jlcr.2580140204.
- ^ Brownell GL, Burnham CA, Hoop Jr B, Bohning DE (agosto de 1945). Estudios dinámicos cuantitativos utilizando radioisótopos de vida corta y detección de positrones . Simposio sobre estudios dinámicos con radioisótopos en medicina. Rotterdam: OIEA, Viena. págs. 161-172.
- ^ Robertson JS, Marr RB, Rosenblum M, Radeka V, Yamamoto YL (1983). "Detector de sección transversal de positrones de 32 cristales". En Freedman GS (ed.). Tomographic Imaging in Nuclear Medicine . Nueva York: The Society of Nuclear Medicine. págs. 142-153.
- ^ Cho ZH, Eriksson L, Chan JK (1975). "Una cámara axial de positrones transversal con anillo circular". En Ter-Pogossian MM (ed.). Tomografía de reconstrucción en radiología diagnóstica y medicina nuclear . Baltimore: University Park Press.
- ^ "Michel Ter-Pogossian homenajeado como pionero de la medicina nuclear". The Journal of Nuclear Medicine . 26 (5): 449. Mayo de 1985.
- ^ "PET Scan: PET/CT History". Petscaninfo.com. Archivado desde el original el 14 de abril de 2012. Consultado el 13 de agosto de 2012 .
- ^ Comité Directivo de PET de Ontario (31 de agosto de 2008), PET SCAN PRIMER, A Guide to the Implementation of Positron Emission Tomography Imaging in Ontario, Resumen ejecutivo, págs. iii
- ^ "Costes de referencia del NHS de 2015 a 2016". Departamento de Salud. 15 de diciembre de 2016. Consultado el 22 de diciembre de 2016 .
- ^ "MBS online". Departamento de Salud del Gobierno de Australia . Consultado el 16 de octubre de 2018 .
- ^ Prekeges, Jennifer (2012). Instrumentación de medicina nuclear . Jones & Bartlett Publishers. ISBN 1449645372. pág. 189.
Enlaces externos
- Hofman MS, Hicks RJ (octubre de 2016). "Cómo leemos la PET/CT con FDG oncológica". Cancer Imaging . 16 (1): 35. doi : 10.1186/s40644-016-0091-3 . PMC 5067887 . PMID 27756360.
- Atlas PET-CT de la Facultad de Medicina de Harvard Archivado el 11 de mayo de 2019 en Wayback Machine.
- Centro Nacional de Desarrollo de Isótopos: fuente de radionucleidos del gobierno de EE. UU., incluidos los utilizados para PET: producción, investigación, desarrollo, distribución e información



