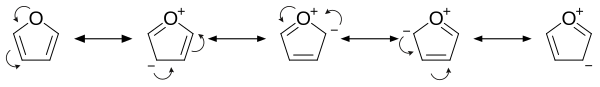Furano
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Furano [1] | |||
| Nombre sistemático de la IUPAC 1,4-Epoxibuta-1,3-dieno 1-Oxaciclopenta-2,4-dieno | |||
| Otros nombres Oxole Oxa[5]anuleno 1,4-Epoxi-1,3-butadieno 5-Oxaciclopenta-1,3-dieno 5-Oxaciclo-1,3-pentadieno Furfurano Óxido de divinileno | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 103221 | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.003.390 | ||
| Número CE |
| ||
| 25716 | |||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 2389 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C4H4O | |||
| Masa molar | 68,075 g·mol −1 | ||
| Apariencia | Líquido incoloro y volátil. | ||
| Densidad | 0,936 g/ml | ||
| Punto de fusión | -85,6 °C (-122,1 °F; 187,6 K) | ||
| Punto de ebullición | 31,3 °C (88,3 °F; 304,4 K) | ||
| -43,09·10 −6 cm3 / mol | |||
| Peligros | |||
| Etiquetado SGA : | |||
   | |||
| Peligro | |||
| H224 , H302 , H315 , H332 , H341 , H350 , H373 , H412 | |||
| P201 , P202 , P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P273 , P280 , P281 , P301+P312 , P302+P352 , P303+P361+P353 , P304+P312 , P304+P340 , P308+P313 , P312 , P314 , P321 , P330 , P332+P313 , P362 , P370+P378 , P403+P235 , P405 , P501 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | -36 °C (-33 °F; 237 K) | ||
| 390 °C (734 °F; 663 K) | |||
| Límites de explosividad | Inferior: 2,3% Superior: 14,3% a 20 °C | ||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | > 2 g/kg (rata) | ||
| Ficha de datos de seguridad (FDS) | Pennakem | ||
| Compuestos relacionados | |||
Heterociclos relacionados | Pirrol tiofeno | ||
Compuestos relacionados | Tetrahidrofurano (THF) 2,5-Dimetilfurano Benzofurano Dibenzofurano | ||
| Estructura | |||
| C2v | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El furano es un compuesto orgánico heterocíclico que consiste en un anillo aromático de cinco miembros con cuatro átomos de carbono y un átomo de oxígeno . Los compuestos químicos que contienen dichos anillos también se denominan furanos.
El furano es un líquido incoloro, inflamable y altamente volátil con un punto de ebullición cercano a la temperatura ambiente. Es soluble en solventes orgánicos comunes , incluidos el alcohol , el éter y la acetona , y es ligeramente soluble en agua . [2] Su olor es "fuerte, etéreo; parecido al cloroformo ". [3] Es tóxico y puede ser cancerígeno para los humanos. El furano se utiliza como punto de partida para otros productos químicos especiales . [4]
Historia
El nombre "furano" proviene del latín furfur , que significa salvado [5] ( el furfural se produce a partir del salvado). El primer derivado del furano que se describió fue el ácido 2-furoico , por Carl Wilhelm Scheele en 1780. Otro derivado importante, el furfural , fue descrito por Johann Wolfgang Döbereiner en 1831 y caracterizado nueve años después por John Stenhouse . El furano en sí fue preparado por primera vez por Heinrich Limpricht en 1870, aunque lo llamó "tetrafenol" (como si fuera un análogo de cuatro carbonos del fenol , C 6 H 5 OH). [6] [7]
Producción
Industrialmente, el furano se fabrica mediante la descarbonilación del furfural catalizada por paladio o mediante la oxidación del 1,3-butadieno catalizada por cobre : [4]
En el laboratorio, el furano se puede obtener a partir del furfural por oxidación al ácido 2-furoico, seguida de descarboxilación . [8] También se puede preparar directamente por descomposición térmica de materiales que contienen pentosas y sólidos celulósicos , especialmente madera de pino .
Síntesis de furanos
La síntesis de Feist-Benary es una forma clásica de sintetizar furanos. La reacción implica la alquilación de 1,3- dicetonas con α-bromocetonas seguida de la deshidratación de un hidroxidihidrofurano intermedio . [9] La otra ruta tradicional implica la reacción de 1,4-dicetonas con pentóxido de fósforo (P 2 O 5 ) en la síntesis de Paal-Knorr . [10]
Existen muchas rutas para la síntesis de furanos sustituidos. [11] [12]
- El furano en la naturaleza y el comercio
- El medicamento Zantac, también conocido como ranitidina .
- Rosefuran , un compuesto aromático que se encuentra en el aceite de rosa. [10]
- El furfural , derivado de los azúcares, es la principal fuente de furanos.
- El metanofurano es un cofactor en la metanogénesis .
Estructura y unión
El furano tiene carácter aromático porque uno de los pares solitarios de electrones en el átomo de oxígeno está deslocalizado en el anillo, creando un sistema aromático 4 n + 2 (ver la regla de Hückel ). La aromaticidad es modesta en relación con la del benceno y los heterociclos relacionados tiofeno y pirrol . Las energías de resonancia del benceno, pirrol , tiofeno y furano son, respectivamente, 152, 88, 121 y 67 kJ/mol (36, 21, 29 y 16 kcal/mol). Por lo tanto, estos heterociclos, especialmente el furano, son mucho menos aromáticos que el benceno, como se manifiesta en la labilidad de estos anillos. [13] La molécula es plana, pero los grupos C=C unidos al oxígeno conservan un carácter significativo de doble enlace . El otro par solitario de electrones del átomo de oxígeno se extiende en el plano del sistema de anillo plano.
El examen de los contribuyentes de resonancia muestra una mayor densidad electrónica del anillo, lo que conduce a mayores tasas de sustitución electrofílica. [14]
Reactividad
Debido a su carácter parcialmente aromático, el comportamiento del furano es intermedio entre el de un éter enólico y el de un anillo aromático. Es diferente al de éteres como el tetrahidrofurano .
Al igual que los éteres enólicos, los furanos 2,5-disustituidos son susceptibles a la hidrólisis para dar reversiblemente 1,4-dicetonas.
El furano actúa como dieno en las reacciones de Diels-Alder con dienófilos deficientes en electrones, como el ( E )-3-nitroacrilato de etilo. [15] El producto de la reacción es una mezcla de isómeros con preferencia por el isómero endo :
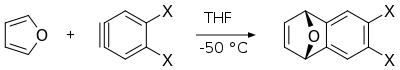
La reacción de Diels-Alder del furano con arinos proporciona los derivados correspondientes de dihidronaftalenos, que son intermediarios útiles en la síntesis de otros compuestos aromáticos policíclicos . [16]
- Es considerablemente más reactivo que el benceno en reacciones de sustitución electrofílica , debido a los efectos donadores de electrones del heteroátomo de oxígeno. Reacciona con bromo a 0 °C para dar 2-bromofurano.
- La hidrogenación de furanos produce secuencialmente dihidrofuranos y tetrahidrofuranos . [ cita requerida ]
- En la reacción de Achmatowicz , los furanos se convierten en compuestos de dihidropirano .
- El pirrol se puede preparar industrialmente tratando el furano con amoníaco en presencia de catalizadores ácidos sólidos , como SiO 2 y Al 2 O 3 . [17]
Seguridad
El furano se encuentra en alimentos comerciales tratados térmicamente y se produce a través de la degradación térmica de los componentes naturales de los alimentos. [18] [19] Se puede encontrar en el café tostado , el café instantáneo y los alimentos procesados para bebés . [19] [20] [21] Las investigaciones han indicado que el café elaborado en cafeteras expreso y el café elaborado a partir de cápsulas contienen más furano que el elaborado en cafeteras de goteo tradicionales , aunque los niveles aún se encuentran dentro de límites seguros para la salud. [22]
La exposición al furano en dosis aproximadamente 2.000 veces superiores al nivel proyectado de exposición humana a través de los alimentos aumenta el riesgo de tumores hepatocelulares en ratas y ratones y de tumores de los conductos biliares en ratas. [23] Por lo tanto, el furano está catalogado como un posible carcinógeno humano . [23]
Véase también
- BS 4994 – Resina de furano como FRP termoendurecible para equipos de plantas de procesamiento químico
- Furanocumarina
- Furanoflavonoide
- Furanosa
- Ácido furantetracarboxílico
- Anillos aromáticos simples
- Ácidos grasos furánicos
- Tetrahidrofurano
Referencias
- ^ Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul) . Cambridge: The Royal Society of Chemistry . 2014. p. 392. doi :10.1039/9781849733069-FP001. ISBN. 978-0-85404-182-4.
- ^ Jakubke, Hans Dieter; Jeschkeit, Hans (1994). Enciclopedia concisa de química . Walter de Gruyter. págs. 1–1201. ISBN 0-89925-457-8.
- ^ Publicación n.° 2016–171 del DHHS (NIOSH), pág. 2, consultado en noviembre de 2019
- ^ ab Hoydonckx, ÉL; Van Rhijn, WM; Van Rhijn, W.; De Vos, DE; Jacobs, PA "Furfural y derivados". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a12_119.pub2. ISBN 978-3527306732.
- ^ Senning, Alexander (2006). Diccionario de quimioetimología de Elsevier . Elsevier. ISBN 0-444-52239-5.
- ^ Limpricht, H. (1870). "Ueber das tetrafenol C4H4O". Berichte der Deutschen Chemischen Gesellschaft . 3 (1): 90–91. doi : 10.1002/cber.18700030129.
- ^ Rodd, Ernest Harry (1971). Química de los compuestos de carbono: un tratado moderno y completo . Elsevier.
- ^ Wilson, WC (1941). "Furan". Síntesis orgánicas; Volúmenes recopilados , vol. 1, pág. 274.
- ^ Hou, XL; Cheung, HY; Hon, TY; Kwan, PL; Lo, TH; Tong, SY; Wong, HN (1998). "Síntesis regioselectiva de furanos sustituidos". Tetrahedron . 54 (10): 1955–2020. doi :10.1016/S0040-4020(97)10303-9.
- ^ ab Gilchrist, Thomas L. (1997). Química heterocíclica (3.ª ed.). Liverpool: Longman. págs. 209-212.
- ^ Adam Sniady, Marco S. Morreale, Roman Dembinski (2007). "Ciclización electrofílica con N-yodosuccinimida: preparación de 5-(4-bromofenil)-3-yodo-2-(4-metil-fenil)furano". Organic Syntheses . 84 : 199. doi :10.15227/orgsyn.084.0199.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ James A. Marshall, Clark A. Sehon (1999). "Isomerización de alcoholes alílicos b-alquinílicos a furanos catalizados por nitrato de plata sobre gel de sílice: 2-pentil-3-metil-5-heptilfurano". Organic Syntheses . 76 : 263. doi :10.15227/orgsyn.076.0263.
- ^ Smith, Michael B.; March, Jerry (2007), Química orgánica avanzada: reacciones, mecanismos y estructura (6.ª ed.), Nueva York: Wiley-Interscience, pág. 62, ISBN 978-0-471-72091-1
- ^ Bruice, Paula Y. (2007). Química orgánica (5.ª ed.). Upper Saddle River, Nueva Jersey: Pearson Prentice Hall. ISBN 978-0-13-196316-0.
- ^ Masesane, I.; Batsanov, A.; Howard, J.; Modal, R.; Steel, P. (2006). "El enfoque del oxanorborneno para los derivados 3-hidroxi, 3,4-dihidroxi y 3,4,5-trihidroxi del ácido 2-aminociclohexanocarboxílico". Beilstein Journal of Organic Chemistry . 2 (9): 9. doi : 10.1186/1860-5397-2-9 . PMC 1524792 . PMID 16674802.
- ^ Filatov, MA; Baluschev, S.; Ilieva, IZ; Enkelmann, V.; Miteva, T.; Landfester, K. ; Aleshchenkov, SE; Cheprakov, AV (2012). "Tetraaryltetraanthra[2,3]porfirinas: síntesis, estructura y propiedades ópticas" (PDF) . J. Org. Chem . 77 (24): 11119–11131. doi :10.1021/jo302135q. PMID 23205621. Archivado desde el original (PDF) el 19 de febrero de 2020.
- ^ Harreus, Albrecht Ludwig. "Pirrol". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a22_453. ISBN 978-3527306732.
- ^ Anese, M.; Manzocco, L.; Calligaris, S.; Nicoli, MC (2013). "Estrategias aplicables industrialmente para mitigar la acrilamida, el furano y el 5-hidroximetilfurfural en los alimentos" (PDF) . Journal of Agricultural and Food Chemistry . 61 (43): 10209–14. doi :10.1021/jf305085r. PMID 23627283. Archivado desde el original (PDF) el 8 de agosto de 2017.
- ^ ab Moro, S.; Chipman, JK; Wegener, JW; Hamberger, C.; Dekant, W.; Mally, A. (2012). "Furano en alimentos tratados térmicamente: Formación, exposición, toxicidad y aspectos de la evaluación de riesgos" (PDF) . Molecular Nutrition & Food Research . 56 (8): 1197–1211. doi :10.1002/mnfr.201200093. hdl :1871/41889. PMID 22641279. S2CID 12446132.
- ^ Autoridad Europea de Seguridad Alimentaria (2011). «Actualización de los niveles de furano en los alimentos a partir de los años de seguimiento 2004-2010 y evaluación de la exposición». Revista EFSA . 9 (9): 2347. doi : 10.2903/j.efsa.2011.2347 .

- ^ Waizenegger, J.; Winkler, G.; Kuballa, T.; Ruge, W.; Kersting, M.; Alexy, U.; Lachenmeier, D.W. (2012). "Análisis y evaluación de riesgos de furano en productos de café destinados a adolescentes". Aditivos alimentarios y contaminantes: Parte A. 29 ( 1): 19–28. doi :10.1080/19440049.2011.617012. PMID 22035212. S2CID 29027966.
- ^ "Máquinas de café expreso: el café en cápsulas contiene más furano que el resto". Science Daily . 14 de abril de 2011.
- ^ ab Bakhiya, N.; Appel, KE (2010). "Toxicidad y carcinogenicidad del furano en la dieta humana" (PDF) . Archivos de toxicología . 84 (7): 563–578. doi :10.1007/s00204-010-0531-y. PMID 20237914. S2CID 19389984.
Enlaces externos
- Métodos sintéticos recientes







![Rosefuran, un compuesto aromático que se encuentra en el aceite de rosa.[10]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b6/Rosefuran-2D-skeletal.png/180px-Rosefuran-2D-skeletal.png)