Plerixafor
 | |
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Mozobil |
| Otros nombres | JM3100, AMD3100 |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a609018 |
| Datos de licencia |
|
Categoría de embarazo |
|
| Vías de administración | Subcutáneo |
| Código ATC |
|
| Estatus legal | |
| Estatus legal | |
| Datos farmacocinéticos | |
| Unión de proteínas | Hasta el 58% |
| Metabolismo | Ninguno |
| Vida media de eliminación | 3–5 horas |
| Excreción | Riñón |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD | |
| BARRIL | |
| EBICh |
|
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Datos químicos y físicos | |
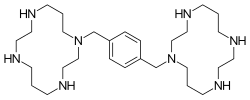
| Fórmula | C28H54N8 |
| Masa molar | 502,796 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
 norte norte Y (¿que es esto?) (verificar) Y (¿que es esto?) (verificar) | |
Plerixafor , comercializado bajo la marca Mozobil , es un inmunoestimulante que se utiliza para movilizar células madre hematopoyéticas en pacientes con cáncer hacia el torrente sanguíneo. Luego, las células madre se extraen de la sangre y se trasplantan al paciente. El fármaco fue desarrollado por AnorMED, que posteriormente fue adquirida por Genzyme .
Usos médicos
La movilización de células madre de sangre periférica, que es importante como fuente de células madre hematopoyéticas para el trasplante , generalmente se realiza utilizando el factor estimulante de colonias de granulocitos (G-CSF), pero es ineficaz en alrededor del 15 al 20% de los pacientes. La combinación de G-CSF con plerixafor aumenta el porcentaje de personas que responden a la terapia y producen suficientes células madre para el trasplante. [4] El fármaco está aprobado para pacientes con linfoma y mieloma múltiple . [5]
Los ensayos clínicos de fase 2 comenzaron en 2021 para explorar la combinación de plerixafor y MGTA-145, un ligando CXCL2 . [6] [7]
Contraindicaciones
Embarazo y lactancia
Los estudios realizados en animales gestantes han demostrado efectos teratogénicos . Por lo tanto, Plerixafor está contraindicado en mujeres embarazadas, excepto en casos críticos. Las mujeres fértiles deben utilizar métodos anticonceptivos . Se desconoce si el fármaco se excreta en la leche materna. La lactancia materna debe interrumpirse durante el tratamiento. [5]
Efectos adversos
En más del 10% de los pacientes se observaron náuseas , diarrea y reacciones locales. Otros problemas digestivos y síntomas generales como mareos, dolor de cabeza y dolor muscular también son relativamente comunes; se detectaron en más del 1% de los pacientes. Las alergias se producen en menos del 1% de los casos. La mayoría de los efectos adversos en los ensayos clínicos fueron leves y transitorios. [5] [8]
La Agencia Europea de Medicamentos ha enumerado una serie de cuestiones de seguridad que se deben evaluar después de la comercialización, en particular las posibilidades teóricas de rotura del bazo y movilización de células tumorales. La primera preocupación se ha planteado porque se observó esplenomegalia en estudios con animales y el G-CSF puede causar rotura del bazo en casos raros. Se ha producido movilización de células tumorales en pacientes con leucemia tratados con plerixafor. [9]
Interacciones
No se han realizado estudios de interacción. El hecho de que plerixafor no interactúe con el sistema del citocromo indica un bajo potencial de interacciones con otros fármacos. [5]
Farmacología
Mecanismo de acción
En forma de su complejo de zinc, plerixafor actúa como antagonista (o quizás más exactamente como agonista parcial ) del receptor de quimiocina alfa CXCR4 y como agonista alostérico de CXCR7 . [10] El receptor de quimiocina alfa CXCR4 y uno de sus ligandos , SDF-1 , son importantes en la localización de las células madre hematopoyéticas en la médula ósea y en la quiescencia de las células madre hematopoyéticas . Se desconoce el efecto in vivo de plerixafor con respecto a la ubiquitina , el ligando endógeno alternativo de CXCR4. Se ha descubierto que plerixafor es un fuerte inductor de la movilización de células madre hematopoyéticas desde la médula ósea al torrente sanguíneo como células madre de sangre periférica . [11] Además, plerixafor inhibe la expresión de CD20 en las células B al interferir con el eje CXCR4/SDF1 que regula su expresión. [ cita requerida ]
Farmacocinética
Tras la inyección subcutánea , el plerixafor se absorbe rápidamente y las concentraciones máximas se alcanzan después de 30 a 60 minutos. Hasta el 58% se une a las proteínas plasmáticas, el resto reside principalmente en compartimentos extravasculares . El fármaco no se metaboliza en cantidades significativas; no se ha encontrado interacción con las enzimas del citocromo P450 o las glicoproteínas P. La vida media plasmática es de 3 a 5 horas. El plerixafor se excreta por vía renal , y el 70% del fármaco se excreta en 24 horas. [5]
Química
Plerixafor es un compuesto macrocíclico y un derivado biciclam , cuyos anillos ciclamos están unidos en los átomos de nitrógeno de la amina por un espaciador 1,4- xililo . [4] Es una base; los ocho átomos de nitrógeno aceptan protones fácilmente. Los dos anillos macrocíclicos forman complejos quelatos con iones metálicos bivalentes, especialmente zinc , cobre y níquel , así como cobalto y rodio . La forma biológicamente activa de plerixafor es su complejo de zinc. [12]
Síntesis
Tres de los cuatro átomos de nitrógeno del macrociclo ciclamo... (1,4,8,11-tetraazaciclotetradecano) están protegidos con grupos tosilo . El producto se trata con 1,4-bis(bromometil)benceno y carbonato de potasio en acetonitrilo . Después de la escisión de los grupos tosilo con ácido bromhídrico , se obtiene octahidrobromuro de plerixafor. [13]
Historia
La molécula se sintetizó por primera vez en 1987 para llevar a cabo estudios básicos sobre la química redox de compuestos de coordinación dimetálicos. [14] Luego, otro químico descubrió por casualidad que dicha molécula podría tener un uso potencial en el tratamiento del VIH debido a su papel en el bloqueo de CXCR4, un receptor de quimiocina que actúa como correceptor para ciertas cepas del VIH (junto con el principal receptor celular del virus, CD4). [15] El desarrollo de esta indicación se interrumpió debido a la falta de disponibilidad oral y a los trastornos cardíacos . Estudios posteriores llevaron a la nueva indicación para pacientes con cáncer. [15]
Sociedad y cultura
Plerixafor tiene estatus de medicamento huérfano en los Estados Unidos y la Unión Europea para la movilización de células madre hematopoyéticas . Fue aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para esta indicación el 15 de diciembre de 2008. [16] En la Unión Europea, el medicamento fue aprobado después de un informe de evaluación positivo del Comité de Productos Medicinales para Uso Humano el 29 de mayo de 2009. [9] El medicamento fue aprobado para su uso en Canadá por Health Canada el 8 de diciembre de 2011. [17]
Investigación
Propiedades anticancerígenas
En varios estudios se observó que el plerixafor reducía la metástasis en ratones. [18] También se ha demostrado que reduce la recurrencia del glioblastoma en un modelo de ratón después de la radioterapia. En este modelo, las células cancerosas que sobrevivieron a la radiación dependían críticamente de las células derivadas de la médula ósea para la vasculogénesis, y el reclutamiento de estas últimas estaba mediado por interacciones SDF-1 CXCR4, que son bloqueadas por el plerixafor. [19]
Uso en la investigación con células madre
Los investigadores del Imperial College han demostrado que el plerixafor en combinación con el factor de crecimiento endotelial vascular (VEGF) puede movilizar células madre mesenquimales y células progenitoras endoteliales a la sangre periférica de ratones. [20]
En un estudio de 2020, los investigadores no encontraron evidencia de que el plerixafor ayudara a curar las úlceras por insuficiencia arterial relacionadas con la diabetes . [21]
Neurológico
También se ha descubierto inesperadamente que el bloqueo de la señalización CXCR4 por plerixafor es eficaz para contrarrestar la hiperalgesia inducida por opioides producida por el tratamiento crónico con morfina , aunque hasta ahora solo se han realizado estudios en animales. [22]
Referencias
- ^ "Actualizaciones de seguridad de la marca de la monografía del producto". Health Canada . Febrero de 2024 . Consultado el 24 de marzo de 2024 .
- ^ "Mozobil-plerixafor inyectable, solución". DailyMed . 26 de junio de 2023 . Consultado el 13 de septiembre de 2023 .
- ^ "Plerixafor Accord EPAR". Agencia Europea de Medicamentos . 12 de octubre de 2022 . Consultado el 7 de febrero de 2023 .
- ^ ab "Plerixafor: AMD 3100, AMD3100, JM 3100, SDZ SID 791". Medicamentos en I+D . 8 (2): 113–9. 2007. doi :10.2165/00126839-200708020-00006. PMID 17324009. S2CID 20824572.
- ^ abcde Haberfeld, H, ed. (2009). Austria-Codex (en alemán) (edición 2009/2010). Viena: Österreichischer Apothekerverlag. ISBN 978-3-85200-196-8.
- ^ Universidad de Stanford (16 de agosto de 2021). "Estudio de fase II de MGTA-145 en combinación con plerixafor en la movilización de células madre hematopoyéticas para trasplante autólogo en pacientes con mieloma múltiple".
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Magenta Therapeutics, Inc. (23 de agosto de 2021). "Estudio de fase II que evalúa la seguridad y eficacia de MGTA-145 en combinación con plerixafor para la movilización y el trasplante de células madre hematopoyéticas de donantes compatibles con HLA en receptores con neoplasias hematológicas". Programa Nacional de Donantes de Médula Ósea.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Wagstaff AJ (2009). "Plerixafor: en pacientes con linfoma no Hodgkin o mieloma múltiple". Drugs . 69 (3): 319–26. doi :10.2165/00003495-200969030-00007. PMID 19275275. S2CID 195684110.
- ^ ab "Informe de evaluación del CHMP sobre Mozobil" (PDF) . Agencia Europea de Medicamentos . Archivado desde el original (PDF) el 18 de junio de 2018 . Consultado el 12 de octubre de 2010 .
- ^ Kalatskaya I, Berchiche YA, Gravel S, Limberg BJ, Rosenbaum JS, Heveker N (mayo de 2009). "AMD3100 es un ligando CXCR7 con propiedades agonistas alostéricas". Farmacología molecular . 75 (5): 1240–7. doi :10.1124/mol.108.053389. PMID 19255243. S2CID 28540154.
- ^ Cashen AF, Nervi B, DiPersio J (febrero de 2007). "AMD3100: antagonista de CXCR4 y agente movilizador rápido de células madre". Future Oncology . 3 (1): 19–27. doi :10.2217/14796694.3.1.19. PMID 17280498.
- ^ Esté JA, Cabrera C, De Clercq E, Struyf S, Van Damme J, Bridger G, et al. (enero de 1999). "La actividad de diferentes derivados de bicyclam contra el virus de la inmunodeficiencia humana depende de su interacción con el receptor de quimiocina CXCR4". Farmacología molecular . 55 (1): 67–73. doi :10.1124/mol.55.1.67. PMID 9882699. S2CID 8565063.
- ^ WO 93012096, Bridger G, Padmanabhan S, Skerlj RT, Thornton DM, "Poliaminas cíclicas ligadas con actividad contra el VIH", publicada el 24 de junio de 1993, asignada a Johnson Matthey Public Limited Company
- ^ Ciampolini M, Fabbrizzi L, Perotti A, Poggi A, Seghi B, Zanobini F (1987). "Complejos de diníquel y dicobre con ligandos bis(ciclam) unidos a N,N. Un sistema ideal para la investigación de los efectos electrostáticos en el comportamiento redox de pares de iones metálicos". Química inorgánica . 26 (21): 3527–3533. doi :10.1021/ic00268a022.
- ^ ab Davies SL, Serradell N, Bolos J, Bayes M (2007). "Clorhidrato de plerixafor". Medicamentos del futuro . 32 (2): 123. doi :10.1358/dof.2007.032.02.1071897.
- ^ "Mozobil aprobado para el linfoma no Hodgkin y el mieloma múltiple" (Nota de prensa). Monthly Prescribing Reference. 18 de diciembre de 2008. Archivado desde el original el 6 de enero de 2009 . Consultado el 3 de enero de 2009 .
- ^ Aviso de información de cumplimiento
- ^ Smith MC, Luker KE, Garbow JR, Prior JL, Jackson E, Piwnica-Worms D, et al. (diciembre de 2004). "CXCR4 regula el crecimiento del cáncer de mama primario y metastásico". Cancer Research . 64 (23): 8604–12. doi : 10.1158/0008-5472.CAN-04-1844 . PMID 15574767.
- ^ Kioi M, Vogel H, Schultz G, Hoffman RM, Harsh GR, Brown JM (marzo de 2010). "La inhibición de la vasculogénesis, pero no de la angiogénesis, previene la recurrencia del glioblastoma después de la irradiación en ratones". The Journal of Clinical Investigation . 120 (3): 694–705. doi :10.1172/JCI40283. PMC 2827954 . PMID 20179352.
- ^ Pitchford SC, Furze RC, Jones CP, Wengner AM, Rankin SM (enero de 2009). "Movilización diferencial de subconjuntos de células progenitoras de la médula ósea". Cell Stem Cell . 4 (1): 62–72. doi :10.1016/j.stem.2008.10.017. hdl : 10044/1/23497 . PMID 19128793.
- ^ Bonora BM, Cappellari R, Mazzucato M, Rigato M, Grasso M, Menegolo M, et al. (septiembre de 2020). "Movilización de células madre con plerixafor y curación de heridas isquémicas diabéticas: un ensayo de fase IIa, aleatorizado, doble ciego y controlado con placebo". Medicina Traslacional de Células Madre . 9 (9): 965–973. doi :10.1002/sctm.20-0020. PMC 7445026 . PMID 32485785. S2CID 219285881.
- ^ Wilson NM, Jung H, Ripsch MS, Miller RJ, White FA (marzo de 2011). "La señalización de CXCR4 media la hiperalgesia táctil inducida por morfina". Cerebro, comportamiento e inmunidad . 25 (3): 565–73. doi :10.1016/j.bbi.2010.12.014. PMC 3039030 . PMID 21193025.
