Acrilonitrilo
| |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Prop-2-enonitrilo | |||
| Otros nombres | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.003.152 | ||
| Número CE |
| ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1093 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C3H3N | |||
| Masa molar | 53,064 g·mol −1 | ||
| Apariencia | Líquido incoloro | ||
| Densidad | 0,81 g/ cm3 | ||
| Punto de fusión | -84 °C (-119 °F; 189 K) | ||
| Punto de ebullición | 77 °C (171 °F; 350 K) | ||
| 70 g/l | |||
| registro P | 0,19 [2] | ||
| Presión de vapor | 83 mmHg [1] | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Carcinógeno ocupacional potencial tóxico reactivo inflamable [1] | ||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | -1 °C; 30 °F; 272 K | ||
| 471 °C (880 °F; 744 K) | |||
| Límites de explosividad | 3–17% | ||
| Dosis o concentración letal (LD, LC): | |||
LC 50 ( concentración media ) | 500 ppm (rata, 4 h) 313 ppm (ratón, 4 h) 425 ppm (rata, 4 h) [3] | ||
LC Lo ( valor más bajo publicado ) | 260 ppm (conejo, 4 h) 575 ppm (conejillo de indias, 4 h) 636 ppm (rata, 4 h) 452 ppm (humano, 1 h) [3] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 2 ppm C 10 ppm [15 minutos] [piel] [1] | ||
REL (recomendado) | Ca TWA 1 ppm C 10 ppm [15 minutos] [piel] [1] | ||
IDLH (Peligro inmediato) | 85 ppm [1] | ||
| Ficha de datos de seguridad (FDS) | ICSC 0092 | ||
| Compuestos relacionados | |||
Nitrilos relacionados | propionitrilo acetonitrilo | ||
Compuestos relacionados | acroleína de ácido acrílico | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
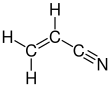
El acrilonitrilo es un compuesto orgánico con la fórmula CH 2 CHCN y la estructura H 2 C=CH−C≡N . Es un líquido incoloro y volátil . Tiene un olor penetrante a ajo o cebolla. [4] Su estructura molecular consiste en un grupo vinilo ( −CH=CH 2 ) unido a un nitrilo ( −C≡N ). Es un monómero importante para la fabricación de plásticos útiles como el poliacrilonitrilo . Es reactivo y tóxico a bajas dosis. [5]
El acrilonitrilo es uno de los componentes del plástico ABS (acrilonitrilo butadieno estireno) . [6]
Estructura y propiedades básicas
El acrilonitrilo es un compuesto orgánico con la fórmula CH 2 CHCN y la estructura H 2 C=CH−C≡N . Es un líquido incoloro y volátil aunque las muestras comerciales pueden ser amarillas debido a las impurezas . Tiene un olor penetrante a ajo o cebolla. [4] Su estructura molecular consiste en un grupo vinilo ( −CH=CH 2 ) unido a un nitrilo ( −C≡N ). Es un monómero importante para la fabricación de plásticos útiles como el poliacrilonitrilo . Es reactivo y tóxico a bajas dosis. [5]
Producción
El acrilonitrilo fue sintetizado por primera vez por el químico francés Charles Moureu en 1893. [7] El acrilonitrilo se produce mediante amoxidación catalítica de propileno , también conocida como proceso SOHIO . En 2002, la capacidad de producción mundial se estimó en 5 millones de toneladas por año, [5] [8] aumentando a alrededor de 6 millones de toneladas para 2017. [9] El acetonitrilo y el cianuro de hidrógeno son subproductos importantes que se recuperan para la venta. [5] De hecho, la escasez de acetonitrilo de 2008-2009 fue causada por una disminución en la demanda de acrilonitrilo. [10]
- 2 CH 3 −CH=CH 2 + 2 NH 3 + 3 O 2 → 2 CH 2 =CH−C≡N + 6 H 2 O
En el proceso SOHIO, el propileno , el amoníaco y el aire (oxidante) pasan a través de un reactor de lecho fluidizado que contiene el catalizador a 400–510 °C y 50–200 kPa g . Los reactivos pasan por el reactor solo una vez, antes de ser enfriados en ácido sulfúrico acuoso. El exceso de propileno, monóxido de carbono, dióxido de carbono y dinitrógeno que no se disuelven se ventilan directamente a la atmósfera o se incineran. La solución acuosa consta de acrilonitrilo, acetonitrilo, ácido cianhídrico y sulfato de amonio (del exceso de amoníaco). Una columna de recuperación elimina el agua a granel, y el acrilonitrilo y el acetonitrilo se separan por destilación. Uno de los primeros catalizadores útiles fue el fosfomolibdato de bismuto ( Bi 9 PMo 12 O 52 ) soportado en sílice. [11] Desde entonces se han realizado más mejoras. [5]
Rutas alternativas
Se están explorando varias rutas de química verde para el acrilonitrilo a partir de materias primas renovables, como biomasa lignocelulósica , glicerol (de la producción de biodiésel ) o ácido glutámico (que puede producirse a partir de materias primas renovables). La ruta lignocelulósica implica la fermentación de la biomasa a ácido propiónico y ácido 3-hidroxipropiónico , que luego se convierten en acrilonitrilo por deshidratación y amoxidación . [12] [9] La ruta del glicerol comienza con su deshidratación a acroleína , que sufre amoxidación para dar acrilonitrilo. [13] La ruta del ácido glutámico emplea la descarboxilación oxidativa al ácido 3-cianopropanoico, seguida de una descarbonilación-eliminación al acrilonitrilo. [14] De estos, la ruta del glicerol se considera ampliamente como la más viable, aunque ninguno de estos métodos verdes es comercialmente competitivo. [12] [13]
Usos
El acrilonitrilo se utiliza principalmente como monómero para preparar poliacrilonitrilo , un homopolímero , o varios copolímeros importantes , como el estireno-acrilonitrilo (SAN), el acrilonitrilo butadieno estireno (ABS), el acrilonitrilo estireno acrilato (ASA) y otros cauchos sintéticos como el acrilonitrilo butadieno (NBR). La hidrodimerización del acrilonitrilo [15] [16] produce adiponitrilo , utilizado en la síntesis de ciertos nailones :
- 2 CH 2 =CHCN + 2 e − + 2 H + → NCCH 2 −CH 2 −CH 2 −CH 2 CN
El acrilonitrilo también es un precursor en la fabricación de acrilamida y ácido acrílico . [5]
Síntesis de productos químicos
La hidrogenación del acrilonitrilo es una vía para obtener propionitrilo. La hidrólisis con ácido sulfúrico produce sulfato de acrilamida, CH=CHC(O)NH 2 ·H 2 SO 4 . Esta sal se puede convertir en acrilamida mediante tratamiento con una base o en acrilato de metilo mediante tratamiento con metanol . [5]
La reacción del acrilonitrilo con nucleófilos próticos es una vía común para la obtención de una variedad de productos químicos especiales. El proceso se denomina cianoetilación :
- YH + H 2 C = CHCN → Y − CH 2 −CH 2 CN
Los nucleófilos próticos típicos son los alcoholes , los tioles y, especialmente, las aminas . [17]
El acrilonitrilo y sus derivados, como el 2-cloroacrilonitrilo, son dienófilos en las reacciones de Diels-Alder .
Efectos sobre la salud
El acrilonitrilo es moderadamente tóxico con LD50 = 81 mg/kg (ratas). Sufre una polimerización explosiva . El material en combustión libera humos de cianuro de hidrógeno y óxidos de nitrógeno . Está clasificado como carcinógeno de clase 1 (carcinógeno) por la Agencia Internacional para la Investigación sobre el Cáncer (IARC), [18] y los trabajadores expuestos a altos niveles de acrilonitrilo en el aire son diagnosticados con mayor frecuencia con cáncer de pulmón que el resto de la población. [19] El acrilonitrilo es uno de los siete tóxicos en el humo del cigarrillo que están más asociados con la carcinogénesis del tracto respiratorio . [20] El mecanismo de acción del acrilonitrilo parece involucrar estrés oxidativo y daño oxidativo del ADN. [21] El acrilonitrilo aumenta el cáncer en pruebas de dosis altas en ratas y ratones machos y hembras [22] e induce apoptosis en células madre mesenquimales del cordón umbilical humano . [23]
Se evapora rápidamente a temperatura ambiente (20 °C) para alcanzar concentraciones peligrosas; la irritación de la piel , la irritación respiratoria y la irritación ocular son los efectos inmediatos de esta exposición. [24] Las vías de exposición para los humanos incluyen emisiones , escape de automóviles y humo de cigarrillo que pueden exponer al sujeto humano directamente si inhala o fuma. Las vías de exposición incluyen inhalación, oral y, en cierta medida, absorción dérmica (probado con humanos voluntarios y en estudios con ratas). [25] La exposición repetida causa sensibilización de la piel y puede causar daño al sistema nervioso central y al hígado . [24]
Existen dos procesos principales de excreción del acrilonitrilo. El método principal es la excreción en la orina, cuando el acrilonitrilo se metaboliza al conjugarse directamente con glutatión . El otro método es cuando el acrilonitrilo se convierte enzimáticamente en óxido de 2-cianoetileno, que producirá productos finales de cianuro que finalmente forman tiocianato , que se excreta a través de la orina. [25] Por lo tanto, la exposición se puede detectar mediante extracciones de sangre y muestras de orina. [18]
En julio de 2024, la Agencia Internacional para la Investigación sobre el Cáncer actualizó la clasificación del acrilonitrilo de "posiblemente cancerígeno" a "carcinógeno para los seres humanos". La Agencia encontró pruebas suficientes que lo vinculan con el cáncer de pulmón . [26] [27]
Incidentes
Una gran cantidad de acrilonitrilo (aproximadamente 6500 toneladas) se filtró de una planta industrial de polímeros propiedad de Aksa Akrilik después del violento terremoto del 17 de agosto de 1999 en Turquía. Más de 5000 personas se vieron afectadas y los animales expuestos murieron. [28] La fuga fue notada por la empresa solo 8 horas después del incidente. Los trabajadores de la salud no sabían sobre los efectos sobre la salud del acrilonitrilo y trataron de tratar a las víctimas con analgésicos y líquidos intravenosos. [29] Un abogado, Ayşe Akdemir, demandó a la empresa con 44 familias como demandantes. [29] Aksa Akrilik fue demandada por 200 residentes que fueron afectados por el acrilonitrilo. [30] La Asociación Médica Turca confirmó un aumento de los casos de cáncer en la zona , [30] ya que la tasa de cáncer en la zona afectada aumentó en un 80%, desde 1999 hasta abril de 2002. [29] En 2003, el propietario de Aksa Akrilik murió de cáncer de pulmón relacionado con la exposición al acrilonitrilo. [29] A partir de 2001, esta es la fuga de acrilonitrilo más grande conocida. [28]
Aparición
El acrilonitrilo no se forma de forma natural en la Tierra. Se ha detectado en niveles inferiores a ppm en sitios industriales. Persiste en el aire hasta una semana. Se descompone al reaccionar con el oxígeno y el radical hidroxilo para formar cianuro de formilo y formaldehído . [31] El acrilonitrilo es nocivo para la vida acuática . [24] Se ha detectado acrilonitrilo en la atmósfera de Titán , una luna de Saturno . [32] [33] [34] Las simulaciones por computadora sugieren que en Titán existen condiciones tales que el compuesto podría formar estructuras similares a las membranas celulares y vesículas de la Tierra, llamadas azotosomas. [32] [33]
Referencias
- ^ abcdefgh Guía de bolsillo del NIOSH sobre peligros químicos. "#0014". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Acrilonitrilo_msds".
- ^ ab "Acrilonitrilo". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ ab "Pautas de manejo médico para el acrilonitrilo". Agencia para Sustancias Tóxicas y Registro de Enfermedades . Consultado el 10 de junio de 2020 .
- ^ abcdefg Brazdil, James F. "Acrilonitrilo". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a01_177.pub3. ISBN 978-3527306732.
- ^ Campo, E. Alfredo (1 de enero de 2008), Campo, E. Alfredo (ed.), "1 - Propiedades y materiales poliméricos", Selección de materiales poliméricos , Biblioteca de diseño de plásticos, Norwich, Nueva York: William Andrew Publishing, págs. 1–39, doi :10.1016/b978-081551551-7.50003-6, ISBN 978-0-8155-1551-7, consultado el 20 de noviembre de 2023
- ^
- Moureu, C. (1893). "Contribution à l'étude de l'acide acrylique et de ses dérivés" [Contribución al estudio del ácido acrílico y de sus derivados]. Annales de chimie et de physique . 7mo. 2 : 145–212.Véanse especialmente las págs. 187-189 ("Nitrile acrylique ou cyanure de Vinyle (Propène-nitrile)").
- Moureu, C. (1893). "Nitrilo acrílico, cianuro de vinilo (propène-nitrilo)" [Nitrilo acrílico, cianuro de vinilo (propenenitrilo)]. Boletín de la Société Chimique de France . 3er. 9 : 424–427.
- ^ "El proceso de acrilonitrilo de Sohio". Monumentos históricos químicos nacionales de la Sociedad Química Estadounidense. Archivado desde el original el 23 de febrero de 2013. Consultado el 13 de mayo de 2013 .
- ^ ab Davey, Stephen G. (enero de 2018). "Sostenibilidad: una nueva y dulce ruta hacia el acrilonitrilo". Nature Reviews Chemistry . 2 (1): 0110. doi : 10.1038/s41570-017-0110 .
- ^ Tullo, A. (2008). "Un disolvente se seca". Chemical & Engineering News . 86 (47): 27. doi :10.1021/cen-v086n047.p027.
- ^ Grasselli, Robert K. (2014). "Aislamiento de sitios y cooperación de fases: dos conceptos importantes en la catálisis de oxidación selectiva: una retrospectiva". Catalysis Today . 238 : 10–27. doi :10.1016/j.cattod.2014.05.036.
- ^ ab Grasselli, Robert K.; Trifirò, Ferruccio (2016). "Acrilonitrilo a partir de biomasa: aún lejos de ser un proceso sostenible". Temas de catálisis . 59 (17–18): 1651–1658. doi :10.1007/s11244-016-0679-7. ISSN 1022-5528. S2CID 99550463.
- ^ ab Guerrero-Pérez, M. Olga; Bañares, Miguel A. (2015). "Métricas del acrilonitrilo: ruta de biomasa vs. ruta petroquímica". Catalysis Today . 239 : 25–30. doi :10.1016/j.cattod.2013.12.046. ISSN 0920-5861.
- ^ Le Nôtre, Jérôme; Scott, Elinor L.; Franssen, Maurice CR; Sanders, Johan PM (2011). "Síntesis de base biológica de acrilonitrilo a partir de ácido glutámico". Química verde . 13 (4): 807. doi :10.1039/c0gc00805b. ISSN 1463-9262.
- ^ Ellis, Paul G (1972). Un estudio químico-radiológico de la hidrodimerización del acrilonitrilo . Reino Unido: Leeds University, tesis doctoral.
- ^ Buxton, George V.; Ellis, Paul G.; McKillop, Thomas FW (1979). "Estudio de la radiólisis pulsátil del acrilonitrilo en solución acuosa". J. Chem. Soc., Faraday Trans. 1. 75 : 1050. doi :10.1039/f19797501050.
- ^ Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000). "Aminas alifáticas". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a02_001. ISBN 3527306730.
- ^ ab "Carcinogenicidad del talco y el acrilonitrilo". The Lancet, volumen 25, número 8 (2024)
- ^ Hoja informativa sobre el acrilonitrilo (N.° CAS 107-13-1). epa.gov
- ^ Cunningham FH, Fiebelkorn S, Johnson M, Meredith C. Una nueva aplicación del enfoque del margen de exposición: segregación de tóxicos del humo del tabaco. Food Chem Toxicol. 2011 Nov;49(11):2921-33. doi: 10.1016/j.fct.2011.07.019. Publicación electrónica 23 de julio de 2011. PMID 21802474
- ^ Pu X, Kamendulis LM, Klaunig JE. Estrés oxidativo inducido por acrilonitrilo y daño oxidativo del ADN en ratas Sprague-Dawley macho. Toxicol Sci. 2009;111(1):64-71. doi:10.1093/toxsci/kfp133
- ^ "Acrilonitrilo: base de datos de potencia cancerígena".
- ^ Sun, X. (enero de 2014). "Efectos citotóxicos del acrilonitrilo en células madre mesenquimales del cordón umbilical humano in vitro". Molecular Medicine Reports . 9 (1): 97–102. doi : 10.3892/mmr.2013.1802 . PMID 24248151.
- ^ abc "CDC – Acrilonitrilo – Fichas internacionales de seguridad química". www.cdc.gov . NIOSH . Consultado el 31 de julio de 2015 .
- ^ Hoja informativa sobre el acrilonitrilo: Documento de apoyo (N.° CAS 107-13-1). epa.gov
- ^ "La agencia de la OMS dice que el talco es 'probablemente' cancerígeno". Philippine Daily Inquirer . 6 de julio de 2024 . Consultado el 7 de julio de 2024 .
- ^ Stayner, Leslie T; Carreón-Valencia, Tania; Demers, Paul A; Fritz, Jason M; Sim, Malcolm R; Stewart, Patricia; Tsuda, Hiroyuki; Cárdenas, Andrés; Consonni, Darío; Davies, Laurie; De Matteis, Sara; Felley-Bosco, Emanuela; Ghio, Andrew J; Goen, Thomas; Grosse, Yann (5 de julio de 2024). "Carcinogenicidad del talco y acrilonitrilo". Oncología de The Lancet . doi :10.1016/s1470-2045(24)00384-x. ISSN 1470-2045.
- ^ ab Nadi Bakırcı (2001). "ENDÜSTRİYEL BİR ÇEVRE FELAKETİ: AKRİLONİTRİL" [UN DESASTRE EN EL MEDIO AMBIENTE INDUSTRIAL: ACRILONITRILO]. Asociación Médica Turca .
- ^ abcd Fatma Dalokay (30 de noviembre de 2020). "17 Ağustos 1999 Depremi: Akrilonitril Zehirlenmesi" [Terremoto del 17 de agosto de 1999: intoxicación por acrilonitrilo]. Tablala .
- ^ ab "İSO'nun şaşırtan çevre ödülü Aksa'nın". Hürriyet . 26 de junio de 2005.
- ^ Grosjean, Daniel (diciembre de 1990). "Química atmosférica de contaminantes tóxicos. 3. Compuestos alifáticos insaturados: acroleína, acrilonitrilo, anhídrido maleico". Revista de la Asociación de Gestión del Aire y los Residuos . 40 (12): 1664–1669. Bibcode :1990JAWMA..40.1664G. doi :10.1080/10473289.1990.10466814.
- ^ ab Wall, Mike (28 de julio de 2017). "La luna Titán de Saturno tiene moléculas que podrían ayudar a crear membranas celulares". Space.com . Consultado el 29 de julio de 2017 .
- ^ ab Palmer, Maureen Y.; et al. (28 de julio de 2017). "Detección mediante ALMA y potencial astrobiológico del cianuro de vinilo en Titán". Science Advances . 3 (7): e1700022. Bibcode :2017SciA....3E0022P. doi :10.1126/sciadv.1700022. PMC 5533535 . PMID 28782019.
- ^ Kaplan, Sarah (8 de agosto de 2017). «Esta extraña luna de Saturno tiene algunos ingredientes esenciales para la vida». The Washington Post . Consultado el 8 de agosto de 2017 .
Enlaces externos
- Inventario Nacional de Contaminantes – Acrilonitrilo
- Comparación de los posibles riesgos de cáncer derivados de la exposición humana a carcinógenos de roedores Archivado el 3 de septiembre de 2012 en Wayback Machine
- Acrilonitrilo – Sistema integrado de información sobre riesgos, Agencia de Protección Ambiental de Estados Unidos
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos: acrilonitrilo
- Tabla Z-1 de OSHA para contaminantes del aire