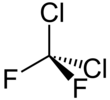
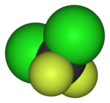
Diclorodifluorometano
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Diclorodi(fluoro)metano | |||
Otros nombres
| |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.000.813 | ||
| Número CE |
| ||
| Número E | E940 (agentes de recubrimiento, ...) | ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
| Número de la ONU | 1028 | ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| CCl2F2 | |||
| Masa molar | 120,91 g·mol −1 | ||
| Apariencia | Gas incoloro | ||
| Olor | similar al éter en concentraciones muy altas | ||
| Densidad | 1,486 g/cm3 ( −29,8 °C (−21,6 °F)) | ||
| Punto de fusión | -157,7 °C (-251,9 °F; 115,5 K) | ||
| Punto de ebullición | -29,8 °C (-21,6 °F; 243,3 K) | ||
| 0,286 g/L a 20 °C (68 °F) | |||
| Solubilidad en alcohol, éter, benceno, ácido acético. | Soluble | ||
| registro P | 2.16 | ||
| Presión de vapor | 568 kPa (20 °C (68 °F)) | ||
Constante de la ley de Henry ( k H ) | 0,0025 mol kg -1 bar -1 | ||
| −52,2·10 −6 cm3 / mol | |||
| Conductividad térmica | 0,0097 W/(m·K) (300 K) [1] | ||
| Estructura | |||
| Tetraédrico | |||
| 0,51 D [2] | |||
| Peligros | |||
| Etiquetado SGA : | |||
  | |||
| Advertencia | |||
| H280 , H336 , H420 | |||
| P261 , P271 , P304+P340 , P319 , P403+P233 , P405 , P410+P403 , P501 , P502 | |||
| NFPA 704 (rombo cortafuegos) | |||
| punto de inflamabilidad | No inflamable [3] | ||
| Dosis o concentración letal (LD, LC): | |||
LC 50 ( concentración media ) | 760.000 ppm (ratón, 30 min) 800.000 ppm (conejo, 30 min) 800.000 ppm (conejillo de indias, 30 min) 600.000 ppm (rata, 2 h ) [4] | ||
| NIOSH (límites de exposición a la salud en EE. UU.): | |||
PEL (Permisible) | TWA 1000 ppm (4950 mg/m3 ) [ 3] | ||
REL (recomendado) | TWA 1000 ppm (4950 mg/m3 ) [ 3] | ||
IDLH (Peligro inmediato) | 15000 ppm [3] | ||
| Página de datos complementarios | |||
| Diclorodifluorometano (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
El diclorodifluorometano ( R-12 ) es un gas incoloro que se vende habitualmente bajo la marca Freón-12 y un halometano clorofluorocarbonado (CFC) utilizado como refrigerante y propulsor de aerosoles . En cumplimiento del Protocolo de Montreal , su fabricación se prohibió en los países desarrollados (países no incluidos en el Artículo 5) en 1996, y en los países en desarrollo (países incluidos en el Artículo 5) en 2010 debido a las preocupaciones sobre su efecto dañino sobre la capa de ozono . [5] Su único uso permitido es como retardante de fuego en submarinos y aviones. Es soluble en muchos disolventes orgánicos . Los cilindros de R-12 son de color blanco.
Preparación
Se puede preparar haciendo reaccionar tetracloruro de carbono con fluoruro de hidrógeno en presencia de una cantidad catalítica de pentacloruro de antimonio :
- CCl4 + 2HF → CCl2F2 + 2HCl
Esta reacción también puede producir triclorofluorometano (CCl 3 F), clorotrifluorometano (CClF 3 ) y tetrafluorometano (CF 4 ). [6]
Historia
Charles F. Kettering , vicepresidente de General Motors Research Corporation, buscaba un sustituto de refrigerante que fuera incoloro, inodoro, insípido, no tóxico y no inflamable. Reunió un equipo que incluía a Thomas Midgley Jr. , Albert Leon Henne y Robert McNary. De 1930 a 1935, desarrollaron diclorodifluorometano (CCl 2 F 2 o R12), triclorofluorometano (CCl 3 F o R11), clorodifluorometano (CHClF 2 o R22), triclorotrifluoroetano (CCl 2 FCClF 2 o R113) y diclorotetrafluoroetano (CClF 2 CClF 2 o R114), a través de Kinetic Chemicals , que era una empresa conjunta entre DuPont y General Motors . [7]
Utilizar como aerosol
La Administración de Alimentos y Medicamentos de Estados Unidos ha eliminado gradualmente el uso de clorofluorocarbonos como aerosoles en medicina, como el salbutamol aprobado por la USP . Se eligió un propulsor diferente conocido como hidrofluoroalcano o HFA, que no se sabía que dañara el medio ambiente, para reemplazarlo. [8]
Modernización
El R-12 se utilizó en la mayoría de las aplicaciones de refrigeración y aire acondicionado de vehículos antes de 1994 antes de ser reemplazado por 1,1,1,2-tetrafluoroetano (R-134a), que tiene un potencial insignificante de agotamiento de la capa de ozono . Los fabricantes de automóviles comenzaron a utilizar R-134a en lugar de R-12 en 1992-1994. Cuando las unidades más antiguas tienen fugas o requieren reparación que implique la eliminación del refrigerante, en algunas jurisdicciones se requiere la modernización a un refrigerante distinto del R-12 (más comúnmente R-134a). Estados Unidos no exige a los propietarios de automóviles que modernicen sus sistemas; sin embargo, los impuestos sobre los productos químicos que agotan la capa de ozono junto con la relativa escasez de los refrigerantes originales en el mercado abierto hacen que la modernización sea la única opción económica. La modernización requiere una limpieza del sistema y un nuevo filtro/secador o acumulador, y también puede implicar la instalación de nuevos sellos y/o mangueras hechas de materiales compatibles con el refrigerante que se está instalando. El aceite mineral utilizado con R-12 no es compatible con R-134a. Algunos aceites diseñados para la conversión a R-134a se anuncian como compatibles con el aceite mineral R-12 residual. Otro sustituto del R-12 es el HC-12a , altamente inflamable, pero realmente de uso directo , cuya inflamabilidad ha provocado lesiones y muertes en un incendio de autobús en 2006. [9] [10]
Peligros
Además de sus impactos ambientales, el R12, como la mayoría de los clorofluoroalcanos, forma gas fosgeno cuando se expone a una llama abierta. [11]
Propiedades
Tabla de propiedades térmicas y físicas del refrigerante líquido saturado 12: [12] [13]
| Temperatura (°C) | Densidad (kg/m3) | Calor específico (kJ/kg·K) | Viscosidad cinemática (m^2/s) | Conductividad (W/m·K) | Difusividad térmica (m^2/s) | Número de Prandtl | Módulo volumétrico (K^-1) |
| -50 | 1546,75 | 0,875 | 3.10E-07 | 0,067 | 5.01E-01 | 6.2 | 2.63E-03 |
| -40 | 1518,71 | 0,8847 | 2.79E-07 | 0,069 | 5.14E-01 | 5.4 | - |
| -30 | 1489,56 | 0,8956 | 2.53E-07 | 0,069 | 5.26E-01 | 4.8 | - |
| -20 | 1460,57 | 0,9073 | 2.35E-07 | 0,071 | 5.39E-01 | 4.4 | - |
| -10 | 1429,49 | 0,9203 | 2.21E-07 | 0,073 | 5.50E-01 | 4 | - |
| 0 | 1397,45 | 0,9345 | 2.14E-07 | 0,073 | 5.57E-01 | 3.8 | - |
| 10 | 1364.3 | 0,9496 | 2.03E-07 | 0,073 | 5.60E-01 | 3.6 | - |
| 20 | 1330.18 | 0,9659 | 1.98E-07 | 0,073 | 5.60E-01 | 3.5 | - |
| 30 | 1295.1 | 0,9835 | 1.94E-07 | 0,071 | 5.60E-01 | 3.5 | - |
| 40 | 1257.13 | 1.0019 | 1.91E-07 | 0,069 | 5.55E-01 | 3.5 | - |
| 50 | 1215,96 | 1.0216 | 1.90E-07 | 0,067 | 5.45E-01 | 3.5 | - |
Galería
- CFC-12 medido por el Experimento Avanzado de Gases Atmosféricos Globales (AGAGE) en la atmósfera inferior ( troposfera ) en estaciones de todo el mundo. Las abundancias se expresan como fracciones molares medias mensuales libres de contaminación en partes por billón .
- Concentraciones medias hemisféricas y globales de CFC-12 (NOAA/ESRL)
- Series temporales de concentraciones atmosféricas de CFC-12 (Walker et al. , 2000)
- Concentración de CFC-12 en la superficie del mar en los años 1990
- Inventario vertical oceánico de CFC-12 de la década de 1990
- Perfiles verticales CFC-12, CFC-11, H-1211 y SF 6
Referencias
- ^ Touloukian, YS, Liley, PE y Saxena, SC Propiedades termofísicas de la materia: serie de datos TPRC. Volumen 3. Conductividad térmica: líquidos y gases no metálicos. Libro de datos. 1970.
- ^ Khristenko, Sergei V.; Maslov, Alexander I. y Viatcheslav P. Shevelko; Moléculas y sus propiedades espectroscópicas , pág. 74 ISBN 3642719481 .
- ^ abcd Guía de bolsillo del NIOSH sobre peligros químicos. "#0192". Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "Diclorodifluorometano". Concentraciones inmediatamente peligrosas para la vida o la salud (IDLH) . Instituto Nacional de Seguridad y Salud Ocupacional (NIOSH).
- ^ "1: Actualización sobre sustancias que agotan la capa de ozono (SAO) y otros gases de interés para el Protocolo de Montreal". Evaluación científica del agotamiento de la capa de ozono: 2018 (PDF) (Proyecto mundial de investigación y vigilancia del ozono, informe n.º 58, ed.). Ginebra (Suiza): Organización Meteorológica Mundial. 2018. pág. 1.10. ISBN 978-1-7329317-1-8. Recuperado el 22 de noviembre de 2020 .
- ^ Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 304. ISBN 978-0-08-037941-8.
- ^ Plunkett, Roy J. (1986). Polímeros de alto rendimiento: su origen y desarrollo . Elsevier Science Publishing Co., Inc., págs. 261-262. ISBN 978-94-011-7073-4.
- ^ "Reemplazos de inhaladores para el asma en Pensilvania - Pittsburgh Tribune-Review". 16 de febrero de 2007. Archivado desde el original el 16 de febrero de 2007. Consultado el 26 de abril de 2022 .
- ^ "Se cumplen 13 años de la Tragedia de la Cresta". Ensegundos.com.pa . 23 de octubre de 2019.
- ^ "Recordaron a víctimas de la tragedia de La Cresta". M.metrolibra.com . Consultado el 26 de abril de 2022 .
- ^ "Falsas alarmas: el legado del gas fosgeno". Escuela de HVAC . 4 de enero de 2021 . Consultado el 9 de mayo de 2022 .
- ^ Holman, Jack P. (2002). Transferencia de calor (novena edición). Nueva York, NY: McGraw-Hill Companies, Inc., págs. 600-606. ISBN 9780072406559.
- ^ Incropera 1 Dewitt 2 Bergman 3 Lavigne 4 Frank P. 1 David P. 2 Theodore L. 3 Adrienne S. 4 (2007). Fundamentos de transferencia de calor y masa (6.ª ed.). Hoboken, Nueva Jersey: John Wiley and Sons, Inc., págs. 941–950. ISBN 9780471457282.
{{cite book}}: CS1 maint: nombres numéricos: lista de autores ( enlace )
Enlaces externos
- Mediciones globales de CFC-12 de la NOAA/ESRL
- Ficha internacional de seguridad química 0048
- Descripción general del Freón-12 y algunos de sus problemas ambientales
- Hojas de datos de seguridad de materiales en la Universidad de Oxford
- Datos de termoquímica en chemnet.ru
- Espectros de absorción IR
- CDC - Guía de bolsillo de NIOSH sobre peligros químicos