Hidantoína
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido Imidazolidina-2,4-diona | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.006.650 | ||
| BARRIL | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD |
| ||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C3H4N2O2 | |||
| Masa molar | 100,077 g·mol −1 | ||
| Punto de fusión | 220 °C (428 °F; 493 K) | ||
| 39,7 g/l (100 °C) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
La hidantoína , o glicolilurea , es un compuesto orgánico heterocíclico con la fórmula CH2C ( O)NHC(O)NH. Es un sólido incoloro que surge de la reacción del ácido glicólico y la urea . Es un derivado oxidado de la imidazolidina . En un sentido más general, las hidantoínas pueden referirse a grupos o una clase de compuestos con la misma estructura de anillo que el compuesto original. Por ejemplo, la fenitoína (mencionada a continuación) tiene dos grupos fenilo sustituidos en el carbono número 5 en una molécula de hidantoína. [1]
Síntesis
La hidantoína fue aislada por primera vez en 1861 por Adolf von Baeyer durante su estudio del ácido úrico . La obtuvo por hidrogenación de la alantoína , de ahí su nombre.
Friedrich Urech sintetizó la 5-metilhidantoína en 1873 a partir de sulfato de alanina y cianato de potasio en lo que ahora se conoce como la síntesis de hidantoína de Urech . [2] El método es muy similar a la ruta moderna que utiliza cianohidrinas de alquilo y arilo. El compuesto 5,5-dimetil también se puede obtener a partir de cianhidrina de acetona (también descubierta por Urech: ver reacción de cianhidrina ) y carbonato de amonio . [3] Este tipo de reacción se llama reacción de Bucherer-Bergs . [4] [5]
La hidantoína también se puede sintetizar calentando la alantoína con ácido yodhídrico o calentando bromacetilurea con amoníaco alcohólico. [6] La estructura cíclica de las hidantoínas fue confirmada por Dorothy Hahn en 1913. [7]
De importancia práctica, las hidantoínas se obtienen por condensación de una cianhidrina con carbonato de amonio . Otra vía útil, que sigue el trabajo de Urech, implica la condensación de aminoácidos con cianatos e isocianatos:
Usos y ocurrencia
Productos farmacéuticos
El grupo de la hidantoína se puede encontrar en varios compuestos importantes desde el punto de vista medicinal. [1] En productos farmacéuticos, los derivados de la hidantoína forman una clase de anticonvulsivos ; [8] tanto la fenitoína como la fosfenitoína contienen fracciones de hidantoína y ambas se utilizan como anticonvulsivos en el tratamiento de trastornos convulsivos. El derivado de la hidantoína, el dantroleno, se utiliza como relajante muscular para tratar la hipertermia maligna , el síndrome neuroléptico maligno , la espasticidad y la intoxicación por éxtasis . La ropitoína es un ejemplo de una hidantoína antiarrítmica .
Pesticidas
El derivado de la hidantoína, la imiprotrina, es un insecticida piretroide . La iprodiona es un fungicida popular que contiene el grupo de las hidantoínas. [9]
Síntesis de aminoácidos
La hidrólisis de las hidantoínas proporciona los aminoácidos:
La hidantoína reacciona con ácido clorhídrico caliente y diluido para formar glicina . La metionina se produce industrialmente a partir de la hidantoína obtenida a partir del metional . [9]
Metilación
La metilación de la hidantoína produce una variedad de derivados. La dimetilhidantoína (DMH) [10] puede referirse a cualquier derivado dimetílico de la hidantoína, pero especialmente a la 5,5-dimetilhidantoína . [11]
Halogenación
Algunos derivados N -halogenados de la hidantoína se utilizan como agentes clorantes o bromantes en productos desinfectantes /sanitizantes o biocidas . Los tres principales derivados N -halogenados son la diclorodimetilhidantoína (DCDMH), la bromoclorodimetilhidantoína (BCDMH) y la dibromodimetilhidantoína (DBDMH). Un análogo de etil-metilo mixto, la 1,3-dicloro-5-etil-5-metilimidazolidina-2,4-diona ( bromocloroetilmetilhidantoína ), también se utiliza en mezclas con los anteriores.

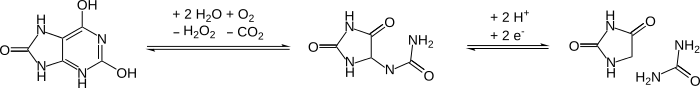
Oxidación del ADN a hidantoínas después de la muerte celular
Una gran proporción de bases de citosina y timina en el ADN se oxidan a hidantoínas con el tiempo después de la muerte de un organismo. Estas modificaciones bloquean las ADN polimerasas y, por lo tanto, impiden que la PCR funcione. Este daño es un problema cuando se trabaja con muestras de ADN antiguas. [12]
Enlaces externos y lectura adicional
- Ware, Elinor (1950). "La química de las hidantoínas". Chem. Rev. 46 (3): 403–470. doi :10.1021/cr60145a001. PMID 24537833.
- [1] Archivado el 18 de octubre de 2020 en Wayback Machine Traducción al inglés de un artículo de revisión alemán de 1926 sobre la preparación de hidantoínas de Heinrich Biltz y Karl Slotta
Referencias
- ^ ab Konnert, Laure; Lamaty, Frédéric; Martinez, Jean; Colacino, Evelina (2017). "Avances recientes en la síntesis de hidantoínas: el estado del arte de un valioso andamiaje" (PDF) . Chemical Reviews . 117 (23): 13757–13809. doi :10.1021/acs.chemrev.7b00067. PMID 28644621. S2CID 23653941.
- ^ Urech, Friedrich (1873). "Ueber Lacturaminsäure und Lactylharnstoff". Liebigs Ann. (en alemán). 165 (1): 99-103. doi :10.1002/jlac.18731650110.
- ^ Wagner, EC; Baizer, Manuel (1940). "5,5-Dimetilhidantoína". Síntesis orgánicas . 20 : 42. doi :10.15227/orgsyn.020.0042; Volúmenes recopilados , vol. 3, pág. 323.
- ^ Bucherer, HT ; Steiner, W. (1934). " J. Prakt. Chem. " (en alemán). 140 : 291.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ Bergs, alemán. palmadita. 566.094 ( 1929 ) [CA, 27, 1001 ( 1933 )].
- ^ Chisholm, Hugh , ed. (1911). . Encyclopædia Britannica . Vol. 14 (11.ª ed.). Cambridge University Press. págs. 29–30.
- ^ Oakes, Elizabeth H. (2007). Enciclopedia de científicos del mundo . Datos archivados . pág. 298. ISBN 9780816061587.
- ^ "Anticonvulsivos hidantoína". drugs.com .
- ^ ab Drauz, Karlheinz; Grayson, Ian; Kleemann, Axel; Krimmer, Hans-Peter; Leuchtenberger, Wolfgang; Weckbecker, Christoph (2007). "Aminoácidos". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a02_057.pub2. ISBN 978-3527306732.
- ^ "5,5-dimetilhidantoína (DMH), un estabilizador de halógeno altamente eficaz para aplicaciones de extremo húmedo, PaperCo".
- ^ "5,5-Dimetilhidantoína".
- ^ Hofreiter, Michael; Serré, David; Poinar, Hendrik N.; Kuch, Melanie; Pääbo, Svante (2001). "ADN antiguo". Naturaleza Reseñas Genética . 2 (5): 353–359. doi :10.1038/35072071. PMID 11331901. S2CID 205016024.