azul de Prusia
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Hexacianuroferrato de hierro (II,III) (II,III) | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.034.418 |
| Número CE |
|
| 1093743 | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C18Fe7N18 | |
| Masa molar | 859,239 g·mol −1 |
| Apariencia | Cristales azules opacos |
| Insoluble | |
| Estructura | |
| Cúbica centrada en las caras, cF43 | |
| Fm 3 m, n.º 225 [1] | |
| Farmacología | |
| V03AB31 ( OMS ) | |
| Oral | |
| Peligros | |
| Ficha de datos de seguridad (FDS) | Ficha de datos de seguridad del azul de Prusia |
| Compuestos relacionados | |
Otros cationes | Ferrocianuro de potasio |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El azul de Prusia (también conocido como azul de Berlín , azul de Brandeburgo , azul parisino y azul de París ) es un pigmento azul oscuro producido por oxidación de sales de ferrocianuro ferroso . Su fórmula química es FeIII
4[FeII
( CN )
6]
3El azul de Turnbull es químicamente idéntico, pero está hecho de diferentes reactivos y su color ligeramente diferente se debe a diferentes impurezas y tamaños de partículas.
El azul de Prusia se creó a principios del siglo XVIII y es el primer pigmento sintético moderno . Se prepara como una dispersión coloidal muy fina , porque el compuesto no es soluble en agua. Contiene cantidades variables [2] de otros iones y su apariencia depende sensiblemente del tamaño de las partículas coloidales. El pigmento se utiliza en pinturas , se hizo prominente en las xilografías japonesas aizuri-e (藍摺り絵) del siglo XIX y es el "azul" tradicional en los planos técnicos .
En medicina, el azul de Prusia administrado por vía oral se utiliza como antídoto para ciertos tipos de intoxicación por metales pesados , por ejemplo, por talio (I) e isótopos radiactivos de cesio . La terapia explota las propiedades de intercambio iónico del azul de Prusia y su alta afinidad por ciertos cationes metálicos " blandos " . Está en la Lista de Medicamentos Esenciales de la Organización Mundial de la Salud , los medicamentos más importantes necesarios en un sistema de salud básico . [3]
El azul de Prusia debe su nombre al ácido prúsico (cianuro de hidrógeno) derivado de él. En alemán, el cianuro de hidrógeno se llama Blausäure ('ácido azul'). El cianuro también obtuvo su nombre de esta relación.
Historia

El pigmento azul de Prusia es importante porque fue el primer pigmento azul estable y relativamente resistente a la luz que se utilizó ampliamente desde la pérdida de conocimiento sobre la síntesis del azul egipcio . Los pintores europeos habían utilizado anteriormente una serie de pigmentos como el tinte índigo , el esmalte y el púrpura de Tiro , y el extremadamente caro ultramar hecho de lapislázuli . Los pintores japoneses y los artistas de la impresión en madera , del mismo modo, no tuvieron acceso a un pigmento azul de larga duración hasta que comenzaron a importar azul de Prusia de Europa. [4]
Azul de Prusia Fe
7( CN )
18(también ( Fe
4[Fe(CN)
6]
3) · xAl
2El pigmento O ) fue probablemente sintetizado por primera vez por el fabricante de pinturas Johann Jacob Diesbach en Berlín alrededor de 1706. [5] [6] Se cree que el pigmento se creó accidentalmente cuando Diesbach utilizó potasa contaminada con sangre para crear un tinte rojo de cochinilla . El tinte original requería potasa, sulfato férrico y cochinilla seca. En cambio, la sangre, la potasa y el sulfato de hierro reaccionaron para crear un compuesto conocido como ferrocianuro de hierro, que, a diferencia del pigmento rojo deseado, tiene un tono azul muy distintivo. [7] Su primer comerciante lo denominó Preußisch blau y Berlinisch Blau en 1709. [8] [9] [10]
El pigmento reemplazó rápidamente al costoso azul ultramar derivado del lapislázuli y fue un tema importante en las cartas intercambiadas entre Johann Leonhard Frisch y el presidente de la Academia Prusiana de Ciencias , Gottfried Wilhelm Leibniz , entre 1708 y 1716. [8] Se menciona por primera vez en una carta escrita por Frisch a Leibniz, del 31 de marzo de 1708. A más tardar en 1708, Frisch comenzó a promover y vender el pigmento en toda Europa. En agosto de 1709, el pigmento había sido denominado Preussisch blau ; en noviembre de 1709, Frisch había utilizado por primera vez el nombre alemán Berlinisch Blau . El propio Frisch es el autor de la primera publicación conocida del azul de Prusia en el periódico Notitia Coerulei Berolinensis nuper inventi en 1710, como se puede deducir de sus cartas. Diesbach había estado trabajando para Frisch desde aproximadamente 1701.

Hasta la fecha, el Entierro de Cristo , fechado en 1709 por Pieter van der Werff (Pinacoteca de Sanssouci , Potsdam), es la pintura más antigua conocida en la que se utilizó el azul de Prusia. Alrededor de 1710, los pintores de la corte prusiana ya utilizaban el pigmento. Casi al mismo tiempo, el azul de Prusia llegó a París, donde Antoine Watteau y más tarde sus sucesores Nicolas Lancret y Jean-Baptiste Pater lo utilizaron en sus pinturas. [5] [11] François Boucher utilizó el pigmento ampliamente tanto para azules como para verdes. [12]
En 1731, Georg Ernst Stahl publicó un relato de la primera síntesis del azul de Prusia. [13] La historia no solo involucra a Diesbach, sino también a Johann Konrad Dippel . Diesbach estaba intentando crear un pigmento de laca roja a partir de cochinilla, pero obtuvo el azul como resultado de la potasa contaminada que estaba usando. Tomó prestada la potasa de Dippel, quien la había usado para producir su aceite animal . Ninguna otra fuente histórica conocida menciona a Dippel en este contexto. Por lo tanto, es difícil juzgar la confiabilidad de esta historia hoy. En 1724, la receta fue finalmente publicada por John Woodward. [14] [15] [16]
En 1752, el químico francés Pierre J. Macquer dio el importante paso de demostrar que el azul de Prusia podía reducirse a una sal de hierro y un nuevo ácido, que podía usarse para reconstituir el tinte. [17] El nuevo ácido, el cianuro de hidrógeno , aislado por primera vez del azul de Prusia en forma pura y caracterizado en 1782 por el químico sueco Carl Wilhelm Scheele , [18] recibió finalmente el nombre de Blausäure (literalmente "ácido azul") debido a su derivación del azul de Prusia, y en inglés se lo conoció popularmente como ácido prúsico. El cianuro , un anión incoloro que se forma en el proceso de elaboración del azul de Prusia, deriva su nombre de la palabra griega para azul oscuro.
A fines del siglo XIX, el rabino Gershon Henoch Leiner , el Rebe jasídico de Radzin , tiñó tzitziot con azul de Prusia hecho con sepia , creyendo que este era el verdadero tinte techeiles . Aunque algunos han cuestionado su identidad como techeiles debido a su producción artificial, y afirmaron que si el rabino Leiner hubiera estado al tanto de esto se habría retractado de su posición de que su tinte era techeiles, [19] otros han cuestionado esto y afirmado que el rabino Leiner no se habría retractado. [20]
Símbolo militar

Desde principios del siglo XVIII, el azul de Prusia fue el color predominante en los uniformes de los regimientos de infantería y artillería del ejército prusiano . [21] Como Dunkelblau (azul oscuro), este tono alcanzó una importancia simbólica y continuó siendo usado por la mayoría de los soldados alemanes para ocasiones ceremoniales y fuera de servicio hasta el estallido de la Primera Guerra Mundial , cuando fue reemplazado por el gris verdoso ( Feldgrau ). [22]
Síntesis
El azul de Prusia se produce por oxidación de sales de ferrocianuro ferroso. Estos sólidos blancos tienen la fórmula M
2Fe[Fe(CN)
6] donde M+
= N/A+
o K+
El hierro de este material es totalmente ferroso, de ahí la ausencia del color intenso asociado con la valencia mixta. La oxidación de este sólido blanco con peróxido de hidrógeno o clorato de sodio produce ferricianuro y da lugar al azul de Prusia. [23]
Una forma "soluble", KFe III [Fe II (CN)
6] , que es realmente coloidal , se puede fabricar a partir de ferrocianuro de potasio y hierro (III):
- K+
+ Fe3+
+ [Fe II (CN)
6]4−
→ KFe III [Fe II (CN)
6]
La reacción similar del ferricianuro de potasio y el hierro (II) da como resultado la misma solución coloidal, porque [Fe III (CN)
6]3−
se convierte en ferrocianuro.
El azul de Prusia "insoluble" se obtiene si, en las reacciones anteriores, se añade un exceso de Fe3+
se añade:
- 4 Fe3+
+ 3 [Fe II (CN)
6]4−
→ Fe III [Fe III Fe II (CN)
6]
3 [24]
A pesar de que se prepara a partir de sales de cianuro, el azul de Prusia no es tóxico porque los grupos cianuro están fuertemente unidos al hierro. [25] Tanto el ferrocianuro ((Fe II (CN) 6 ) 4− ) como el ferricianuro ((Fe III (CN) 6 ) 3− ) son cianometalatos poliméricos particularmente estables y no tóxicos debido a la fuerte coordinación del hierro con los iones cianuro. Aunque el cianuro se une bien con los metales de transición en general, como el cromo, estos compuestos de coordinación sin hierro no son tan estables como los cianuros de hierro, por lo que aumentan el riesgo de liberar iones CN − y, posteriormente, la toxicidad comparativa. [26]
El azul de Turnbull
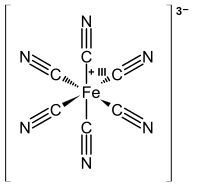
Antiguamente, se creía que la adición de sales de hierro (II) a una solución de ferrocianuro proporcionaba un material diferente del azul de Prusia. El producto se denominaba tradicionalmente azul de Turnbull (TB). Sin embargo, los métodos de difracción de rayos X y de difracción de electrones han demostrado que las estructuras del PB y el TB son idénticas. [27] [28] Las diferencias en los colores del TB y el PB reflejan diferencias sutiles en los métodos de precipitación, que afectan en gran medida al tamaño de las partículas y al contenido de impurezas.
Blanco de Prusia
El blanco de Prusia, también conocido como blanco de Berlín o sal de Everett , es el miembro terminal de sodio de la forma totalmente reducida del azul de Prusia en el que todo el hierro está presente como Fe II . Es un hexacianoferrato de sodio de Fe(II) de fórmula Na 2 Fe[Fe(CN) 6 ] . [29] Su valor de peso molecular es 314 g/mol . [29]
Una fórmula más genérica que permite la sustitución de cationes Na + por cationes K + es A (2−x) B x Fe 2 (CN) 6 (en la que A o B = Na + o K + ).
El blanco de Prusia está estrechamente relacionado con el azul de Prusia, pero difiere significativamente por su estructura cristalográfica, tamaño de poro de la estructura molecular y su color. El blanco de Prusia de sodio cúbico, Na (2−x) K x Fe 2 (CN) 6 ·yH 2 O , y el blanco de Prusia de potasio, K (2−x) Na x Fe 2 (CN) 6 ·yH 2 O , son candidatos como materiales de cátodo para baterías de iones de Na . [30] La inserción de cationes Na + y K + en la estructura del blanco de Prusia de potasio proporciona efectos sinérgicos favorables que mejoran la estabilidad de la batería a largo plazo y aumentan el número de posibles ciclos de recarga, alargando su vida útil. [30] La estructura de gran tamaño del blanco de Prusia que acomoda fácilmente los cationes Na + y K + facilita su intercalación y posterior extracción durante los ciclos de carga/descarga. La estructura cristalina espaciosa y rígida del dispositivo contribuye a su estabilidad volumétrica frente a la tensión y el hinchamiento internos que se desarrollan en las baterías de sodio después de muchos ciclos. [29] El material también ofrece perspectivas de altas densidades de energía (Ah/kg) al tiempo que proporciona una alta tasa de recarga, incluso a baja temperatura. [29]
Propiedades
El azul de Prusia es un polvo azul microcristalino . Es insoluble, pero los cristalitos tienden a formar un coloide. Estos coloides pueden pasar a través de filtros finos. [2] A pesar de ser uno de los compuestos sintéticos más antiguos que se conocen, la composición del azul de Prusia permaneció incierta durante muchos años. Su identificación precisa se complicó por tres factores:
- El azul de Prusia es extremadamente insoluble, pero también tiende a formar coloides.
- Las síntesis tradicionales tienden a producir composiciones impuras.
- Incluso el azul de Prusia puro es estructuralmente complejo y desafía el análisis cristalográfico de rutina.
Estructura cristalina
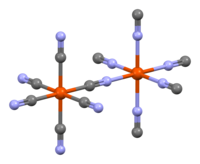

6Los grupos mostrados faltarán, al azar, dando como resultado en promedio solo 18 iones de cianuro (en lugar de los 24 mostrados) y tres átomos de hierro ferroso.

La fórmula química del azul de Prusia insoluble es Fe
7(CN)
18 · xAlto
2O , donde x = 14–16. La estructura se determinó mediante espectroscopia IR , espectroscopia Mössbauer , cristalografía de rayos X y cristalografía de neutrones . Dado que la difracción de rayos X no puede distinguir fácilmente el carbono del nitrógeno en presencia de elementos más pesados como el hierro, la ubicación de estos elementos más ligeros se deduce por medios espectroscópicos, así como observando las distancias desde los centros de los átomos de hierro. La difracción de neutrones puede distinguir fácilmente los átomos de N y C, y se ha utilizado para determinar la estructura detallada del azul de Prusia y sus análogos. [31] [32] [33] [34 ] [35] [36] [37] [38] [39] [40] [41]
El PB tiene una estructura reticular cúbica centrada en las caras , con cuatro iones de hierro (III) por celda unitaria. Los cristales de PB "solubles" contienen K intersticial+
iones; el PB insoluble tiene agua intersticial, en cambio. En los cristales de PB insolubles ideales, la estructura cúbica está formada por secuencias Fe(II)–C–N–Fe(III), con distancias Fe(II)–carbono de 1,92 Å y distancias Fe(III)–nitrógeno de 2,03 Å. Una cuarta parte de los sitios de Fe(CN)
6Las subunidades (supuestamente aleatorias) están vacantes (vacías), lo que deja tres grupos de este tipo en promedio por celda unitaria. [42] Los sitios de nitrógeno vacíos se llenan con moléculas de agua, que están coordinadas a Fe(III).

6Los grupos que se muestran no estarán presentes. Esta ilustración superpone ambas posibilidades en cada sitio: moléculas de agua o iones de cianuro.
Los centros Fe(II), que tienen un espín bajo , están rodeados por seis ligandos de carbono en una configuración octaédrica . Los centros Fe(III), que tienen un espín alto , están rodeados octaédricamente en promedio por 4,5 átomos de nitrógeno y 1,5 átomos de oxígeno (el oxígeno de las seis moléculas de agua coordinadas). Alrededor de ocho moléculas de agua (intersticiales) están presentes en la celda unitaria, ya sea como moléculas aisladas o unidas por enlaces de hidrógeno al agua coordinada. Vale la pena señalar que en los hexacianoferratos solubles , el Fe(II o III) siempre está coordinado al átomo de carbono de un cianuro , mientras que en el azul de Prusia cristalino los iones Fe están coordinados tanto a C como a N. [43]
La composición es notoriamente variable debido a la presencia de defectos en la red, lo que le permite hidratarse en diversos grados a medida que las moléculas de agua se incorporan a la estructura para ocupar las vacantes de cationes . La variabilidad de la composición del azul de Prusia es atribuible a su baja solubilidad , lo que conduce a su rápida precipitación sin el tiempo necesario para alcanzar el equilibrio completo entre sólido y líquido. [42] [44]
Color
El azul de Prusia es muy colorido y tiende al negro y al azul oscuro cuando se mezcla con pinturas al óleo . El tono exacto depende del método de preparación, que determina el tamaño de las partículas. El color azul intenso del azul de Prusia está asociado con la energía de la transferencia de electrones de Fe(II) a Fe(III). Muchos de estos compuestos de valencia mixta absorben ciertas longitudes de onda de luz visible resultantes de la transferencia de carga intervalar . En este caso, se absorbe luz naranja rojiza de alrededor de 680 nanómetros de longitud de onda y, como resultado, la luz reflejada aparece azul.
Al igual que la mayoría de los pigmentos de alta croma , el azul de Prusia no se puede visualizar con precisión en una pantalla de computadora. El azul de Prusia es electrocrómico , es decir, cambia de azul a incoloro al reducirse . Este cambio se produce por la reducción de Fe(III) a Fe(II), lo que elimina la transferencia de carga de intervalencia que causa el color del azul de Prusia.
Usar
Pigmento

Debido a que se fabrica fácilmente, es barato, no es tóxico y tiene colores intensos, el azul de Prusia ha atraído muchas aplicaciones. Fue adoptado como pigmento muy pronto después de su invención y casi de inmediato se usó ampliamente en pinturas al óleo, acuarelas y teñidos. [46] Los usos dominantes son para pigmentos: anualmente se producen alrededor de 12.000 toneladas de azul de Prusia para su uso en tintas negras y azuladas . Una variedad de otros pigmentos también contienen el material. [23] El azul de ingeniero y el pigmento formado en cianotipos, lo que les da su nombre común de planos . Ciertos crayones alguna vez se colorearon con azul de Prusia (más tarde rebautizado como azul medianoche ). De manera similar, el azul de Prusia es la base para el azulado de la ropa .
Las nanopartículas de azul de Prusia se utilizan como pigmentos en algunos ingredientes cosméticos, según el Observatorio de Nanomateriales de la Unión Europea.
| azul de Prusia | |
|---|---|
 Coordenadas de color Coordenadas de color | |
| Triplete hexadecimal | #003153 |
| sRGB B ( r , g , b ) | (0, 49, 83) |
| VHS ( h , s , v ) | (205°, 100%, 33%) |
| CIELCh uv ( L , C , h ) | (19, 30, 247°) |
| Fuente | [1] |
| B : Normalizado a [0–255] (byte) H : Normalizado a [0–100] (cien) | |
Medicamento
La capacidad del azul de Prusia para incorporar cationes metálicos monovalentes (Me + ) lo hace útil como agente secuestrante de ciertos metales pesados tóxicos . El azul de Prusia de grado farmacéutico en particular se utiliza para personas que han ingerido talio (Tl + ) o cesio radiactivo ( 134 Cs + , 137 Cs + ). Según el Organismo Internacional de Energía Atómica (OIEA), un hombre adulto puede comer al menos 10 g de azul de Prusia por día sin sufrir daños graves. La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) ha determinado que "las cápsulas de azul de Prusia de 500 mg, cuando se fabrican en las condiciones de una solicitud de nuevo fármaco aprobada, pueden considerarse una terapia segura y eficaz" en ciertos casos de intoxicación. [47] [48] Radiogardase (cápsulas insolubles de azul de Prusia [49] ) es un producto comercial para la eliminación del cesio-137 del intestino , es decir, indirectamente del torrente sanguíneo al intervenir en la circulación enterohepática del cesio-137, [50] reduciendo el tiempo de residencia interna (y exposición) en aproximadamente dos tercios. En particular, se utilizó para adsorber y eliminar 137
Cs+
de los envenenados en el accidente de Goiânia en Brasil. [2]
Mancha para hierro
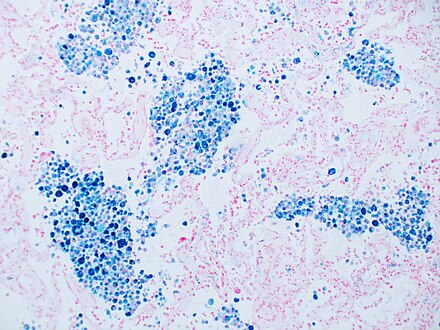
El azul de Prusia es una tinción histopatológica común que utilizan los patólogos para detectar la presencia de hierro en muestras de biopsia , como las de médula ósea . La fórmula original de la tinción, conocida históricamente (1867) como " azul de Prusia de Perls " en honor a su inventor, el patólogo alemán Max Perls (1843-1881), utilizaba soluciones separadas de ferrocianuro de potasio y ácido para teñir el tejido (ahora se utilizan combinadas, justo antes de la tinción). Los depósitos de hierro en el tejido forman entonces el tinte azul de Prusia púrpura en el lugar, y se visualizan como depósitos azules o púrpuras. [51]
- Histopatología del hígado que muestra células de Kupffer con importante depósito de hemosiderina junto a un hepatocito con pigmento lipofuscina . Tinción H&E.
- Tinción azul de Prusia, resaltando el pigmento hemosiderina en color azul.
- Tinte azul de Prusia
Por maquinistas y fabricantes de herramientas
El azul de ingeniero , azul de Prusia en una base aceitosa, es el material tradicional utilizado para marcar superficies metálicas como placas de superficie y cojinetes para raspar a mano . Se aplica una fina capa de pasta que no se seca a una superficie de referencia y se transfiere a los puntos altos de la pieza de trabajo. Luego, el fabricante de herramientas raspa, afila o elimina de alguna otra manera los puntos altos marcados. El azul de Prusia es preferible porque no desgastará las superficies de referencia extremadamente precisas como lo hacen muchos pigmentos molidos. Otros usos incluyen marcar los dientes de los engranajes durante el ensamblaje para determinar sus características de interfaz.
En química analítica
El azul de Prusia se forma en el ensayo de azul de Prusia para fenoles totales . A las muestras y los estándares fenólicos se les administra cloruro férrico ácido y ferricianuro, que se reduce a ferrocianuro por los fenoles. El cloruro férrico y el ferrocianuro reaccionan para formar azul de Prusia. La comparación de la absorbancia a 700 nm de las muestras con los estándares permite la determinación de fenoles o polifenoles totales . [52] [53]
Uso doméstico
El azul de Prusia está presente en algunas preparaciones para teñir la ropa , como el azulado de la Sra. Stewart . [54]
Investigación
Materiales de la batería
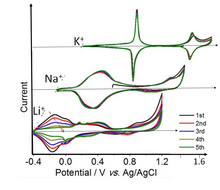
El azul de Prusia (PB) se ha estudiado por sus aplicaciones en el almacenamiento de energía electroquímica desde 1978. [55] El Azul de Prusia propiamente dicho (el sólido Fe-Fe) muestra dos transiciones redox reversibles bien definidas en soluciones de K + . Los iones de potasio débilmente solvatados (así como Rb + y Cs + , no mostrados) tienen el radio solvatado, que se ajusta al marco del Azul de Prusia. Por otro lado, los tamaños de Na + y Li + solvatados son demasiado grandes para la cavidad del PB, y la intercalación de estos iones se ve obstaculizada y es mucho más lenta. Los conjuntos de picos de bajo y alto voltaje en la voltamperometría cíclica corresponden a 1 y ⅔ electrones por átomo de Fe, respectivamente. [56] El conjunto de alto voltaje se debe a la transición Fe3 + /Fe2 + en los iones Fe de espín bajo coordinados a átomos de C. El conjunto de bajo voltaje se debe al ion Fe de espín alto coordinado a átomos de N. [57] [58] [59]
Es posible reemplazar los centros metálicos Fe en PB con otros iones metálicos como Mn, Co, Ni, Zn, etc. para formar análogos de azul de Prusia (PBA) electroquímicamente activos. Los PB/PBA y sus derivados también se han evaluado como materiales de electrodos para la inserción y extracción reversible de iones alcalinos en baterías de iones de litio , baterías de iones de sodio y baterías de iones de potasio .
Véase también
- Blue billy – Depósito de azul de Prusia formado en suelos contaminados por efluentes de la industria química
- Pigmentos azules
- Azul cobalto – Pigmento azul
- Violeta de cristal : colorante de triarilmetano utilizado como colorante histológico y en el método de Gram para clasificar bacterias.
- Fluoresceína : compuesto orgánico sintético utilizado como colorante y trazador fluorescente.
- Púrpura Han y azul Han : pigmentos artificiales de silicato de cobre y bario desarrollados en la antigua China durante la dinastía Han
- Lista de pigmentos inorgánicos
- Azul medianoche – Tono oscuro de azul
- Azul de ftalocianina BN : pigmento azul sintético del grupo de los colorantes de ftalocianinaPáginas que muestran descripciones breves de los objetivos de redireccionamiento
Referencias
- ^ Fuess, H. (20 de julio de 2010). Tablas internacionales de cristalografía, vol. A (edición de 2016). Wiley. ISBN 978-0-470-68575-4.
- ^ abc Dunbar, KR y Heintz, RA (1997). Química de compuestos de cianuro de metales de transición: perspectivas modernas . Progreso en química inorgánica. Vol. 45. págs. 283–391. doi :10.1002/9780470166468.ch4. ISBN 9780470166468.
- ^ "Lista Modelo de Medicamentos Esenciales de la OMS" (PDF) . Organización Mundial de la Salud . Octubre de 2013 . Consultado el 22 de abril de 2014 .
- ^ St. Clair, Kassia (2016). Las vidas secretas del color . Londres: John Murray. pp. 189-191. ISBN. 9781473630819. OCLC 936144129.
- ^ ab Bartoll, Jens. "El uso temprano del azul de Prusia en pinturas" (PDF) . 9.ª Conferencia Internacional sobre NDT en Arte, Jerusalén, Israel, 25-30 de mayo de 2008. Consultado el 22 de enero de 2010 .
- ^ Berger, JE (c.1730) Kerrn aller Fridrichs = Städtschen Begebenheiten . Staatsbibliothek zu Berlin – Preußischer Kulturbesitz, Handschriftenabteilung, Sra. Boruss. cuarto de galón. 124.
- ^ Finlay, Victoria (2014). La brillante historia del color en el arte . Museo J. Paul Getty. pp. 86–87. ISBN 978-1606064290.
- ^ ab Frisch, JL (1896) Briefwechsel mit Gottfried Wilhelm Leibniz LH Fischer (ed.), Berlín, Stankiewicz Buchdruck, reimpresión Hildesheim/Nueva York: Georg Olms Verlag, 1976
- ^ Frisch, JL (1710). "Serius Exhibita. Notitia Coerulei Berolinensis nuper inventi" [Anexo. Información sobre el azul de Berlín recientemente descubierto.]. Miscellanea Berolinensia Ad Incrementum Scientiarum (en latín). 1 : 377–378.
- ^ Kraft, Alexander (2011). ""Notitia Coerulei Berolinensis nuper inventi" en el 300 aniversario de la primera publicación sobre el azul de Prusia" (PDF) . Boletín de Historia de la Química . 36 (1): 3–9. PMID 21612121.
- ^ Bartoll, J.; Jackisch, B.; Most, M.; Wenders de Calisse, E.; Vogtherr, CM (2007). "Azul de Prusia temprano. Pigmentos azules y verdes en las pinturas de Watteau, Lancret y Pater en la colección de Federico II de Prusia". Techné . 25 : 39–46.
- ^ Mulherron, Jamie (2001). "Azul de Prusia, Boucher y Newton: el material, la práctica y la teoría de la pintura rococó". Object (3): 68–93.
- ^ Stahl, Georg Ernst (1731). Georgii Ernesti Stahlii, Experimenta, Observationes, Animadversiones, CCC Numero, Chymicae Et Physicae: Qualium alibi vel nulla, vel rara, nusquam autem satis ampla, ad debitos nexus, & veros usus, deducta mentio, commemeratio, aut explicatio, invenitur. Qualium partim, in aliis Autoris scriptis, varia mentio facta habetur; partim autem nova commemoratio hoc Tractatu exhibetur: utrimque vero, universa res uberius explicatur atque confirmatur (en latín). Alto.
- ^ Woodward, J. (1724–1725). "Praeparatio coerulei Prussiaci es Germanica missa ad Johannem Woodward". [Preparación de azul de Prusia enviada desde Alemania a John Woodward...]. Philosophical Transactions of the Royal Society of London . 33 (381): 15–17. doi : 10.1098/rstl.1724.0005 .
- ^ Brown, John (1724–1725). "Observaciones y experimentos sobre la preparación anterior". Philosophical Transactions . 33 (381): 17–24. Bibcode :1724RSPT...33...17B. doi : 10.1098/rstl.1724.0006 . JSTOR 103734.. La receta se publicó posteriormente en Geoffroy, Étienne-François (1727) "Observations sur la Preparation de Bleu de Prusse ou Bleu de Berlin", Mémoires de l'Académie royale des Sciences année 1725 . París. págs. 153-172.
- ^ "La creación del color en la Europa del siglo XVIII: el azul de Prusia". www.gutenberg-e.org . Consultado el 28 de julio de 2022 .
- ^ Macquer, Pierre-Joseph (1752) "Éxamen chymique de bleu de Prusse", Mémoires de l'Académie royale des Sciences année 1752 ... (París, 1756), págs. Este artículo fue revisado en "Sur le bleu de Prusse", Histoire de l'Académie royale des Sciences ... (1752), (París, 1756), págs. 79–85.
- ^ Scheele, Carl W. (1782) "Försök, beträffande det färgande ämnet uti Berlinerblå" (Experimento sobre la sustancia colorante en azul de Berlín), Kungliga Svenska Vetenskapsakademiens handlear (Actas de la Real Academia Sueca de Ciencias), 3 : 264–275 (en Sueco). Reimpreso en latín como: "De materia tingente caerulei berolinensis" en: Carl Wilhelm Scheele con Ernst Benjamin Gottlieb Hebenstreit (ed.) y Gottfried Heinrich Schäfer (trad.), Opuscula Chemica et Physica (Leipzig ("Lipsiae"), (Alemania) : Johann Godfried Müller, 1789), vol. 2, páginas 148-174.
- ^ ver Tekhelet#Sepia officinalis
- ^ "¿Se ha redescubierto el chilazón, fuente del tinte azul bíblico para techeiles, perdido hace mucho tiempo?". 8 de abril de 2008. Archivado desde el original el 8 de abril de 2008. Consultado el 12 de mayo de 2020 .
- ^ Haythornthwaite, Philip (1991) El ejército de Federico el Grande: infantería . Bloomsbury, EE. UU., pág. 14. ISBN 1855321602
- ^ Bull, Stephen (2000) Primera Guerra Mundial: Ejército alemán . Brassey's. págs. 8-10. ISBN 1-85753-271-6
- ^ ab Völz, Hans G. et al. (2006) "Pigmentos inorgánicos" en la Enciclopedia de química industrial de Ullmann. Wiley-VCH, Weinheim. doi :10.1002/14356007.a20_243.pub2.
- ^ Egon Wiberg, Nils Wiberg, Arnold Frederick Holleman: Química inorgánica, p. 1444. Academic Press, 2001; Google books
- ^ Revista de toxicología, intento de suicidio por ingestión de ferricianuro de potasio
- ^ Jonathan R. Thurston, Scott E. Waters, Brian H. Robb, Michael P. Marshak (marzo de 2022). "RFB orgánicos y metalorgánicos". Enciclopedia de almacenamiento de energía . 2 : 423–435. doi :10.1016/B978-0-12-819723-3.00082-2. ISBN 9780128197301.S2CID236672995 .
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Ozeki, Toru.; Matsumoto, Koichi.; Hikime, Seiichiro. (1984). "Espectros fotoacústicos del azul de Prusia y reacción fotoquímica del ferricianuro férrico". Química analítica . 56 (14): 2819. doi :10.1021/ac00278a041.
- ^ Izatt, Reed M. ; Watt, Gerald D.; Bartholomew, Calvin H.; Christensen, James J. (1970). "Estudio calorimétrico de la formación del azul de Prusia y del azul de Turnbull". Química inorgánica (manuscrito enviado). 9 (9): 2019. doi :10.1021/ic50091a012.
- ^ abcd "Blanco de Prusia". Macsen Labs . 28 de octubre de 2023 . Consultado el 16 de marzo de 2024 .
- ^ ab Piernas-Muñoz, María José; Castillo-Martínez, Elizabeth; Bondarchuk, Oleksandr; Armand, Michel; Rojo, Teófilo (2016). "Blanco prusiano cúbico de meseta de mayor voltaje para baterías de iones de Na". Revista de fuentes de energía . 324 . Elsevier: 766–773. Código Bib : 2016JPS...324..766P. doi :10.1016/j.jpowsour.2016.05.050. ISSN 0378-7753.
- ^ Electroquímica de cianuros de metales de transición polinucleares: azul de Prusia y sus análogos. 1986. Accounts of Chemical Research. 19/162-168. doi :10.1021/ar00126a001.
- ^ Estructura de FeFe(CN) 6 con bajos defectos como material anfitrión estable para baterías de iones de litio de alto rendimiento. 2016. ACS Applied Materials and Interfaces. 8/23706-23712. doi :10.1021/acsami.6b06880.
- ^ Análogos del azul de Prusia y sus materiales derivados para el almacenamiento de energía electroquímica: promesas y desafíos. 2024. Boletín de investigación de materiales. 170/ doi :10.1016/j.materresbull.2023.112593.
- ^ Algunas características de rendimiento de una batería azul de Prusia. 1985. Journal of the Electrochemical Society. 132/1382-1384. doi :10.1149/1.2114121.
- ^ Un estudio de difracción de neutrones del azul de Prusia, Fe 4 [Fe 4 (CN) 6 ] 3 . 14D 2 O. 1974. Zeitschrift für Physikalische Chemie. 92/354-357. doi :10.1524/zpch.1974.92.4-6.354.
- ^ Deslocalización de valencia en azul de Prusia Fe(III) 4 [Fe(II)(CN) 6 ] 3 ·xD 2 O, por difracción de neutrones polarizados. 1980. Helvetica Chimica Acta. 63/148-153. doi :10.1002/hlca.19800630115.
- ^ Estudio de difracción de neutrones del azul de Prusia, Fe 4 [Fe(CN) 6 ] 3 ·xH 2 O. Ubicación de las moléculas de agua y orden magnético de largo alcance. 1980. Química inorgánica. 19/956-959. doi :10.1021/ic50206a032.
- ^ Estudios de difracción de neutrones y rayos X en polvos y monocristales de compuestos estructuralmente relacionados con el azul de Prusia. 1999. Zeitschrift fur Naturforschung – Sección B Revista de Ciencias Químicas. 54/870-876. doi :10.1515/znb-1999-0708.
- ^ Análogo de manganeso cristalino de valencia mixta del azul de Prusia: estudios magnéticos, espectroscópicos, de difracción de rayos X y de neutrones. 2004. Journal of the American Chemical Society. 126/16472-16477. doi :10.1021/ja0465451.
- ^ Estudios de difracción de neutrones y espectroscopia vibracional de neutrones de la adsorción de hidrógeno en el análogo del azul de Prusia Cu 3 [Co(CN) 6 ] 2 . 2006. Química de materiales. 18/3221-3224. doi :10.1021/cm0608600.
- ^ Estudio de difracción de neutrones del compuesto magnético molecular Ni 1.125 Co 0.375 [Fe(CN) 6 ]·6.4H 2 O. 2006. Physica B: Condensed Matter. 385-386 I/444-446. doi :10.1016/j.physb.2006.05.147.
- ^ abc Herren, F.; Fischer, P.; Ludi, A.; Haelg, W. (1980). "Estudio de difracción de neutrones del azul de Prusia, Fe 4 [Fe(CN) 6 ] 3 ·xH 2 O. Ubicación de las moléculas de agua y orden magnético de largo alcance". Química inorgánica . 19 (4): 956. doi :10.1021/ic50206a032.
- ^ Análogos del azul de Prusia y sus materiales derivados para el almacenamiento de energía electroquímica: promesas y desafíos. 2024. Boletín de investigación de materiales. 170/. M. Fayaz, W. Lai, J. Li, W. Chen, X. Luo, Z. Wang, et al. doi :10.1016/j.materresbull.2023.112593
- ^ Lundgren, CA; Murray, Royce W. (1988). "Observaciones sobre la composición de películas de azul de Prusia y su electroquímica". Química inorgánica . 27 (5): 933. doi :10.1021/ic00278a036.
- ^ "Poniendo las esferas del reloj del Big Ben en azul". Parlamento del Reino Unido . Consultado el 21 de octubre de 2023 .
- ^ Berrie, Barbara H. (1997). "Azul de Prusia". En Pigmentos para artistas. Manual de su historia y características , EW FitzHugh (ed.). Washington, DC: Galería Nacional de Arte. ISBN 0894682563 .
- ^ "Preguntas y respuestas sobre el azul de Prusia". Administración de Alimentos y Medicamentos . Archivado desde el original el 2009-07-10 . Consultado el 2020-03-20 .
- ^ "Preguntas y respuestas sobre calcio-DTPA y zinc-DTPA (actualizado)". Administración de Alimentos y Medicamentos de Estados Unidos . 3 de noviembre de 2018 . Consultado el 21 de marzo de 2020 .
- ^ Radiogardase: prospecto con fórmula Archivado el 20 de marzo de 2011 en Wayback Machine.
- ^ Heyltex Corporation – Toxicología Archivado el 12 de noviembre de 2007 en Wayback Machine.
- ^ Fórmula para la tinción de azul de Prusia de Perls. Consultado el 2 de abril de 2009.
- ^ Hagerman, Ann E. (18 de marzo de 2011). «Tannin Chemistry» (PDF) . Archivado desde el original (PDF) el 26 de agosto de 2013. Consultado el 19 de diciembre de 2009 . (1,41 MB)
- ^ Graham, Horace D. (1992). "Estabilización del color azul de Prusia en la determinación de polifenoles". Revista de química agrícola y alimentaria . 40 (5): 801–805. doi :10.1021/jf00017a018. ISSN 0021-8561.
- ^ Schwarcz, Joe (22 de enero de 2016). «La química correcta: Columbo, tu ropa y el azulado líquido». Montreal Gazette . Consultado el 28 de febrero de 2017 .
- ^ Neff, Vernon D. (1 de junio de 1978). "Oxidación y reducción electroquímica de películas delgadas de azul de Prusia". Revista de la Sociedad Electroquímica . 125 (6): 886–887. Código Bibliográfico : 1978JElS..125..886N. doi : 10.1149/1.2131575. ISSN 1945-7111.
- ^ Neff, Vernon D. (1985-06-01). "Algunas características de rendimiento de una batería azul de Prusia". Journal of the Electrochemical Society . 132 (6): 1382–1384. Bibcode :1985JElS..132.1382N. doi :10.1149/1.2114121. ISSN 0013-4651.
- ^ Itaya, Kingo; Uchida, Isamu; Neff, Vernon D. (1 de junio de 1986). "Electroquímica de cianuros de metales de transición polinucleares: azul de Prusia y sus análogos". Accounts of Chemical Research . 19 (6): 162–168. doi :10.1021/ar00126a001. ISSN 0001-4842.
- ^ Wu, Xianyong; Shao, Miaomiao; Wu, Chenghao; Qian, Jiangfeng; Cao, Yuliang; Ai, Xinping; Yang, Hanxi (14 de septiembre de 2016). "Marco de FeFe(CN) 6 con bajo contenido de defectos como material huésped estable para baterías de iones de litio de alto rendimiento". ACS Applied Materials and Interfaces . 8 (36): 23706–23712. doi :10.1021/acsami.6b06880. ISSN 1944-8244. PMID 27556906.
- ^ Fayaz, Muhammad; Lai, Wende; Li, Jie; Chen, Wen; Luo, Xianyou; Wang, Zhen; Chen, Yingyu; Li, De; Abbas, Syed Mustansar; Chen, Yong (2024). "Análogos del azul de Prusia y sus materiales derivados para el almacenamiento de energía electroquímica: promesas y desafíos". Boletín de investigación de materiales . 170 . Elsevier: 112593. doi :10.1016/j.materresbull.2023.112593. ISSN 0025-5408.
Enlaces externos
- La página de la FDA sobre el azul de Prusia
- La página de los CDC sobre el azul de Prusia
- Inventario Nacional de Contaminantes – Hoja informativa sobre compuestos de cianuro
- Distribuidores de Radiogardase (cápsulas insolubles de azul de Prusia) de Heyltex Corporation Archivado el 21 de febrero de 2020 en Wayback Machine.
- Sarah Lowengard, "Azul de Prusia" en La creación del color en la Europa del siglo XVIII, Columbia University Press, 2006
- Azul de Prusia, ColourLex
- Kraft, Alexander (2008). "Sobre el descubrimiento y la historia del azul de Prusia" (PDF) . Bull. Hist. Chem. 33 (2): 61–67.