Cloruro de calcio
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC Cloruro de calcio | |
Otros nombres
| |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos | |
| Tarjeta informativa de la ECHA | 100.030.115 |
| Número CE |
|
| Número E | E509 (reguladores de acidez, ...) |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| CaCl2 | |
| Masa molar | 110,98 g·mol −1 |
| Apariencia | Polvo higroscópico blanco |
| Olor | Inodoro |
| Densidad |
|
| Punto de fusión | 772–775 °C (1422–1427 °F; 1045–1048 K) anhidro [5] 260 °C (500 °F; 533 K) monohidrato, se descompone 175 °C (347 °F; 448 K) dihidrato, se descompone 45,5 °C (113,9 °F; 318,6 K) tetrahidrato, se descompone [5] 30 °C (86 °F; 303 K) hexahidrato, se descompone [1] |
| Punto de ebullición | 1.935 °C (3.515 °F; 2.208 K) anhidro [1] |
| Anhidro: 74,5 g/100 mL (20 °C) [2] Hexahidrato: 49,4 g/100 mL (−25 °C) 59,5 g/100 mL (0 °C) 65 g/100 mL (10 °C) 81,1 g/100 mL (25 °C) [1] 102,2 g/100 mL (30,2 °C) α-Tetrahidrato: 90,8 g/100 mL (20 °C) 114,4 g/100 mL (40 °C) Dihidrato: 134,5 g/100 mL (60 °C) 152,4 g/100 mL (100 °C) [3] | |
| Solubilidad |
|
| Solubilidad en etanol |
|
| Solubilidad en metanol |
|
| Solubilidad en acetona | 0,1 g/kg (20 °C) [4] |
| Solubilidad en piridina | 16,6 g/kg [4] |
| Acidez (p K a ) |
|
| −5,47·10 −5 cm3 /mol [ 1 ] | |
Índice de refracción ( n D ) | 1.52 |
| Viscosidad |
|
| Estructura | |
| |
| |
| |
a = 6,259 Å, b = 6,444 Å, c = 4,17 Å (anhidro, 17 °C) [6] α = 90°, β = 90°, γ = 90° | |
| Octaédrico en centros Ca 2+ (anhidro) | |
| Termoquímica | |
Capacidad calorífica ( C ) |
|
Entropía molar estándar ( S ⦵ 298 ) | 108,4 J/(mol·K) [1] [5] |
Entalpía estándar de formación (Δ f H ⦵ 298 ) |
|
Energía libre de Gibbs (Δ f G ⦵ ) | −748,81 kJ/mol [1] [5] |
| Farmacología | |
| A12AA07 ( OMS ) B05XA07 ( OMS ), G04BA03 ( OMS ) | |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | Irritante |
| Etiquetado SGA : | |
 [7] [7] | |
| Advertencia | |
| H319 [7] | |
| P305+P351+P338 [7] | |
| NFPA 704 (rombo cortafuegos) | |
| Dosis o concentración letal (LD, LC): | |
LD 50 ( dosis media ) | 1.000-1.400 mg/kg (ratas, oral) [8] |
| Compuestos relacionados | |
Otros aniones | |
Otros cationes | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El cloruro de calcio es un compuesto inorgánico , una sal con la fórmula química CaCl2 . Es un sólido cristalino blanco a temperatura ambiente y es muy soluble en agua. Se puede crear neutralizando el ácido clorhídrico con hidróxido de calcio .
El cloruro de calcio se encuentra comúnmente como un sólido hidratado con la fórmula genérica CaCl2 · n H2O , donde n = 0, 1, 2, 4 y 6. Estos compuestos se utilizan principalmente para descongelar y controlar el polvo. Debido a que la sal anhidra es higroscópica y delicuescente , se utiliza como desecante . [10]
Historia
El cloruro de calcio fue descubierto aparentemente en el siglo XV, pero no fue estudiado adecuadamente hasta el siglo XVIII. [11] Históricamente se le llamó " sal amoniacal fija " ( latín : sal ammoniacum fixum [12] ) porque se sintetizaba durante la destilación de cloruro de amonio con cal y era no volátil (mientras que el primero parecía sublimar ); en tiempos más modernos (siglos XVIII-XIX) se le llamó "muriato de cal" ( latín : murias calcis, calcaria muriatica [12] ). [13]
Usos
Deshielo y depresión del punto de congelación

Al deprimir el punto de congelación del agua, el cloruro de calcio se utiliza para prevenir la formación de hielo y se utiliza para descongelar . Esta aplicación consume la mayor cantidad de cloruro de calcio. El cloruro de calcio es relativamente inofensivo para las plantas y el suelo. Como agente descongelante, es mucho más eficaz a temperaturas más bajas que el cloruro de sodio . Cuando se distribuye para este uso, generalmente toma la forma de pequeñas esferas blancas de unos pocos milímetros de diámetro, llamadas gránulos . Las soluciones de cloruro de calcio pueden prevenir la congelación a temperaturas tan bajas como −52 °C (−62 °F), lo que lo hace ideal para llenar los neumáticos de los implementos agrícolas como lastre líquido, lo que ayuda a la tracción en climas fríos. [14]
También se utiliza en deshumidificadores de aire químicos domésticos e industriales . [15]
Pavimentación de carreteras

La segunda aplicación más importante del cloruro de calcio aprovecha su naturaleza higroscópica y la pegajosidad de sus hidratos; el cloruro de calcio es altamente higroscópico y su hidratación es un proceso exotérmico . Una solución concentrada mantiene una capa líquida en la superficie de los caminos de tierra , lo que suprime la formación de polvo. Mantiene las partículas de polvo más finas en la carretera, proporcionando una capa amortiguadora. Si se permite que se vayan volando, el agregado grande comienza a moverse y la carretera se descompone. El uso de cloruro de calcio reduce la necesidad de nivelación hasta en un 50% y la necesidad de materiales de relleno hasta en un 80%. [16]
Alimento
En la industria alimentaria, el cloruro de calcio se emplea frecuentemente como agente reafirmante en vegetales enlatados, particularmente para tomates enlatados y pepinos encurtidos. [17] También se utiliza para reafirmar cuajada de soja en tofu y para producir un sustituto de caviar a partir de jugos de vegetales o frutas . [17] También se utiliza para mejorar la textura de varios otros productos, como manzanas enteras, pimientos picantes enteros, fresas enteras y en rodajas, tomates cortados en cubitos y melocotones enteros. [18] [19]
El efecto reafirmante del cloruro de calcio se puede atribuir a varios mecanismos: [18]
- Complejación, ya que los iones de calcio forman complejos con la pectina, un polisacárido que se encuentra en la pared celular y la lámina media de los tejidos vegetales. [18]
- Estabilización de la membrana, ya que los iones de calcio contribuyen a la estabilización de la membrana celular. [18]
- Regulación de la presión de turgencia, ya que los iones de calcio influyen en la presión de turgencia celular, que es la presión que ejerce el contenido celular contra la pared celular. [18]
Las propiedades de reducción del punto de congelación del cloruro de calcio se utilizan para retardar la congelación del caramelo en las barras de chocolate rellenas de caramelo. [17] Además, se añade con frecuencia a las manzanas en rodajas para mantener la textura. [20]
En la elaboración de cerveza, a veces se utiliza cloruro de calcio para corregir deficiencias minerales en el agua de elaboración. Afecta el sabor y las reacciones químicas durante el proceso de elaboración y también puede afectar la función de la levadura durante la fermentación. [17]
En la elaboración de quesos , a veces se añade cloruro de calcio a la leche procesada (pasteurizada/homogeneizada) para restablecer el equilibrio natural entre el calcio y la proteína en la caseína . Se añade antes del coagulante. [17]
El cloruro de calcio también se utiliza comúnmente como " electrolito " en bebidas deportivas y otras bebidas; como aditivo alimentario utilizado junto con otras sales inorgánicas, añade sabor al agua embotellada . [21] [17] [22]
Se ha estimado que la ingesta media de cloruro de calcio como aditivo alimentario es de 160 a 345 mg/día. [23] El cloruro de calcio está permitido como aditivo alimentario en la Unión Europea para su uso como agente secuestrante y reafirmante con el número E E509 . [17] La Administración de Alimentos y Medicamentos de los Estados Unidos lo considera generalmente reconocido como seguro (GRAS, por sus siglas en inglés) . [24] Su uso en la producción de cultivos orgánicos está generalmente prohibido según el Programa Orgánico Nacional de los Estados Unidos . [25]
El cloruro de calcio contiene aproximadamente 27,2% o 272 mg de calcio elemental por gramo. Esto significa que por cada gramo de cloruro de calcio, hay 272 mg de calcio real absorbible. El cloruro de calcio tiene un sabor muy salado y puede causar irritación en la boca y la garganta en altas concentraciones, por lo que normalmente no es la primera opción para la suplementación oral a largo plazo (como un suplemento de calcio ). [26] [27] El cloruro de calcio, caracterizado por su bajo peso molecular y alta solubilidad en agua, se descompone fácilmente en iones de calcio y cloruro cuando se expone al agua. Estos iones se absorben eficientemente en el intestino. [28] Sin embargo, se debe tener cuidado al manipular el cloruro de calcio, ya que tiene el potencial de liberar energía térmica al disolverse en agua. Esta liberación de calor puede provocar traumatismos y quemaduras en la boca, la garganta, el esófago y el estómago. De hecho, se han notificado casos de necrosis estomacal resultante de quemaduras causadas por ingestión accidental de grandes cantidades de cloruro de calcio seco. [29] [30]
El sabor extremadamente salado del cloruro de calcio se utiliza para dar sabor a los encurtidos sin aumentar el contenido de sodio del alimento . [17]
El cloruro de calcio se utiliza para prevenir la aparición de manchas de corcho y de manchas amargas en las manzanas rociándolo sobre el árbol durante la última parte de la temporada de crecimiento. [31]
Laboratorio y operaciones de secado relacionadas
Los tubos de secado suelen estar llenos de cloruro de calcio. Las algas marinas se secan con cloruro de calcio para su uso en la producción de carbonato de sodio . La FDA ha aprobado el cloruro de calcio anhidro como ayuda para el envasado para garantizar la sequedad (CPG 7117.02). [32]
La sal hidratada se puede secar para reutilizarla, pero se disolverá en su propia agua de hidratación si se calienta rápidamente y formará un sólido amalgamado duro cuando se enfríe.
Fundente de reducción de metal
De manera similar, el CaCl2 se utiliza como fundente y electrolito en el proceso de electrólisis FFC de Cambridge para la producción de titanio , donde garantiza el intercambio adecuado de iones de calcio y oxígeno entre los electrodos.
Uso médico
Las infusiones de cloruro de calcio se pueden utilizar como terapia intravenosa para prevenir la hipocalcemia .
Otras aplicaciones
Esta sección necesita citas adicionales para su verificación . ( mayo de 2020 ) |
El cloruro de calcio se utiliza en mezclas de hormigón para acelerar el fraguado inicial, pero los iones de cloruro provocan corrosión de las barras de refuerzo de acero , por lo que no debe utilizarse en hormigón armado . [33] La forma anhidra del cloruro de calcio también se puede utilizar para este propósito y puede proporcionar una medida de la humedad en el hormigón. [34]
El cloruro de calcio se incluye como aditivo en plásticos y extintores de incendios , en altos hornos como aditivo para controlar el andamiaje (aglutinación y adhesión de materiales que impiden que la carga del horno descienda) y en suavizantes de telas como diluyente.
La disolución exotérmica del cloruro de calcio se utiliza en latas autocalentables y almohadillas térmicas .
El cloruro de calcio se utiliza como endurecedor de agua en el mantenimiento del agua del jacuzzi , ya que el agua insuficientemente dura puede provocar corrosión y formación de espuma.
En la industria petrolera , el cloruro de calcio se utiliza para aumentar la densidad de las salmueras sin sólidos . También se utiliza para inhibir la expansión de las arcillas en la fase acuosa de los fluidos de perforación de emulsión inversa .
El CaCl2 actúa como material fundente , disminuyendo el punto de fusión, en el proceso Davy para la producción industrial de sodio metálico a través de la electrólisis de NaCl fundido.
El cloruro de calcio también se utiliza en la producción de carbón activado .
El cloruro de calcio se puede utilizar para precipitar iones fluoruro del agua en forma de CaF 2 insoluble .
El cloruro de calcio también es un ingrediente que se utiliza en la fundición de cerámica . Suspende las partículas de arcilla para que floten dentro de la solución, lo que facilita su uso en diversas técnicas de fundición.
El cloruro de calcio dihidratado (20 por ciento en peso) disuelto en etanol (95 por ciento de alcohol) se ha utilizado como esterilizante para animales machos. La solución se inyecta en los testículos del animal. En el plazo de un mes, la necrosis del tejido testicular produce la esterilización. [35] [36]
Los productores de cocaína en Colombia importan toneladas de cloruro de calcio para recuperar solventes que están en la Lista Roja de la JIFE y están controlados más estrictamente. [37]
Peligros
Aunque la sal no es tóxica en pequeñas cantidades cuando está húmeda, las propiedades fuertemente higroscópicas del cloruro de calcio no hidratado presentan algunos peligros. Puede actuar como irritante al desecar la piel húmeda. El cloruro de calcio sólido se disuelve exotérmicamente y puede provocar quemaduras en la boca y el esófago si se ingiere. La ingestión de soluciones concentradas o productos sólidos puede causar irritación o ulceración gastrointestinal . [38]
El consumo de cloruro de calcio puede provocar hipercalcemia . [39]
Propiedades

El cloruro de calcio se disuelve en agua, produciendo cloruro y el complejo acuoso [Ca(H 2 O) 6 ] 2+ . De esta manera, estas soluciones son fuentes de iones de calcio y cloruro libres. Esta descripción se ilustra por el hecho de que estas soluciones reaccionan con fuentes de fosfato para dar un precipitado sólido de fosfato de calcio :
- 3 CaCl2 + 2 PO3−4→ Ca3 ( PO4 ) 2 + 6Cl−
El cloruro de calcio tiene un cambio de entalpía de solución muy alto , lo que se refleja en el aumento considerable de temperatura que acompaña a la disolución de la sal anhidra en agua. Esta propiedad es la base de su aplicación a mayor escala.
El cloruro de calcio fundido se puede electrolizar para producir calcio metálico y gas cloro :
- CaCl2 → Ca + Cl2
Preparación
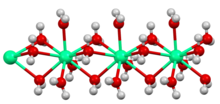
En gran parte del mundo, el cloruro de calcio se deriva de la piedra caliza como subproducto del proceso Solvay , que sigue la reacción neta que se muestra a continuación: [10]
- 2 NaCl + CaCO 3 → Na 2 CO 3 + CaCl 2
El consumo norteamericano en 2002 fue de 1.529.000 toneladas (3.370 millones de libras). [40] En los EE. UU., la mayor parte del cloruro de calcio se obtiene mediante purificación a partir de salmuera . Como ocurre con la mayoría de los productos de sal a granel, suelen aparecer trazas de otros cationes de los metales alcalinos y alcalinotérreos ( grupos 1 y 2) y otros aniones de los halógenos ( grupo 17). [10]
Aparición
El cloruro de calcio se presenta en forma de minerales evaporíticos raros como la sinjarita (dihidrato) y la antarcticita (hexahidrato). [41] [42] [43] Otro hidrato natural conocido es la ghiaraíta, un tetrahidrato. [44] [43] Los minerales relacionados, la clorocalcita (cloruro de calcio y potasio, KCaCl 3 ) y la taquihidrita (cloruro de magnesio y calcio, Ca Mg 2 Cl 6 ·12 H 2 O ), también son muy raros. [45] [46] [43] Lo mismo ocurre con la rorisita, CaClF (fluoruro de cloruro de calcio). [47] [43]
Véase también
Referencias
- ^ abcdefghi Lide DR, ed. (2009). Manual de química y física del CRC (90.ª edición). Boca Raton, Florida : CRC Press . ISBN 978-1-4200-9084-0.
- ^ "Cloruro de calcio (anhidro)". ICSC . Programa Internacional de Seguridad Química y Comisión Europea. Archivado desde el original el 25 de septiembre de 2015 . Consultado el 18 de septiembre de 2015 .
- ^ Seidell A, Linke WF (1919). Solubilidades de compuestos inorgánicos y orgánicos (segunda edición). Nueva York: D. Van Nostrand Company. pág. 196.
- ^ abcdef Anatolievich KR. «Propiedades de la sustancia: cloruro de calcio». chemister.ru . Archivado desde el original el 24 de junio de 2015. Consultado el 7 de julio de 2014 .
- ^ abcdef Pradyot P (2019). Manual de productos químicos inorgánicos . The McGraw-Hill Companies, Inc. pág. 162. ISBN 978-0-07-049439-8.
- ^ abcd Müller U (2006). Química estructural inorgánica (segunda edición). Inglaterra: John Wiley & Sons Ltd. pág. 33. ISBN 978-0-470-01864-4.
- ^ abc Sigma-Aldrich Co. , Cloruro de calcio.
- ^ Garrett DE (2004). Manual de litio y cloruro de calcio natural. Elsevier . p. 379. ISBN 978-0-08-047290-4. Archivado del original el 31 de octubre de 2023 . Consultado el 29 de agosto de 2018 .
Su toxicidad por ingestión está indicada por el ensayo en ratas: la DL50 oral (rata) es de 1,0-1,4 g/kg (la dosis letal para la mitad de los animales de prueba, en este caso ratas...)
- ^ "Ficha de datos de seguridad del cloruro de calcio". fishersci.ca . Fisher Scientific. Archivado desde el original el 25 de septiembre de 2015 . Consultado el 7 de julio de 2014 .
- ^ abc Robert Kemp, Suzanne E. Keegan "Cloruro de calcio" en Ullmann's Encyclopedia of Industrial Chemistry 2000, Wiley-VCH, Weinheim. doi :10.1002/14356007.a04_547
- ^ Peck EL, Hamilton JH, Lewis JR, Hogan MB, Kusian RN, Cope WJ (1954). Actas de la Primera Conferencia Anual sobre Calefacción y Aire Acondicionado: 1953-1955. Universidad de Utah, Departamento de Metalurgia. Archivado desde el original el 15 de marzo de 2024. Consultado el 4 de febrero de 2024 .
- ^ ab Hartmann PK (1816). Pharmacologia Dynamica: Usui Academico Adcommodata (en latín). Kupffer y Wimmer. Archivado desde el original el 29 de diciembre de 2023 . Consultado el 29 de diciembre de 2023 .
- ^ Ottley WC (1826). Diccionario de química y de mineralogía en relación con ella. Murray. Archivado desde el original el 29 de diciembre de 2023. Consultado el 29 de diciembre de 2023 .
- ^ "Diagrama de fase binario: El sistema cloruro de calcio-agua". Aqueous Solutions Aps. Octubre de 2016. Archivado desde el original el 26 de junio de 2019. Consultado el 20 de abril de 2017 .
- ^ "Mantener las cosas secas". humantouchofchemistry.com . Archivado desde el original el 26 de octubre de 2014. Consultado el 23 de octubre de 2014 .
- ^ "Polvo: ¡No lo comas! ¡Contrólalo!". Road Management & Engineering Journal . US Roads (TranSafety Inc.). 1 de junio de 1998. Archivado desde el original el 29 de octubre de 2007 . Consultado el 9 de agosto de 2006 .
- ^ abcdefgh "2.2.4". Enciclopedia de los compuestos alcalinotérreos . pág. 51. doi :10.1016/B978-0-444-59550-8.00002-8.
El cloruro de calcio se utiliza comúnmente como "electrolito" y tiene un sabor extremadamente salado, como el que se encuentra en las bebidas deportivas y otras bebidas como el agua embotellada de Nestlé.
- ^ abcde Luna-Guzmán I, Barrett DM (mayo de 2000). "Comparación de la efectividad del cloruro de calcio y el lactato de calcio en el mantenimiento de la estabilidad de anaquel y la calidad de melones recién cortados". Postharvest Biology and Technology . 19 (1): 61–72. doi :10.1016/S0925-5214(00)00079-X.
- ^ "Técnica del caviar de manzana". StarChefs Studio . StarChefs.com. Abril de 2004. Archivado desde el original el 29 de junio de 2022 . Consultado el 9 de agosto de 2006 .
- ^ Sitbon C, Paliyath G (2011). "Tratamientos pre y poscosecha que afectan la calidad nutricional". Comprehensive Biotechnology . págs. 349–357. doi :10.1016/B978-0-08-088504-9.00275-0. ISBN 978-0-08-088504-9.
- ^ "Por qué el agua embotellada contiene cuatro ingredientes diferentes". 24 de julio de 2014. Archivado desde el original el 8 de febrero de 2019. Consultado el 17 de marzo de 2024 .
- ^ "Marcas de agua embotellada con electrolitos (confirmadas mediante pruebas de laboratorio) - Guía de purificación de agua".
- ^ Perfil de evaluación inicial de los SIDS con cloruro de calcio, Publicaciones del PNUMA, SIAM 15, Boston, 22-25 de octubre de 2002, págs. 13-14.
- ^ Título 21 del Código de Reglamentos Federales, artículo 184.1193
- ^ 7 CFR § 205.602 Archivado el 29 de abril de 2021 en Wayback Machine.
- ^ "Cloruro de calcio: indicaciones, efectos secundarios, advertencias". Archivado desde el original el 17 de febrero de 2023. Consultado el 15 de marzo de 2024 .
- ^ Bendich A (enero de 2001). "Suplementación de calcio y estado de hierro en mujeres". Nutrition . 17 (1): 46–51. doi :10.1016/s0899-9007(00)00482-2. PMID 11165888.
- ^ "Copia archivada" (PDF) . Archivado (PDF) del original el 16 de marzo de 2024 . Consultado el 16 de marzo de 2024 .
{{cite web}}: CS1 maint: copia archivada como título ( enlace ) - ^ Remes-Troche JM (2 de enero de 2013). "Un 'estómago negro' debido a la ingestión de cloruro de calcio anhidro". BMJ Case Reports : bcr2012007716. doi :10.1136/bcr-2012-007716. PMC 3604345. PMID 23283618 .
- ^ Nakagawa Y, Maeda A, Takahashi T, Kaneoka Y (2020). "Necrosis gástrica debido a la ingestión de cloruro de calcio". ACG Case Reports Journal . 7 (8): e00446. doi :10.14309/crj.0000000000000446. PMC 7447462 . PMID 32903978.
- ^ "La mancha de corcho y el hueso amargo de las manzanas", Richard C. Funt y Michael A. Ellis, Ohioline.osu.edu/factsheet/plpath-fru-01
- ^ "CPG 7117.02". Artículos de cumplimiento de la FDA . Administración de Alimentos y Medicamentos de los Estados Unidos. Marzo de 1995. Archivado desde el original el 13 de diciembre de 2007. Consultado el 3 de diciembre de 2007 .
- ^ "Aceleración del tiempo de fraguado del hormigón". Administración Federal de Carreteras . 1 de junio de 1999. Archivado desde el original el 17 de enero de 2007. Consultado el 16 de enero de 2007 .
- ^ Consejo Nacional de Investigación (EE. UU.). Instituto de Investigación de la Construcción (1962). Adhesivos en la construcción: selección y aplicación en campo; cintas sensibles a la presión . Academia Nacional de Ciencias-Consejo Nacional de Investigación. págs. 24–5.
- ^ Koger LM (noviembre de 1977). "Cloruro de calcio, agente necrosante práctico". The Bovine Practitioner : 118-119. doi :10.21423/bovine-vol1977no12p118-119.
- ^ Jana K, Samanta PK (2011). "Evaluación clínica de la esterilización no quirúrgica de gatos machos con una única inyección intratesticular de cloruro de calcio". BMC Veterinary Research . 7 (1): 39. doi : 10.1186/1746-6148-7-39 . PMC 3152893 . PMID 21774835.
- ^ Smith M, Simpson C (26 de octubre de 2020). "Los narcos están librando una nueva guerra contra las drogas por un producto químico básico de una empresa de Texas". Bloomberg . Archivado desde el original el 26 de octubre de 2020 . Consultado el 26 de octubre de 2020 .
{{cite web}}: CS1 maint: bot: estado de URL original desconocido ( enlace ) - ^ "Evaluación de seguridad del producto (PSA): cloruro de calcio". Dow Chemical Company . 2 de mayo de 2006. Archivado desde el original el 17 de septiembre de 2009. Consultado el 22 de julio de 2008 .
- ^ "Posibles efectos secundarios del cloruro de calcio". www.drugs.com . Archivado desde el original el 27 de julio de 2020. Consultado el 23 de enero de 2018 .
- ^ Perfil de evaluación inicial de SIDS sobre cloruro de calcio, Publicaciones del PNUMA, SIAM 15, Boston, 22-25 de octubre de 2002, página 11.
- ^ "Sinjarite". www.mindat.org . Archivado desde el original el 3 de marzo de 2023 . Consultado el 6 de noviembre de 2020 .
- ^ "Antarcticite". www.mindat.org . Archivado desde el original el 1 de mayo de 2023 . Consultado el 6 de noviembre de 2020 .
- ^ abcd «Lista de minerales». www.ima-mineralogy.org . 21 de marzo de 2011. Archivado desde el original el 15 de marzo de 2013 . Consultado el 6 de noviembre de 2020 .
- ^ "Ghiaraite". www.mindat.org . Archivado desde el original el 3 de marzo de 2023 . Consultado el 6 de noviembre de 2020 .
- ^ "Clorocalcita". www.mindat.org . Archivado desde el original el 30 de mayo de 2023 . Consultado el 6 de noviembre de 2020 .
- ^ "Taquihidrita". www.mindat.org . Archivado desde el original el 3 de marzo de 2023 . Consultado el 6 de noviembre de 2020 .
- ^ "Rorisite". www.mindat.org . Archivado desde el original el 3 de marzo de 2023 . Consultado el 6 de noviembre de 2020 .
- Greenwood NN , Earnshaw A (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
Enlaces externos
- Ficha internacional de seguridad química 1184
- Información sobre productos y aplicaciones (anteriormente división Cloruro de calcio de Dow Chemical) Archivado el 17 de septiembre de 2023 en Wayback Machine.
- Informe sobre la corrosión del acero por cloruros, incluido el CaCl2 Archivado el 16 de junio de 2011 en Wayback Machine.
- Colección de informes y artículos sobre cloruro de calcio
- Cloruro de calcio anhidro, MSDS
- Difusividad del cloruro de calcio
- Centros para el Control y la Prevención de Enfermedades, Institutos Nacionales de Seguridad y Salud Ocupacional, "Cloruro de calcio (anhidro)"






