Arseniato
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC Arseniato | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| Araña química | |||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
| |||
| |||
| Propiedades | |||
| ASO3−4 | |||
| Masa molar | 138,918 g·mol −1 | ||
| Ácido conjugado | Ácido arsénico | ||
| Peligros | |||
| Seguridad y salud en el trabajo (SST/OHS): | |||
Principales peligros | Extremadamente tóxico, cancerígeno. | ||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
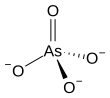
El arseniato es un ion con la fórmula química AsO3−4. [1] El enlace en el arseniato consiste en un átomo central de arsénico , con estado de oxidación +5, doblemente enlazado a un átomo de oxígeno y simple a otros tres átomos de oxígeno . [2] Los cuatro átomos de oxígeno se orientan alrededor del átomo de arsénico en una geometría tetraédrica . [2] La resonancia dispersa la carga −3 del ion entre los cuatro átomos de oxígeno.
El arsenato reacciona fácilmente con los metales para formar compuestos metálicos de arsenato . [2] [3] El arsenato es un oxidante moderado y un aceptor de electrones , con un potencial de electrodo de +0,56 V para su reducción a arsenito . [4] Debido a que el arsénico tiene la misma valencia y un radio atómico similar al fósforo , el arsenato comparte una geometría y reactividad similares con el fosfato . [5] El arsenato puede reemplazar al fosfato en reacciones bioquímicas y es tóxico para la mayoría de los organismos . [5] [6]
Ocurrencia natural

Los arseniatos se encuentran de forma natural, en forma hidratada y anhidra , en una variedad de minerales . Entre los ejemplos de minerales que contienen arseniato se incluyen la adamita , la alarsita , la annabergita , la eritrita y la legrandita . [7] Cuando dos iones de arseniato equilibran la carga en una fórmula, se denomina diarseniato, por ejemplo, diarseniato de zinc, Zn3 ( AsO4 ) 2 .
Usos
Los pesticidas a base de arsenato, como el arseniato de hidrógeno y plomo, se usaban comúnmente hasta que fueron reemplazados por pesticidas más nuevos como el DDT y la prohibición posterior por parte de múltiples organismos reguladores debido a preocupaciones de salud. [8] [9]
Los compuestos de arseniato de metal de transición suelen tener colores brillantes y se han utilizado para fabricar pigmentos . El arseniato de cobre era un compuesto menor utilizado en el pigmento azul egipcio utilizado por los antiguos egipcios y romanos . [10] El pigmento violeta de cobalto se fabricaba a partir de arseniato de cobalto antes de que su toxicidad condujera a su sustitución por fosfato de cobalto . [11] [12] [13]
El arseniato de cobre cromado (CCA) ha sido un conservante de madera ampliamente utilizado desde la década de 1930. [14] Las preocupaciones de seguridad han llevado a la eliminación gradual de la madera tratada con CCA para proyectos residenciales en muchos países. [14] El CCA sigue siendo una opción de tratamiento común y económica para usos no residenciales como la agricultura . [14] [15]
Especiación

Dependiendo del pH , el arseniato se puede encontrar como arseniato trihidrógeno (es decir, ácido arsénico H3AsO4 ) , arseniato dihidrógeno ( H2AsO4 ) .−4), arseniato de hidrógeno ( HAsO2−4), o arseniato ( AsO3−4). [18] El arseniato trihidrógeno también se conoce como ácido arsénico . A un pH determinado , la distribución de estas especies de arseniato se puede determinar a partir de sus respectivas constantes de disociación ácida . [17]
- H3AsO4 + H2O ⇌ H2AsO−4+ [H3O ] + ( pK a1 = 2,19)
- H2AsO−4+ H2O ⇌ HAsO2−4+ [H3O ] + ( pKa2 = 6,94 )
- HAsO2−4+ H2O ⇌ AsO3−4+ [H 3 O] + H (p K a3 = 11,5)
Estos valores son similares a los del ácido fosfórico . El arseniato de hidrógeno y el arseniato de dihidrógeno predominan en solución acuosa cerca del pH neutro. [17]
El potencial de reducción (pe) de una solución también afecta la especiación del arsenato. En aguas naturales, el contenido de oxígeno disuelto es el principal factor que influye en el potencial de reducción. Los arsenatos se encuentran en aguas oxigenadas, que tienen un pe alto, mientras que los arsenitos son las principales especies de arsénico en aguas anóxicas con un pe bajo. [16]
Un diagrama de Pourbaix muestra la influencia combinada del pH y el pe en la especiación del arsenato.
Contaminación
Los arseniatos, junto con los arsenitos, son una fuente importante de contaminación en algunas fuentes naturales de agua y pueden provocar envenenamiento por arsénico con exposición repetida. [19] [20] Los países con altos niveles de minerales de arsénico en sedimentos y rocas, como Bangladesh , corren un riesgo especial de contaminación por arsenato. [21] [20]
Envenenamiento por arseniato
El arsenato es perjudicial para los seres humanos y los animales , ya que interfiere en el funcionamiento normal de la glucólisis y el ciclo de Krebs . El arsenato reemplaza al fosfato inorgánico en el paso de la glucólisis que produce 1,3-bisfosfoglicerato a partir del gliceraldehído 3-fosfato . Esto produce en su lugar 1-arseno-3-fosfoglicerato , que es inestable y se hidroliza rápidamente , formando el siguiente intermediario en la vía, el 3-fosfoglicerato . Por lo tanto, la glucólisis continúa, pero la molécula de ATP que se generaría a partir del 1,3-bisfosfoglicerato se pierde: el arsenato es un desacoplador de la glucólisis, lo que explica su toxicidad. [22] [23]
Al igual que otros compuestos de arsénico, el arsenato se une al ácido lipoico , inhibiendo la conversión de piruvato en acetil-CoA , bloqueando el ciclo de Krebs y, por lo tanto, dando como resultado una mayor pérdida de ATP. [23]
Véase también
Referencias
- ^ PubChem. «Ion arsenato». pubchem.ncbi.nlm.nih.gov . Consultado el 2 de abril de 2023 .
- ^ abc «Mineral de arsenato | Britannica». www.britannica.com . Consultado el 2 de abril de 2023 .
- ^ Waalkes, Michael P. (2019), Baan, Robert A.; Stewart, Bernard W.; Straif, Kurt (eds.), "Arsénico y metales", Concordancia del sitio del tumor y mecanismos de carcinogénesis , Publicaciones científicas del IARC, Lyon (FR): Agencia Internacional para la Investigación sobre el Cáncer, ISBN 978-92-832-2217-0, PMID 33979075 , consultado el 2 de abril de 2023
- ^ "P1: Potenciales de reducción estándar por elemento". Chemistry LibreTexts . 2 de diciembre de 2013 . Consultado el 29 de marzo de 2023 .
- ^ ab Contaminantes, Comité sobre Efectos Médicos y Biológicos del Medio Ambiente del Consejo Nacional de Investigación (EE. UU.) (1977). Química del arsénico. National Academies Press (EE. UU.).
- ^ Elías, Mikael; Wellner, Alon; Goldin-Azulay, Korina; Chabrière, Eric; Vorholt, Julia A.; Erb, Tobías J.; Tawfik, Dan S. (2012). "La base molecular de la discriminación de fosfatos en entornos ricos en arseniato". Naturaleza . 491 (7422): 134-137. Código Bib :2012Natur.491..134E. doi : 10.1038/naturaleza11517. ISSN 1476-4687. PMID 23034649. S2CID 99851438.
- ^ "La mineralogía del arsénico". Mindat.org .
- ^ "La evolución de los pesticidas químicos". www.fishersci.ca . Consultado el 2 de abril de 2023 .
- ^ "El problema mundial del pesticida arseniato de plomo". lead.org.au . Consultado el 2 de abril de 2023 .
- ^ Dariz, Petra; Schmid, Thomas (28 de mayo de 2021). "Los compuestos traza en el azul egipcio de la Alta Edad Media contienen información sobre procedencia, fabricación, aplicación y envejecimiento". Scientific Reports . 11 (1): 11296. Bibcode :2021NatSR..1111296D. doi :10.1038/s41598-021-90759-6. ISSN 2045-2322. PMC 8163881 . PMID 34050218.
- ^ Corbeil, Marie-Claude; Charland, Jean-Pierre; Moffatt, Elizabeth A. (2002). "La caracterización de los pigmentos violeta cobalto". Estudios en conservación . 47 (4): 237–249. doi :10.2307/1506784. ISSN 0039-3630. JSTOR 1506784.
- ^ "Violeta de cobalto". ColourLex . Consultado el 10 de abril de 2023 .
- ^ "Arseniato de cobalto - CAMEO". cameo.mfa.org . Consultado el 10 de abril de 2023 .
- ^ abc Barton, C. (1 de enero de 2014), "Madera tratada con CCA", en Wexler, Philip (ed.), Enciclopedia de toxicología (tercera edición) , Oxford: Academic Press, págs. 751–752, ISBN 978-0-12-386455-0, consultado el 10 de abril de 2023
- ^ Likar, M; Schauer, P; Japelj, M; Globokar, M; Oklobdzija, M; Povse, A; Sunjić, V (1 de enero de 1970). "Síntesis y actividad antimicrobiana de algunas amidas de tenoilo". Revista de química medicinal . 13 (1): 159–161. doi :10.1021/jm00295a053. ISSN 1520-4804. PMID 5412102.
- ^ ab Marinho, Belisa A.; Cristóvão, Raquel O.; Boaventura, Rui AR; Vilar, Vítor JP (1 de enero de 2019). "Eliminación de oxianiones de As (III) y Cr (VI) del agua mediante procesos avanzados de oxidación/reducción: una revisión". Investigación en ciencias ambientales y contaminación . 26 (3): 2203–2227. doi :10.1007/s11356-018-3595-5. ISSN 1614-7499. PMID 30474808. S2CID 53783178.
- ^ abc Jekel, M.; Amy, GL (1 de enero de 2006), Newcombe, Gayle; Dixon, David (eds.), "Capítulo 11: Eliminación de arsénico durante el tratamiento del agua potable", Interface Science and Technology , Interface Science in Drinking Water Treatment, vol. 10, Elsevier, págs. 193–206 , consultado el 15 de abril de 2023
- ^ Contaminantes, Comité sobre Efectos Médicos y Biológicos del Medio Ambiente del Consejo Nacional de Investigación (EE. UU.) (1977). Química del arsénico. National Academies Press (EE. UU.).
- ^ Sánchez-Rodas, Daniel; Luis Gómez-Ariza, José; Giráldez, Inmaculada; Velasco, Alfredo; Morales, Emilio (1 de junio de 2005). "Especiación de arsénico en aguas fluviales y estuarinas del suroeste de España". La ciencia del medio ambiente total . 345 (1–3): 207–217. Bibcode :2005ScTEn.345..207S. doi :10.1016/j.scitotenv.2004.10.029. ISSN 0048-9697. PMID 15919540.
- ^ ab "Arsénico". www.who.int . Consultado el 15 de abril de 2023 .
- ^ UCL (10 de mayo de 2022). «Reducción de la exposición de la población al arsénico en las aguas subterráneas en Bangladesh». UCL Earth Sciences . Consultado el 15 de abril de 2023 .
- ^ "¿Cómo mata el arsénico?". livescience.com . Consultado el 31 de marzo de 2023 .
- ^ ab Hughes, Michael F. (7 de julio de 2002). "Toxicidad del arsénico y posibles mecanismos de acción". Toxicology Letters . 133 (1): 1–16. doi :10.1016/s0378-4274(02)00084-x. ISSN 0378-4274. PMID 12076506.