Espectroscopia ultravioleta-visible
Este artículo necesita citas adicionales para su verificación . ( abril de 2018 ) |

La espectroscopia ultravioleta (UV) o espectrofotometría ultravioleta-visible (UV-VIS) [1] [2] [3] se refiere a la espectroscopia de absorción o espectroscopia de reflectancia en parte de la región ultravioleta y la región visible adyacente completa del espectro electromagnético . [2] Al ser relativamente económica y de fácil implementación, esta metodología se usa ampliamente en diversas aplicaciones fundamentales y aplicadas. El único requisito es que la muestra absorba en la región UV-Vis, es decir, que sea un cromóforo . La espectroscopia de absorción es complementaria a la espectroscopia de fluorescencia . Los parámetros de interés, además de la longitud de onda de medición, son la absorbancia (A) o la transmitancia (%T) o la reflectancia (%R), y su cambio con el tiempo. [4] [5]
Un espectrofotómetro UV-VIS es un instrumento analítico que mide la cantidad de luz ultravioleta (UV) y visible que absorbe una muestra. Es una técnica ampliamente utilizada en química, bioquímica y otros campos para identificar y cuantificar compuestos en una variedad de muestras. [6]
Los espectrofotómetros UV-VIS funcionan haciendo pasar un haz de luz a través de la muestra y midiendo la cantidad de luz que se absorbe en cada longitud de onda. La cantidad de luz absorbida es proporcional a la concentración del compuesto absorbente en la muestra.
Transiciones ópticas
La mayoría de las moléculas e iones absorben energía en el rango ultravioleta o visible, es decir, son cromóforos . El fotón absorbido excita un electrón en el cromóforo a orbitales moleculares de mayor energía, dando lugar a un estado excitado . [7] Para los cromóforos orgánicos, se suponen cuatro tipos posibles de transiciones: π–π*, n–π*, σ–σ* y n–σ*. Los complejos de metales de transición a menudo están coloreados (es decir, absorben luz visible) debido a la presencia de múltiples estados electrónicos asociados con orbitales d incompletamente llenos. [5]
Aplicaciones
_nickel_(II)_chloride_UV-vis.JPG/440px-Bis(triphenylphosphine)_nickel_(II)_chloride_UV-vis.JPG)
La luz UV/Vis se puede utilizar para monitorear cambios estructurales en el ADN. [8]
La espectroscopia UV/Vis se utiliza habitualmente en química analítica para la determinación cuantitativa de diversos analitos o muestras, como iones de metales de transición , compuestos orgánicos altamente conjugados y macromoléculas biológicas. El análisis espectroscópico se lleva a cabo habitualmente en soluciones, pero también se pueden estudiar sólidos y gases.
- Los compuestos orgánicos , especialmente aquellos con un alto grado de conjugación , también absorben luz en las regiones UV o visible del espectro electromagnético . Los disolventes para estas determinaciones suelen ser agua para compuestos solubles en agua, o etanol para compuestos solubles en orgánicos. (Los disolventes orgánicos pueden tener una absorción UV significativa; no todos los disolventes son adecuados para su uso en espectroscopia UV. El etanol absorbe muy débilmente en la mayoría de las longitudes de onda). La polaridad del disolvente y el pH pueden afectar al espectro de absorción de un compuesto orgánico. La tirosina , por ejemplo, aumenta en los máximos de absorción y el coeficiente de extinción molar cuando el pH aumenta de 6 a 13 o cuando la polaridad del disolvente disminuye.
- Si bien los complejos de transferencia de carga también dan lugar a colores, estos suelen ser demasiado intensos para ser utilizados en mediciones cuantitativas.
La ley de Beer-Lambert establece que la absorbancia de una solución es directamente proporcional a la concentración de la especie absorbente en la solución y a la longitud del camino. [9] Por lo tanto, para una longitud de camino fija, se puede utilizar la espectroscopia UV/Vis para determinar la concentración del absorbente en una solución. Es necesario saber con qué rapidez cambia la absorbancia con la concentración. Esto se puede obtener de referencias (tablas de coeficientes de extinción molar ) o, más exactamente, determinar a partir de una curva de calibración .
Se puede utilizar un espectrofotómetro UV/Vis como detector para la cromatografía líquida de alto rendimiento (HPLC) . La presencia de un analito da una respuesta que se supone es proporcional a la concentración. Para obtener resultados precisos, la respuesta del instrumento al analito en la muestra desconocida debe compararse con la respuesta a un estándar; esto es muy similar al uso de curvas de calibración. La respuesta (por ejemplo, la altura del pico) para una concentración particular se conoce como factor de respuesta .
Las longitudes de onda de los picos de absorción se pueden correlacionar con los tipos de enlaces en una molécula dada y son valiosas para determinar los grupos funcionales dentro de una molécula. Las reglas de Woodward-Fieser , por ejemplo, son un conjunto de observaciones empíricas utilizadas para predecir λ max , la longitud de onda de la absorción UV/Vis más intensa, para compuestos orgánicos conjugados como dienos y cetonas . Sin embargo, el espectro por sí solo no es una prueba específica para cualquier muestra dada. La naturaleza del solvente, el pH de la solución, la temperatura, las altas concentraciones de electrolitos y la presencia de sustancias interferentes pueden influir en el espectro de absorción. Las variaciones experimentales como el ancho de rendija (ancho de banda efectivo) del espectrofotómetro también alterarán el espectro. Para aplicar la espectroscopia UV/Vis al análisis, estas variables deben controlarse o tenerse en cuenta para identificar las sustancias presentes. [10]
El método se utiliza con mayor frecuencia de forma cuantitativa para determinar las concentraciones de una especie absorbente en solución, utilizando la ley de Beer-Lambert : [11]
- ,
donde A es la absorbancia medida (formalmente adimensional pero generalmente reportada en unidades de absorbancia (AU) [12] ), es la intensidad de la luz incidente a una longitud de onda dada , es la intensidad transmitida, L la longitud del camino a través de la muestra, y c la concentración de la especie absorbente. Para cada especie y longitud de onda, ε es una constante conocida como absortividad molar o coeficiente de extinción. Esta constante es una propiedad molecular fundamental en un solvente dado, a una temperatura y presión particulares, y tiene unidades de .
La absorbancia y la extinción ε a veces se definen en términos del logaritmo natural en lugar del logaritmo de base 10.
La ley de Beer-Lambert es útil para caracterizar muchos compuestos, pero no se cumple como una relación universal para la concentración y absorción de todas las sustancias. A veces se encuentra una relación polinómica de segundo orden entre la absorción y la concentración [13] para moléculas muy grandes y complejas, como los colorantes orgánicos ( naranja de xilenol o rojo neutro , por ejemplo). [14] [15]
La espectroscopia UV-Vis también se utiliza en la industria de semiconductores para medir el espesor y las propiedades ópticas de películas delgadas sobre una oblea. Los espectrómetros UV-Vis se utilizan para medir la reflectancia de la luz y se pueden analizar mediante las ecuaciones de dispersión de Forouhi-Bloomer para determinar el índice de refracción ( ) y el coeficiente de extinción ( ) de una película dada en todo el rango espectral medido. [16]
Consideraciones prácticas
La ley de Beer-Lambert tiene supuestos implícitos que deben cumplirse experimentalmente para que se aplique; de lo contrario, existe la posibilidad de desviaciones de la ley. [14] Por ejemplo, la composición química y el entorno físico de la muestra pueden alterar su coeficiente de extinción. Por lo tanto, las condiciones químicas y físicas de una muestra de prueba deben coincidir con las mediciones de referencia para que las conclusiones sean válidas. En todo el mundo, las farmacopeas como la farmacopea estadounidense (USP) y la europea (Ph. Eur.) exigen que los espectrofotómetros funcionen de acuerdo con estrictos requisitos regulatorios que abarcan factores como la luz difusa [17] y la precisión de la longitud de onda. [18]
Ancho de banda espectral
El ancho de banda espectral de un espectrofotómetro es el rango de longitudes de onda que el instrumento transmite a través de una muestra en un momento dado. [19] Está determinado por la fuente de luz, el monocromador , su ancho de rendija físico y dispersión óptica y el detector del espectrofotómetro. El ancho de banda espectral afecta la resolución y precisión de la medición. Un ancho de banda espectral más estrecho proporciona mayor resolución y precisión, pero también requiere más tiempo y energía para escanear todo el espectro. Un ancho de banda espectral más amplio permite un escaneo más rápido y fácil, pero puede resultar en una resolución y precisión más bajas, especialmente para muestras con picos de absorción superpuestos. Por lo tanto, elegir un ancho de banda espectral apropiado es importante para obtener resultados confiables y precisos.
Es importante tener una fuente de radiación monocromática para la luz que incide sobre la celda de muestra para mejorar la linealidad de la respuesta. [14] Cuanto más monocromático sea el ancho de banda (unidad de longitud de onda de transmisión), más lineal será la respuesta. El ancho de banda espectral se mide como el número de longitudes de onda transmitidas a la mitad de la intensidad máxima de la luz que sale del monocromador.
El mejor ancho de banda espectral alcanzable es una especificación del espectrofotómetro UV y caracteriza cuán monocromática puede ser la luz incidente. Si este ancho de banda es comparable (o mayor) al ancho del pico de absorción del componente de muestra, entonces el coeficiente de extinción medido no será preciso. En mediciones de referencia, el ancho de banda del instrumento (ancho de banda de la luz incidente) se mantiene por debajo del ancho de los picos espectrales. Cuando se mide un material de prueba, el ancho de banda de la luz incidente también debe ser lo suficientemente estrecho. Reducir el ancho de banda espectral reduce la energía que pasa al detector y, por lo tanto, requerirá un tiempo de medición más largo para lograr la misma relación señal/ruido.
Error de longitud de onda
El coeficiente de extinción de un analito en solución cambia gradualmente con la longitud de onda. Un pico (una longitud de onda donde la absorbancia alcanza un máximo) en la curva de absorbancia vs longitud de onda, es decir, el espectro UV-VIS, es donde la tasa de cambio de absorbancia con la longitud de onda es la más baja. [14] Por lo tanto, las mediciones cuantitativas de un soluto se realizan generalmente, utilizando una longitud de onda alrededor del pico de absorbancia, para minimizar las imprecisiones producidas por errores en la longitud de onda, debido al cambio del coeficiente de extinción con la longitud de onda.
Luz dispersa
La luz difusa [20] en un espectrofotómetro UV es cualquier luz que llega a su detector y que no tiene la longitud de onda seleccionada por el monocromador. Esto puede deberse, por ejemplo, a la dispersión de la luz dentro del instrumento o a los reflejos de las superficies ópticas.
La luz difusa puede provocar errores importantes en las mediciones de absorbancia, especialmente con absorbancias altas, porque se sumará a la señal detectada por el detector, aunque no forme parte de la longitud de onda seleccionada. El resultado es que la absorbancia medida y registrada será inferior a la absorbancia real de la muestra.
La luz difusa es un factor importante, ya que determina la pureza de la luz utilizada para el análisis. El factor más importante que la afecta es el nivel de luz difusa del monocromador . [14]
Normalmente, un detector utilizado en un espectrofotómetro UV-VIS es de banda ancha; responde a toda la luz que lo alcanza. Si una cantidad significativa de la luz que pasa a través de la muestra contiene longitudes de onda que tienen coeficientes de extinción mucho más bajos que el nominal, el instrumento informará una absorbancia incorrectamente baja. Cualquier instrumento llegará a un punto en el que un aumento en la concentración de la muestra no dará como resultado un aumento en la absorbancia informada, porque el detector simplemente está respondiendo a la luz difusa. En la práctica, la concentración de la muestra o la longitud del camino óptico deben ajustarse para colocar la absorbancia desconocida dentro de un rango que sea válido para el instrumento. A veces se desarrolla una función de calibración empírica, utilizando concentraciones conocidas de la muestra, para permitir mediciones en la región donde el instrumento se está volviendo no lineal.
Como guía aproximada, un instrumento con un solo monocromador normalmente tendría un nivel de luz difusa correspondiente a aproximadamente 3 unidades de absorbancia (AU), lo que haría que las mediciones por encima de aproximadamente 2 AU fueran problemáticas. Un instrumento más complejo con un monocromador doble tendría un nivel de luz difusa correspondiente a aproximadamente 6 AU, lo que permitiría medir un rango de absorbancia mucho más amplio.
Desviaciones de la ley de Beer-Lambert
En concentraciones suficientemente altas, las bandas de absorción se saturarán y mostrarán un aplanamiento de la absorción. El pico de absorción parece aplanarse porque ya se está absorbiendo cerca del 100% de la luz. La concentración a la que esto ocurre depende del compuesto en particular que se esté midiendo. Una prueba que se puede utilizar para comprobar este efecto es variar la longitud del recorrido de la medición. En la ley de Beer-Lambert, variar la concentración y la longitud del recorrido tiene un efecto equivalente: diluir una solución por un factor de 10 tiene el mismo efecto que acortar la longitud del recorrido por un factor de 10. Si se dispone de celdas con diferentes longitudes de recorrido, comprobar si esta relación es cierta es una forma de juzgar si se está produciendo un aplanamiento de la absorción.
Las soluciones que no son homogéneas pueden mostrar desviaciones de la ley de Beer-Lambert debido al fenómeno de aplanamiento de la absorción. Esto puede suceder, por ejemplo, cuando la sustancia absorbente se encuentra dentro de partículas suspendidas. [21] [22] Las desviaciones serán más notorias en condiciones de baja concentración y alta absorbancia. La última referencia describe una forma de corregir esta desviación.
Algunas soluciones, como el cloruro de cobre (II) en agua, cambian visualmente a una determinada concentración debido a cambios en las condiciones alrededor del ion coloreado (el ion de cobre divalente). En el caso del cloruro de cobre (II), esto significa un cambio de azul a verde, [23] lo que significaría que las mediciones monocromáticas se desviarían de la ley de Beer-Lambert.
Fuentes de incertidumbre de la medición
Los factores anteriores contribuyen a la incertidumbre de medición de los resultados obtenidos con espectrofotometría UV/Vis . Si se utiliza la espectrofotometría UV/Vis en el análisis químico cuantitativo, los resultados se ven afectados además por fuentes de incertidumbre que surgen de la naturaleza de los compuestos y/o soluciones que se miden. Estas incluyen interferencias espectrales causadas por la superposición de bandas de absorción, la pérdida de color de las especies absorbentes (causada por descomposición o reacción) y la posible discrepancia de composición entre la muestra y la solución de calibración. [24]
Espectrofotómetro ultravioleta-visible
El instrumento utilizado en la espectroscopia ultravioleta-visible se denomina espectrofotómetro UV/Vis . Mide la intensidad de la luz después de pasar a través de una muestra ( ) y la compara con la intensidad de la luz antes de pasar a través de la muestra ( ). La relación se denomina transmitancia y suele expresarse como porcentaje (%T). La absorbancia , , se basa en la transmitancia:
El espectrofotómetro UV-visible también se puede configurar para medir la reflectancia. En este caso, el espectrofotómetro mide la intensidad de la luz reflejada desde una muestra ( ) y la compara con la intensidad de la luz reflejada desde un material de referencia ( ) (como una baldosa blanca). La relación se denomina reflectancia y suele expresarse como un porcentaje (%R).
Las partes básicas de un espectrofotómetro son una fuente de luz, un soporte para la muestra, una rejilla de difracción o un prisma como monocromador para separar las diferentes longitudes de onda de la luz y un detector. La fuente de radiación es a menudo un filamento de tungsteno (300–2500 nm), una lámpara de arco de deuterio , que es continua sobre la región ultravioleta (190–400 nm), una lámpara de arco de xenón , que es continua de 160 a 2.000 nm; o más recientemente, diodos emisores de luz (LED) [4] para las longitudes de onda visibles. El detector es típicamente un tubo fotomultiplicador , un fotodiodo , una matriz de fotodiodos o un dispositivo acoplado a carga (CCD). Los detectores de fotodiodo único y los tubos fotomultiplicadores se utilizan con monocromadores de barrido, que filtran la luz de modo que solo la luz de una sola longitud de onda llega al detector a la vez. El monocromador de barrido mueve la rejilla de difracción para "recorrer" cada longitud de onda de modo que su intensidad pueda medirse en función de la longitud de onda. Los monocromadores fijos se utilizan con CCD y conjuntos de fotodiodos. Como ambos dispositivos constan de muchos detectores agrupados en conjuntos unidimensionales o bidimensionales, pueden recolectar luz de diferentes longitudes de onda en diferentes píxeles o grupos de píxeles simultáneamente.
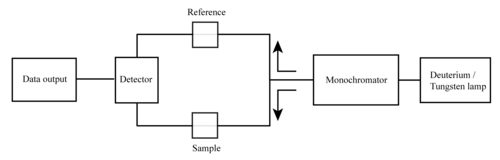
Un espectrofotómetro puede ser de haz simple o de haz doble . En un instrumento de haz simple (como el Spectronic 20 ), toda la luz pasa a través de la celda de muestra. La luz se debe medir retirando la muestra. Este fue el primer diseño y todavía se usa comúnmente tanto en laboratorios de enseñanza como industriales.
En un instrumento de doble haz, la luz se divide en dos haces antes de llegar a la muestra. Un haz se utiliza como referencia; el otro haz pasa a través de la muestra. La intensidad del haz de referencia se toma como 100% de transmisión (o 0 de absorbancia), y la medición mostrada es la relación de las dos intensidades de haz. Algunos instrumentos de doble haz tienen dos detectores (fotodiodos), y el haz de muestra y el de referencia se miden al mismo tiempo. En otros instrumentos, los dos haces pasan a través de un cortador de haz , que bloquea un haz a la vez. El detector alterna entre la medición del haz de muestra y el haz de referencia en sincronismo con el cortador. También puede haber uno o más intervalos oscuros en el ciclo del cortador. En este caso, las intensidades de haz medidas se pueden corregir restando la intensidad medida en el intervalo oscuro antes de que se tome la relación.
En un instrumento de un solo haz, primero se debe medir la cubeta que contiene solo un disolvente. Mettler Toledo desarrolló un espectrofotómetro de matriz de un solo haz que permite mediciones rápidas y precisas en el rango UV/VIS. La fuente de luz consiste en una lámpara de destellos de xenón para las regiones de longitud de onda ultravioleta (UV), visible (VIS) e infrarroja cercana que cubren un rango espectral de 190 a 1100 nm. Los destellos de la lámpara se enfocan en una fibra de vidrio que dirige el haz de luz hacia una cubeta que contiene la solución de muestra. El haz pasa a través de la muestra y las longitudes de onda específicas son absorbidas por los componentes de la muestra. La luz restante se recoge después de la cubeta mediante una fibra de vidrio y se conduce a un espectrógrafo. El espectrógrafo consiste en una rejilla de difracción que separa la luz en las diferentes longitudes de onda y un sensor CCD para registrar los datos, respectivamente. De este modo, se mide todo el espectro simultáneamente, lo que permite un registro rápido. [25]
Las muestras para espectrofotometría UV/Vis suelen ser líquidos, aunque también se puede medir la absorbancia de gases e incluso de sólidos. Las muestras se colocan normalmente en una celda transparente , conocida como cubeta . Las cubetas suelen tener forma rectangular, normalmente con un ancho interno de 1 cm. (Este ancho se convierte en la longitud del camino, , en la ley de Beer-Lambert). Los tubos de ensayo también se pueden utilizar como cubetas en algunos instrumentos. El tipo de recipiente de muestra utilizado debe permitir que la radiación pase sobre la región espectral de interés. Las cubetas más aplicables están hechas de sílice fundida de alta calidad o vidrio de cuarzo porque son transparentes en todas las regiones UV, visible e infrarroja cercana. Las cubetas de vidrio y plástico también son comunes, aunque el vidrio y la mayoría de los plásticos absorben en el UV, lo que limita su utilidad a las longitudes de onda visibles. [4]
También se han fabricado instrumentos especializados, como la conexión de espectrofotómetros a telescopios para medir los espectros de las características astronómicas. Los microespectrofotómetros UV-visibles consisten en un microscopio UV-visible integrado con un espectrofotómetro UV-visible.
Un espectro completo de la absorción en todas las longitudes de onda de interés puede generarse directamente mediante un espectrofotómetro más sofisticado. En instrumentos más simples, la absorción se determina una longitud de onda a la vez y luego el operador la compila en un espectro. Al eliminar la dependencia de la concentración, se puede determinar el coeficiente de extinción (ε) como una función de la longitud de onda.
Microespectrofotometría
La espectroscopia UV-visible de muestras microscópicas se realiza mediante la integración de un microscopio óptico con óptica UV-visible, fuentes de luz blanca, un monocromador y un detector sensible como un dispositivo de carga acoplada (CCD) o un tubo fotomultiplicador (PMT). Como solo hay disponible un único camino óptico, estos son instrumentos de haz único. Los instrumentos modernos son capaces de medir espectros UV-visibles tanto en reflectancia como en transmisión de áreas de muestreo a escala micrométrica. Las ventajas de utilizar estos instrumentos es que pueden medir muestras microscópicas, pero también pueden medir los espectros de muestras más grandes con alta resolución espacial. Como tales, se utilizan en el laboratorio forense para analizar los tintes y pigmentos en fibras textiles individuales, [26] chips de pintura microscópicos [27] y el color de fragmentos de vidrio. También se utilizan en la ciencia de los materiales y la investigación biológica y para determinar el contenido energético de la roca madre del carbón y el petróleo midiendo la reflectancia de la vitrinita . Los microespectrofotómetros se utilizan en las industrias de semiconductores y microóptica para controlar el espesor de películas delgadas después de que se han depositado. En la industria de semiconductores, se utilizan porque las dimensiones críticas de los circuitos son microscópicas. Una prueba típica de una oblea de semiconductor implicaría la adquisición de espectros de muchos puntos en una oblea con o sin patrón. El espesor de las películas depositadas se puede calcular a partir del patrón de interferencia de los espectros. Además, la espectrofotometría ultravioleta-visible se puede utilizar para determinar el espesor, junto con el índice de refracción y el coeficiente de extinción de películas delgadas. [16] Luego se puede generar un mapa del espesor de la película a lo largo de toda la oblea y utilizarlo para fines de control de calidad. [28]
Aplicaciones adicionales
La luz UV/Vis se puede utilizar para caracterizar la velocidad de una reacción química . Un ejemplo ilustrativo es la conversión de los isómeros amarillo-naranja y azul del ditizonato de mercurio. Este método de análisis se basa en el hecho de que la concentración es linealmente proporcional a la concentración. El mismo enfoque permite la determinación de equilibrios entre cromóforos. [29] [30]
A partir del espectro de gases en combustión, es posible determinar la composición química de un combustible, la temperatura de los gases y la relación aire-combustible. [31]
Véase también
- Espectroscopia aplicada
- Método de Benesi-Hildebrand
- Espectroscopia color -vis con el ojo humano
- Espectroscopia de modulación de carga
- Espectrofotómetro DU : el primer instrumento UV-Vis
- Espectroscopia por transformada de Fourier
- La espectroscopia infrarroja y la espectroscopia Raman son otras técnicas espectroscópicas comunes, que se utilizan habitualmente para obtener información sobre la estructura de los compuestos o para identificarlos. Ambas son formas de espectroscopia vibracional .
- Punto isosbéstico : longitud de onda en la que la absorción no cambia a medida que avanza la reacción. Es importante en las mediciones cinéticas como control.
- Espectroscopia de infrarrojo cercano
- Espectroscopia rotacional
- Espectroscopia de pendiente
- Espectroscopia ultravioleta-visible de estereoisómeros
- Espectroscopia vibracional
Referencias
- ^ Cole, Kenneth; Levine, Barry S. (2020), Levine, Barry S.; Kerrigan, Sarah (eds.), "Espectrofotometría ultravioleta-visible" , Principios de toxicología forense , Cham: Springer International Publishing, págs. 127-134, doi :10.1007/978-3-030-42917-1_10, ISBN 978-3-030-42917-1, consultado el 19 de octubre de 2023
- ^ ab Vitha, Mark F. (2018). "Capítulo 2". Espectroscopia: principios e instrumentación . Hoboken, NJ: John Wiley & Sons. ISBN 978-1-119-43664-5.
{{cite book}}: Mantenimiento CS1: fecha y año ( enlace ) - ^ Edwards, Alison A.; Alexander, Bruce D. (1 de enero de 2017), "Espectroscopia de absorción UV-visible, aplicaciones orgánicas" , en Lindon, John C.; Tranter, George E.; Koppenaal, David W. (eds.), Enciclopedia de espectroscopia y espectrometría (tercera edición) , Oxford: Academic Press, págs. 511–519, doi :10.1016/b978-0-12-803224-4.00013-3, ISBN 978-0-12-803224-4, consultado el 19 de octubre de 2023
- ^ abc Skoog, Douglas A.; Holler, F. James; Crouch, Stanley R. (2007). Principios del análisis instrumental (6.ª ed.). Belmont, CA: Thomson Brooks/Cole. págs. 169–173. ISBN 978-0-495-01201-6.[ enlace muerto ]
- ^ de RS Drago (1992). Métodos físicos para químicos, 2.ª edición . WB Saunders. ISBN 0030751764.
- ^ Franca, Adriana S.; Nollet, Leo ML (2017). Métodos espectroscópicos en el análisis de alimentos . CRC Press. pág. 664.
- ^ Metha, Akul (13 de diciembre de 2011). "Principio". PharmaXChange.info .
- ^ Carroll, Gregory T.; Dowling, Reed C.; Kirschman, David L.; Masthay, Mark B.; Mammana, Angela (2023). "Fluorescencia intrínseca del ADN irradiado con UV" . Journal of Photochemistry and Photobiology A: Chemistry . 437 : 114484. doi :10.1016/j.jphotochem.2022.114484. S2CID 254622477.
- ^ Metha, Akul (22 de abril de 2012). "Derivación de la ley de Beer-Lambert". PharmaXChange.info .
- ^ Misra, Prabhakar ; Dubinskii, Mark, eds. (2002). Espectroscopia ultravioleta y láseres UV . Nueva York: Marcel Dekker . ISBN 978-0-8247-0668-5.[ página necesaria ]
- ^ "La ley de Beer-Lambert". Chemistry LibreTexts . 3 de octubre de 2013 . Consultado el 19 de octubre de 2023 .
- ^ Históricamente, se utilizaba el término "densidad óptica" (OD) en lugar de AU. Pero también vale la pena señalar que lo que se mide habitualmente es el porcentaje de transmisión (%T), una relación lineal que el instrumento convierte al logaritmo para su presentación.
- ^ Bozdoğan, Abdürrezzak E. (1 de noviembre de 2022). "Ecuaciones polinómicas basadas en las leyes de Bouguer-Lambert y Beer para desviaciones de la linealidad y aplanamiento de la absorción" . Revista de química analítica . 77 (11): 1426–1432. doi :10.1134/S1061934822110028. ISSN 1608-3199. S2CID 253463022.
- ^ abcde Metha, Akul (14 de mayo de 2012). "Limitaciones y desviaciones de la ley de Beer-Lambert". PharmaXChange.info .
- ^ Cinar, Mehmet; Coruh, Ali; Karabacak, Mehmet (25 de marzo de 2014). "Un estudio comparativo de derivados de colorantes azoicos dispersos seleccionados basado en comportamientos ópticos espectroscópicos (FT-IR, RMN y UV-Vis) y no lineales" . Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy . 122 : 682–689. Bibcode :2014AcSpA.122..682C. doi :10.1016/j.saa.2013.11.106. ISSN 1386-1425. PMID 24345608.
- ^ ab Löper, Philipp; Stuckelberger, Michael; Niesen, Bjoern; Werner, Jérémie; Filipič, Miha; Moon, Soo-Jin; Yum, Jun-Ho; Topič, Marko; De Wolf, Stefaan; Ballif, Christophe (2015). "Espectros de índice de refracción complejos de películas delgadas de perovskita CH3NH3PbI3 determinados por elipsometría espectroscópica y espectrofotometría" . The Journal of Physical Chemistry Letters . 6 (1): 66–71. doi :10.1021/jz502471h. PMID 26263093 . Consultado el 16 de noviembre de 2021 .
- ^ "Luz parásita y verificación del rendimiento".
- ^ "Precisión de longitud de onda en espectrofotometría UV/VIS".
- ^ "Persee PG Scientific Inc. – Preguntas frecuentes sobre New-UV: ancho de banda espectral". www.perseena.com .
- ^ "¿Qué es la luz parásita y cómo se controla?". 12 de junio de 2015.
- ^ Berberan-Santos, MN (septiembre de 1990). "Revisión de la ley de Beer". Journal of Chemical Education . 67 (9): 757. Bibcode :1990JChEd..67..757B. doi :10.1021/ed067p757.
- ^ Wittung, Pernilla; Kajanus, Johan; Kubista, Mikael; Malmström, Bo G. (19 de septiembre de 1994). "Aplanamiento de la absorción en los espectros ópticos de sustancias atrapadas en liposomas". FEBS Letters . 352 (1): 37–40. doi :10.1016/0014-5793(94)00912-0. PMID 7925937. S2CID 11419856.
- ^ Ansell, S; Tromp, RH; Neilson, GW (20 de febrero de 1995). "La estructura del soluto y del agua en una solución acuosa concentrada de cloruro de cobre (II)". Journal of Physics: Condensed Matter . 7 (8): 1513–1524. Bibcode :1995JPCM....7.1513A. doi :10.1088/0953-8984/7/8/002. S2CID 250898349.
- ^ Sooväli, L.; Rõõm, E.-I.; Kütt, A.; et al. (2006). "Fuentes de incertidumbre en la medición espectrofotométrica UV-Vis". Acreditación y garantía de calidad . 11 (5): 246–255. doi :10.1007/s00769-006-0124-x. S2CID 94520012.
- ^ Reservados todos los derechos, Mettler-Toledo International Inc. "Aplicaciones y fundamentos de la espectrofotometría". www.mt.com . Consultado el 10 de julio de 2018 .
- ^ Directrices para el examen forense de fibras, Grupo de trabajo científico, materiales, 1999, http://www.swgmat.org/fiber.htm
- ^ Guía estándar para microespectrofotometría y medición del color en el análisis forense de pintura, Scientific Working Group-Materials, 1999, http://www.swgmat.org/paint.htm
- ^ Horie, M.; Fujiwara, N.; Kokubo, M.; Kondo, N. (1994). "Sistema de medición de espesor de película delgada espectroscópica para industrias de semiconductores". Actas de congresos. 10.º aniversario. IMTC/94. Tecnologías avanzadas en I & M. Conferencia de tecnología de medición e instrumentación del IEEE de 1994 (n.º de cat. 94CH3424-9) . págs. 677–682. doi :10.1109/IMTC.1994.352008. ISBN . 0-7803-1880-3.S2CID110637259 .
- ^ Sertova, N.; Petkov, I.; Nunzi, J.-M. (junio de 2000). "Fotocromismo del ditizonato de mercurio(II) en solución". Journal of Photochemistry and Photobiology A: Chemistry . 134 (3): 163–168. doi :10.1016/s1010-6030(00)00267-7.
- ^ UC Davis (2 de octubre de 2013). "The Rate Law". ChemWiki . Consultado el 11 de noviembre de 2014 .
- ^ Mekhrengin, MV; Meshkovskii, IK; Tashkinov, VA; Guryev, VI; Sukhinets, AV; Smirnov, DS (junio de 2019). "Pirómetro multiespectral para mediciones de alta temperatura dentro de la cámara de combustión de motores de turbina de gas". Measurement . 139 : 355–360. Bibcode :2019Meas..139..355M. doi :10.1016/j.measurement.2019.02.084. S2CID 116260472.











