Carotenoide

Los carotenoides ( / k ə ˈ r ɒ t ɪ n ɔɪ d / ) son pigmentos orgánicos amarillos, naranjas y rojos que producen las plantas y las algas , así como varias bacterias, arqueas y hongos . [1] Los carotenoides dan el color característico a las calabazas , zanahorias , chirivías , maíz , tomates , canarios , flamencos , salmones , langostas , camarones y narcisos . Más de 1100 carotenoides identificados se pueden clasificar en dos clases: xantofilas (que contienen oxígeno) y carotenos (que son puramente hidrocarburos y no contienen oxígeno). [2]
Todos son derivados de tetraterpenos , lo que significa que se producen a partir de 8 unidades de isopreno y contienen 40 átomos de carbono. En general, los carotenoides absorben longitudes de onda que van desde 400 a 550 nanómetros (luz violeta a verde). Esto hace que los compuestos sean de colores intensos de amarillo, naranja o rojo. Los carotenoides son el pigmento dominante en la coloración de las hojas de otoño de aproximadamente el 15-30% de las especies de árboles, [3] pero muchos colores de las plantas, especialmente los rojos y morados, se deben a los polifenoles .

Los carotenoides cumplen dos funciones clave en las plantas y las algas: absorben la energía de la luz para usarla en la fotosíntesis y brindan fotoprotección a través de un apagado no fotoquímico . [4] Los carotenoides que contienen anillos de beta-ionona no sustituidos (incluidos β-caroteno , α-caroteno , β-criptoxantina y γ-caroteno ) tienen actividad de vitamina A (lo que significa que se pueden convertir en retinol ). En el ojo, la luteína , la meso -zeaxantina y la zeaxantina están presentes como pigmentos maculares cuya importancia en la función visual, a partir de 2016, sigue siendo objeto de investigación clínica . [3] [5]
Estructura y función



Los carotenoides son producidos por todos los organismos fotosintéticos y se utilizan principalmente como pigmentos accesorios de la clorofila en la parte de captación de luz de la fotosíntesis.
Son altamente insaturados con dobles enlaces conjugados , lo que permite a los carotenoides absorber luz de varias longitudes de onda . Al mismo tiempo, los grupos terminales regulan la polaridad y las propiedades dentro de las membranas lipídicas .
La mayoría de los carotenoides son tetraterpenoides , isoprenoides regulares . Existen varias modificaciones de estas estructuras: incluyendo ciclización , diversos grados de saturación o insaturación y otros grupos funcionales . [6] Los carotenos típicamente contienen solo carbono e hidrógeno, es decir, son hidrocarburos . Los miembros prominentes incluyen α-caroteno , β-caroteno y licopeno , se conocen como carotenos . Los carotenoides que contienen oxígeno incluyen luteína y zeaxantina . Se conocen como xantofilas . [3] Su color, que va desde amarillo pálido pasando por naranja brillante hasta rojo oscuro, está directamente relacionado con su estructura, especialmente la longitud de la conjugación. [3] Las xantofilas son a menudo amarillas, lo que da su nombre de clase.
Los carotenoides también participan en diferentes tipos de señalización celular. [7] Son capaces de señalar la producción de ácido abscísico , que regula el crecimiento de las plantas, la latencia de las semillas , la maduración y germinación del embrión , la división y elongación celular , el crecimiento floral y las respuestas al estrés. [8]
Fotofísica
La longitud de los enlaces dobles conjugados múltiples determina su color y fotofísica. [9] [10] Después de absorber un fotón, el carotenoide transfiere su electrón excitado a la clorofila para su uso en la fotosíntesis. [9] Tras la absorción de luz, los carotenoides transfieren energía de excitación hacia y desde la clorofila . La transferencia de energía singlete-singlete es una transferencia de estado de energía más baja y se utiliza durante la fotosíntesis. [7] La transferencia triplete-triplete es un estado de energía más alto y es esencial en la fotoprotección. [7] La luz produce especies dañinas durante la fotosíntesis, siendo las más dañinas las especies reactivas de oxígeno (ROS). [11] A medida que estas ROS de alta energía se producen en la clorofila, la energía se transfiere a la cola de polieno del carotenoide y sufre una serie de reacciones en las que los electrones se mueven entre los enlaces carotenoides para encontrar el estado más equilibrado (de menor energía) para el carotenoide. [9]
Los carotenoides defienden a las plantas contra el oxígeno singlete , tanto por transferencia de energía como por reacciones químicas. También protegen a las plantas extinguiendo la clorofila triplete. [12] Al proteger los lípidos del daño de los radicales libres, que generan peróxidos lipídicos cargados y otros derivados oxidados, los carotenoides apoyan la arquitectura cristalina y la hidrofobicidad de las lipoproteínas y las estructuras lipídicas celulares, por lo tanto, la solubilidad del oxígeno y su difusión en ellas. [13]
Relaciones estructura-propiedad
Al igual que algunos ácidos grasos , los carotenoides son lipofílicos debido a la presencia de largas cadenas alifáticas insaturadas . [3] Como consecuencia, los carotenoides suelen estar presentes en las lipoproteínas plasmáticas y en las estructuras lipídicas celulares. [14]
Morfología
Los carotenoides se encuentran principalmente fuera del núcleo celular en diferentes orgánulos del citoplasma, gotitas lipídicas , citosomas y gránulos. Se han visualizado y cuantificado mediante espectroscopia Raman en una célula de alga . [15]
Con el desarrollo de anticuerpos monoclonales contra el trans -licopeno fue posible localizar este carotenoide en diferentes células animales y humanas. [16]
.jpg/440px-Aerial_image_of_Grand_Prismatic_Spring_(view_from_the_south).jpg)
Alimentos
El betacaroteno , presente en calabazas , batatas , zanahorias y calabazas de invierno , es responsable de sus colores naranja-amarillo. [3] Las zanahorias secas tienen la mayor cantidad de caroteno de cualquier alimento por porción de 100 gramos, medida en equivalentes de actividad de retinol (equivalentes de provitamina A). [3] [17] La fruta gac vietnamita contiene la concentración más alta conocida del carotenoide licopeno . [18] Aunque las hojas verdes, la col rizada , las espinacas , la berza y las hojas de nabo contienen cantidades sustanciales de betacaroteno. [3] La dieta de los flamencos es rica en carotenoides, lo que imparte las plumas de color naranja de estas aves. [19]
Las revisiones de investigaciones preliminares en 2015 indicaron que los alimentos ricos en carotenoides pueden reducir el riesgo de cáncer de cabeza y cuello [20] y cáncer de próstata . [21] No existe correlación entre el consumo de alimentos ricos en carotenoides y vitamina A y el riesgo de enfermedad de Parkinson . [22]
Los seres humanos y otros animales son en su mayoría incapaces de sintetizar carotenoides y deben obtenerlos a través de su dieta. Los carotenoides son una característica común y a menudo ornamental en los animales. Por ejemplo, el color rosa del salmón y la coloración roja de las langostas cocidas y las escamas de la morfología amarilla de las lagartijas comunes se deben a los carotenoides. [23] [ cita requerida ] Se ha propuesto que los carotenoides se utilizan en rasgos ornamentales (para ejemplos extremos, consulte los pájaros frailecillos ) porque, dadas sus propiedades fisiológicas y químicas, pueden usarse como indicadores visibles de la salud individual y, por lo tanto, los animales los usan al seleccionar posibles parejas. [24]
Los carotenoides de la dieta se almacenan en los tejidos grasos de los animales [3] y los animales exclusivamente carnívoros obtienen los compuestos de la grasa animal. En la dieta humana, la absorción de carotenoides mejora cuando se consumen con grasa en una comida [25] . Cocinar verduras que contienen carotenoides en aceite y desmenuzar la verdura aumenta la biodisponibilidad de los carotenoides [3] [25] [26]
Colores de las plantas


Los carotenoides más comunes incluyen el licopeno y el precursor de la vitamina A, el β-caroteno. En las plantas, la xantofila luteína es el carotenoide más abundante y actualmente se está investigando su papel en la prevención de enfermedades oculares relacionadas con la edad. [5] La luteína y los demás pigmentos carotenoides que se encuentran en las hojas maduras a menudo no son obvios debido a la presencia enmascaradora de clorofila . Cuando la clorofila no está presente, como en el follaje de otoño, predominan los amarillos y naranjas de los carotenoides. Por la misma razón, los colores de los carotenoides a menudo predominan en la fruta madura después de ser desenmascarados por la desaparición de la clorofila.
Los carotenoides son responsables de los brillantes amarillos y naranjas que tiñen el follaje caducifolio (como las hojas moribundas de otoño ) de ciertas especies de madera dura como nogales , fresnos , arces , álamos amarillos , álamos temblones , abedules , cerezos negros , sicomoros , álamos , sasafrás y alisos . Los carotenoides son el pigmento dominante en la coloración de las hojas otoñales de aproximadamente el 15-30% de las especies de árboles. [27] Sin embargo, los rojos, los púrpuras y sus combinaciones mezcladas que decoran el follaje otoñal generalmente provienen de otro grupo de pigmentos en las células llamadas antocianinas . A diferencia de los carotenoides, estos pigmentos no están presentes en la hoja durante toda la temporada de crecimiento, sino que se producen activamente hacia el final del verano. [28]
Colores de las aves y selección sexual
Los carotenoides dietéticos y sus derivados metabólicos son responsables de la coloración amarilla brillante a roja en las aves. [29] Los estudios estiman que alrededor de 2956 especies de aves modernas muestran coloración carotenoides y que la capacidad de utilizar estos pigmentos para la coloración externa ha evolucionado independientemente muchas veces a lo largo de la historia evolutiva de las aves. [30] La coloración carotenoides exhibe altos niveles de dimorfismo sexual , y los pájaros machos adultos generalmente muestran una coloración más vibrante que las hembras de la misma especie. [31]
Estas diferencias surgen debido a la selección de coloración amarilla y roja en los machos por preferencia de las hembras . [32] [31] En muchas especies de aves, las hembras invierten más tiempo y recursos en la crianza de las crías que sus parejas masculinas. Por lo tanto, es imperativo que las aves hembras seleccionen cuidadosamente parejas de alta calidad. La literatura actual apoya la teoría de que la coloración vibrante de los carotenoides está correlacionada con la calidad masculina, ya sea a través de efectos directos sobre la función inmune y el estrés oxidativo, [33] [34] [35] o a través de una conexión entre las vías de metabolización de los carotenoides y las vías de respiración celular. [36] [37]
En general, se considera que los rasgos seleccionados sexualmente, como la coloración basada en carotenoides, evolucionan porque son señales honestas de calidad fenotípica y genética. Por ejemplo, entre los machos de la especie de ave Parus major , los machos con ornamentación más colorida producen esperma que está mejor protegido contra el estrés oxidativo debido a una mayor presencia de antioxidantes carotenoides . [38] Sin embargo, también hay evidencia de que la coloración masculina atractiva puede ser una señal defectuosa de la calidad masculina. Entre los peces espinosos , los machos que son más atractivos para las hembras debido a los colorantes carotenoides parecen asignar carotenoides de forma insuficiente a sus células de la línea germinal. [39] Dado que los carotinoides son antioxidantes beneficiosos, su asignación insuficiente a las células de la línea germinal puede conducir a un mayor daño oxidativo del ADN a estas células. [39] Por lo tanto, las hembras de espinosos pueden arriesgar la fertilidad y la viabilidad de su descendencia al elegir parejas más rojas, pero más deterioradas, con una calidad de esperma reducida .
Productos químicos aromáticos
Los productos de degradación de carotenoides, como las iononas , las damasconas y las damascenonas, también son sustancias químicas importantes que se utilizan ampliamente en la industria de los perfumes y las fragancias. Tanto la β-damascenona como la β-ionona, aunque se encuentran en concentraciones bajas en los destilados de rosas , son los principales compuestos que contribuyen al olor de las flores. De hecho, los dulces olores florales presentes en el té negro , el tabaco añejo , la uva y muchas frutas se deben a los compuestos aromáticos resultantes de la descomposición de los carotenoides.
Enfermedad
Algunas bacterias producen carotenoides para protegerse del ataque inmunitario oxidativo. El pigmento aureus (dorado) que da nombre a algunas cepas de Staphylococcus aureus es un carotenoide llamado estafiloxantina . Este carotenoide es un factor de virulencia con una acción antioxidante que ayuda al microbio a evadir la muerte por especies reactivas de oxígeno utilizadas por el sistema inmunitario del huésped. [40]
Biosíntesis

Los componentes básicos de los carotenoides son el difosfato de isopentenilo (IPP) y el difosfato de dimetilalilo (DMAPP). [41] Estos dos isómeros de isopreno se utilizan para crear varios compuestos según la vía biológica utilizada para sintetizar los isómeros. [42] Se sabe que las plantas utilizan dos vías diferentes para la producción de IPP: la vía del ácido mevalónico citosólico (MVA) y la vía del metileritritol 4-fosfato plastídico (MEP). [41] En los animales, la producción de colesterol comienza creando IPP y DMAPP utilizando el MVA. [42] Para la producción de carotenoides, las plantas utilizan MEP para generar IPP y DMAPP. [41] La vía MEP da como resultado una mezcla 5:1 de IPP:DMAPP. [42] El IPP y el DMAPP experimentan varias reacciones, lo que da como resultado el principal precursor de carotenoides, el difosfato de geranilgeranilo (GGPP). El GGPP se puede convertir en carotenos o xantofilas al atravesar una serie de pasos diferentes dentro de la vía biosintética de los carotenoides. [41]
Ruta del MEP
El gliceraldehído 3-fosfato y el piruvato , intermediarios de la fotosíntesis , se convierten en desoxi-D-xilulosa 5-fosfato (DXP) catalizada por la DXP sintasa (DXS). La DXP reductoisomerasa cataliza la reducción por NADPH y la posterior reorganización. [41] [42] El MEP resultante se convierte en 4-(citidina 5'-difosfo)-2-C-metil-D-eritritol (CDP-ME) en presencia de CTP utilizando la enzima MEP citidililtransferasa. Luego, el CDP-ME se convierte, en presencia de ATP , en 2-fosfo-4-(citidina 5'-difosfo)-2-C-metil-D-eritritol (CDP-ME2P). La conversión a CDP-ME2P es catalizada por la CDP-ME quinasa . A continuación, el CDP-ME2P se convierte en 2-C-metil-D-eritritol 2,4-ciclodifosfato (MECDP). Esta reacción ocurre cuando la MECDP sintasa cataliza la reacción y el CMP se elimina de la molécula de CDP-ME2P. Luego, el MECDP se convierte en (e)-4-hidroxi-3-metilbut-2-en-1-il difosfato (HMBDP) a través de la HMBDP sintasa en presencia de flavodoxina y NADPH. El HMBDP se reduce a IPP en presencia de ferredoxina y NADPH por la enzima HMBDP reductasa . Los dos últimos pasos que involucran a la HMBPD sintasa y reductasa solo pueden ocurrir en entornos completamente anaeróbicos . Luego, el IPP puede isomerizarse a DMAPP a través de la IPP isomerasa. [42]
Vía biosintética de los carotenoides
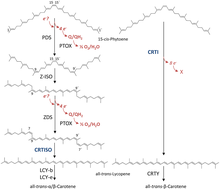
Dos moléculas de GGPP se condensan a través de la fitoeno sintasa (PSY), formando el isómero 15-cis del fitoeno . La PSY pertenece a la familia de las escualenos/fitoeno sintasas y es homóloga a la escualeno sintasa que participa en la biosíntesis de esteroides . La conversión posterior del fitoeno en licopeno todo-trans depende del organismo. Las bacterias y los hongos emplean una sola enzima, la fitoeno desaturasa bacteriana (CRTI) para la catálisis. Sin embargo, las plantas y las cianobacterias utilizan cuatro enzimas para este proceso. [43] La primera de estas enzimas es una fitoeno desaturasa de tipo vegetal que introduce dos dobles enlaces adicionales en el 15-cis-fitoeno por deshidrogenación e isomeriza dos de sus dobles enlaces existentes de trans a cis produciendo 9,15,9'-tri-cis-ζ-caroteno. El doble enlace central de este tri-cis-ζ-caroteno es isomerizado por la zeta-caroteno isomerasa Z-ISO y el 9,9'-di-cis-ζ-caroteno resultante es deshidrogenado nuevamente por medio de una ζ-caroteno desaturasa (ZDS) . Esto nuevamente introduce dos dobles enlaces, resultando en 7,9,7',9'-tetra-cis-licopeno. CRTISO , una carotenoide isomerasa, es necesaria para convertir el cis -licopeno en un licopeno todo-trans en presencia de FAD reducido .
Este licopeno totalmente trans se cicla; la ciclización da lugar a la diversidad de carotenoides, que se puede distinguir en función de los grupos terminales. Puede haber un anillo beta o un anillo épsilon, cada uno generado por una enzima diferente ( licopeno beta-ciclasa [beta-LCY] o licopeno épsilon-ciclasa [épsilon-LCY]). El α-caroteno se produce cuando el licopeno totalmente trans primero experimenta una reacción con épsilon-LCY y luego una segunda reacción con beta-LCY; mientras que el β-caroteno se produce mediante dos reacciones con beta-LCY. El α- y el β-caroteno son los carotenoides más comunes en los fotosistemas de las plantas , pero aún pueden convertirse en xantofilas mediante el uso de beta-hidrolasa y épsilon-hidrolasa, lo que da lugar a una variedad de xantofilas. [41]
Regulación
Se cree que tanto DXS como DXR son enzimas que determinan la velocidad, lo que les permite regular los niveles de carotenoides. [41] Esto se descubrió en un experimento en el que DXS y DXR se sobreexpresaron genéticamente, lo que provocó un aumento de la expresión de carotenoides en las plántulas resultantes. [41] Además, se cree que las chaperonas de la proteína J (J20) y la proteína de choque térmico 70 (Hsp70) están involucradas en la regulación postranscripcional de la actividad de DXS, de modo que los mutantes con actividad J20 defectuosa exhiben una actividad enzimática DXS reducida mientras acumulan proteína DXS inactiva. [44] La regulación también puede ser causada por toxinas externas que afectan a las enzimas y proteínas necesarias para la síntesis. La ketoclomazona se deriva de herbicidas aplicados al suelo y se une a la sintasa DXP. [42] Esto inhibe la sintasa DXP, lo que evita la síntesis de DXP y detiene la vía MEP. [42] El uso de esta toxina conduce a niveles más bajos de carotenoides en plantas cultivadas en el suelo contaminado. [42] La fosmidomicina , un antibiótico , es un inhibidor competitivo de la DXP reductoisomerasa debido a su estructura similar a la enzima. [42] La aplicación de dicho antibiótico previene la reducción de DXP, deteniendo nuevamente la vía MEP. [42]
Carotenoides de origen natural
- Hidrocarburos
- Licoperseno 7,8,11,12,15,7',8',11',12',15'-Decahidro-γ,γ-caroteno
- Fitoflueno
- Licopeno
- Hexahidrolicopeno 15- cis -7,8,11,12,7',8'-Hexahidro-γ,γ-caroteno
- Toruleno 3',4'-Didehidro-β,γ-caroteno
- α-Zeacaroteno 7',8'-Dihidro-ε,γ-caroteno
- α-caroteno
- β-caroteno
- γ-caroteno
- δ-caroteno
- ε-caroteno
- ζ-caroteno
- Alcoholes
- Aloxantina
- Bacteriouberina 2,2'-Bis(3-hidroxi-3-metilbutil)-3,4,3',4'-tetradehidro-1,2,1',2'-tetrahidro-γ,γ-caroteno-1,1'-diol
- Cintiaxantina
- Pectenoxantina
- Criptomonaxantina (3R,3'R)-7,8,7',8'-Tetradehidro-β,β-caroteno-3,3'-diol
- Crustaxantina β,-Caroteno-3,4,3',4'-tetrol
- Gazaniaxantina (3R)-5'-cis-β,γ-Caroten-3-ol
- OH-Clorobacteno 1',2'-Dihidro-f,γ-caroten-1'-ol
- Loroxantina β,ε-Caroteno-3,19,3'-triol
- Luteína (3R,3′R,6′R)-β,ε-caroteno-3,3′-diol
- Licoxantina γ,γ-Caroten-16-ol
- Rodopina 1,2-Dihidro-γ,γ-caroten-l-ol
- Rodopinol también conocido como Warmingol 13- cis -1,2-Dihidro-γ,γ-caroteno-1,20-diol
- Saproxantina 3',4'-Didehidro-1',2'-dihidro-β,γ-caroteno-3,1'-diol
- Zeaxantina
- Glicósidos
- Oscillaxantina 2,2'-Bis(β-L-ramnopiranosiloxi)-3,4,3',4'-tetradehidro-1,2,1',2'-tetrahidro-γ,γ-caroteno-1,1'-diol
- Fleixantofila 1'-(β-D-glucopiranosiloxi)-3',4'-didehidro-1',2'-dihidro-β,γ-caroten-2'-ol
- Éteres
- Rodovibrina 1'-metoxi-3',4'-dideshidro-1,2,1',2'-tetrahidro-γ,γ-caroten-1-ol
- Esferoideno 1-Metoxi-3,4-didehidro-1,2,7',8'-tetrahidro-γ,γ-caroteno
- Epóxidos
- Diadinoxantina 5,6-epoxi-7',8'-didehidro-5,6-dihidro—caroteno-3,3-diol
- Luteoxantina 5,6: 5',8'-Diepoxi-5,6,5',8'-tetrahidro-β,β-caroteno-3,3'-diol
- Mutatoxantina
- Citroxantina
- Furanóxido de zeaxantina 5,8-epoxi-5,8-dihidro-β,β-caroteno-3,3'-diol
- Neocromo 5',8'-epoxi-6,7-didehidro-5,6,5',8'-tetrahidro-β,β-caroteno-3,5,3'-triol
- Foliacromo
- Trolicroma
- Vaucheriaxantina 5',6'-Epoxi-6,7-didehidro-5,6,5',6'-tetrahidro-β,β-caroteno-3,5,19,3'-tetrol
- Aldehídos
- rodopinal
- Warmingona 13-cis-1-hidroxi-1,2-dihidro-γ,γ-caroten-20-al
- Torularodinaldehído 3',4'-Didehidro-β,γ-caroten-16'-al
- Ácidos y ésteres de ácidos
- Ácido torularodin 3',4'-dideshidro-β,γ-caroteno-16'-oico
- Éster metílico de torularhodina 3',4'-dideshidro-β,γ-caroten-16'-oato de metilo
- Cetonas
- Astaceno
- Astaxantina
- Cantaxantina [45] también conocida como afanicina, clorellaxantina β,β-caroteno-4,4'-diona
- Capsantina (3R,3'S,5'R)-3,3'-Dihidroxi-β,κ-caroteno-6'-ona
- Capsorubina (3S,5R,3'S,5'R)-3,3'-Dihidroxi-κ,κ-caroteno-6,6'-diona
- Criptocapsina (3'R,5'R)-3'-Hidroxi-β,κ-caroteno-6'-ona
- 2,2'-Diketospirilloxantina 1,1'-Dimetoxi-3,4,3',4'-tetradehidro-1,2,1',2'-tetrahidro-γ,γ-caroteno-2,2'-diona
- Equinenona β,β-caroteno-4-ona
- 3'-Hidroxiequinenona
- Flexixantina 3,1'-Dihidroxi-3',4'-dideshidro-1',2'-dihidro-β,γ-caroten-4-ona
- 3-OH-cantaxantina también conocida como adonirrubina también conocida como fenicoxantina 3-hidroxi-β,β-caroteno-4,4'-diona
- Hidroxiesferiodenona 1'-Hidroxi-1-metoxi-3,4-didehidro-1,2,1',2',7',8'-hexahidro-γ,γ-caroten-2-ona
- Okenona 1'-Metoxi-1',2'-dihidro-c,γ-caroten-4'-ona
- Pectenolona 3,3'-Dihidroxi-7',8'-didehidro-β,β-caroten-4-ona
- Feniconona también conocida como deshidroadonirubina 3-hidroxi-2,3-dideshidro-β,β-caroteno-4,4'-diona
- Fenicopterona β,ε-caroteno-4-ona
- Rubixantona 3-hidroxi-β,γ-caroteno-4'-ona
- Sifonaxantina 3,19,3'-Trihidroxi-7,8-dihidro-β,ε-caroten-8-ona
- Ésteres de alcoholes
- Dipalmitato de astaceína 3,3'-bispalmitoiloxi-2,3,2',3'-tetradehidro-β,β-caroteno-4,4'-diona o 3,3'-dihidroxi-2,3,2',3'-tetradehidro-β,β-caroteno-4,4'-diona
- Fucoxantina 3'-Acetoxi-5,6-epoxi-3,5'-dihidroxi-6',7'-didehidro-5,6,7,8,5',6'-hexahidro-β,β-caroten-8-ona
- Isofucoxantina 3'-Acetoxi-3,5,5'-trihidroxi-6',7'-didehidro-5,8,5',6'-tetrahidro-β,β-caroten-8-ona
- Fisalien
- Sifoneína 3,3'-Dihidroxi-19-lauroiloxi-7,8-dihidro-β,ε-caroten-8-ona o 3,19,3'-trihidroxi-7,8-dihidro-β,ε-caroten-8-ona 19-laurato
- Apocarotenoides
- β-Apo-2'-carotenal 3',4'-Didehidro-2'-apo-b-caroten-2'-al
- Apo-2-licopenal
- Apo-6'-licopenal 6'-Apo-y-caroten-6'-al
- Azafrinaldehído 5,6-Dihidroxi-5,6-dihidro-10'-apo-β-caroten-10'-al
- Bixina 6'-Metil hidrógeno 9'-cis-6,6'-diapocaroteno-6,6'-dioato
- Citranaxantina 5',6'-Dihidro-5'-apo-β-caroten-6'-ona o 5',6'-dihidro-5'-apo-18'-nor-β-caroten-6'-ona o 6'-metil-6'-apo-β-caroten-6'-ona
- Crocetina Ácido 8,8'-diapo-8,8'-carotenodioico
- Semialdehído crocetina Ácido 8'-oxo-8,8'-diapo-8-carotenoico
- Digentiobiosilo 8,8'-diapo-8,8'-carotenodioato de crocina
- Hopkinsiaxantina 3-Hidroxi-7,8-didehidro-7',8'-dihidro-7'-apo-b-caroteno-4,8'-diona o 3-hidroxi-8'-metil-7,8-didehidro-8'-apo-b-caroteno-4,8'-diona
- Apo-6'-licopenoato de metilo 6'-apo-y-caroten-6'-oato de metilo
- Paracentrona 3,5-Dihidroxi-6,7-didehidro-5,6,7',8'-tetrahidro-7'-apo-b-caroten-8'-ona o 3,5-dihidroxi-8'-metil-6,7-didehidro-5,6-dihidro-8'-apo-b-caroten-8'-ona
- Sintaxantina 7',8'-Dihidro-7'-apo-b-caroten-8'-ona u 8'-metil-8'-apo-b-caroten-8'-ona
- Nor- y seco-carotenoides
- Actinioeritrina 3,3'-bisaciloxi-2,2'-dinor-b,b-caroteno-4,4'-diona
- β-Carotenona 5,6:5',6'-Diseco-b,b-caroteno-5,6,5',6'-tetrona
- Peridinina 3'-Acetoxi-5,6-epoxi-3,5'-dihidroxi-6',7'-didehidro-5,6,5',6'-tetrahidro-12',13',20'-trinor-b,b-caroten-19,11-olida
- Pirroxantininol 5,6-epoxi-3,3'-dihidroxi-7',8'-didehidro-5,6-dihidro-12',13',20'-trinor-b,b-caroten-19,11-olida
- Semi-α-carotenona 5,6-Seco-b,e-caroteno-5,6-diona
- Semi-β-carotenona 5,6-seco-b,b-caroteno-5,6-diona o 5',6'-seco-b,b-caroteno-5',6'-diona
- Trifasiaxantina 3-Hidroxisemi-b-carotenona 3'-Hidroxi-5,6-seco-b,b-caroteno-5,6-diona o 3-hidroxi-5',6'-seco-b,b-caroteno-5',6'-diona
- Retrocarotenoides y retroapocarotenoides
- Eschscholtzxanthin 4',5'-Didehidro-4,5'-retro-b,b-caroteno-3,3'-diol
- Eschscholtzxanthone 3'-Hidroxi-4',5'-didehidro-4,5'-retro-b,b-caroten-3-ona
- Rodoxantina 4',5'-Didehidro-4,5'-retro-b,b-caroteno-3,3'-diona
- Tangeraxantina 3-Hidroxi-5'-metil-4,5'-retro-5'-apo-b-caroten-5'-ona o 3-hidroxi-4,5'-retro-5'-apo-b-caroten-5'-ona
- Carotenoides más altos
- Nonaprenoxantina 2-(4-Hidroxi-3-metil-2-butenil)-7',8',11',12'-tetrahidro-e,y-caroteno
- Decaprenoxantina 2,2'-Bis(4-hidroxi-3-metil-2-butenil)-e,e-caroteno
- Cp 450 2-[4-Hidroxi-3-(hidroximetil)-2-butenil]-2'-(3-metil-2-butenil)-b,b-caroteno
- Cp 473 2'-(4-Hidroxi-3-metil-2-butenil)-2-(3-metil-2-butenil)-3',4'-didehidro-1',2'-dihidro-β,γ-caroten-1'-ol
- Bacteriouberina 2,2'-Bis(3-hidroxi-3-metilbutil)-3,4,3',4'-tetradehidro-1,2,1',2'-tetrahidro-γ,γ-caroteno-1,1'-diol
Véase también
- Lista de fitoquímicos presentes en los alimentos
- CRT (genética) , grupo de genes responsables de la biosíntesis de carotenoides
- Número E#E100–E199 (colores)
- Fitoquímica
Referencias
- ^ Nelson, David L.; Cox, Michael M. (2005). Principios de bioquímica (4.ª ed.). Nueva York: W. H. Freeman. ISBN 0-7167-4339-6.
- ^ Yabuzaki, Junko (1 de enero de 2017). "Base de datos de carotenoides: estructuras, huellas químicas y distribución entre organismos". Base de datos . 2017 (1). doi :10.1093/database/bax004. PMC 5574413 . PMID 28365725.
- ^ abcdefghij «Carotenoides». Centro de Información sobre Micronutrientes, Instituto Linus Pauling, Universidad Estatal de Oregón. 1 de agosto de 2016. Consultado el 17 de abril de 2019 .
- ^ Armstrong GA, Hearst JE (1996). "Carotenoides 2: Genética y biología molecular de la biosíntesis de pigmentos carotenoides". FASEB J . 10 (2): 228–37. doi : 10.1096/fasebj.10.2.8641556 . PMID 8641556. S2CID 22385652.
- ^ ab Bernstein, PS; Li, B; Vachali, PP; Gorusupudi, A; Shyam, R; Henriksen, BS; Nolan, JM (2015). "Luteína, zeaxantina y mesozeaxantina: la ciencia básica y clínica que subyace a las intervenciones nutricionales basadas en carotenoides contra la enfermedad ocular". Progreso en la investigación de la retina y los ojos . 50 : 34–66. doi :10.1016/j.preteyeres.2015.10.003. PMC 4698241. PMID 26541886 .
- ^ Maresca, Julia A.; Romberger, Steven P.; Bryant, Donald A. (28 de mayo de 2008). "La biosíntesis de isorenierateno en bacterias verdes del azufre requiere las acciones cooperativas de dos carotenoides ciclasas". Journal of Bacteriology . 190 (19): 6384–6391. doi :10.1128/JB.00758-08. ISSN 0021-9193. PMC 2565998 . PMID 18676669.
- ^ abc Cogdell, RJ (30 de noviembre de 1978). "Carotenoides en la fotosíntesis". Phil. Trans. R. Soc. Lond. B . 284 (1002): 569–579. Código Bibliográfico :1978RSPTB.284..569C. doi :10.1098/rstb.1978.0090. ISSN 0080-4622.
- ^ Finkelstein, Ruth (1 de noviembre de 2013). "Síntesis y respuesta del ácido abscísico". The Arabidopsis Book . 11 : e0166. doi :10.1199/tab.0166. ISSN 1543-8120. PMC 3833200 . PMID 24273463.
- ^ abc Vershinin, Alexander (1999-01-01). "Funciones biológicas de los carotenoides: diversidad y evolución". BioFactors . 10 (2–3): 99–104. doi :10.1002/biof.5520100203. ISSN 1872-8081. PMID 10609869. S2CID 24408277.
- ^ Polívka, Tomáš; Sundström, Villy (2004). "Dinámica ultrarrápida de estados excitados de carotenoides: de la solución a los sistemas naturales y artificiales". Chemical Reviews . 104 (4): 2021–2072. doi :10.1021/cr020674n. PMID 15080720.
- ^ Aizpuru, Aitor; González-Sánchez, Armando (2024-07-20). "Estrategias tradicionales y de nueva tendencia para mejorar el contenido de pigmentos en microalgas". Revista Mundial de Microbiología y Biotecnología . 40 (9): 272. doi :10.1007/s11274-024-04070-3. ISSN 1573-0972. PMC 11271434 . PMID 39030303.
- ^ Ramel, Fanny; Birtic, Simona; Cuiné, Stéphan; Triantaphylidès, Christian; Ravanat, Jean-Luc; Havaux, Michel (2012). "Extinción química del oxígeno singlete por carotenoides en plantas". Fisiología vegetal . 158 (3): 1267–1278. doi :10.1104/pp.111.182394. PMC 3291260 . PMID 22234998.
- ^ John Thomas Landrum (2010). Carotenoides: funciones y propiedades físicas, químicas y biológicas. Boca Raton: CRC Press. ISBN 978-1-4200-5230-5.OCLC 148650411 .
- ^ Gruszecki, Wieslaw I. (2004), Frank, Harry A.; Young, Andrew J.; Britton, George; Cogdell, Richard J. (eds.), "Carotenoides en membranas", La fotoquímica de los carotenoides , Avances en la fotosíntesis y la respiración, vol. 8, Dordrecht: Kluwer Academic Publishers, págs. 363–379, doi :10.1007/0-306-48209-6_20, ISBN 978-0-7923-5942-5, consultado el 28 de marzo de 2021
- ^ Timlin, Jerilyn A.; Collins, Aaron M.; Beechem, Thomas A.; Shumskaya, Maria; Wurtzel, Eleanore T. (14 de junio de 2017), "Localización y cuantificación de carotenoides en células y tejidos intactos", Carotenoids , InTech, doi : 10.5772/68101 , ISBN 978-953-51-3211-0, Número de identificación del sujeto 54807067
- ^ Petyaev, Ivan M.; Zigangirova, Naylia A.; Pristensky, Dmitry; et al. (2018). "Evaluación por inmunofluorescencia no invasiva del estado de suplementación con licopeno en frotis de piel". Anticuerpos monoclonales en inmunodiagnóstico e inmunoterapia . 37 (3): 139–146. doi :10.1089/mab.2018.0012. ISSN 2167-9436. PMID 29901405. S2CID 49190846.
- ^ "Alimentos con mayor equivalente de actividad de retinol". nutritiondata.self.com . Consultado el 4 de diciembre de 2015 .
- ^ Tran, XT; Parks, SE; Roach, PD; Golding, JB; Nguyen, MH (2015). "Efectos de la madurez en las propiedades fisicoquímicas de la fruta Gac (Momordica cochinchinensis Spreng.)". Ciencia y nutrición de los alimentos . 4 (2): 305–314. doi :10.1002/fsn3.291. PMC 4779482 . PMID 27004120.
- ^ Yim, KJ; Kwon, J; Cha, IT; Oh, KS; Song, HS; Lee, HW; Rhee, JK; Song, EJ; Rho, JR; Seo, ML; Choi, JS; Choi, HJ; Lee, SJ; Nam, YD; Roh, SW (2015). "Presencia de haloarqueas viables pigmentadas de rojo en el plumaje de flamencos cautivos". Scientific Reports . 5 : 16425. Bibcode :2015NatSR...516425Y. doi :10.1038/srep16425. PMC 4639753 . PMID 26553382.
- ^ Leoncini; Fuentes, Natural; Cabeza; Cáncer, Cuello; et al. (julio de 2015). "Una revisión sistemática y metaanálisis de estudios epidemiológicos". Cancer Epidemiol Biomarkers Prev . 24 (7): 1003–11. doi :10.1158/1055-9965.EPI-15-0053. PMID 25873578. S2CID 21131127.
- ^ Soares Nda, C; et al. (octubre de 2015). "Propiedades anticancerígenas de los carotenoides en el cáncer de próstata. Una revisión" (PDF) . Histol Histopathol . 30 (10): 1143–54. doi :10.14670/HH-11-635. PMID 26058846.
- ^ Takeda, A; et al. (2014). "Vitamina A y carotenoides y el riesgo de enfermedad de Parkinson: una revisión sistemática y metanálisis". Neuroepidemiología . 42 (1): 25–38. doi : 10.1159/000355849 . PMID 24356061. S2CID 12396064.
- ^ Sacchi, Roberto (4 de junio de 2013). "Variación de color en la lagartija roquera polimórfica (Podarcis muralis): un análisis utilizando el sistema de color RGB". Zoologischer Anzeiger . 252 (4): 431–439. Bibcode :2013ZooAn.252..431S. doi :10.1016/j.jcz.2013.03.001.
- ^ Whitehead RD, Ozakinci G, Perrett DI (2012). "Coloración atractiva de la piel: aprovechamiento de la selección sexual para mejorar la dieta y la salud". Evol Psychol . 10 (5): 842–54. doi : 10.1177/147470491201000507 . PMC 10429994 . PMID 23253790. S2CID 8655801.
- ^ ab Mashurabad, Purna Chandra; Palika, Ravindranadh; Jyrwa, Yvette Wilda; Bhaskarachary, K.; Pullakhandam, Raghu (3 de enero de 2017). "La composición de la grasa dietética, la matriz alimentaria y la polaridad relativa modulan la micelarización y la absorción intestinal de carotenoides de verduras y frutas". Revista de ciencia y tecnología de los alimentos . 54 (2): 333–341. doi :10.1007/s13197-016-2466-7. ISSN 0022-1155. PMC 5306026 . PMID 28242932.
- ^ Rodrigo, María Jesús; Cilla, Antonio; Barberá, Reyes; Zacarías, Lorenzo (2015). "Biodisponibilidad de carotenoides en pulpa y jugo fresco de naranjas y mandarinas dulces ricas en carotenoides". Food & Function . 6 (6): 1950–1959. doi :10.1039/c5fo00258c. PMID 25996796.
- ^ Archetti, Marco; Döring, Thomas F.; Hagen, Snorre B.; Hughes, Nicole M.; Leather, Simon R.; Lee, David W.; Lev-Yadun, Simcha; Manetas, Yiannis; Ougham, Helen J. (2011). "Descifrando la evolución de los colores del otoño: un enfoque interdisciplinario". Tendencias en ecología y evolución . 24 (3): 166–73. doi :10.1016/j.tree.2008.10.006. PMID 19178979.
- ^ Davies, Kevin M., ed. (2004). Pigmentos vegetales y su manipulación. Reseñas anuales de plantas. Vol. 14. Oxford: Blackwell Publishing. pág. 6. ISBN 978-1-4051-1737-1.
- ^ Delhey, Kaspar; Peters, Anne (16 de noviembre de 2016). "El efecto de los mecanismos de producción de color en el dicromatismo sexual del plumaje en paseriformes y loros". Ecología funcional . 31 (4): 903–914. doi : 10.1111/1365-2435.12796 . ISSN 0269-8463.
- ^ Thomas, Daniel B.; McGraw, Kevin J.; Butler, Michael W.; Carrano, Matthew T.; Madden, Odile; James, Helen F. (7 de agosto de 2014). "Orígenes antiguos y apariencias múltiples de plumas pigmentadas con carotenoides en aves". Actas de la Royal Society B: Ciencias Biológicas . 281 (1788): 20140806. doi :10.1098/rspb.2014.0806. ISSN 0962-8452. PMC 4083795 . PMID 24966316.
- ^ ab Cooney, Christopher R.; Varley, Zoë K.; Nouri, Lara O.; Moody, Christopher JA; Jardine, Michael D.; Thomas, Gavin H. (16 de abril de 2019). "La selección sexual predice la tasa y la dirección de la divergencia del color en una gran radiación aviar". Nature Communications . 10 (1): 1773. Bibcode :2019NatCo..10.1773C. doi :10.1038/s41467-019-09859-7. ISSN 2041-1723. PMC 6467902 . PMID 30992444.
- ^ Hill, Geoffrey E. (septiembre de 1990). "Las hembras de pinzón doméstico prefieren machos coloridos: selección sexual para un rasgo dependiente de la condición". Animal Behaviour . 40 (3): 563–572. doi :10.1016/s0003-3472(05)80537-8. ISSN 0003-3472. S2CID 53176725.
- ^ Weaver, Ryan J.; Santos, Eduardo SA; Tucker, Anna M.; Wilson, Alan E.; Hill, Geoffrey E. (8 de enero de 2018). "El metabolismo de los carotenoides fortalece el vínculo entre la coloración de las plumas y la calidad individual". Nature Communications . 9 (1): 73. Bibcode :2018NatCo...9...73W. doi :10.1038/s41467-017-02649-z. ISSN 2041-1723. PMC 5758789 . PMID 29311592.
- ^ Simons, Mirre JP; Cohen, Alan A.; Verhulst, Simon (14 de agosto de 2012). "¿Qué nos dice la coloración dependiente de los carotenoides? El nivel plasmático de carotenoides indica inmunocompetencia y estado de estrés oxidativo en aves: un metaanálisis". PLOS ONE . 7 (8): e43088. Bibcode :2012PLoSO...743088S. doi : 10.1371/journal.pone.0043088 . ISSN 1932-6203. PMC 3419220 . PMID 22905205.
- ^ Koch, Rebecca E.; Hill, Geoffrey E. (14 de mayo de 2018). "¿Los adornos basados en carotenoides implican compensaciones de recursos? Una evaluación de la teoría y los datos". Ecología funcional . 32 (8): 1908–1920. Bibcode :2018FuEco..32.1908K. doi : 10.1111/1365-2435.13122 . ISSN 0269-8463.
- ^ Hill, Geoffrey E.; Johnson, James D. (noviembre de 2012). "La hipótesis de la vitamina A-Redox: una base bioquímica para la señalización honesta a través de la pigmentación de carotenoides". The American Naturalist . 180 (5): E127–E150. doi :10.1086/667861. ISSN 0003-0147. PMID 23070328. S2CID 2013258.
- ^ Powers, Matthew J; Hill, Geoffrey E (3 de mayo de 2021). "Una revisión y evaluación de la hipótesis de la vía compartida para el mantenimiento de la honestidad de la señal en la coloración basada en cetocarotenoides rojos". Biología integrativa y comparada . 61 (5): 1811–1826. doi : 10.1093/icb/icab056 . ISSN 1540-7063. PMID 33940618.
- ^ Helfenstein, Fabrice; Losdat, Sylvain; Møller, Anders Pape; Blount, Jonathan D.; Richner, Heinz (febrero de 2010). "Los espermatozoides de los machos coloridos están mejor protegidos contra el estrés oxidativo". Ecology Letters . 13 (2): 213–222. Bibcode :2010EcolL..13..213H. doi : 10.1111/j.1461-0248.2009.01419.x . ISSN 1461-0248. PMID 20059524.
- ^ ab Kim, Sin-Yeon; Velando, Alberto (enero de 2020). "Los espinosos machos atractivos presentan más daño oxidativo del ADN en el soma y la línea germinal". Revista de biología evolutiva . 33 (1): 121–126. doi :10.1111/jeb.13552. ISSN 1420-9101. PMID 31610052. S2CID 204702365.
- ^ Liu GY, Essex A, Buchanan JT, et al. (2005). "El pigmento dorado de Staphylococcus aureus afecta la destrucción de neutrófilos y promueve la virulencia a través de su actividad antioxidante". J. Exp. Med . 202 (2): 209–15. doi :10.1084/jem.20050846. PMC 2213009. PMID 16009720 .
- ^ abcdefgh Nisar, Nazia; Li, Li; Lu, Shan; Khin, Nay Chi; Pogson, Barry J. (5 de enero de 2015). "Metabolismo de carotenoides en plantas". Molecular Plant . Metabolismo vegetal y biología sintética. 8 (1): 68–82. doi : 10.1016/j.molp.2014.12.007 . PMID 25578273. S2CID 26818009.
- ^ abcdefghij KUZUYAMA, Tomohisa; SETO, Haruo (9 de marzo de 2012). "Dos vías distintas para los precursores metabólicos esenciales para la biosíntesis de isoprenoides". Actas de la Academia Japonesa. Serie B, Ciencias Físicas y Biológicas . 88 (3): 41–52. Bibcode :2012PJAB...88...41K. doi :10.2183/pjab.88.41. ISSN 0386-2208. PMC 3365244 . PMID 22450534.
- ^ Moise, Alexander R.; Al-Babili, Salim; Wurtzel, Eleanore T. (31 de octubre de 2013). "Aspectos mecanicistas de la biosíntesis de carotenoides". Chemical Reviews . 114 (1): 164–93. doi :10.1021/cr400106y. PMC 3898671 . PMID 24175570.
- ^ Nisar, Nazia; Li, Li; Lu, Shan; ChiKhin, no; Pogson, Barry J. (5 de enero de 2015). "Metabolismo de carotenoides en plantas". Planta Molecular . 8 (1): 68–82. doi : 10.1016/j.molp.2014.12.007 . PMID 25578273. S2CID 26818009.
- ^ Choi, Seyoung; Koo, Sangho (2005). "Síntesis eficientes de los cetocarotenoides cantaxantina, astaxantina y astaceno". J. Org. química . 70 (8): 3328–3331. doi :10.1021/jo050101l. PMID 15823009.
Enlaces externos
- Carotenoides en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.

