Arginina
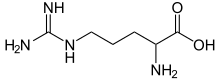 Fórmula esquelética de la arginina | |||
| |||
| Nombres | |||
|---|---|---|---|
| Nombres IUPAC Arginina | |||
| Otros nombres Ácido 2-amino-5-guanidinopentanoico | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| 3DMet |
| ||
| 1725411, 1725412 D , 1725413 L | |||
| EBICh | |||
| Química biológica | |||
| Araña química | |||
| Banco de medicamentos | |||
| Tarjeta informativa de la ECHA | 100.000.738 | ||
| Número CE |
| ||
| 364938 D | |||
| |||
| BARRIL | |||
| Malla | Arginina | ||
Identificador de centro de PubChem |
| ||
| Número RTECS |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| |||
| Propiedades | |||
| C6H14N4O2 | |||
| Masa molar | 174,204 g·mol −1 | ||
| Apariencia | Cristales blancos | ||
| Olor | Inodoro | ||
| Punto de fusión | 260 °C; 500 °F; 533 K | ||
| Punto de ebullición | 368 °C (694 °F; 641 K) | ||
| 14,87 g/100 ml (20 °C) | |||
| Solubilidad | ligeramente soluble en etanol insoluble en éter etílico | ||
| registro P | -1.652 | ||
| Acidez (p K a ) | 2,18 (carboxilo), 9,09 (amino), 13,8 (guanidino) | ||
| Termoquímica | |||
Capacidad calorífica ( C ) | 232,8 JK −1 mol −1 (a 23,7 °C) | ||
Entropía molar estándar ( S ⦵ 298 ) | 250,6 JK −1 mol −1 | ||
Entalpía estándar de formación (Δ f H ⦵ 298 ) | −624,9–−622,3 kJ mol −1 | ||
Entalpía estándar de combustión (Δ c H ⦵ 298 ) | −3,7396–−3,7370 MJ mol −1 | ||
| Farmacología | |||
| B05XB01 ( QUIÉN ) S | |||
| Peligros | |||
| Etiquetado SGA : | |||
 | |||
| Advertencia | |||
| H319 | |||
| P305+P351+P338 | |||
| Dosis o concentración letal (LD, LC): | |||
LD 50 ( dosis media ) | 5110 mg/kg (rata, oral) | ||
| Ficha de datos de seguridad (FDS) | L-Arginina | ||
| Compuestos relacionados | |||
Ácidos alcanoicos relacionados | |||
Compuestos relacionados | |||
| Página de datos complementarios | |||
| Arginina (página de datos) | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
La arginina es el aminoácido con la fórmula (H 2 N)(HN)CN(H)(CH 2 ) 3 CH(NH 2 )CO 2 H. La molécula presenta un grupo guanidino anexado a una estructura de aminoácidos estándar. A pH fisiológico, el ácido carboxílico se desprotona (−CO 2 − ) y tanto el grupo amino como el guanidino se protonan, lo que da como resultado un catión. Solo el enantiómero l -arginina (símbolo Arg o R ) se encuentra de forma natural. [1] Los residuos de Arg son componentes comunes de las proteínas . Está codificado por los codones CGU, CGC, CGA, CGG, AGA y AGG. [2] El grupo guanidina en la arginina es el precursor de la biosíntesis de óxido nítrico . [3] Como todos los aminoácidos, es un sólido blanco soluble en agua.
El símbolo de una letra R se asignó a la arginina por su similitud fonética. [4]
Historia
La arginina fue aislada por primera vez en 1886 a partir de plántulas de lupino amarillo por el químico alemán Ernst Schulze y su asistente Ernst Steiger. [5] [6] La nombró a partir del griego árgyros (ἄργυρος), que significa "plata", debido a la apariencia blanca plateada de los cristales de nitrato de arginina. [7] En 1897, Schulze y Ernst Winterstein (1865-1949) determinaron la estructura de la arginina. [8] Schulze y Winterstein sintetizaron la arginina a partir de ornitina y cianamida en 1899, [9] pero algunas dudas sobre la estructura de la arginina persistieron [10] hasta la síntesis de Sørensen en 1910. [11]
Fuentes
Producción
Tradicionalmente se obtiene por hidrólisis de diversas fuentes baratas de proteína, como la gelatina . [12] Se obtiene comercialmente por fermentación. De esta forma se pueden producir 25-35 g/litro, utilizando glucosa como fuente de carbono. [13]
Fuentes dietéticas
La arginina se clasifica como un aminoácido semiesencial o condicionalmente esencial , dependiendo de la etapa de desarrollo y el estado de salud del individuo. [14] Los bebés prematuros no pueden sintetizar arginina internamente, lo que hace que el aminoácido sea nutricionalmente esencial para ellos. [15] La mayoría de las personas sanas no necesitan complementar con arginina porque es un componente de todos los alimentos que contienen proteínas [16] y puede sintetizarse en el cuerpo a partir de glutamina a través de citrulina . [17] [18] Además, la arginina dietética es necesaria para individuos sanos que se encuentran temporalmente bajo estrés fisiológico, por ejemplo durante la recuperación de quemaduras, lesiones o sepsis, [18] o si alguno de los principales sitios de biosíntesis de arginina, el intestino delgado y los riñones , tienen una función reducida, porque el intestino delgado realiza el primer paso del proceso de síntesis y los riñones el segundo. [3]
La arginina es un aminoácido esencial para las aves, ya que no tienen un ciclo de urea . [19] Para algunos carnívoros, por ejemplo gatos, perros [20] y hurones, la arginina es esencial, [3] porque después de una comida, su catabolismo proteico altamente eficiente produce grandes cantidades de amoníaco que necesitan ser procesadas a través del ciclo de la urea, y si no hay suficiente arginina presente, la toxicidad del amoníaco resultante puede ser letal. [21] Esto no es un problema en la práctica, porque la carne contiene suficiente arginina para evitar esta situación. [21]
Las fuentes animales de arginina incluyen carne, productos lácteos y huevos, [22] [23] y las fuentes vegetales incluyen semillas de todo tipo, por ejemplo, granos, frijoles y nueces. [23]
Biosíntesis
La arginina se sintetiza a partir de la citrulina en el ciclo de la urea mediante la acción secuencial de las enzimas citosólicas argininosuccinato sintetasa y argininosuccinato liasa . Se trata de un proceso energéticamente costoso, ya que por cada molécula de argininosuccinato que se sintetiza, se hidroliza una molécula de trifosfato de adenosina (ATP) a monofosfato de adenosina (AMP), consumiendo dos equivalentes de ATP. [ cita requerida ]
Las vías que unen la arginina, la glutamina y la prolina son bidireccionales. Por lo tanto, el uso neto o la producción de estos aminoácidos depende en gran medida del tipo de célula y de la etapa de desarrollo. [ cita requerida ]

El organismo produce arginina de la siguiente manera: las células epiteliales del intestino delgado producen citrulina, principalmente a partir de glutamina y glutamato , que se secreta al torrente sanguíneo, que la transporta a las células del túbulo proximal del riñón , que extraen la citrulina y la convierten en arginina, que se devuelve a la sangre. Esto significa que una alteración de la función renal o del intestino delgado puede reducir la síntesis de arginina y, por lo tanto, crear una necesidad dietética de arginina. Para una persona así, la arginina se volvería "esencial".
La síntesis de arginina a partir de citrulina también se produce en un nivel bajo en muchas otras células, y la capacidad celular para la síntesis de arginina puede aumentar notablemente en circunstancias que aumentan la producción de óxido nítrico sintasa inducible (NOS) . Esto permite que la citrulina, un subproducto de la producción de óxido nítrico catalizada por NOS, se recicle a arginina en una vía conocida como la vía de citrulina a óxido nítrico (citrulina-NO) o vía arginina-citrulina. Esto se demuestra por el hecho de que, en muchos tipos de células, la síntesis de óxido nítrico puede ser apoyada en cierta medida por la citrulina, y no solo por la arginina. Sin embargo, este reciclaje no es cuantitativo, porque la citrulina se acumula en las células productoras de óxido nítrico junto con el nitrato y el nitrito , los productos finales estables de la descomposición del óxido nítrico. [24]
Función
La arginina juega un papel importante en la división celular , la cicatrización de heridas , la eliminación de amoníaco del cuerpo, la función inmune , [25] y la liberación de hormonas. [14] [26] [27] Es un precursor para la síntesis de óxido nítrico (NO), [28] por lo que es importante en la regulación de la presión arterial . [29] [30] La arginina es necesaria para que las células T funcionen en el cuerpo y puede conducir a su desregulación si se agotan. [31] [32]
Proteínas
La cadena lateral de la arginina es anfipática , porque a pH fisiológico contiene un grupo guanidinio cargado positivamente, que es altamente polar, al final de una cadena hidrocarbonada alifática hidrófoba . Debido a que las proteínas globulares tienen interiores hidrófobos y superficies hidrófilas, [33] la arginina se encuentra típicamente en el exterior de la proteína, donde el grupo de cabeza hidrófilo puede interactuar con el entorno polar, por ejemplo, participando en la unión de hidrógeno y puentes salinos. [34] Por esta razón, se encuentra con frecuencia en la interfaz entre dos proteínas. [35] La parte alifática de la cadena lateral a veces permanece debajo de la superficie de la proteína. [34]
Los residuos de arginina en las proteínas pueden ser deiminados por enzimas PAD para formar citrulina, en un proceso de modificación postraduccional llamado citrulinación . Esto es importante en el desarrollo fetal, es parte del proceso inmunológico normal, así como el control de la expresión genética, pero también es significativo en enfermedades autoinmunes . [36] Otra modificación postraduccional de la arginina involucra la metilación por metiltransferasas de proteínas . [37]
Precursor
La arginina es el precursor inmediato del óxido nítrico, una importante molécula de señalización que puede actuar como segundo mensajero , así como mensajero intercelular que regula la vasodilatación y también tiene funciones en la reacción del sistema inmunológico a las infecciones. [ cita requerida ]
La arginina también es un precursor de la urea , la ornitina y la agmatina ; es necesaria para la síntesis de creatina ; y también se puede utilizar para la síntesis de poliaminas (principalmente a través de la ornitina y en menor grado a través de la agmatina, la citrulina y el glutamato). La presencia de dimetilarginina asimétrica (ADMA), un pariente cercano, inhibe la reacción del óxido nítrico; por lo tanto, la ADMA se considera un marcador de enfermedad vascular , al igual que la L -arginina se considera un signo de un endotelio sano . [38]
Estructura

La cadena lateral de aminoácidos de la arginina consiste en una cadena lineal alifática de 3 carbonos , cuyo extremo distal está cubierto por un grupo guanidinio , que tiene un p K a de 13,8, [39] y, por lo tanto, siempre está protonado y cargado positivamente a pH fisiológico. Debido a la conjugación entre el doble enlace y los pares solitarios de nitrógeno , la carga positiva está deslocalizada, lo que permite la formación de múltiples enlaces de hidrógeno .
Investigación
Hormona del crecimiento
La arginina administrada por vía intravenosa se utiliza en pruebas de estimulación de la hormona del crecimiento [40] porque estimula la secreción de la hormona del crecimiento . [41] Una revisión de ensayos clínicos concluyó que la arginina oral aumenta la hormona del crecimiento, pero disminuye la secreción de la hormona del crecimiento, que normalmente se asocia con el ejercicio. [42] Sin embargo, un ensayo más reciente informó que aunque la arginina oral aumentó los niveles plasmáticos de L -arginina, no provocó un aumento de la hormona del crecimiento. [43]
Virus del herpes simple (herpes labial)
Una investigación de 1964 sobre los requerimientos de aminoácidos del virus del herpes simple en las células humanas indicó que "...la falta de arginina o histidina , y posiblemente la presencia de lisina , interferirían notablemente con la síntesis del virus", pero concluye que "no hay una explicación inmediata para ninguna de estas observaciones". [44]
Otras revisiones concluyen que "la eficacia de la lisina para el herpes labial puede residir más en la prevención que en el tratamiento" y que "el uso de lisina para disminuir la gravedad o la duración de los brotes" no está respaldado, mientras que se necesita más investigación. [45] Un estudio de 2017 concluye que "los médicos podrían considerar la posibilidad de informar a los pacientes que existe un papel teórico de la suplementación con lisina en la prevención de las llagas del herpes simple, pero la evidencia de la investigación es insuficiente para respaldar esto. Se debe advertir y advertir a los pacientes con enfermedades cardiovasculares o de la vesícula biliar sobre los riesgos teóricos". [46]
Hipertensión
Un metanálisis mostró que la L -arginina reduce la presión arterial con estimaciones agrupadas de 5,4 mmHg para la presión arterial sistólica y 2,7 mmHg para la presión arterial diastólica. [47]
La suplementación con l -arginina reduce la presión arterial diastólica y prolonga el embarazo en mujeres con hipertensión gestacional , incluidas las mujeres con presión arterial alta como parte de la preeclampsia . No redujo la presión arterial sistólica ni mejoró el peso al nacer . [48]
Esquizofrenia
Tanto la cromatografía líquida como los ensayos de cromatografía líquida/espectrometría de masas han descubierto que el tejido cerebral de las personas fallecidas con esquizofrenia muestra un metabolismo alterado de la arginina. Los ensayos también confirmaron niveles significativamente reducidos de ácido γ-aminobutírico (GABA), pero una mayor concentración de agmatina y la relación glutamato/GABA en los casos de esquizofrenia. El análisis de regresión indicó correlaciones positivas entre la actividad de la arginasa y la edad de aparición de la enfermedad y entre el nivel de L-ornitina y la duración de la enfermedad. Además, los análisis de conglomerados revelaron que la L-arginina y sus principales metabolitos L-citrulina, L-ornitina y agmatina formaban grupos distintos, que estaban alterados en el grupo de esquizofrenia. A pesar de esto, la base biológica de la esquizofrenia aún es poco conocida, y varios factores, como la hiperfunción dopaminérgica, la hipofunción glutamatérgica, los déficits GABAérgicos, la disfunción del sistema colinérgico, la vulnerabilidad al estrés y la alteración del desarrollo neurológico, se han vinculado a la etiología y/o fisiopatología de la enfermedad. [49]
Fenómeno de Raynaud
Se ha demostrado que la L-arginina oral revierte la necrosis digital en el síndrome de Raynaud [50]
Seguridad y posibles interacciones farmacológicas
La L-arginina está reconocida como segura (estatus GRAS) en ingestas de hasta 20 gramos por día. [51] La L-arginina se encuentra en muchos alimentos, como pescado, aves y productos lácteos, y se utiliza como suplemento dietético. [52] Puede interactuar con varios medicamentos recetados y suplementos herbales. [52]
Véase también
- Glutamato de arginina
- AKG-Asociación Americana de Jubilados y Alumnos (AAKG)
- La canavanina y la canalina son análogos tóxicos de la arginina y la ornitina .
Referencias
- ^ "Nomenclatura y simbolismo de aminoácidos y péptidos". Comisión Conjunta IUPAC-IUB sobre Nomenclatura Bioquímica. 1983. Archivado desde el original el 9 de octubre de 2008. Consultado el 5 de marzo de 2018 .
- ^ Comisión Conjunta IUPAC-IUBMB sobre Nomenclatura Bioquímica. "Nomenclatura y simbolismo de aminoácidos y péptidos". Recomendaciones sobre nomenclatura orgánica y bioquímica, símbolos y terminología , etc. Archivado desde el original el 29 de mayo de 2007. Consultado el 17 de mayo de 2007 .
- ^ abc Ignarro LJ (13 de septiembre de 2000). Óxido nítrico: biología y patobiología. Academic Press. pág. 189. ISBN 978-0-08-052503-7.
- ^ "Comisión IUPAC-IUB sobre nomenclatura bioquímica: una notación de una letra para secuencias de aminoácidos". Journal of Biological Chemistry . 243 (13): 3557–3559. 10 de julio de 1968. doi : 10.1016/S0021-9258(19)34176-6 .
- ^ Apel F (julio de 2015). "Biografía de Ernst Schulze" (PDF) . Archivado desde el original (PDF) el 17 de noviembre de 2015 . Consultado el 6 de noviembre de 2017 .
- ^ Schulze E, Steiger E (1887). "Ueber das Arginin" [Sobre la arginina]. Zeitschrift für Physiologische Chemie . 11 (1–2): 43–65.
- ^ "BIOETIMOLOGÍA: ORIGEN EN TÉRMINOS BIOMÉDICOS: arginina (Arg R)" . Consultado el 25 de julio de 2019 .
- ^ Schulze E, Winterstein E (septiembre de 1897). "Ueber ein Spaltungs-product des Arginins" [Sobre un producto de escisión de arginina]. Berichte der Deutschen Chemischen Gesellschaft (en alemán). 30 (3): 2879–2882. doi :10.1002/cber.18970300389.La estructura de la arginina se presenta en la página 2882.
- ^ Schulze E, Winterstein E (octubre de 1899). "Ueber die Constitution des Arginins" [Sobre la constitución de la arginina]. Berichte der Deutschen Chemischen Gesellschaft (en alemán). 32 (3): 3191–3194. doi :10.1002/cber.18990320385.
- ^ Cohen JB (1919). Química orgánica para estudiantes avanzados, Parte 3 (2.ª ed.). Nueva York, Nueva York, EE. UU.: Longmans, Green & Co. pág. 140.
- ^ Sölrensen SP (enero de 1910). "Über die Synthese des dl-Arginins (α-Amino-δ-guanido-n-valeriansäure) und der isomeren α-Guanido-δ-amino-n-valeriansäure" [Sobre la síntesis de arginina racémica (α-amino-δ- ácido guanido- n -valérico) y del ácido isomérico α-guanido-δ-amino- n -valérico]. Berichte der Deutschen Chemischen Gesellschaft (en alemán). 43 (1): 643–651. doi :10.1002/cber.191004301109.
- ^ Marca E, Sandberg M (1932). "Clorhidrato de d-arginina". Org. Sintetizador . 12 : 4. doi : 10.15227/orgsyn.012.0004.
- ^ Drauz K, Grayson I, Kleemann A, et al. (2006). "Aminoácidos". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a02_057.pub2. ISBN 978-3527306732.
- ^ ab Tapiero H, Mathé G, Couvreur P, Tew KD (noviembre de 2002). "L-Arginina". (revisar). Biomedicina y Farmacoterapia . 56 (9): 439–445. doi :10.1016/s0753-3322(02)00284-6. PMID 12481980.
- ^ Wu G, Jaeger LA, Bazer FW, Rhoads JM (agosto de 2004). "Deficiencia de arginina en bebés prematuros: mecanismos bioquímicos e implicaciones nutricionales". (revisión). The Journal of Nutritional Biochemistry . 15 (8): 442–51. doi : 10.1016/j.jnutbio.2003.11.010 . PMID 15302078.
- ^ "Medicamentos y suplementos Arginina". Mayo Clinic . Consultado el 15 de enero de 2015 .
- ^ Skipper A (1998). Manual del dietista sobre nutrición enteral y parenteral. Jones & Bartlett Learning. pág. 76. ISBN 978-0-8342-0920-6.
- ^ ab Borlase antes de Cristo (1994). Nutrición Enteral. Aprendizaje de Jones y Bartlett. pag. 48.ISBN 978-0-412-98471-6.
- ^ Freedland RA, Briggs S (6 de diciembre de 2012). Un enfoque bioquímico de la nutrición. Springer Science & Business Media. pág. 45. ISBN 9789400957329.
- ^ Requerimientos nutricionales de los perros. National Academies Press. 1985. p. 65. ISBN 978-0-309-03496-8.
- ^ ab Wortinger A, Burns K (11 de junio de 2015). Nutrición y manejo de enfermedades para técnicos y enfermeros veterinarios. John Wiley & Sons. pág. 232. ISBN 978-1-118-81108-5.
- ^ Spano MA, Kruskall LJ, Thomas DT (30 de agosto de 2017). Nutrición para el deporte, el ejercicio y la salud. Human Kinetics. pág. 240. ISBN 978-1-4504-1487-6.
- ^ ab Watson RR, Zibadi S (28 de noviembre de 2012). Factores dietéticos bioactivos y extractos de plantas en dermatología. Springer Science & Business Media. pág. 75. ISBN 978-1-62703-167-7.
- ^ Morris SM (octubre de 2004). "Enzimas del metabolismo de la arginina". (revisión). The Journal of Nutrition . 134 (10 Suppl): 2743S–2747S, discusión 2765S–2767S. doi : 10.1093/jn/134.10.2743S . PMID 15465778.
- ^ Mauro C, Frezza C (13 de julio de 2015). Los desafíos metabólicos de las células inmunitarias en la salud y la enfermedad. Frontiers Media SA. pág. 17. ISBN 9782889196227.
- ^ Stechmiller JK, Childress B, Cowan L (febrero de 2005). "Suplementación con arginina y cicatrización de heridas". (revisión). Nutrición en la práctica clínica . 20 (1): 52–61. doi :10.1177/011542650502000152. PMID 16207646.
- ^ Witte MB, Barbul A (2003). "Fisiología de la arginina y su implicación en la cicatrización de heridas". (revisión). Reparación y regeneración de heridas . 11 (6): 419–23. doi :10.1046/j.1524-475X.2003.11605.x. PMID 14617280. S2CID 21239136.
- ^ Andrew PJ, Mayer B (agosto de 1999). "Función enzimática de las sintetasas de óxido nítrico". (revisión). Investigación cardiovascular . 43 (3): 521–31. doi : 10.1016/S0008-6363(99)00115-7 . PMID 10690324.
- ^ Gokce N (octubre de 2004). "L-arginina e hipertensión". The Journal of Nutrition . 134 (10 Suppl): 2807S–2811S, discusión 2818S–2819S. doi : 10.1093/jn/134.10.2807S . PMID 15465790.
- ^ Kibe R, Kurihara S, Sakai Y, et al. (2014). "La regulación positiva de las poliaminas luminales del colon producidas por la microbiota intestinal retrasa la senescencia en ratones". Scientific Reports . 4 (4548): 4548. Bibcode :2014NatSR...4E4548K. doi : 10.1038/srep04548 . PMC 4070089 . PMID 24686447.
- ^ Banerjee, Kasturi; Chattopadhyay, Agnibha; Banerjee, Satarupa (1 de julio de 2022). "Comprensión de la asociación de las células madre en el desarrollo fetal y la carcinogénesis durante el embarazo". Avances en biología del cáncer - Metástasis . 4 : 100042. doi : 10.1016/j.adcanc.2022.100042 . ISSN 2667-3940. S2CID 248485831.
- ^ Rodriguez, Paulo C.; Quiceno, David G.; Ochoa, Augusto C. (5 de octubre de 2006). "La disponibilidad de l-arginina regula la progresión del ciclo celular de los linfocitos T". Blood . 109 (4): 1568–1573. doi :10.1182/blood-2006-06-031856. ISSN 0006-4971. PMC 1794048 . PMID 17023580.
- ^ Mathews CK, Van Holde KE, Ahern KG (2000). Bioquímica (3.ª ed.). San Francisco, California: Benjamin Cummings. pp. 180. ISBN 978-0805330663.OCLC 42290721 .
- ^ ab Barnes MR (16 de abril de 2007). Bioinformática para genetistas: una introducción a la bioinformática para el análisis de datos genéticos. John Wiley & Sons. pág. 326. ISBN 9780470026199.
- ^ Kleanthous C (2000). Reconocimiento proteína-proteína. Oxford University Press. pág. 13. ISBN 9780199637607.
- ^ Griffiths y Unwin 2016, pág. 275.
- ^ Griffiths y Unwin 2016, pág. 176.
- ^ Gambardella J, Khondkar W, Morelli MB, Wang X, Santulli G, Trimarco V (agosto de 2020). "Arginina y función endotelial". Biomedicinas . 8 (8): 277. doi : 10.3390/biomedicinas8080277 . PMC 7460461 . PMID 32781796.
- ^ Fitch CA, Platzer G, Okon M, et al. (mayo de 2015). "Arginina: su valor pKa revisado". Protein Science . 24 (5): 752–61. doi :10.1002/pro.2647. PMC 4420524 . PMID 25808204.
- ^ Enciclopedia MedlinePlus : Prueba de estimulación de la hormona del crecimiento
- ^ Alba-Roth J, Müller OA, Schopohl J, von Werder K (diciembre de 1988). "La arginina estimula la secreción de la hormona del crecimiento al suprimir la secreción endógena de somatostatina". The Journal of Clinical Endocrinology and Metabolism . 67 (6): 1186–9. doi :10.1210/jcem-67-6-1186. PMID 2903866. S2CID 7488757.
- ^ Kanaley JA (enero de 2008). "Hormona del crecimiento, arginina y ejercicio". Current Opinion in Clinical Nutrition and Metabolic Care . 11 (1): 50–4. doi :10.1097/MCO.0b013e3282f2b0ad. PMID 18090659. S2CID 22842434.
- ^ Forbes SC, Bell GJ (junio de 2011). "Los efectos agudos de una dosis baja y alta de suplementación oral con L-arginina en varones jóvenes activos en reposo". Fisiología aplicada, nutrición y metabolismo . 36 (3): 405–11. doi :10.1139/h11-035. PMID 21574873.
- ^ Tankersley RW (marzo de 1964). "Requerimientos de aminoácidos del virus del herpes simple en células humanas". Journal of Bacteriology . 87 (3): 609–613. doi : 10.1128/jb.87.3.609-613.1964 . PMC 277062 . PMID 14127578.
- ^ Tomblin FA, Lucas KH (febrero de 2001). "Lisina para el tratamiento del herpes labial". American Journal of Health-System Pharmacy . 58 (4): 298–300, 304. doi : 10.1093/ajhp/58.4.298 . PMID 11225166.
- ^ Mailoo VJ, Rampes S (junio de 2017). "Lisina para la profilaxis del herpes simple: una revisión de la evidencia". Medicina integrativa . 16 (3): 42–46. PMC 6419779 . PMID 30881246.
- ^ Dong JY, Qin LQ, Zhang Z, et al. (diciembre de 2011). "Efecto de la suplementación oral con L-arginina en la presión arterial: un metaanálisis de ensayos aleatorizados, doble ciego y controlados con placebo". revisión. American Heart Journal . 162 (6): 959–65. doi :10.1016/j.ahj.2011.09.012. PMID 22137067.
- ^ Gui S, Jia J, Niu X, et al. (marzo de 2014). "Suplementación con arginina para mejorar los resultados maternos y neonatales en el trastorno hipertensivo del embarazo: una revisión sistemática". (revisión). Journal of the Renin-Angiotensin-Aldosterone System . 15 (1): 88–96. doi : 10.1177/1470320313475910 . PMID 23435582.
- ^ Liu P, Jing Y, Collie ND, et al. (agosto de 2016). "Metabolismo alterado de la arginina en el cerebro en la esquizofrenia". Psiquiatría Traslacional . 6 (8): e871. doi : 10.1038/tp.2016.144 . PMC 5022089 . PMID 27529679.
- ^ Rembold, Christopher M.; Ayers, Carlos R. (febrero de 2003). "La L-arginina oral puede revertir la necrosis digital en el fenómeno de Raynaud". Bioquímica molecular y celular . 244 (1–2): 139–141. doi :10.1023/A:1022422932108. ISSN 0300-8177. PMID 12701823. S2CID 30249281.
- ^ Shao A, Hathcock JN (abril de 2008). "Evaluación de riesgos para los aminoácidos taurina, L-glutamina y L-arginina". Toxicología y farmacología regulatorias . 50 (3): 376–99. doi :10.1016/j.yrtph.2008.01.004. PMID 18325648.
- ^ ab "L-Arginina". MedlinePlus, Institutos Nacionales de Salud de EE. UU. 13 de octubre de 2021. Consultado el 27 de mayo de 2021 .
Fuentes
- Griffiths JR, Unwin RD (2016). Análisis de modificaciones postraduccionales de proteínas mediante espectrometría de masas . John Wiley & Sons. ISBN 978-1-119-25088-3.
Enlaces externos
- Libro web de química del NIST
- L-arginina, Clínica Mayo