Imiquimod
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Aldara, otros [1] |
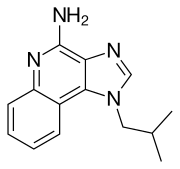
| Otros nombres | 1-isobutil-1 H -imidazo[4,5- c ]quinolin-4-amina |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a698010 |
| Datos de licencia | |
Categoría de embarazo |
|
| Vías de administración | Actual |
| Código ATC |
|
| Estatus legal | |
| Estatus legal |
|
| Datos farmacocinéticos | |
| Vida media de eliminación | 30 horas (dosis tópica), 2 horas (dosis subcutánea) |
| Identificadores | |
| |
| Número CAS | |
| Identificador de centro de PubChem |
|
| Unión Internacional para la Investigación y el Desarrollo (IUPHAR)/BPS |
|
| Banco de medicamentos | |
| Araña química | |
| UNIVERSIDAD |
|
| BARRIL | |
| EBICh | |
| Química biológica | |
| Panel de control CompTox ( EPA ) |
|
| Tarjeta informativa de la ECHA | 100.131.047 |
| Datos químicos y físicos | |
| Fórmula | C14H16N4 |
| Masa molar | 240,310 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| (verificar) | |
Imiquimod , vendido bajo la marca Aldara entre otras, es un medicamento que actúa como un modificador de la respuesta inmune que se utiliza para tratar las verrugas genitales , el carcinoma basocelular superficial y la queratosis actínica . [4]
Los científicos de la división farmacéutica de 3M descubrieron el fármaco y 3M obtuvo la primera aprobación de la FDA en 1997. A partir de 2015, el imiquimod es genérico y está disponible en todo el mundo bajo muchas marcas. En 2021, fue el medicamento número 290 más recetado en los Estados Unidos, con más de 600.000 recetas. [5] [6]
Usos médicos
Imiquimod es una crema que se aplica al paciente y se prescribe para tratar las verrugas genitales , la enfermedad de Bowens ( carcinoma de células escamosas in situ) y, como consecuencia de la cirugía, el carcinoma de células basales , [7] [8] así como la queratosis actínica . [9]
La crema de imiquimod al 5% está indicada para el tratamiento tópico de:
- verrugas genitales externas y perianales (condilomas acuminados) en adultos; [10]
- carcinomas basocelulares superficiales pequeños (CCBS) en adultos; [10]
- queratosis actínicas (QA) clínicamente típicas, no hiperqueratósicas, no hipertróficas en la cara o el cuero cabelludo en adultos inmunocompetentes cuando el tamaño o el número de lesiones limitan la eficacia y/o aceptabilidad de la crioterapia y otras opciones de tratamiento tópico están contraindicadas o son menos apropiadas. [10]
La crema de imiquimod al 3,75 % está indicada para el tratamiento tópico de la queratosis actínica clínicamente típica, no hiperqueratósica, no hipertrófica, visible o palpable del rostro completo o del cuero cabelludo calvo en adultos inmunocompetentes cuando otras opciones de tratamiento tópico están contraindicadas o son menos apropiadas. [11]
Efectos secundarios
Los efectos secundarios incluyen reacciones inflamatorias locales, como ampollas, sensación de ardor, enrojecimiento de la piel, piel seca, picazón, daño en la piel, formación de costras o costras, drenaje de la piel, descamación o descamación de la piel, ulceración de la piel, llagas, hinchazón, así como reacciones sistémicas, como fiebre, síntomas "similares a la gripe", dolor de cabeza y cansancio. [9] [12]
Las personas que han recibido un trasplante de órgano y están tomando medicamentos inmunosupresores no deben usar imiquimod. [9]
Mecanismo de acción
El imiquimod produce una profunda actividad antitumoral al actuar en varios niveles inmunológicos de forma sinérgica. [13] El imiquimod estimula el sistema inmunológico innato activando el receptor tipo Toll 7 (TLR7), comúnmente involucrado en el reconocimiento de patógenos. [14] [15] Las células activadas por imiquimod a través de TLR-7 secretan citocinas (principalmente interferón-α (IFN-α), interleucina-6 (IL-6) y factor de necrosis tumoral-α (TNF-α)). [16] Hay evidencia de que el imiquimod, cuando se aplica a la piel, puede conducir a la activación de las células de Langerhans , que posteriormente migran a los ganglios linfáticos locales para activar el sistema inmunológico adaptativo . [17] Otros tipos de células activadas por imiquimod incluyen células asesinas naturales , macrófagos y linfocitos B. [17]
El imiquimod ejerce su efecto aumentando los niveles del receptor del factor de crecimiento opioide (OGFr). En experimentos, el bloqueo de la función del OGFr con tecnología de ARNi resultó en la pérdida de cualquier efecto antiproliferativo del imiquimod. [18]
Historia
Los científicos de la división farmacéutica de 3M descubrieron el imiquimod como parte de un programa para descubrir inhibidores de la replicación del virus del herpes simple basados en un derivado conocido de la adenina . [19] : 369–372 3M obtuvo la primera aprobación de la FDA para él en 1997 como tratamiento para verrugas genitales externas y perianales bajo la marca "Aldara". [20] En 2004, 3M obtuvo la aprobación de la FDA para comercializar imiquimod como tratamiento para el carcinoma basocelular superficial . [21]
En 2006, 3M vendió su negocio farmacéutico en América a Graceway Pharmaceuticals , su negocio farmacéutico europeo a Meda AB y su negocio farmacéutico en otros territorios a dos empresas de capital privado . [22]
Graceway se declaró en quiebra en 2011, después de que expiraran las patentes de imiquimod, y sus activos, incluidos los derechos de marca y aprobaciones de imiquimod en las Américas, fueron adquiridos por Medicis Pharmaceutical . [23]
El imiquimod al 5% fue aprobado para uso médico en la Unión Europea en septiembre de 1998. [10] El imiquimod al 3,75% fue aprobado para uso médico en la Unión Europea en agosto de 2012. [11]
A partir de 2015, el imiquimod es genérico y está disponible en todo el mundo bajo muchas marcas. [1]
Investigación
Un estudio clínico aleatorizado, doble ciego, de fase III determinó que la eliminación de las verrugas genitales (una indicación aprobada por la FDA) mejoró del 9 % con placebo al 24,9 % con crema de imiquimod al 3,75 % aplicada durante hasta ocho semanas. [24]
Se ha probado el imiquimod para el tratamiento del molusco contagioso . Sin embargo, dos grandes ensayos controlados aleatorizados no encontraron evidencia de la eficacia del imiquimod en el tratamiento de niños con molusco contagioso, y también se observaron efectos adversos preocupantes. [25] Estos refutan afirmaciones anecdóticas anteriores y estudios más pequeños y menos confiables. [26] [27] [28] [29]
El imiquimod también se ha probado para el tratamiento de la neoplasia intraepitelial vulvar , [30] la neoplasia intraepitelial vaginal , [31] las verrugas comunes (una revisión Cochrane de 2012 no encontró ensayos controlados aleatorios), [32] las verrugas plantares , [33] las verrugas en personas con sistemas inmunitarios deprimidos, [34] las verrugas planas en la cara y el cuello, [33] y las verrugas debajo y alrededor de las uñas de las manos y de los pies. [33] A partir de 2014, no existe evidencia suficiente para recomendar el tratamiento de las verrugas (que no sean verrugas genitales) con imiquimod, debido al pequeño tamaño y la falta de controles en los estudios existentes. [35] [33]
Referencias
- ^ ab Drugs.com Listados internacionales de imiquimod en Drugs.com Página consultada el 14 de junio de 2015
- ^ "Uso tópico de imiquimod durante el embarazo". Drugs.com . 29 de mayo de 2019 . Consultado el 14 de julio de 2020 .
- ^ "Lista de todos los medicamentos con advertencias de recuadro negro obtenida por la FDA (use los enlaces Descargar resultados completos y Ver consulta)". nctr-crs.fda.gov . FDA . Consultado el 22 de octubre de 2023 .
- ^ "Imiquimod tópico". MedlinePlus . Biblioteca Nacional de Medicina . Consultado el 2 de junio de 2021 .
- ^ "Los 300 mejores de 2021". ClinCalc . Archivado desde el original el 15 de enero de 2024 . Consultado el 14 de enero de 2024 .
- ^ "Imiquimod - Estadísticas de uso de medicamentos". ClinCalc . Consultado el 14 de enero de 2024 .
- ^ "Aprobación de la FDA para Imiquimod". Administración de Alimentos y Medicamentos de EE. UU . . 1 de enero de 2011. Archivado desde el original el 6 de abril de 2015 . Consultado el 19 de octubre de 2012 .
Imiquimod debe utilizarse para el tratamiento del [carcinoma basocelular superficial] solo cuando la cirugía sea menos apropiada desde el punto de vista médico
- ^ "Crema de imiquimod". Guía de medicamentos contra el cáncer . Sociedad Estadounidense del Cáncer. Archivado desde el original el 7 de febrero de 2015. Consultado el 28 de abril de 2014 .
- ^ abc Agencia Europea de Medicamentos. Publicado por primera vez el 14 de septiembre de 2009, actualizado el 25 de marzo de 2015. Resumen de las características del producto de la EMA Archivado el 25 de septiembre de 2017 en Wayback Machine.
- ^ abcd «Aldara EPAR». Agencia Europea de Medicamentos (EMA) . 17 de septiembre de 2018. Consultado el 14 de julio de 2020 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ ab «Zyclara EPAR». Agencia Europea de Medicamentos (EMA) . 17 de septiembre de 2018. Consultado el 14 de julio de 2020 .El texto se ha copiado de esta fuente, cuyos derechos de autor pertenecen a la Agencia Europea de Medicamentos. Se autoriza la reproducción siempre que se cite la fuente.
- ^ PDR Salud PDR: Aldara
- ^ Schön MP, Schön M (diciembre de 2007). "Imiquimod: modo de acción". The British Journal of Dermatology . 157 (Supl. 2): 8–13. doi :10.1111/j.1365-2133.2007.08265.x. PMID 18067624. S2CID 36643157.
- ^ Walter A, Schäfer M, Cecconi V, Matter C, Urosevic-Maiwald M, Belloni B, et al. (2013). "Aldara activa la defensa inmune independiente de TLR7". Comunicaciones de la naturaleza . 4 : 1560. Código Bib : 2013NatCo...4.1560W. doi : 10.1038/ncomms2566 . PMID 23463003.
- ^ Hemmi H, Kaisho T, Takeuchi O, Sato S, Sanjo H, Hoshino K, et al. (febrero de 2002). "Pequeños compuestos antivirales activan las células inmunes a través de la vía de señalización dependiente de TLR7 MyD88". Nature Immunology . 3 (2): 196–200. doi :10.1038/ni758. PMID 11812998. S2CID 1694900.
- ^ Bilu D, Sauder DN (noviembre de 2003). "Imiquimod: modos de acción". The British Journal of Dermatology . 149 (Supl. 66): 5–8. doi :10.1046/j.0366-077x.2003.05628.x. PMID 14616337. S2CID 41274637.
- ^ ab Miller RL, Gerster JF, Owens ML, Slade HB, Tomai MA (enero de 1999). "Imiquimod aplicado tópicamente: un nuevo modificador de la respuesta inmunitaria y una nueva clase de fármaco". Revista Internacional de Inmunofarmacología . 21 (1): 1–14. doi :10.1016/s0192-0561(98)00068-x. PMID 10411278.
- ^ Zagon IS, Donahue RN, Rogosnitzky M, McLaughlin PJ (agosto de 2008). "El imiquimod aumenta la expresión del receptor del factor de crecimiento opioide para inhibir la proliferación celular independientemente de la función inmunitaria". Experimental Biology and Medicine . 233 (8): 968–979. doi :10.3181/0802-RM-58. PMID 18480416. S2CID 35164284.
- ^ Randall L. Halcomb. Agonistas de TLR-7 para el tratamiento de la hepatitis viral. Capítulo 10 de Estrategias exitosas para el descubrimiento de fármacos antivirales. Número 32 de la serie de descubrimiento de fármacos de la RSC. Eds. Manoj C. Desai y Nicholas A. Meanwell. Royal Society of Chemistry, 2013. ISBN 9781849736572
- ^ Centerwatch. Centerwatch:Aldara (imiquimod) Página consultada el 14 de junio de 2015
- ^ "NCI: Aprobación de la FDA para Imiquimod". Instituto Nacional del Cáncer . 3 de julio de 2013. Archivado desde el original el 23 de enero de 2018.
- ^ "Nota de prensa: 3M alcanza acuerdos para vender su negocio farmacéutico". 3M . 9 de noviembre de 2006. Archivado desde el original el 21 de agosto de 2019.
- ^ Johnson JA (29 de noviembre de 2011). «Medicis compra Graceway Pharmaceuticals por 455 millones de dólares». The Phoenix Business Journal .
- ^ Número de ensayo clínico NCT00735462 para el "Estudio de fase 3 de cremas de imiquimod en el tratamiento de verrugas genitales externas" en ClinicalTrials.gov
- ^ "Aldara (imiquimod) crema para uso tópico. Información de prescripción". Archivado desde el original el 2 de noviembre de 2013.
- ^ Molusco contagioso ~ tratamiento en eMedicine
- ^ Theos AU, Cummins R, Silverberg NB, Paller AS (agosto de 2004). "Eficacia de la crema de imiquimod al 5% para el tratamiento del molusco contagioso infantil en un ensayo piloto aleatorizado y doble ciego". Cutis . 74 (2): 134–8, 141–2. PMID 15379366.
- ^ Bayerl C, Feller G, Goerdt S (noviembre de 2003). "Experiencia en el tratamiento del molusco contagioso en niños con crema de imiquimod al 5%". The British Journal of Dermatology . 149 (Supl. 66): 25–29. doi :10.1046/j.0366-077x.2003.05631.x. PMID 14616342. S2CID 23728783.
- ^ Arican O (agosto de 2006). "Tratamiento tópico del molusco contagioso con crema de imiquimod al 5% en niños turcos". Pediatría Internacional . 48 (4): 403–405. doi :10.1111/j.1442-200X.2006.02229.x. PMID 16911087. S2CID 2867793.
- ^ van Seters M, van Beurden M, ten Kate FJ, Beckmann I, Ewing PC, Eijkemans MJ, et al. (abril de 2008). "Tratamiento de la neoplasia intraepitelial vulvar con imiquimod tópico". The New England Journal of Medicine . 358 (14): 1465–1473. doi : 10.1056/NEJMoa072685 . PMID 18385498.
- ^ Buck HW, Guth KJ (octubre de 2003). "Tratamiento de la neoplasia intraepitelial vaginal (principalmente de bajo grado) con crema de imiquimod al 5%". Journal of Lower Genital Tract Disease . 7 (4): 290–293. doi :10.1097/00128360-200310000-00011. PMID 17051086. S2CID 44649376.
- ^ Kwok CS, Gibbs S, Bennett C, Holland R, Abbott R (septiembre de 2012). "Tratamientos tópicos para las verrugas cutáneas". Base de datos Cochrane de revisiones sistemáticas . 2012 (9): CD001781. doi :10.1002 / 14651858.CD001781.pub3. PMC 8101088. PMID 22972052.
- ^ abcd "Imiquimod para verrugas cutáneas no genitales". www.dpic.org .
- ^ Harwood CA, Perrett CM, Brown VL, Leigh IM, McGregor JM, Proby CM (enero de 2005). "Crema de imiquimod al 5% para verrugas cutáneas recalcitrantes en individuos inmunodeprimidos". The British Journal of Dermatology . 152 (1): 122–129. doi :10.1111/j.1365-2133.2005.06322.x. PMID 15656812. S2CID 42369353.
- ^ Ahn CS, Huang WW (octubre de 2014). "Imiquimod en el tratamiento de las verrugas cutáneas: una revisión basada en evidencia". American Journal of Clinical Dermatology . 15 (5): 387–399. doi :10.1007/s40257-014-0093-5. PMID 25186654. S2CID 26624740.
Enlaces externos
- Tratamientos DermNet /imiquimod

