Melanoma
| Melanoma | |
|---|---|
| Otros nombres | Melanoma maligno |
 | |
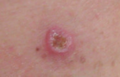
| Un melanoma de aproximadamente 2,5 cm (1 pulgada) por 1,5 cm (0,6 pulgadas) | |
| Pronunciación | |
| Especialidad | Oncología y dermatología |
| Síntomas | Lunar que aumenta de tamaño, tiene bordes irregulares, cambio de color, picazón o daño en la piel . [1] |
| Causas | Luz ultravioleta (sol, aparatos de bronceado ) [2] |
| Factores de riesgo | Antecedentes familiares, muchos lunares, función inmunológica deficiente [1] |
| Método de diagnóstico | Biopsia de tejido [1] |
| Diagnóstico diferencial | Queratosis seborreica , lentigo , nevo azul , dermatofibroma [3] |
| Prevención | Protector solar , evitando la luz ultravioleta [2] |
| Tratamiento | Cirugía [1] |
| Pronóstico | Las tasas de supervivencia a cinco años en EE. UU. son del 99 % (localizada) y del 25 % (diseminada) [4] |
| Frecuencia | 3,1 millones (2015) [5] |
| Fallecidos | 59.800 (2015) [6] |
El melanoma es el tipo más peligroso de cáncer de piel ; se desarrolla a partir de las células productoras de melanina , conocidas como melanocitos . [1] Por lo general, se presenta en la piel, pero en raras ocasiones puede aparecer en la boca, los intestinos o los ojos ( melanoma uveal ). [1] [2]
En las mujeres, los melanomas se presentan con mayor frecuencia en las piernas, mientras que en los hombres, en la espalda. [2] Con frecuencia, se hace referencia al melanoma como melanoma maligno . Sin embargo, la comunidad médica enfatiza que no existe tal cosa como un "melanoma benigno" y recomienda que se evite el término "melanoma maligno" por ser redundante . [7] [8] [9]
Aproximadamente el 25% de los melanomas se desarrollan a partir de lunares . [2] Los cambios en un lunar que pueden indicar un melanoma incluyen aumento (especialmente aumento rápido) en el tamaño, bordes irregulares, cambio de color, picazón o daño en la piel . [1]
La causa principal del melanoma es la exposición a la luz ultravioleta (UV) en aquellas personas con niveles bajos del pigmento de la piel melanina . [2] [10] La luz ultravioleta puede provenir del sol o de otras fuentes, como los aparatos de bronceado . [2] Las personas con muchos lunares, antecedentes de familiares afectados y una función inmunológica deficiente tienen mayor riesgo. [1] Una serie de enfermedades genéticas raras , como el xeroderma pigmentoso , también aumentan el riesgo. [11] El diagnóstico se realiza mediante biopsia y análisis de cualquier lesión cutánea que presente signos de ser potencialmente cancerosa. [1]
Evitar la luz ultravioleta y usar protector solar en condiciones de sol con rayos ultravioleta intensos puede prevenir el melanoma. [2] El tratamiento generalmente es la extirpación quirúrgica del melanoma y del tejido adyacente potencialmente afectado que bordea el melanoma. [1] En aquellos con cánceres ligeramente más grandes, se pueden analizar los ganglios linfáticos cercanos para detectar si se ha propagado ( metástasis ). [1] La mayoría de las personas se curan si no se ha producido metástasis. [1] Para aquellos en quienes el melanoma se ha propagado, la inmunoterapia , la terapia biológica , la radioterapia o la quimioterapia pueden mejorar la supervivencia. [1] [12] Con tratamiento, las tasas de supervivencia a cinco años en los Estados Unidos son del 99 % entre aquellos con enfermedad localizada, del 65 % cuando la enfermedad se ha propagado a los ganglios linfáticos y del 25 % entre aquellos con propagación distante. [4] La probabilidad de que el melanoma vuelva a aparecer o se propague depende de su grosor , de la velocidad de división de las células y de si la piel suprayacente se ha desgarrado o no. [2]
El melanoma es el tipo de cáncer de piel más peligroso. [2] A nivel mundial, en 2012, se presentó en 232.000 personas. [2] En 2015, 3,1 millones de personas tenían la enfermedad activa, lo que resultó en 59.800 muertes. [5] [6] Australia y Nueva Zelanda tienen las tasas más altas de melanoma en el mundo. [2] Las tasas altas también se dan en el norte de Europa y América del Norte, mientras que es menos común en Asia, África y América Latina. [2] En los Estados Unidos, el melanoma se presenta aproximadamente 1,6 veces más a menudo en hombres que en mujeres. [13] El melanoma se ha vuelto más común desde la década de 1960 en áreas pobladas principalmente por personas de ascendencia europea . [2] [11]
Signos y síntomas
Los primeros signos del melanoma son cambios en la forma o el color de los lunares existentes o, en el caso del melanoma nodular , la aparición de un nuevo bulto en cualquier parte de la piel. En etapas posteriores, el lunar puede picar , ulcerarse o sangrar. Los primeros signos del melanoma se resumen con la regla mnemotécnica "ABCDEEFG": [14] [15]
- Una simetría
- Órdenes B (irregulares con aristas y esquinas)
- Color ( abigarrado )
- Diámetro (mayor de 6 mm (0,24 pulgadas ), aproximadamente el tamaño de una goma de borrar de lápiz)
- Evolucionando con el tiempo
Esta clasificación no se aplica al melanoma nodular, que tiene sus propias clasificaciones: [16]
- E elevado por encima de la superficie de la piel
- Firme al tacto
- Creciente
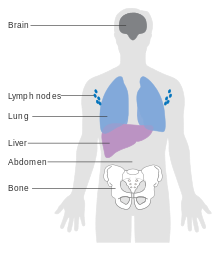
El melanoma metastásico puede causar síntomas paraneoplásicos inespecíficos , como pérdida de apetito, náuseas , vómitos y fatiga. La metástasis (diseminación) del melanoma en etapa temprana es posible, pero relativamente rara; menos de una quinta parte de los melanomas diagnosticados en etapa temprana se vuelven metastásicos. Las metástasis cerebrales son particularmente comunes en pacientes con melanoma metastásico. [17] También puede propagarse al hígado, los huesos, el abdomen o los ganglios linfáticos distantes. [ cita requerida ]
Causa
Los melanomas suelen ser causados por daños en el ADN que resultan de la exposición a la luz ultravioleta del sol. La genética también influye. [18] [19] El melanoma también puede aparecer en áreas de la piel con poca exposición al sol (es decir, boca, plantas de los pies, palmas de las manos, áreas genitales). [20] Las personas con síndrome de nevo displásico , también conocido como melanoma múltiple atípico familiar, tienen un mayor riesgo de desarrollar melanoma. [21]
Tener más de 50 lunares indica un mayor riesgo de melanoma. Un sistema inmunológico debilitado facilita el desarrollo del cáncer debido a la menor capacidad del cuerpo para combatir las células cancerosas. [18]
Radiación ultravioleta
La exposición a la radiación ultravioleta de las camas solares aumenta el riesgo de melanoma. [22] La Agencia Internacional para la Investigación sobre el Cáncer considera que las camas solares son "cancerígenas para los seres humanos" y que las personas que comienzan a utilizar aparatos de bronceado antes de los treinta años tienen un 75% más de probabilidades de desarrollar melanoma. [23]
Quienes trabajan en aviones también parecen tener un mayor riesgo, lo que se cree que se debe a una mayor exposición a los rayos UV. [24]
La luz UVB , que emana del sol en longitudes de onda entre 315 y 280 nm, es absorbida directamente por el ADN de las células de la piel, lo que produce un tipo de daño directo al ADN llamado dímeros de pirimidina de ciclobutano . Los dímeros de timina , citosina o citosina-timina se forman mediante la unión de dos bases de pirimidina adyacentes dentro de una cadena de ADN. La luz UVA se presenta en longitudes de onda más largas que la UVB (entre 400 y 315 nm); y también puede ser absorbida directamente por el ADN de las células de la piel, pero con menor eficiencia, aproximadamente 1/100 a 1/1000 de la UVB. [25]
La exposición a la radiación (UVA y UVB) es un factor importante que contribuye al desarrollo del melanoma. [26] La exposición extrema ocasional al sol que produce " quemaduras solares " en zonas del cuerpo humano está relacionada causalmente con el melanoma; [27] y estas zonas de exposición intermitente aparentemente explican por qué el melanoma es más común en la espalda en los hombres y en las piernas en las mujeres. El riesgo parece estar fuertemente influenciado por las condiciones socioeconómicas más que por las ocupaciones en interiores frente a las ocupaciones al aire libre; es más común en trabajadores profesionales y administrativos que en trabajadores no cualificados. [28] [29] Otros factores son las mutaciones en los genes supresores de tumores (o la pérdida total de los mismos) . El uso de camas solares con sus rayos UVA de penetración profunda se ha relacionado con el desarrollo de cánceres de piel, incluido el melanoma. [30]
Entre los posibles factores de riesgo se encuentran la intensidad y la duración de la exposición al sol, la edad a la que se produce la exposición y el grado de pigmentación de la piel . Las tasas de melanoma tienden a ser más altas en los países colonizados por inmigrantes del norte de Europa que tienen una gran cantidad de luz solar directa e intensa a la que la piel de los colonos no está adaptada, sobre todo Australia. La exposición durante la infancia es un factor de riesgo más importante que la exposición en la edad adulta, como se observa en los estudios sobre migración en Australia. [31]
Sufrir múltiples quemaduras solares graves aumenta la probabilidad de que futuras quemaduras solares se conviertan en melanoma debido al daño acumulativo. [18] La luz solar con alto contenido de rayos UV y las camas solares son las principales fuentes de radiación UV que aumentan el riesgo de melanoma [32] y vivir cerca del ecuador aumenta la exposición a la radiación UV. [18]
Genética
Una serie de mutaciones raras, que suelen ser hereditarias, aumentan considerablemente la susceptibilidad al melanoma. [33] Varios genes aumentan los riesgos. Algunos genes raros tienen un riesgo relativamente alto de causar melanoma; algunos genes más comunes, como un gen llamado MC1R que causa el pelo rojo, tienen un riesgo elevado relativamente menor. Se pueden utilizar pruebas genéticas para buscar las mutaciones. [ cita requerida ]
Una clase de mutaciones afecta al gen CDKN2A . Una mutación de marco de lectura alternativo en este gen conduce a la desestabilización de p53 , un factor de transcripción involucrado en la apoptosis y en el 50% de los cánceres humanos. Otra mutación en el mismo gen da como resultado un inhibidor no funcional de CDK4 , una quinasa dependiente de ciclina que promueve la división celular . Las mutaciones que causan la enfermedad de la piel llamada xeroderma pigmentosum (XP) también aumentan la susceptibilidad al melanoma. Dispersas por todo el genoma, estas mutaciones reducen la capacidad de una célula para reparar el ADN. Tanto las mutaciones CDKN2A como las XP son altamente penetrantes (las probabilidades de que un portador exprese el fenotipo son altas). [ cita requerida ]
El melanoma familiar es genéticamente heterogéneo, [19] y los loci del melanoma familiar aparecen en los brazos cromosómicos 1p, 9p y 12q. Múltiples eventos genéticos se han relacionado con la patogénesis del melanoma (desarrollo de la enfermedad). [34] El gen supresor múltiple de tumores 1 (CDKN2A/MTS1) codifica p16INK4a, un inhibidor proteico de bajo peso molecular de las proteínas quinasas dependientes de ciclina (CDK), que se ha localizado en la región p21 del cromosoma 9 humano . [35] El FAMMM se caracteriza típicamente por tener 50 o más lunares combinados además de una historia familiar de melanoma. [20] Se transmite de forma autosómica dominante y se asocia principalmente con las mutaciones CDKN2A . [20] Las personas que tienen FAMMM asociado con la mutación CDKN2A tienen un riesgo 38 veces mayor de cáncer de páncreas. [36]
Otras mutaciones conllevan un riesgo menor, pero son más comunes en la población. Las personas con mutaciones en el gen MC1R tienen entre dos y cuatro veces más probabilidades de desarrollar melanoma que aquellas con dos copias de tipo salvaje (tipo típico no afectado). Las mutaciones del MC1R son muy comunes y todas las personas pelirrojas tienen una copia mutada. [ cita requerida ] La mutación del gen MDM2 SNP309 se asocia con mayores riesgos para las mujeres más jóvenes. [37]
Las personas de cabello rubio o pelirrojo, las personas con múltiples nevos atípicos o nevos displásicos y las personas nacidas con nevos melanocíticos congénitos gigantes tienen mayor riesgo. [38]
Los antecedentes familiares de melanoma aumentan considerablemente el riesgo de una persona, porque se han encontrado mutaciones en varios genes en familias propensas al melanoma. [39] [18] Las personas con antecedentes de un melanoma tienen un mayor riesgo de desarrollar un segundo tumor primario. [40]
La piel clara es el resultado de tener menos melanina en la piel, lo que significa que existe menos protección contra la radiación UV. [18]
Fisiopatología


La etapa más temprana del melanoma comienza cuando los melanocitos comienzan a crecer sin control. Los melanocitos se encuentran entre la capa externa de la piel (la epidermis ) y la siguiente capa (la dermis ). Esta etapa temprana de la enfermedad se llama fase de crecimiento radial, cuando el tumor tiene menos de 1 mm de espesor y se propaga a nivel de la epidermis basal. [41] Debido a que las células cancerosas aún no han llegado a los vasos sanguíneos más profundos en la piel, es muy poco probable que este melanoma en etapa temprana se propague a otras partes del cuerpo. Si el melanoma se detecta en esta etapa, generalmente se puede extirpar por completo con cirugía. [ cita requerida ]
Cuando las células tumorales comienzan a moverse en una dirección diferente (verticalmente hacia arriba, hacia la epidermis y hacia la dermis papilar ), el comportamiento celular cambia drásticamente. [42]
El siguiente paso en la evolución es la fase de crecimiento radial invasivo, en la que las células individuales comienzan a adquirir potencial invasivo. A partir de este punto, el melanoma es capaz de propagarse. [ cita requerida ] La profundidad de Breslow de la lesión suele ser inferior a 1 mm (0,04 pulgadas ), mientras que el nivel de Clark suele ser de 2.
La fase de crecimiento vertical (FV) que sigue es el melanoma invasivo. El tumor puede crecer hacia el tejido circundante y propagarse por el cuerpo a través de los vasos sanguíneos o linfáticos . El grosor del tumor suele ser superior a 1 mm (0,04 pulgadas ) y afecta las partes más profundas de la dermis.
El huésped provoca una reacción inmunológica contra el tumor durante el VGP, [43] que se juzga por la presencia y actividad de los linfocitos infiltrantes del tumor (TIL). Estas células a veces destruyen completamente el tumor primario; esto se llama regresión, que es la última etapa del desarrollo. En ciertos casos, el tumor primario se destruye completamente y solo se descubre el tumor metastásico. Alrededor del 40% de los melanomas humanos contienen mutaciones activadoras que afectan la estructura de la proteína B-Raf , lo que resulta en una señalización constitutiva a través de la vía de Raf a MAP quinasa . [44]
Una causa común a la mayoría de los cánceres es el daño al ADN. [45] La luz UVA causa principalmente dímeros de timina . [46] La UVA también produce especies reactivas de oxígeno y estas infligen otros daños al ADN, principalmente roturas de cadena simple, pirimidinas oxidadas y la purina oxidada 8-oxoguanina (un cambio mutagénico del ADN) a 1/10, 1/10 y 1/3 de las frecuencias de dímeros de timina inducidos por UVA, respectivamente.
Si no se reparan, los fotoproductos del dímero de pirimidina de ciclobutano (CPD) pueden provocar mutaciones por síntesis de translesión inexacta durante la replicación o reparación del ADN. Las mutaciones más frecuentes debidas a una síntesis inexacta después de los CPD son las mutaciones de transición de citosina a timina (C>T) o CC>TT . Estas se conocen comúnmente como mutaciones de huella UV, ya que son la mutación más específica causada por los rayos UV, y se encuentran con frecuencia en la piel expuesta al sol, pero rara vez en los órganos internos. [47] Los errores en la reparación del ADN de los fotoproductos UV, o la síntesis inexacta después de estos fotoproductos, también pueden provocar deleciones, inserciones y translocaciones cromosómicas .
Se secuenciaron los genomas completos de 25 melanomas. [48] En promedio, se encontraron alrededor de 80.000 bases mutadas (en su mayoría transiciones C>T) y alrededor de 100 reordenamientos estructurales por genoma de melanoma. Esto es mucho más alto que las aproximadamente 70 mutaciones a lo largo de generaciones (de padre a hijo). [49] [50] Entre los 25 melanomas, alrededor de 6.000 genes codificadores de proteínas tenían mutaciones sin sentido , sin sentido o en el sitio de empalme . También se han secuenciado y analizado los transcriptomas de más de 100 melanomas. Casi el 70% de todos los genes codificadores de proteínas humanos se expresan en el melanoma. La mayoría de estos genes también se expresan en otros tejidos normales y cancerosos, y unos 200 genes muestran un patrón de expresión más específico en el melanoma en comparación con otras formas de cáncer. Ejemplos de genes específicos del melanoma son la tirosinasa , MLANA y PMEL . [51] [52]
La radiación UV causa daño al ADN de las células, típicamente dimerización de timina, que cuando no se repara puede crear mutaciones en los genes de la célula. Este fuerte factor mutagénico hace que el melanoma cutáneo sea el tipo de tumor con el mayor número de mutaciones. [53] Cuando la célula se divide , estas mutaciones se propagan a nuevas generaciones de células. Si las mutaciones ocurren en protooncogenes o genes supresores de tumores , la tasa de mitosis en las células portadoras de la mutación puede volverse descontrolada, lo que lleva a la formación de un tumor . Los datos de pacientes sugieren que los niveles aberrantes del factor de transcripción activador en el núcleo de las células de melanoma están asociados con una mayor actividad metastásica de las células de melanoma; [54] [55] [56] los estudios de ratones sobre cáncer de piel tienden a confirmar un papel para el factor de transcripción activador-2 en la progresión del cáncer. [57] [58]
Las células madre cancerosas también pueden estar involucradas. [59]
Mutaciones genéticas
Estudios a gran escala, como el Atlas del Genoma del Cáncer , han caracterizado alteraciones somáticas recurrentes que probablemente impulsan el inicio y desarrollo del melanoma cutáneo. El estudio Atlas del Genoma del Cáncer ha establecido cuatro subtipos: mutante BRAF , mutante RAS , mutante NF1 y triple tipo salvaje. [60]
La mutación más frecuente ocurre en el codón 600 de BRAF (50% de los casos). BRAF normalmente está involucrado en el crecimiento celular, y esta mutación específica hace que la proteína sea constitutivamente activa e independiente de la regulación fisiológica normal, fomentando así el crecimiento tumoral. [61] Los genes RAS ( NRAS , HRAS y KRAS ) también están mutados recurrentemente (30% de los casos de TCGA) y las mutaciones en los codones 61 o 12 desencadenan la actividad oncogénica. Las mutaciones de pérdida de función a menudo afectan a genes supresores de tumores como NF1 , TP53 y CDKN2A . Otras alteraciones oncogénicas incluyen fusiones que involucran varias quinasas como BRAF, [62] RAF1, [63] ALK, RET, ROS1, NTRK1, [64] NTRK3 [65] y MET [66] . Las mutaciones de BRAF, RAS y NF1 y las fusiones de quinasas son notablemente excluyentes entre sí, ya que ocurren en diferentes subconjuntos de pacientes. Por lo tanto, la evaluación del estado de mutación puede mejorar la estratificación de los pacientes e informar la terapia dirigida con inhibidores específicos. [ cita requerida ]
En algunos casos (3-7 %) las versiones mutadas de BRAF y NRAS experimentan una amplificación del número de copias . [60]
Metástasis
La investigación realizada por el equipo de Sarna demostró que las células de melanoma altamente pigmentadas tienen un módulo de Young de aproximadamente 4,93, mientras que en las no pigmentadas era de solo 0,98. [67] En otro experimento, descubrieron que la elasticidad de las células de melanoma es importante para su metástasis y crecimiento: los tumores no pigmentados eran más grandes que los pigmentados y les resultaba mucho más fácil propagarse. Demostraron que en los tumores de melanoma hay células tanto pigmentadas como no pigmentadas , de modo que ambos pueden ser resistentes a los fármacos y metastásicos. [67]
Diagnóstico

La observación o inspección visual del área en cuestión es el método más común para sospechar un melanoma. [68] Los lunares que son irregulares en color o forma generalmente se tratan como candidatos. Para detectar melanomas (y aumentar las tasas de supervivencia), se recomienda aprender a reconocerlos (ver la regla mnemotécnica "ABCDE"), examinar regularmente los lunares para detectar cambios (forma, tamaño, color, picazón o sangrado) y consultar a un médico calificado cuando aparezca un candidato. [69] [70] La inspección en persona de lesiones cutáneas sospechosas es más precisa que la inspección visual de imágenes de lesiones cutáneas sospechosas. [71]
Cuando la utilizan especialistas capacitados, la dermatoscopia es más útil para identificar lesiones malignas que el uso del ojo desnudo únicamente. [72] La microscopía confocal de reflectancia puede tener mejor sensibilidad y especificidad que la dermatoscopia para diagnosticar el melanoma cutáneo, pero se necesitan más estudios para confirmar este resultado. [73]
Sin embargo, muchos melanomas se presentan como lesiones de menos de 6 mm de diámetro, y todos los melanomas son malignos cuando aparecen por primera vez como un pequeño punto. Los médicos suelen examinar todos los lunares, incluidos los de menos de 6 mm de diámetro. La queratosis seborreica puede cumplir algunos o todos los criterios ABCD, y puede dar lugar a falsas alarmas . Los médicos generalmente pueden distinguir la queratosis seborreica del melanoma mediante un examen o con dermatoscopia . [ cita requerida ]
Algunos médicos recomiendan reemplazar "agrandamiento" por "evolución": los lunares que cambian y evolucionan son motivo de preocupación. Por otra parte, algunos médicos prefieren la "elevación". La elevación puede ayudar a identificar un melanoma, pero la falta de elevación no significa que la lesión no sea un melanoma. La mayoría de los melanomas en los EE. UU. se detectan antes de que se eleven. Para cuando la elevación es visible, es posible que hayan progresado a la etapa invasiva más peligrosa. [ cita requerida ]
- Melanoma en biopsia de piel con tinción H&E : este caso puede representar un melanoma de propagación superficial.
- Ganglio linfático con reemplazo casi completo por melanoma metastásico. El pigmento marrón es un depósito focal de melanina.
- Melanoma, muslo posterior derecho
- Melanoma in situ, vértice del cuero cabelludo marcado para biopsia
- Melanoma in situ, en evolución, clavícula derecha marcada para biopsia
- Melanoma, vértice del cuero cabelludo marcado para biopsia
- Melanoma, muslo medial derecho marcado para biopsia
- Melanoma, hombro posterior derecho rodeado para biopsia
- Melanoma, antebrazo izquierdo marcado para biopsia
- Melanoma en antebrazo izquierdo post escisión con cierre en bolsa de tabaco
- Melanoma in situ, frente derecha marcada para biopsia
- Melanoma in situ, imagen dermatoscópica, frente derecha marcada para biopsia
- Melanoma in situ, en evolución, sien derecha medial con hiperplasia sebácea adyacente, lateral
- Melanoma in situ, hombro anterior izquierdo marcado para biopsia
- Melanoma in situ, hombro anterior derecho marcado para biopsia
- Melanoma in situ, parte superior interna del brazo izquierdo
- Melanoma in situ marcado para biopsia, antebrazo izquierdo
- Melanoma in situ, región medial superior de la espalda derecha, marcado para biopsia
- Melanoma, cuero cabelludo frontal medio
- Melanoma, parte media de la espalda izquierda marcada para biopsia
- Melanoma, parte media de la espalda izquierda marcado para biopsia, mediante dermatoscopio
- Patología macroscópica de la metástasis del melanoma, que en la gran mayoría de los casos es formadora de pigmento, lo que le da un aspecto oscuro.
- Histopatología de un melanoma metastásico en un ganglio linfático, tinción H&E, que muestra células poco diferenciadas.
- Melanoma metastásico en inmunohistoquímica para Melan-A , que ayuda a diagnosticar casos inciertos
- Melanoma metastásico en inmunohistoquímica para SOX10 , otra tinción útil en casos inciertos
Patito feo
Un método es el " signo del patito feo ". [74] Se realiza una correlación de las características comunes de las lesiones. Las lesiones que se desvían de las características comunes se etiquetan como "patito feo", y se requiere un examen profesional adicional. El signo de " Caperucita Roja " [74] sugiere que las personas con piel clara y cabello de color claro podrían tener melanomas amelanóticos difíciles de diagnosticar . Se requiere un cuidado especial al examinar a estos individuos, ya que pueden tener múltiples melanomas y nevos severamente displásicos. Se debe utilizar un dermatoscopio para detectar "patitos feos", ya que muchos melanomas en estos individuos se parecen a los no melanomas o se consideran " lobos con piel de oveja ". [75]
Estos individuos de piel clara suelen tener melanomas poco pigmentados o amelanóticos que no presentan cambios ni variaciones de color fáciles de observar. Sus bordes suelen ser indistintos, lo que complica la identificación visual sin un dermatoscopio.
Los melanomas amelanóticos y los melanomas que surgen en personas de piel clara son muy difíciles de detectar, ya que no muestran muchas de las características de la regla ABCD, rompen el signo del "patito feo" y son difíciles de distinguir de las cicatrices del acné , las picaduras de insectos, los dermatofibromas o los lentigos .
Biopsia
Después de un examen visual y un examen dermatoscópico [75] , o herramientas de diagnóstico in vivo como un microscopio confocal, el médico puede realizar una biopsia del lunar sospechoso. A menudo se requiere una biopsia de piel realizada con anestesia local para ayudar a hacer o confirmar el diagnóstico y definir la gravedad. Las biopsias escisionales elípticas pueden eliminar el tumor, seguidas de un análisis histológico y una puntuación de Breslow. Las biopsias incisionales, como las biopsias con sacabocados, suelen estar contraindicadas en los melanomas sospechosos, debido a la posibilidad de un error de muestreo [76] o de una implantación local que provoque una estimación errónea del espesor del tumor. [77] [78] Sin embargo, los temores de que dichas biopsias puedan aumentar el riesgo de enfermedad metastásica parecen infundados. [79] [80]
La fotografía corporal total, que implica la documentación fotográfica de la mayor superficie corporal posible, se utiliza a menudo durante el seguimiento de pacientes de alto riesgo. Se ha informado que la técnica permite la detección temprana y proporciona un enfoque rentable (con cualquier cámara digital), pero se ha cuestionado su eficacia debido a su incapacidad para detectar cambios macroscópicos. [68] El método de diagnóstico debe utilizarse junto con (y no como reemplazo de) la imagen dermatoscópica, ya que una combinación de ambos métodos parece dar tasas de detección extremadamente altas.
Tipos histopatológicos
El melanoma es un tipo de neoplasia neuroectodérmica . [81] Hay cuatro tipos principales de melanoma: [82]
| SN | Tipo | Características | Incidencia [82] [notas 1] | Fotografía | Micrografía |
|---|---|---|---|---|---|
| 1. | Melanoma de propagación superficial | Células de melanoma con formación de nidos a lo largo de la unión dermoepidérmica. | 70% |  |  |
| 2. | Melanoma nodular | Crece relativamente más en profundidad que en ancho. | 15% - 20% |  |  |
| 3. | Melanoma lentigo maligno | Propagación lineal de melanocitos epidérmicos atípicos, así como invasión de la dermis. [83] | 5% - 10% |  |  |
| 4. | Melanoma lentiginoso acral | Proliferación continua de melanocitos atípicos en la unión dermoepidérmica. [84] | 7% - 10% |  |  |
Otros tipos histopatológicos son:

- Melanoma de las mucosas ; Cuando el melanoma aparece en las membranas mucosas .
- Melanoma desmoplásico
- Melanoma con pequeñas células similares a nevos
- Melanoma con características de un nevo de Spitz
- Melanoma uveal
- Melanoma vaginal
- Melanoma polipoide , una subclase de melanoma nodular.
In situ o invasivo
Un melanoma in situ no ha invadido más allá de la membrana basal , mientras que un melanoma invasivo se ha propagado más allá de ella.
Algunos tipos histopatológicos de melanoma son inherentemente invasivos, incluido el melanoma nodular y el melanoma lentigo maligno , donde la contraparte in situ del melanoma lentigo maligno es el lentigo maligno . [85] El lentigo maligno a veces se clasifica como un melanoma muy temprano, [86] y a veces como un precursor del melanoma. [87]
Los melanomas de propagación superficial y los melanomas lentiginosos acrales pueden ser in situ o invasivos, [88] pero los melanomas lentiginosos acrales casi siempre son invasivos. [89]
Puesta en escena
Hay más contexto sobre la estadificación del cáncer disponible en TNM .

Los melanomas metastásicos se pueden detectar mediante radiografías, tomografías computarizadas, resonancias magnéticas, tomografías por emisión de positrones y tomografías por emisión de positrones/tomografías computarizadas, ecografías, pruebas de LDH y detección fotoacústica. [90] Sin embargo, no hay evidencia sobre la precisión de la estadificación de las personas con melanoma con varios métodos de diagnóstico por imágenes. [91]
Estadios del melanoma según AJCC , 8.ª edición: [92]
- TX: No se puede evaluar el espesor del tumor primario (como en un diagnóstico por legrado)
- T0: No hay evidencia de tumor primario (como melanoma primario desconocido o completamente involucionado)
| Escenario | Categoría T [92] | Espesor [92] | Ulceración [92] |
|---|---|---|---|
| Etapa 0 | Melanoma in situ | ||
| Etapa I | T1a | Menos de 0,8 mm | No |
| T1b | Menos de 0,8 mm | Sí | |
| >0,8 a 1,0 mm | sí o no | ||
| T2a | >1,0 a 2,0 mm | No | |
| Estadio II | T2b | >1,0 a 2,0 mm | Sí |
| T3a | >2,0 a 4,0 mm | No | |
| T3b | >2,0 a 4,0 mm | Sí | |
| T4a | >4,0 mm | No | |
| T4b | >4,0 mm | Sí | |
Las etapas 1 y 2 requieren una clase N (ganglio linfático) de:
- N0 – Sin metástasis regionales. [92]
| Escenario | Categoría N | Número de ganglios linfáticos regionales afectados por el tumor | Presencia de metástasis en tránsito, satélites y/o microsatélites |
|---|---|---|---|
| N / A | NX | Ganglios regionales no evaluados (como biopsia de ganglio linfático centinela no realizada o ganglios regionales extirpados previamente por otro motivo) [notas 2] | |
| Estadio III | N1 | Un ganglio linfático afectado, o cualquier número de metástasis en tránsito, satélites y/o microsatélites sin ganglios afectados por el tumor. | |
| N1a | Uno clínicamente oculto (es decir, detectado mediante biopsia del ganglio centinela) | No | |
| N1b | Uno detectado clínicamente | No | |
| N1c | Sin enfermedad de los ganglios linfáticos regionales | Sí | |
| N2 | Dos o tres ganglios afectados por el tumor o cualquier número de metástasis en tránsito, satélites y/o microsatélites con un ganglio afectado por el tumor | ||
| N2a | Dos o 3 clínicamente ocultos (es decir, detectados mediante biopsia del ganglio centinela) | No | |
| N2b | Dos o tres, de los cuales al menos uno fue detectado clínicamente | No | |
| N2c | Uno clínicamente oculto o clínicamente detectado | Sí | |
| N3 | Cuatro o más ganglios afectados por el tumor o cualquier cantidad de metástasis en tránsito, satélites y/o microsatélites con 2 o más ganglios afectados por el tumor, o cualquier cantidad de ganglios enmarañados sin o con metástasis en tránsito, satélites y/o microsatélites | ||
| N3a | Cuatro o más tumores clínicamente ocultos (es decir, detectados mediante biopsia del ganglio centinela) | No | |
| N3b | Cuatro o más, al menos uno de los cuales fue detectado clínicamente, o la presencia de cualquier número de ganglios enmarañados | No | |
| N3c | Dos o más ganglios clínicamente ocultos o clínicamente detectados y/o presencia de cualquier número de ganglios enmarañados | Sí | |
Los estadios 1, 2 y 3 requieren un M (estado de metástasis) de:
- M0 : No hay evidencia de metástasis a distancia
| Escenario | Categoría M | Sitio anatómico | nivel de lactato deshidrogenasa (LDH) |
|---|---|---|---|
| Estadio IV | M1 | Evidencia de metástasis a distancia | |
| M1a | Metástasis a distancia en la piel, tejido blando, incluido el músculo, y/o ganglio linfático no regional. | No registrado o no especificado | |
| M1a(0) | No elevado | ||
| M1a(1) | Elevado | ||
| M1b | Metástasis a distancia al pulmón con o sin metástasis en sitios M1a | No registrado o no especificado | |
| M1b(0) | No elevado | ||
| M1b(1) | Elevado | ||
| M1c | Metástasis a distancia en sitios viscerales no pertenecientes al SNC, con o sin metástasis en sitios M1a o M1b | No registrado o no especificado | |
| M1c(0) | No elevado | ||
| M1c(1) | Elevado | ||
| M1d | Metástasis a distancia al SNC, con o sin metástasis en sitios M1a, M1b o M1c | No registrado o no especificado | |
| M1d(0) | No elevado | ||
| M1d(1) | Elevado | ||
Los sistemas más antiguos incluyen el “ nivel de Clark ” y la “ profundidad de Breslow ”, que cuantifican la profundidad microscópica de la invasión tumoral.

Laboratorio
Las pruebas de lactato deshidrogenasa (LDH) se utilizan a menudo para detectar metástasis , aunque muchos pacientes con metástasis (incluso en etapa terminal) tienen una LDH normal; una LDH extraordinariamente alta a menudo indica la propagación metastásica de la enfermedad al hígado.
Es común que a los pacientes con diagnóstico de melanoma se les realicen radiografías de tórax y una prueba de LDH, y en algunos casos tomografías computarizadas , resonancias magnéticas y/o tomografías por emisión de positrones . Aunque es controvertido, también se realizan biopsias de ganglio linfático centinela y exámenes de los ganglios linfáticos en los pacientes para evaluar la propagación a los ganglios linfáticos. El diagnóstico de melanoma se sustenta en la presencia del marcador proteico S-100 .
El HMB-45 es un anticuerpo monoclonal que reacciona contra un antígeno presente en tumores melanocíticos como los melanomas. Se utiliza en patología anatómica como marcador de dichos tumores. El anticuerpo se generó a partir de un extracto de melanoma. Reacciona positivamente contra tumores melanocíticos pero no contra otros tumores, lo que demuestra especificidad y sensibilidad. El anticuerpo también reacciona positivamente contra células névus de unión pero no contra nevos intradérmicos, y contra melanocitos fetales pero no contra melanocitos adultos normales.
El HMB-45 no es reactivo con casi ninguna neoplasia maligna humana no melanoma, con excepción de tumores raros que muestran evidencia de melanogénesis (por ejemplo, schwannoma pigmentado, sarcoma de células claras) o tumores asociados con el complejo de esclerosis tuberosa (angiomiolipoma y linfangiomioma).
Prevención
No existe evidencia que respalde o refute el cribado del melanoma en la población adulta. [93]
Radiación ultravioleta
Minimizar la exposición a fuentes de radiación ultravioleta (el sol y las camas solares), [94] seguir medidas de protección solar y usar ropa protectora solar (camisas de manga larga, pantalones largos y sombreros de ala ancha) pueden ofrecer protección.
Antes se creía que el uso de luz artificial para broncearse ayudaba a prevenir el cáncer de piel, pero en realidad puede conducir a una mayor incidencia de melanomas. [95]
Las lámparas UV para uñas, que se utilizan en los salones de uñas para secar el esmalte de uñas, son otra fuente común y generalizada de radiación UV que podría evitarse. [96] [97] Aunque el riesgo de desarrollar cáncer de piel a través del uso de lámparas UV para uñas es bajo, aún se recomienda usar guantes sin dedos y/o aplicar protector solar FPS 30 o superior en las manos antes de usar una lámpara UV para uñas. [96] [97]
El cuerpo utiliza la luz ultravioleta para generar vitamina D, por lo que es necesario equilibrar la cantidad de luz solar necesaria para mantener niveles saludables de vitamina D y reducir el riesgo de melanoma; el cuerpo necesita alrededor de media hora de luz solar para generar la vitamina D necesaria para el día, y este es aproximadamente el mismo tiempo que tardan las personas de piel clara en sufrir una quemadura solar. La exposición a la luz solar puede ser intermitente en lugar de toda a la vez. [98]
Protector solar
El protector solar parece ser eficaz para prevenir el melanoma. [2] [10] En el pasado, se recomendaba el uso de protectores solares con un factor de protección solar (FPS) de 50 o superior en las zonas expuestas, ya que los protectores solares más antiguos bloqueaban de forma más eficaz los rayos UVA con un FPS más alto. [99] En la actualidad, los ingredientes más nuevos de los protectores solares ( avobenzona , óxido de zinc y dióxido de titanio ) bloquean eficazmente tanto los rayos UVA como los UVB incluso con FPS más bajos. El protector solar también protege contra el carcinoma de células escamosas , otro cáncer de piel. [100]
Se ha expresado la preocupación de que el protector solar podría crear una falsa sensación de seguridad frente al daño solar. [101]
Medicamentos
Una revisión de 2005 encontró evidencia tentativa de que la medicación con estatinas y fibratos puede disminuir el riesgo de melanoma. [102] Sin embargo, una revisión de 2006 no respaldó ningún beneficio. [103]
Tratamiento

La confirmación del diagnóstico clínico se realiza con una biopsia de piel . Por lo general, se realiza una escisión más amplia de la cicatriz o el tumor. Según el estadio, se puede realizar una biopsia del ganglio linfático centinela . Existe controversia en torno a la evidencia de los ensayos clínicos sobre la biopsia del ganglio linfático centinela; [104] con evidencia poco clara de beneficio hasta 2015. [105] El tratamiento del melanoma avanzado se realiza desde un enfoque multidisciplinario.
Cirugía
Las biopsias escisionales pueden extirpar el tumor, pero a menudo es necesaria una cirugía adicional para reducir el riesgo de recurrencia. La escisión quirúrgica completa con márgenes quirúrgicos adecuados y evaluación de la presencia de enfermedad metastásica detectable junto con un seguimiento a corto y largo plazo es estándar. A menudo, esto se realiza mediante una escisión local amplia (WLE) con márgenes de 1 a 2 cm (0,4 a 0,8 pulgadas). El melanoma in situ y los lentigos malignos se tratan con márgenes quirúrgicos más estrechos, generalmente de 0,2 a 0,5 cm (0,1 a 0,2 pulgadas). Muchos cirujanos consideran que 0,5 cm (0,2 pulgadas) es el estándar de atención para la escisión estándar del melanoma in situ, [106] pero un margen de 0,2 cm (0,1 pulgadas) podría ser aceptable para la cirugía controlada por márgenes ( cirugía de Mohs o la técnica de doble hoja con control de márgenes). La escisión amplia tiene como objetivo reducir la tasa de recurrencia del tumor en el sitio de la lesión original. Este es un patrón común de fracaso del tratamiento en el melanoma. Se han realizado muchas investigaciones para dilucidar los márgenes apropiados para la escisión, pero en las últimas décadas se ha observado una tendencia general hacia un tratamiento menos agresivo. [107] Un metaanálisis de ensayos controlados aleatorizados de 2009 encontró una pequeña diferencia en las tasas de supervivencia a favor de la escisión amplia de los melanomas cutáneos primarios, pero estos resultados no fueron estadísticamente significativos. [108]
Se ha informado que la cirugía de Mohs tiene una tasa de curación tan baja como 77% [109] y tan alta como 98,0% para el melanoma in situ. [110] La CCPDMA y la cirugía periférica controlada con "doble bisturí" son equivalentes a la cirugía de Mohs en efectividad en este tipo de melanoma "intraepitelial".
Los melanomas que se diseminan generalmente lo hacen a los ganglios linfáticos en el área del tumor antes de diseminarse a otras partes. Los intentos de mejorar la supervivencia mediante la extirpación quirúrgica de los ganglios linfáticos ( linfadenectomía ) se asociaron con muchas complicaciones, pero sin ningún beneficio en la supervivencia general. Recientemente, se ha desarrollado la técnica de biopsia del ganglio linfático centinela para reducir las complicaciones de la cirugía de los ganglios linfáticos y, al mismo tiempo, permitir la evaluación de la afectación de los ganglios con tumor. [111]
La biopsia de los ganglios linfáticos centinela es un procedimiento ampliamente utilizado en el tratamiento del melanoma cutáneo. [112] [113]
Ni la biopsia del ganglio linfático centinela ni otras pruebas diagnósticas deben realizarse para evaluar el melanoma temprano y delgado, incluido el melanoma in situ, el melanoma T1a o el melanoma T1b ≤ 0,5 mm. [114] Es poco probable que las personas con estas afecciones tengan el cáncer diseminado a sus ganglios linfáticos o a cualquier otra parte y tienen una tasa de supervivencia a 5 años del 97%. [114] Debido a estas consideraciones, la biopsia del ganglio linfático centinela se considera una atención médica innecesaria para ellos. [114] Además, los análisis de sangre de referencia y los estudios radiográficos no deben realizarse solo en función de la identificación de este tipo de melanoma, ya que existen pruebas más precisas para detectar el cáncer y estas pruebas tienen altas tasas de falsos positivos. [114] Para corregir potencialmente los falsos positivos, se puede utilizar el perfil de expresión genética como prueba auxiliar para lesiones ambiguas y pequeñas. [115] [116]
La biopsia del ganglio linfático centinela se realiza a menudo, especialmente para tumores T1b/T2+, tumores de las mucosas, melanoma ocular y tumores de las extremidades. [ cita requerida ] Se realiza un proceso llamado linfogammagrafía en el que se inyecta un trazador radiactivo en el sitio del tumor para localizar el ganglio o los ganglios centinela. Se proporciona mayor precisión utilizando un tinte trazador azul y se realiza una cirugía para biopsiar el ganglio o los ganglios. La tinción de rutina con hematoxilina y eosina (H&E) e inmunoperoxidasa será adecuada para descartar la afectación del ganglio. Las pruebas de reacción en cadena de la polimerasa (PCR) en los ganglios, que generalmente se realizan para evaluar la entrada en ensayos clínicos, ahora demuestran que muchos pacientes con un ganglio linfático centinela negativo en realidad tenían una pequeña cantidad de células positivas en sus ganglios. Alternativamente, se puede realizar una biopsia por aspiración con aguja fina y a menudo se utiliza para evaluar masas.
Si un ganglio linfático es positivo, dependiendo de la extensión de la propagación del ganglio linfático, a menudo se realizará una disección radical del ganglio linfático. Si la enfermedad se reseca por completo, se considerará al paciente para terapia adyuvante. La biopsia de piel por escisión es el tratamiento de elección. Aquí, la lesión sospechosa se elimina totalmente con una elipse adecuada (pero mínima, generalmente 1 o 2 mm) de piel y tejido circundante. [117] Para evitar la interrupción del drenaje linfático local, el margen quirúrgico preferido para la biopsia inicial debe ser estrecho (1 mm). La biopsia debe incluir las capas epidérmica, dérmica y subcutánea de la piel. Esto permite al histopatólogo determinar el grosor del melanoma mediante examen microscópico. Esto se describe por el grosor de Breslow (medido en milímetros). Sin embargo, en el caso de lesiones grandes, como la sospecha de lentigo maligno, o en el caso de lesiones en zonas quirúrgicamente difíciles (cara, dedos de los pies, de las manos, párpados), una pequeña biopsia por punción en zonas representativas proporcionará información adecuada y no alterará la estadificación final ni la determinación de la profundidad. En ningún caso la biopsia inicial debe incluir el margen quirúrgico final (0,5 cm, 1,0 cm o 2 cm), ya que un diagnóstico erróneo puede dar lugar a una cicatrización excesiva y morbilidad a causa del procedimiento. Una escisión inicial grande interrumpirá el drenaje linfático local y puede afectar a una posterior disección de ganglios linfáticos dirigida por linfangiograma. Se puede utilizar una pequeña biopsia por punción en cualquier momento en el que, por razones logísticas y personales, un paciente rechace una biopsia por escisión más invasiva. Las pequeñas biopsias por punción son mínimamente invasivas y cicatrizan rápidamente, normalmente sin dejar cicatrices visibles.
Tratamiento complementario
El tratamiento adyuvante después de la cirugía puede reducir el riesgo de recurrencia después de la cirugía, especialmente en melanomas de alto riesgo. Las rutinas varían en diferentes países, pero hoy (2024) el tratamiento adyuvante más común es el tratamiento con inhibidores de puntos de control inmunitario durante hasta un año después de la cirugía. [118]
A principios de la década de 2000, una estrategia relativamente común era tratar a los pacientes con alto riesgo de recurrencia con hasta un año de tratamiento con interferón en dosis altas , que tiene efectos secundarios graves, pero puede mejorar ligeramente el pronóstico del paciente. [119] Un metaanálisis de 2013 sugirió que la adición de interferón alfa aumentó la supervivencia libre de enfermedad y la supervivencia general para las personas con melanoma cutáneo en estadio II-III según la clasificación TNM del AJCC. [120] Un metaanálisis de 2011 mostró que el interferón podría alargar el tiempo antes de que un melanoma regrese, pero aumentó la supervivencia solo en un 3% a los 5 años. Los efectos secundarios desagradables también reducen en gran medida la calidad de vida. [121] En la Unión Europea, el interferón no suele usarse fuera del ámbito de los ensayos clínicos. [122] [123]
Quimioterapia
Los medicamentos de quimioterapia como la dacarbazina han sido la columna vertebral del tratamiento del melanoma metastásico desde su aprobación por la FDA en 1975; sin embargo, su eficacia en términos de supervivencia nunca ha sido probada en un ensayo clínico aleatorizado . [124] Desde la aprobación de los inhibidores de puntos de control inmunitarios, la dacarbazina y su contraparte oral, la temozolomida, constituyen posibles opciones de tratamiento en líneas de terapia posteriores. [125]
Existen múltiples fármacos disponibles para los pacientes para disminuir el tamaño del tumor. Al disminuir el tamaño del tumor, se pueden aliviar algunos síntomas; sin embargo, esto no conduce necesariamente a la remisión. Algunos de estos fármacos son dacarbazina , temozolomida y fotemustina . También se utilizan combinaciones de fármacos y, en algunos casos, presentan tasas de remisión más altas. Estas combinaciones de medicamentos pueden tener efectos secundarios nocivos. Para mantener la calidad de vida, los pacientes requieren tratamientos de asistencia y observación. Aunque las combinaciones de fármacos aumentan las tasas de remisión, la tasa de supervivencia no muestra un aumento. [126]
En personas con neoplasias cutáneas localmente avanzadas y sarcomas, se ha descubierto que la infusión aislada de extremidades (ILI) es un procedimiento mínimamente invasivo y bien tolerado para administrar quimioterapia regional. [127] [128]
Terapia dirigida
Las células del melanoma tienen mutaciones que les permiten sobrevivir y crecer indefinidamente en el cuerpo. [124] Las terapias dirigidas de moléculas pequeñas funcionan bloqueando los genes involucrados en las vías de proliferación y supervivencia tumoral. [124] Los principales tratamientos son los inhibidores de BRAF, C-Kit y NRAS . [129] Estos inhibidores funcionan para inhibir las vías posteriores involucradas en la proliferación celular y el desarrollo tumoral debido a mutaciones genéticas específicas. [130] Las personas pueden ser tratadas con inhibidores dirigidos de moléculas pequeñas si son positivas para la mutación específica. [124] Los inhibidores de BRAF , como vemurafenib y dabrafenib y un inhibidor de MEK trametinib son los tratamientos aprobados más efectivos para el melanoma BRAF positivo. [131] [124] Los tumores de melanoma pueden desarrollar resistencia durante la terapia, lo que puede hacer que la terapia ya no sea efectiva, pero la combinación del uso de inhibidores de BRAF y MEK puede crear una respuesta rápida y duradera a la terapia del melanoma. [132]
Varios tratamientos mejoran la supervivencia en comparación con la quimioterapia tradicional. [124] La bioquimioterapia (quimioterapia con citocinas IL-2 e IFN-α) combinada con inhibidores de BRAF mejoró la supervivencia de las personas con melanoma BRAF positivo. [124] La bioquimioterapia por sí sola no mejoró la supervivencia general y tuvo una toxicidad mayor que la quimioterapia. [124] La combinación de múltiples agentes quimioterapéuticos (poliquimioterapia) no mejoró la supervivencia en comparación con la monoquimioterapia. [124] Las terapias dirigidas dan como resultado tiempos de supervivencia libre de progresión (SLP) relativamente cortos . La combinación de terapia de dabrafenib y trametinib tiene una SLP a 3 años del 23 % y una SLP a 5 años del 13 %. [133]
Lifileucel (Amtagvi) es una inmunoterapia de células T autólogas derivadas de tumores que fue aprobada para uso médico en los Estados Unidos en febrero de 2024. [134] [135]
Inmunoterapia
La inmunoterapia tiene como objetivo estimular el sistema inmunológico de la persona contra el tumor, mejorando la capacidad del propio cuerpo para reconocer y destruir las células cancerosas. [136] El enfoque actual para tratar el melanoma con inmunoterapia incluye tres amplias categorías de tratamientos que incluyen citocinas , inhibidores de puntos de control inmunológico y transferencia de células adoptivas . [136] Estas opciones de tratamiento se utilizan con mayor frecuencia en personas con melanoma metastásico y mejoran significativamente la supervivencia general. [124] Sin embargo, estos tratamientos suelen ser costosos. Por ejemplo, un tratamiento con inhibidores de puntos de control inmunológico, pembrolizumab , cuesta entre 10 000 y 12 000 dólares estadounidenses por una dosis única administrada cada 3 semanas. [137]
Las terapias con citocinas utilizadas para el melanoma incluyen IFN-a e IL-2 . [138] IL-2 ( Proleukin ) fue la primera terapia nueva aprobada (1990 UE, 1992 EE. UU.) para el tratamiento del melanoma metastásico en 20 años. [139] IL-2 puede ofrecer la posibilidad de una remisión completa y duradera en esta enfermedad en un pequeño porcentaje de personas con melanoma. [140] IL-2 intralesional para metástasis en tránsito tiene una alta tasa de respuesta completa que varía del 40 al 100%. [131] De manera similar, IFN-a ha mostrado solo beneficios de supervivencia modestos y alta toxicidad, lo que limita su uso como terapia independiente. [124] [138]
Los inhibidores del punto de control inmunitario incluyen anticuerpos monoclonales anti- CTLA-4 ( ipilimumab y tremelimumab ), agonistas del receptor tipo Toll (TLR), agonistas CD40 , anti- PD-1 ( pembrolizumab , pidilizumab y nivolumab ) y anticuerpos PD-L1 . [136] [138] La evidencia sugiere que los anticuerpos anti- PD-1 son más efectivos que los anticuerpos anti-CTLA4 con menos toxicidad sistémica. [124] La supervivencia libre de progresión a cinco años para la inmunoterapia con pembrolizumab es del 21%. [133] Un enfoque terapéutico que incluye la combinación de diferentes terapias mejora la supervivencia general y la supervivencia libre de progresión en comparación con el tratamiento con los medicamentos de inmunoterapia separados solos. [124]
Las investigaciones en curso están analizando el tratamiento mediante transferencia de células adoptivas . [141] La transferencia de células adoptivas se refiere a la aplicación de células T o células dendríticas preestimuladas y modificadas y actualmente se utiliza para minimizar las complicaciones de la enfermedad de injerto contra huésped . [138] [142]
La combinación nivolumab/relatlimab (Opdualag) fue aprobada para uso médico en los Estados Unidos en marzo de 2022. [143]
Lentigo maligno
La mayoría de los cirujanos todavía realizan la escisión estándar. Lamentablemente, la tasa de recurrencia es extremadamente alta (hasta el 50%). Esto se debe al margen quirúrgico visible mal definido y a la ubicación facial de las lesiones (que a menudo obliga al cirujano a utilizar un margen quirúrgico estrecho). El margen quirúrgico estrecho utilizado, combinado con la limitación de la técnica estándar de "pan en pan" de histología de tejido fijo, da como resultado una alta tasa de error de "falso negativo" y recurrencias frecuentes. El control de los márgenes (márgenes periféricos) es necesario para eliminar los errores de falso negativo. Si se utiliza el método de pan en pan , las distancias de las secciones deben acercarse a 0,1 mm para asegurar que el método se acerque al control completo de los márgenes. Un metaanálisis de la literatura en 2014 no encontró ensayos controlados aleatorizados de intervenciones quirúrgicas para tratar el lentigo maligno o el melanoma in situ, a pesar de que la cirugía es el tratamiento más utilizado. [144]
Se ha realizado cirugía de Mohs con una tasa de curación que ha sido tan baja como 77%, [109] y tan alta como 95% por otro autor. [110] El método de escisión controlada del margen periférico con "doble bisturí" se aproxima al método de Mohs en el control del margen, pero requiere un patólogo íntimamente familiarizado con la complejidad del manejo del margen vertical en las secciones periféricas delgadas y los métodos de tinción. [145]
Algunos nevos melanocíticos y melanomas in situ ( lentigo maligno ) se han resuelto con un tratamiento experimental, la crema tópica de imiquimod (Aldara), un agente que mejora el sistema inmunitario. Algunos dermatólogos están combinando los dos métodos: extirpando quirúrgicamente el cáncer y luego tratando la zona con crema Aldara en el posoperatorio durante tres meses. Si bien algunos estudios han sugerido el uso adyuvante de tazaroteno tópico, la evidencia actual es insuficiente para recomendarlo y sugiere que aumenta la inflamación tópica, lo que lleva a un menor cumplimiento del tratamiento por parte del paciente. [144]
Radiación
La radioterapia se utiliza a menudo después de la resección quirúrgica en pacientes con melanoma avanzado local o regionalmente o en pacientes con metástasis distantes irresecables. Los rayos X de kilovoltaje se utilizan a menudo para estos tratamientos y tienen la propiedad de que la dosis máxima de radiación se produce cerca de la superficie de la piel. [146] Puede reducir la tasa de recurrencia local, pero no prolonga la supervivencia. [147] La radioinmunoterapia del melanoma metastásico está actualmente en investigación. La radioterapia tiene un papel en la paliación del melanoma metastásico. [148]
Pronóstico

Los factores que afectan el pronóstico incluyen:
- espesor del tumor en milímetros ( profundidad de Breslow ),
- profundidad relacionada con las estructuras de la piel ( nivel de Clark ),
- tipo de melanoma,
- presencia de ulceración,
- presencia de invasión linfática/perineural ,
- presencia de linfocitos infiltrantes del tumor (si están presentes, el pronóstico es mejor),
- localización de la lesión,
- presencia de lesiones satélites, y
- Presencia de metástasis regional o a distancia . [149]
Ciertos tipos de melanoma tienen peor pronóstico, pero esto se explica por su grosor . Los melanomas menos invasivos, incluso con metástasis en los ganglios linfáticos, tienen un mejor pronóstico que los melanomas profundos sin metástasis regional en el momento de la estadificación. Las recurrencias locales tienden a comportarse de manera similar a un tumor primario, a menos que se encuentren en el sitio de una escisión local amplia (a diferencia de una escisión por etapas o una escisión por punción/afeitado), ya que estas recurrencias tienden a indicar invasión linfática.
Cuando los melanomas se han propagado a los ganglios linfáticos , uno de los factores más importantes es el número de ganglios con malignidad. La extensión de la malignidad dentro de un ganglio también es importante; las micrometástasis en las que la malignidad es solo microscópica tienen un pronóstico más favorable que las macrometástasis. En algunos casos, las micrometástasis solo se pueden detectar mediante una tinción especial, y si la malignidad solo se detecta mediante una prueba poco utilizada conocida como reacción en cadena de la polimerasa (PCR), el pronóstico es mejor. Las macrometástasis en las que la malignidad es clínicamente evidente (en algunos casos, el cáncer reemplaza completamente un ganglio) tienen un pronóstico mucho peor, y si los ganglios están enmarañados o si hay extensión extracapsular, el pronóstico es aún peor. Además de estas variables, los niveles de expresión y las variaciones del número de copias de varios genes relevantes se pueden utilizar para respaldar la evaluación del pronóstico del melanoma. [115] [116]
El melanoma en estadio IV, en el que ha hecho metástasis, es la neoplasia maligna cutánea más mortal: la supervivencia a cinco años es del 22,5 %. [133] Cuando hay metástasis a distancia, el cáncer generalmente se considera incurable. La tasa de supervivencia a cinco años es inferior al 10 %. [150] La supervivencia media es de 6 a 12 meses. El tratamiento es paliativo y se centra en la prolongación y la calidad de vida . En algunos casos, los pacientes pueden vivir muchos meses o incluso años con melanoma metastásico (dependiendo de la agresividad del tratamiento). Las metástasis en la piel y los pulmones tienen un mejor pronóstico. Las metástasis en el cerebro, los huesos y el hígado se asocian a un peor pronóstico. La supervivencia es mejor con metástasis en las que se desconoce la ubicación del tumor primario. [151]
No hay suficientes pruebas definitivas para estadificar adecuadamente y, por lo tanto, dar un pronóstico para el melanoma ocular y el melanoma de partes blandas, o el melanoma de las mucosas (p. ej., el melanoma rectal), aunque estos tienden a hacer metástasis con mayor facilidad. Si bien la regresión puede aumentar la supervivencia, cuando un melanoma ha retrocedido, es imposible saber su tamaño original y, por lo tanto, el tumor original a menudo es peor de lo que podría indicar un informe patológico .
Alrededor de 200 genes son pronósticos en el melanoma, con genes desfavorables donde la expresión alta se correlaciona con una supervivencia pobre y genes favorables donde la expresión alta se asocia con tiempos de supervivencia más largos. Ejemplos de genes desfavorables son MCM6 y TIMELESS ; un ejemplo de un gen favorable es WIPI1 . [51] [52]
Una mayor proporción de neutrófilos a linfocitos se asocia con peores resultados. [152] [153] [154]
Epidemiología
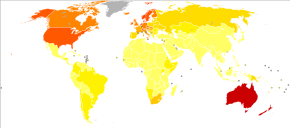
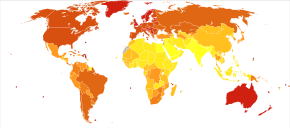
En 2012, a nivel mundial, el melanoma se presentó en 232.000 personas y provocó 55.000 muertes. [2] Australia y Nueva Zelanda tienen las tasas más altas de melanoma en el mundo. [2] Se ha vuelto más común en los últimos 20 años en áreas que son mayoritariamente caucásicas . [2]
La tasa de melanoma ha aumentado en los últimos años, pero no está claro en qué medida influyen los cambios en el comportamiento, en el entorno o en la detección temprana. [156]
Australia
Australia tiene una tasa muy alta –y en aumento– de melanoma. En 2012, las muertes por melanoma ocurrieron en 7,3–9,8 por cada 100.000 habitantes. En Australia, el melanoma es el tercer cáncer más común en ambos sexos; de hecho, su incidencia es mayor que la del cáncer de pulmón , aunque este último representa más muertes. Se estima que en 2012, más de 12.000 australianos fueron diagnosticados con melanoma: dada la modesta población de Australia, esto se expresa mejor como 59,6 casos nuevos por cada 100.000 habitantes por año; >1 de cada 10 de todos los casos nuevos de cáncer fueron melanomas. [157] La incidencia de melanoma en Australia es un asunto de importancia, por las siguientes razones:
- La incidencia del melanoma en Australia ha aumentado más del 30 por ciento entre 1991 y 2009.
- En 2008, las tasas de incidencia de melanoma estandarizadas por edad en Australia eran al menos 12 veces superiores al promedio mundial.
- La incidencia de melanoma en Australia es, por un margen amplio, la más alta del mundo.
- La incidencia general de cáncer estandarizada por edad en Australia es la más alta del mundo, y esto se debe únicamente al melanoma. La incidencia general de cáncer estandarizada por edad es similar a la de Nueva Zelanda, pero hay una diferencia estadísticamente significativa entre Australia y todas las demás partes del mundo desarrollado, incluidas América del Norte, Europa occidental y el Mediterráneo.
Estados Unidos
En Estados Unidos, aproximadamente 9.000 personas mueren de melanoma al año. [159] En 2011, afectó a 19,7 por cada 100.000 y resultó en la muerte de 2,7 por cada 100.000. [159]
En 2013:
- En Estados Unidos se diagnosticaron 71.943 personas con melanomas de la piel, incluidos 42.430 hombres y 29.513 mujeres.
- En Estados Unidos, 9.394 personas murieron a causa de melanomas de la piel, incluidos 6.239 hombres y 3.155 mujeres. [160]
Las estimaciones de la Sociedad Estadounidense del Cáncer sobre la incidencia de melanoma en los Estados Unidos para 2017 son:
- Se diagnosticarán aproximadamente 87.110 nuevos melanomas (unos 52.170 en hombres y 34.940 en mujeres).
- Se estima que unas 9.730 personas morirán de melanoma (unos 6.380 hombres y 3.350 mujeres).
El melanoma es 20 veces más común en blancos que en afroamericanos. En general, el riesgo de padecer melanoma a lo largo de la vida es de aproximadamente el 2,5 % (1 de cada 40) para los blancos, el 0,1 % (1 de cada 1000) para los afroamericanos y el 0,5 % (1 de cada 200) para los mexicanos.
El riesgo de melanoma aumenta con la edad. La edad promedio de las personas cuando se diagnostica la enfermedad es de 63 años. [161]
Historia
Aunque el melanoma no es una enfermedad nueva, la evidencia de su aparición en la antigüedad es bastante escasa. Sin embargo, un ejemplo lo constituye un examen realizado en la década de 1960 de nueve momias peruanas , datadas mediante radiocarbono con una antigüedad de aproximadamente 2400 años, que mostraban signos evidentes de melanoma: masas melánicas en la piel y metástasis difusas en los huesos. [162]
Se dice que John Hunter fue el primero en operar un melanoma metastásico en 1787. Aunque no sabía exactamente de qué se trataba, lo describió como una "excrecencia fungosa cancerosa". El tumor extirpado se conservó en el Museo Hunterian del Real Colegio de Cirujanos de Inglaterra . No fue hasta 1968 que el examen microscópico del espécimen reveló que se trataba de un ejemplo de melanoma metastásico. [163]
El médico francés René Laennec fue el primero en describir el melanoma como una entidad patológica. Su informe se presentó inicialmente durante una conferencia para la Facultad de Medicina de París en 1804 y luego se publicó como boletín en 1806. [164]
El primer informe en inglés sobre melanoma fue presentado por un médico general inglés de Stourbridge, William Norris en 1820. [165] En su trabajo posterior en 1857, comentó que existe una predisposición familiar para el desarrollo de melanoma ( Ocho casos de melanosis con observaciones patológicas y terapéuticas sobre esa enfermedad ). Norris también fue pionero en sugerir un vínculo entre los nevos y el melanoma y la posibilidad de una relación entre el melanoma y las exposiciones ambientales, al observar que la mayoría de sus pacientes tenían tez pálida. [166] También describió que los melanomas podrían ser amelanóticos y más tarde mostró la naturaleza metastásica del melanoma al observar que pueden diseminarse a otros órganos viscerales.
El primer reconocimiento formal del melanoma avanzado como intratable provino de Samuel Cooper en 1840. Él afirmó que la única posibilidad de cura depende de la eliminación temprana de la enfermedad (es decir, la escisión temprana del lunar maligno)...' [167]
Más de un siglo y medio después esta situación sigue siendo prácticamente la misma.
Terminología
La palabra melanoma llegó al inglés a partir del neolatín del siglo XIX [168] y utiliza formas combinadas derivadas de raíces griegas antiguas : melano- (que denota melanina ) + -oma (que denota una masa de tejido y especialmente una neoplasia ), a su vez del griego μέλας melas , "oscuro", [169] y -ωμα oma , "proceso". La palabra melanoma tiene una larga historia de ser utilizada en un sentido más amplio para referirse a cualquier tumor melanocítico , típicamente, pero no siempre maligno, [170] [171] pero hoy en día el sentido más estricto que se refiere solo a los tipos malignos se ha vuelto tan dominante que los tumores benignos generalmente ya no se llaman melanomas y la palabra melanoma ahora generalmente se toma para significar melanoma maligno a menos que se especifique lo contrario. Términos como " tumor melanocítico benigno " etiquetan inequívocamente los tipos benignos, y las clasificaciones histopatológicas modernas de tumores utilizadas en medicina no utilizan la palabra para referirse a tumores benignos.
Investigación
La investigación farmacoterapéutica para el melanoma irresecable o metastásico está en curso. [172]
Terapias dirigidas
En la investigación clínica se están probando la terapia celular adoptiva y la terapia génica . [173]
Se han utilizado dos tipos de tratamientos experimentales desarrollados en el Instituto Nacional del Cáncer (NCI) en el melanoma metastásico con cierto éxito. [42]
El primer tratamiento consiste en la terapia celular adoptiva (ACT) con células inmunitarias TIL (linfocitos infiltrantes de tumores) aisladas del propio tumor de melanoma de la persona. [131] Estas células se cultivan en grandes cantidades en un laboratorio y se devuelven al paciente después de un tratamiento que reduce temporalmente las células T normales en el cuerpo del paciente. La terapia con TIL después de la linfodepleción puede dar como resultado una respuesta completa duradera en una variedad de configuraciones. [174] [175]
El segundo tratamiento, la transferencia adoptiva de linfocitos autólogos genéticamente alterados, depende de la administración de genes que codifican los llamados receptores de células T (TCR) a los linfocitos del paciente. [131] Después de esa manipulación, los linfocitos reconocen y se unen a ciertas moléculas que se encuentran en la superficie de las células del melanoma y las matan. [176]
Una vacuna contra el cáncer mostró un beneficio modesto en pruebas de última etapa en 2009 contra el melanoma. [177] [178]
Inhibidores de BRAF
Alrededor del 60% de los melanomas contienen una mutación en el gen B-Raf . Los primeros ensayos clínicos sugirieron que los inhibidores de B-Raf, incluido el vemurafenib de Plexxicon , podrían conducir a una regresión tumoral sustancial en la mayoría de los pacientes si su tumor contiene la mutación B-Raf. [179] En junio de 2011, un ensayo clínico a gran escala confirmó los hallazgos positivos de esos ensayos anteriores. [180] [181]
En agosto de 2011, la FDA aprobó el vemurafenib para el tratamiento del melanoma en etapa avanzada. En mayo de 2013, la FDA estadounidense aprobó el dabrafenib como tratamiento de agente único para pacientes con melanoma avanzado con mutación BRAF V600E positiva. [182]
Algunos investigadores creen que las terapias combinadas que bloquean simultáneamente múltiples vías pueden mejorar la eficacia al dificultar que las células tumorales muten antes de ser destruidas. En octubre de 2012, un estudio informó que la combinación de Dabrafenib con un inhibidor de MEK, trametinib, produjo resultados aún mejores. En comparación con Dabrafenib solo, la supervivencia libre de progresión aumentó del 9% al 41%, y la supervivencia libre de progresión media aumentó de 5,8 meses a 9,4 meses. Sin embargo, algunos efectos secundarios aumentaron en el estudio combinado. [183] [184]
En enero de 2014, la FDA aprobó la combinación de dabrafenib y trametinib para el tratamiento de personas con melanoma metastásico con mutación BRAF V600E/K. [185] En junio de 2018, la FDA aprobó la combinación de un inhibidor de BRAF, encorafenib , y un inhibidor de MEK, binimetinib, para el tratamiento del melanoma irresecable o metastásico con una mutación BRAF V600E o V600K. [186]
La resistencia final a los inhibidores de BRAF y MEK puede deberse a una proteína de la superficie celular conocida como EphA2 que actualmente se está investigando. [187]
Ipilimumab
En la Conferencia de la Sociedad Americana de Oncología Clínica en junio de 2010, la compañía farmacéutica Bristol Myers Squibb informó los hallazgos clínicos de su fármaco ipilimumab . El estudio encontró un aumento en la supervivencia media de 6,4 a 10 meses en pacientes con melanomas avanzados tratados con el monoclonal ipilimumab, frente a una vacuna experimental. También encontró una tasa de supervivencia de un año del 25% en el grupo de control que utilizó la vacuna, del 44% en el grupo de la vacuna y el ipilimumab, y del 46% en el grupo tratado con ipilimumab solo. [188] Sin embargo, algunos han expresado inquietudes sobre este estudio por su uso del brazo de control no convencional, en lugar de comparar el fármaco con un placebo o un tratamiento estándar. [189] [190] La crítica fue que, aunque el ipilimumab funcionó mejor que la vacuna, la vacuna no se ha probado antes y puede estar causando toxicidad, lo que hace que el fármaco parezca mejor en comparación.
La FDA aprobó el ipilimumab en marzo de 2011 para tratar a pacientes con melanoma en etapa avanzada que se ha propagado o que no se puede extirpar mediante cirugía. [191] [192] [193]
En junio de 2011, un ensayo clínico de ipilimumab más dacarbazina combinó este estimulante del sistema inmunitario con el fármaco de quimioterapia estándar que actúa sobre la división celular. El ensayo mostró un aumento de la supervivencia media de estos pacientes en fase avanzada a 11 meses en lugar de los 9 meses que se observan normalmente. Los investigadores también tenían la esperanza de mejorar la tasa de supervivencia a cinco años, aunque se observaron efectos secundarios adversos graves en algunos pacientes. Un tratamiento cuesta 120.000 dólares. La marca del fármaco es Yervoy. [180] [194]
Métodos de vigilancia
Los avances en la ecografía de alta resolución han permitido la vigilancia de la carga metastásica en los ganglios linfáticos centinela. [195] El ensayo de detección y vigilancia de la ecografía en el melanoma (SUNMEL) está evaluando la ecografía como una alternativa a los métodos quirúrgicos invasivos. [196]
Viroterapia oncolítica
En algunos países se estudian y utilizan métodos de viroterapia oncolítica para tratar el melanoma. La viroterapia oncolítica es una rama prometedora de la viroterapia , en la que se utilizan virus oncolíticos para tratar enfermedades; los virus pueden aumentar el metabolismo, reducir la inmunidad antitumoral y desorganizar la vasculatura. [197] Talimogene laherparepvec (T-VEC) (que es una inmunoterapia oncolítica derivada del virus del herpes simple tipo 1), demostró ser útil contra el melanoma metastásico en 2015 con un aumento de la supervivencia de 4,4 meses. [198] [12]
Antivirales
Los antirretrovirales se han probado in vitro contra el melanoma. La razón de ello radica en su potencial para inhibir los retrovirus endógenos humanos, cuya actividad se ha asociado con el desarrollo del melanoma. [199] [200] Los resultados en células malignas han demostrado una eficacia moderada y se esperan más avances mediante pruebas con modelos animales.
Notas
- ^ La incidencia es en comparación con todos los melanomas.
- ^ No se requiere una categoría N patológica para los melanomas T1. En tales casos, se puede utilizar la información N clínica.
Referencias
- ^ abcdefghijklm «Tratamiento del melanoma: para profesionales de la salud». Instituto Nacional del Cáncer . 26 de junio de 2015. Archivado desde el original el 4 de julio de 2015. Consultado el 30 de junio de 2015 .
- ^ abcdefghijklmnopqr Informe mundial sobre el cáncer (PDF) . Organización Mundial de la Salud. 2014. pp. Capítulo 5.14. ISBN 978-92-832-0429-9. Archivado (PDF) del original el 30 de mayo de 2014.
- ^ Goldstein BG, Goldstein AO (abril de 2001). "Diagnóstico y tratamiento del melanoma maligno". American Family Physician . 63 (7): 1359–68, 1374. PMID 11310650.
- ^ ab "Hojas informativas de SEER Stat: Melanoma de la piel". NCI . Archivado desde el original el 6 de julio de 2014.
- ^ ab Vos T, Allen C, Arora M, Barber RM, Bhutta ZA, Brown A, et al. (GBD 2015 Disease Injury Incidence Prevalence Collaborators) (octubre de 2016). "Incidencia, prevalencia y años vividos con discapacidad a nivel mundial, regional y nacional para 310 enfermedades y lesiones, 1990-2015: un análisis sistemático para el Estudio de la Carga Global de Enfermedades 2015". Lancet . 388 (10053): 1545–1602. doi :10.1016/S0140-6736(16)31678-6. PMC 5055577 . PMID 27733282.
- ^ ab Wang H, Naghavi M, Allen C, Barber RM, Bhutta ZA, Carter A, et al. (Colaboradores de causas de muerte de GBD 2015) (octubre de 2016). "Esperanza de vida global, regional y nacional, mortalidad por todas las causas y mortalidad por causas específicas para 249 causas de muerte, 1980-2015: un análisis sistemático para el Estudio de la carga mundial de enfermedades 2015". Lancet . 388 (10053): 1459–1544. doi :10.1016/s0140-6736(16)31012-1. PMC 5388903 . PMID 27733281.
- ^ Schwartzman RM, Orkin M (1962). Un estudio comparativo de las enfermedades del perro y del hombre . Springfield, IL: Thomas. pág. 85.
El término "melanoma" en medicina humana indica un crecimiento maligno; el prefijo "maligno" es redundante.
- ^ Bobonich M, Nolen ME (2015). Dermatología para médicos de práctica avanzada . Filadelfia: Wolters Kluwer. pág. 106.
El término melanoma maligno se está volviendo obsoleto porque la palabra "maligno" es redundante, ya que no existen melanomas benignos.
- ^ Diccionario médico de Farlex Partner. 2012. Archivado desde el original el 10 de junio de 2022. Consultado el 4 de marzo de 2021.
Evite la frase redundante melanoma maligno.
- ^ ab Kanavy HE, Gerstenblith MR (diciembre de 2011). "Radiación ultravioleta y melanoma". Seminarios en medicina y cirugía cutánea . 30 (4): 222–228. doi :10.1016/j.sder.2011.08.003 (inactivo el 27 de agosto de 2024). PMID 22123420.
{{cite journal}}: CS1 maint: DOI inactivo a partir de agosto de 2024 ( enlace ) - ^ ab Azoury SC, Lange JR (octubre de 2014). "Epidemiología, factores de riesgo, prevención y detección temprana del melanoma". The Surgical Clinics of North America . 94 (5): 945–62, vii. doi :10.1016/j.suc.2014.07.013. PMID 25245960.
- ^ ab Syn NL, Teng MW, Mok TS, Soo RA (diciembre de 2017). "Resistencia de novo y adquirida a la focalización de puntos de control inmunitario". The Lancet. Oncología . 18 (12): e731–e741. doi :10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ "Visualizaciones de datos de USCS". gis.cdc.gov . Archivado desde el original el 17 de marzo de 2020 . Consultado el 7 de marzo de 2020 .
Debe seleccionar "melanoma"
- ^ "CDC - ¿Cuáles son los síntomas del cáncer de piel?". www.cdc.gov . 26 de junio de 2018. Archivado desde el original el 7 de diciembre de 2018 . Consultado el 1 de febrero de 2019 .
- ^ Daniel Jensen J, Elewski BE (febrero de 2015). "La regla ABCDEF: combinación de la "regla ABCDE" y el "signo del patito feo" en un esfuerzo por mejorar los exámenes de autoevaluación de los pacientes". The Journal of Clinical and Aesthetic Dermatology . 8 (2): 15. PMC 4345927 . PMID 25741397.
- ^ "El EFG de los melanomas nodulares | MoleMap Nueva Zelanda". El EFG de los melanomas nodulares | MoleMap Nueva Zelanda . Archivado desde el original el 2 de febrero de 2019. Consultado el 1 de febrero de 2019 .
- ^ Fiddler IJ (octubre de 1995). "Melanoma Metastasis". Cancer Control . 2 (5): 398–404. doi : 10.1177/107327489500200503 . PMID 10862180.
- ^ abcdef «Factores de riesgo del melanoma». Mayo Clinic . Archivado desde el original el 10 de abril de 2017. Consultado el 10 de abril de 2017 .
- ^ ab Greene MH (diciembre de 1999). "La genética del melanoma y los nevos hereditarios. Actualización de 1998". Cancer . 86 (11 Suppl): 2464–2477. doi : 10.1002/(SICI)1097-0142(19991201)86:11+<2464::AID-CNCR3>3.0.CO;2-F . PMID 10630172. S2CID 32817426.
- ^ abc Goydos JS, Shoen SL (2016). "Melanoma lentiginoso acral". Melanoma . Tratamiento e investigación del cáncer. Vol. 167. págs. 321–9. doi :10.1007/978-3-319-22539-5_14. ISBN 978-3-319-22538-8. Número de identificación personal 26601870.
- ^ Perkins A, Duffy RL (junio de 2015). "Lunares atípicos: diagnóstico y tratamiento". American Family Physician . 91 (11): 762–767. PMID 26034853.
- ^ Boniol M, Autier P, Boyle P, Gandini S (julio de 2012). "Melanoma cutáneo atribuible al uso de camas solares: revisión sistemática y metanálisis". BMJ . 345 : e4757. doi :10.1136/bmj.e4757. PMC 3404185 . PMID 22833605.
- ^ El Ghissassi F, Baan R, Straif K, Grosse Y, Secretan B, Bouvard V, et al. (Grupo de trabajo de monografías de la Agencia Internacional de Investigación sobre el Cáncer de la OMS) (agosto de 2009). "Una revisión de carcinógenos humanos - parte D: radiación". The Lancet. Oncología . 10 (8): 751–752. doi : 10.1016/S1470-2045(09)70213-X . PMID 19655431.
- ^ Sanlorenzo M, Wehner MR, Linos E, Kornak J, Kainz W, Posch C, et al. (enero de 2015). "El riesgo de melanoma en pilotos de aerolíneas y tripulantes de cabina: un metaanálisis". JAMA Dermatology . 151 (1): 51–58. doi :10.1001/jamadermatol.2014.1077. PMC 4482339 . PMID 25188246.
- ^ Rünger TM, Farahvash B, Hatvani Z, Rees A (enero de 2012). "Comparación de las respuestas al daño del ADN tras dosis equimutagénicas de UVA y UVB: una detención del ciclo celular menos eficaz con UVA puede hacer que los dímeros de pirimidina inducidos por UVA sean más mutagénicos que los inducidos por UVB". Photochemical & Photobiological Sciences . 11 (1): 207–215. doi : 10.1039/c1pp05232b . PMID 22005748. S2CID 25209863.
- ^ Wang SQ, Setlow R, Berwick M, Polsky D, Marghoob AA, Kopf AW, et al. (mayo de 2001). "Ultravioleta A y melanoma: una revisión". Revista de la Academia Estadounidense de Dermatología . 44 (5): 837–846. doi :10.1067/mjd.2001.114594. PMID 11312434. S2CID 7655216.
- ^ Oliveria SA, Saraiya M, Geller AC, Heneghan MK, Jorgensen C (febrero de 2006). "Exposición al sol y riesgo de melanoma". Archivos de enfermedades en la infancia . 91 (2): 131–138. doi :10.1136 / adc.2005.086918. PMC 2082713. PMID 16326797.
- ^ Lee JA, Strickland D (mayo de 1980). "Melanoma maligno: estatus social y trabajo al aire libre". British Journal of Cancer . 41 (5): 757–763. doi :10.1038/bjc.1980.138. PMC 2010319 . PMID 7426301.
- ^ Pion IA, Rigel DS, Garfinkel L, Silverman MK, Kopf AW (enero de 1995). "Ocupación y riesgo de melanoma maligno". Cancer . 75 (2 Suppl): 637–644. doi :10.1002/1097-0142(19950115)75:2+<637::aid-cncr2820751404>3.0.co;2-#. PMID 7804988. S2CID 196354681.
- ^ "OMS | La Organización Mundial de la Salud recomienda que ninguna persona menor de 18 años utilice una cama solar". OMS . Archivado desde el original el 16 de junio de 2009.
- ^ Khlat M, Vail A, Parkin M, Green A (mayo de 1992). "Mortalidad por melanoma en migrantes a Australia: variación según la edad de llegada y la duración de la estancia". American Journal of Epidemiology . 135 (10): 1103–1113. doi :10.1093/oxfordjournals.aje.a116210. PMID 1632422.
- ^ "¿Podemos contraer cáncer de piel por las camas solares?". CuradermBCC . 1 de septiembre de 2022. Archivado desde el original el 3 de septiembre de 2022 . Consultado el 3 de septiembre de 2022 .
- ^ Soura E, Eliades PJ, Shannon K, Stratigos AJ, Tsao H (marzo de 2016). "Melanoma hereditario: actualización sobre síndromes y tratamiento: genética del síndrome de melanoma de lunares múltiples atípicos familiar". Revista de la Academia Estadounidense de Dermatología . 74 (3): 395–407, cuestionario 408–410. doi :10.1016/j.jaad.2015.08.038. PMC 4761105 . PMID 26892650.
- ^ Halachmi S, Gilchrest BA (marzo de 2001). "Actualización sobre eventos genéticos en la patogénesis del melanoma". Current Opinion in Oncology . 13 (2): 129–136. doi :10.1097/00001622-200103000-00008. PMID 11224711. S2CID 29876528.
- ^ "Inhibidor de la quinasa dependiente de ciclina CDKN2A 2A (melanoma, p16, inhibe CDK4)". Biblioteca Nacional de Medicina de Estados Unidos. Archivado desde el original el 17 de noviembre de 2004. Consultado el 4 de septiembre de 2017 .
- ^ Soura E, Eliades PJ, Shannon K, Stratigos AJ, Tsao H (marzo de 2016). "Melanoma hereditario: actualización sobre síndromes y tratamiento: genética del síndrome de melanoma de lunares múltiples atípicos familiar". Revista de la Academia Estadounidense de Dermatología . 74 (3): 395–407, cuestionario 408–10. doi :10.1016/j.jaad.2015.08.038. PMC 4761105 . PMID 26892650.
- ^ Firoz EF, Warycha M, Zakrzewski J, Pollens D, Wang G, Shapiro R, et al. (abril de 2009). "Asociación de MDM2 SNP309, edad de aparición y género en el melanoma cutáneo". Clinical Cancer Research . 15 (7): 2573–2580. doi :10.1158/1078-0432.CCR-08-2678. PMC 3881546 . PMID 19318491.
- ^ Bliss JM, Ford D, Swerdlow AJ, Armstrong BK, Cristofolini M, Elwood JM, et al. (agosto de 1995). "Riesgo de melanoma cutáneo asociado con características de pigmentación y pecas: revisión sistemática de 10 estudios de casos y controles. The International Melanoma Analysis Group (IMAGE)". International Journal of Cancer . 62 (4): 367–376. doi :10.1002/ijc.2910620402. PMID 7635560. S2CID 9539601.
- ^ Miller AJ, Mihm MC (julio de 2006). "Melanoma". The New England Journal of Medicine . 355 (1): 51–65. doi :10.1056/NEJMra052166. PMID 16822996.
- ^ Rhodes AR, Weinstock MA, Fitzpatrick TB, Mihm MC, Sober AJ (diciembre de 1987). "Factores de riesgo del melanoma cutáneo. Un método práctico para reconocer a los individuos predispuestos". JAMA . 258 (21): 3146–3154. doi :10.1001/jama.258.21.3146. PMID 3312689.
- ^ Ciarletta P, Foret L, Ben Amar M (marzo de 2011). "La fase de crecimiento radial del melanoma maligno: modelado multifásico, simulaciones numéricas y análisis de estabilidad lineal". Journal of the Royal Society, Interface . 8 (56): 345–368. doi :10.1098/rsif.2010.0285. PMC 3030817 . PMID 20656740.
- ^ ab Hershkovitz L, Schachter J, Treves AJ, Besser MJ (2010). "Enfoque en ensayos de transferencia de células T adoptivas en melanoma". Inmunología clínica y del desarrollo . 2010 : 260267. doi : 10.1155/2010/260267 . PMC 3018069. PMID 21234353 .
- ^ Spatz A, Gimotty PA, Cook MG, van den Oord JJ, Desai N, Eggermont AM, et al. (2007). "Actas de la reunión anual de la ASCO, parte I. Resumen: Efecto protector de un infiltrado linfocítico con una rápida infiltración tumoral en el melanoma: un estudio del grupo de melanoma de la EORTC" . Journal of Clinical Oncology . 25 (18S): 8519. doi :10.1200/jco.2007.25.18_suppl.8519. Archivado desde el original el 25 de julio de 2011.
- ^ Davies MA, Samuels Y (octubre de 2010). "Análisis del genoma para personalizar la terapia del melanoma". Oncogene . 29 (41): 5545–5555. doi :10.1038/onc.2010.323. PMC 3169242 . PMID 20697348.
- ^ Barrett JC (1991). "Mutagénesis y carcinogénesis" . En Brugge J , Curran T , Harlow E y McCormick F (eds.). Orígenes del cáncer humano . Cold Spring Harbor Press. ISBN 0-87969-404-1– vía Internet Archive.
- ^ Sage E, Girard PM, Francesconi S (enero de 2012). "Descifrando la mutagénesis inducida por rayos UVA". Photochemical & Photobiological Sciences . 11 (1): 74–80. doi : 10.1039/c1pp05219e . PMID 21901217. S2CID 45189513.
- ^ Budden T, Bowden NA (enero de 2013). "El papel de la reparación por escisión de nucleótidos alterados y el daño del ADN inducido por UVB en la melanomagénesis". Revista internacional de ciencias moleculares . 14 (1): 1132–1151. doi : 10.3390/ijms14011132 . PMC 3565312 . PMID 23303275.
- ^ Berger MF, Hodis E, Heffernan TP, Deribe YL, Lawrence MS, Protopopov A, et al. (mayo de 2012). "La secuenciación del genoma del melanoma revela mutaciones frecuentes en PREX2". Nature . 485 (7399): 502–506. Bibcode :2012Natur.485..502B. doi :10.1038/nature11071. PMC 3367798 . PMID 22622578.
- ^ Roach JC, Glusman G, Smit AF, Huff CD, Hubley R, Shannon PT, et al. (abril de 2010). "Análisis de la herencia genética en un cuarteto familiar mediante secuenciación del genoma completo". Science . 328 (5978): 636–639. Bibcode :2010Sci...328..636R. doi :10.1126/science.1186802. PMC 3037280 . PMID 20220176.
- ^ Campbell CD, Chong JX, Malig M, Ko A, Dumont BL, Han L, et al. (noviembre de 2012). "Estimación de la tasa de mutación humana mediante autocigosidad en una población fundadora". Nature Genetics . 44 (11): 1277–1281. doi :10.1038/ng.2418. PMC 3483378 . PMID 23001126.
- ^ ab "El proteoma patológico humano en el melanoma – Atlas de proteínas humanas". www.proteinatlas.org . Archivado desde el original el 2 de octubre de 2017 . Consultado el 2 de octubre de 2017 .
- ^ ab Uhlen M, Zhang C, Lee S, Sjöstedt E, Fagerberg L, Bidkhori G, et al. (Agosto de 2017). "Un atlas de patología del transcriptoma del cáncer humano". Ciencia . 357 (6352): ean2507. doi : 10.1126/ciencia.aan2507 . PMID 28818916. S2CID 206659235.
- ^ Ellrott K, Bailey MH, Saksena G, Covington KR, Kandoth C, Stewart C, et al. (marzo de 2018). "Enfoque científico abierto escalable para la identificación de mutaciones de exomas tumorales utilizando múltiples canales genómicos". Cell Systems . 6 (3): 271–281.e7. doi :10.1016/j.cels.2018.03.002. PMC 6075717 . PMID 29596782.
- ^ Leslie MC, Bar-Eli M (enero de 2005). "Regulación de la expresión génica en el melanoma: nuevos enfoques para el tratamiento". Journal of Cellular Biochemistry . 94 (1): 25–38. doi :10.1002/jcb.20296. PMID 15523674. S2CID 23515325.
- ^ Bhoumik A, Singha N, O'Connell MJ, Ronai ZA (junio de 2008). "La regulación de TIP60 por ATF2 modula la activación de ATM". The Journal of Biological Chemistry . 283 (25): 17605–17614. doi : 10.1074/jbc.M802030200 . PMC 2427333 . PMID 18397884.
- ^ Bhoumik A, Jones N, Ronai Z (marzo de 2004). "El cambio transcripcional mediante la activación del péptido derivado del factor de transcripción 2 sensibiliza a las células de melanoma a la apoptosis e inhibe su tumorigenicidad". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 101 (12): 4222–4227. Bibcode :2004PNAS..101.4222B. doi : 10.1073/pnas.0400195101 . PMC 384722 . PMID 15010535.
- ^ Vlahopoulos SA, Logotheti S, Mikas D, Giarika A, Gorgoulis V, Zoumpourlis V (abril de 2008). "El papel de ATF-2 en la oncogénesis". Bioensayos . 30 (4): 314–327. doi :10.1002/bies.20734. PMID 18348191. S2CID 678541.
- ^ Huang Y, Minigh J, Miles S, Niles RM (febrero de 2008). "El ácido retinoico disminuye la fosforilación de ATF-2 y sensibiliza a las células de melanoma a la inhibición del crecimiento mediada por taxol". Journal of Molecular Signaling . 3 : 3. doi : 10.1186/1750-2187-3-3 . PMC 2265711 . PMID 18269766.
- ^ Parmiani G (marzo de 2016). "Células madre del cáncer de melanoma: marcadores y funciones". Cánceres . 8 (3): 34. doi : 10.3390/cancers8030034 . PMC 4810118 . PMID 26978405.
- ^ ab Akbani R, Akdemir KC, Aksoy BA, Albert M, Ally A, Amin SB, et al. (Red del Atlas del Genoma del Cáncer) (junio de 2015). "Clasificación genómica del melanoma cutáneo". Cell . 161 (7): 1681–1696. doi :10.1016/j.cell.2015.05.044. PMC 4580370 . PMID 26091043.
- ^ Ascierto PA, Kirkwood JM, Grob JJ, Simeone E, Grimaldi AM, Maio M, et al. (julio de 2012). "El papel de la mutación BRAF V600 en el melanoma". Journal of Translational Medicine . 10 (1): 85. doi : 10.1186/1479-5876-10-85 . PMC 3391993 . PMID 22554099.
- ^ Botton T, Talevich E, Mishra VK, Zhang T, Shain AH, Berquet C, et al. (octubre de 2019). "La heterogeneidad genética de las quinasas de fusión BRAF en el melanoma afecta las respuestas a los fármacos". Informes celulares . 29 (3): 573–588.e7. doi :10.1016/j.celrep.2019.09.009. PMC 6939448 . PMID 31618628.
- ^ McEvoy CR, Xu H, Smith K, Etemadmoghadam D, San Leong H, Choong DY, et al. (mayo de 2019). "Respuesta profunda del inhibidor de MEK en un melanoma cutáneo que alberga una fusión GOLGA4-RAF1". The Journal of Clinical Investigation . 129 (5): 1940–1945. doi :10.1172/JCI123089. PMC 6486352 . PMID 30835257.
- ^ Wiesner T, He J, Yelensky R, Esteve-Puig R, Botton T, Yeh I, et al. (mayo de 2014). "Las fusiones de quinasas son frecuentes en tumores de Spitz y melanomas spitzoides". Nature Communications . 5 (1): 3116. Bibcode :2014NatCo...5.3116W. doi :10.1038/ncomms4116. PMC 4084638 . PMID 24445538.
- ^ Yeh I, Tee MK, Botton T, Shain AH, Sparatta AJ, Gagnon A, et al. (noviembre de 2016). "Fusiones de la quinasa NTRK3 en tumores de Spitz". The Journal of Pathology . 240 (3): 282–290. doi :10.1002/path.4775. PMC 5071153 . PMID 27477320.
- ^ Yeh I, Botton T, Talevich E, Shain AH, Sparatta AJ, de la Fouchardiere A, et al. (mayo de 2015). "Activación de reordenamientos de la quinasa MET en melanoma y tumores de Spitz". Nature Communications . 6 (1): 7174. Bibcode :2015NatCo...6.7174Y. doi : 10.1038/ncomms8174 . PMC 4446791 . PMID 26013381.
- ^ ab Sarna M, Krzykawska-Serda M, Jakubowska M, Zadlo A, Urbanska K (junio de 2019). "La presencia de melanina inhibe la propagación de células de melanoma en ratones de una forma mecánica única". Informes científicos . 9 (1): 9280. Código bibliográfico : 2019NatSR...9.9280S. doi :10.1038/s41598-019-45643-9. PMC 6594928 . PMID 31243305.
- ^ ab Wurm EM, Soyer HP (octubre de 2010). "Exploración para melanoma". Australian Prescriber . 33 : 150–55. doi : 10.18773/austprescr.2010.070 .
- ^ "Prevención: ABCD del melanoma". Fundación Estadounidense del Melanoma. Archivado desde el original el 23 de abril de 2003.
- ^ Friedman RJ, Rigel DS, Kopf AW (1985). "Detección temprana del melanoma maligno: el papel del examen médico y el autoexamen de la piel". CA . 35 (3): 130–151. doi : 10.3322/canjclin.35.3.130 . PMID 3921200. S2CID 20787489.
- ^ Dinnes J, Deeks JJ, Grainge MJ, Chuchu N, Ferrante di Ruffano L, Matin RN, et al. (diciembre de 2018). "Inspección visual para el diagnóstico del melanoma cutáneo en adultos". Base de datos Cochrane de revisiones sistemáticas . 2018 (12): CD013194. doi :10.1002/14651858.CD013194. PMC 6492463. PMID 30521684 .
- ^ Dinnes J, Deeks JJ, Chuchu N, Ferrante di Ruffano L, Matin RN, Thomson DR, et al. (diciembre de 2018). "Dermatoscopia, con y sin inspección visual, para diagnosticar el melanoma en adultos". Base de datos Cochrane de revisiones sistemáticas . 2018 (12): CD011902. doi :10.1002/14651858.CD011902.pub2. PMC 6517096. PMID 30521682 .
- ^ Dinnes J, Deeks JJ, Saleh D, Chuchu N, Bayliss SE, Patel L, et al. (Grupo Cochrane de Piel) (diciembre de 2018). "Microscopía confocal de reflectancia para el diagnóstico del melanoma cutáneo en adultos". Base de Datos Cochrane de Revisiones Sistemáticas . 12 (12): CD013190. doi :10.1002/14651858.CD013190. PMC 6492459 . PMID 30521681.
- ^ ab Mascaro JM, Mascaro JM (noviembre de 1998). "La posición del dermatólogo ante los nevos: una visión que va desde "el patito feo" hasta "la caperucita roja"". Archivos de Dermatología . 134 (11): 1484–1485. doi :10.1001/archderm.134.11.1484. PMID 9828892.
- ^ ab "Introducción a la dermatoscopia". DermNet Nueva Zelanda. Archivado desde el original el 7 de mayo de 2009.
- ^ Montgomery BD, Sadler GM (enero de 2009). "La biopsia por punción de lesiones pigmentadas es potencialmente peligrosa". Canadian Family Physician . 55 (1): 24, respuesta del autor 24. PMC 2628830 . PMID 19155361.
- ^ Luk PP, Vilain R, Crainic O, McCarthy SW, Thompson JF, Scolyer RA (agosto de 2015). "Biopsia por punción de melanoma que provoca implantación de células tumorales: otro peligro de utilizar biopsias parciales para tumores melanocíticos". The Australasian Journal of Dermatology . 56 (3): 227–231. doi :10.1111/ajd.12333. PMID 25827527. S2CID 2510803.
- ^ Lin SW, Kaye V, Goldfarb N, Rawal A, Warshaw E (julio de 2012). "Siembra de tumores de melanoma después de una biopsia por punción". Dermatologic Surgery . 38 (7 Pt 1): 1083–1085. doi :10.1111/j.1524-4725.2012.02384.x. PMID 22471244. S2CID 3431248.
- ^ Martin RC, Scoggins CR, Ross MI, Reintgen DS, Noyes RD, Edwards MJ, et al. (diciembre de 2005). "¿Es perjudicial la biopsia incisional del melanoma?". American Journal of Surgery . 190 (6): 913–917. doi :10.1016/j.amjsurg.2005.08.020. PMID 16307945.
- ^ Yamashita Y, Hashimoto I, Abe Y, Seike T, Okawa K, Senzaki Y, et al. (marzo de 2014). "Efecto de la técnica de biopsia en la tasa de supervivencia de pacientes con melanoma maligno". Archivos de Cirugía Plástica . 41 (2): 122–125. doi :10.5999/aps.2014.41.2.122. PMC 3961608 . PMID 24665419.
- ^ Mills SE (marzo de 2002). "Neoplasias neuroectodérmicas de cabeza y cuello con énfasis en carcinomas neuroendocrinos". Patología moderna . 15 (3): 264–278. doi : 10.1038/modpathol.3880522 . PMID 11904342. S2CID 34498802.
- ^ ab Ferri F (2019). "Melanoma". Asesor clínico de Ferri 2019: 5 libros en 1. Filadelfia, PA: Elsevier. pág. 805. ISBN 978-0-323-52957-0. OCLC 1040695302. Archivado desde el original el 4 de agosto de 2020.
- ^ Xiong M, Charifa A, Chen CS (2020). "Lentigo Maligno Melanoma". Cáncer, Lentigo Maligno Melanoma. Estadísticas de perlas. PMID 29489150. Archivado desde el original el 8 de marzo de 2021 . Consultado el 13 de febrero de 2020 a través del Centro Nacional de Información Biotecnológica.Última actualización: 18 de mayo de 2019.
- ^ Piliang MP (septiembre de 2009). "Melanoma lentiginoso acral". Clínicas de patología quirúrgica . 2 (3): 535–541. doi :10.1016/j.path.2009.08.005. PMID 26838538.
- ^ McKenna JK, Florell SR, Goldman GD, Bowen GM (abril de 2006). "Lentigo maligno/lentigo maligno melanoma: estado actual del diagnóstico y tratamiento". Dermatologic Surgery . 32 (4): 493–504. doi :10.1111/j.1524-4725.2006.32102.x. PMID 16681656. S2CID 8312676.
- ^ "Afecciones precancerosas de la piel". Sociedad Canadiense del Cáncer . Archivado desde el original el 3 de agosto de 2020. Consultado el 26 de febrero de 2020 .
- ^ Fleming C (2010). "Cómo tratar a los pacientes con lentigo maligno". Melanoma Research . 20 : e26. doi :10.1097/01.cmr.0000382797.99333.66. ISSN 0960-8931. S2CID 71464540.
- ^ Hale CS. "Tumor melanocítico de la piel - Melanoma - Melanoma in situ". Esquemas de patología . Archivado desde el original el 26 de febrero de 2020. Consultado el 26 de febrero de 2020 .Tema finalizado: 1 de mayo de 2013. Revisado: 23 de mayo de 2019
- ^ Park HS, Cho KH (abril de 2010). "Melanoma lentiginoso acral in situ: un desafío de diagnóstico y tratamiento". Cánceres . 2 (2): 642–652. doi : 10.3390/cancers2020642 . PMC 3835096 . PMID 24281086.
- ^ Weight RM, Viator JA, Dale PS, Caldwell CW, Lisle AE (octubre de 2006). "Detección fotoacústica de células de melanoma metastásico en el sistema circulatorio humano". Optics Letters . 31 (20): 2998–3000. Bibcode :2006OptL...31.2998W. doi :10.1364/OL.31.002998. PMID 17001379.
- ^ Dinnes J, Ferrante di Ruffano L, Takwoingi Y, Cheung ST, Nathan P, Matin RN, et al. (Grupo Cochrane de Piel) (julio de 2019). "Ultrasonido, TC, RMN o PET-TC para la estadificación y reestadificación de adultos con melanoma cutáneo". Base de Datos Cochrane de Revisiones Sistemáticas . 2019 (7): CD012806. doi : 10.1002 /14651858.CD012806.pub2. PMC 6601698. PMID 31260100.
- ^ abcde Gershenwald JE, Scolyer RA, Hess KR, Sondak VK, Long GV, Ross MI, et al. (noviembre de 2017). "Estadificación del melanoma: cambios basados en evidencia en el manual de estadificación del cáncer de la octava edición del Comité Conjunto Estadounidense sobre Cáncer". CA . 67 (6): 472–492. doi :10.3322/caac.21409. PMC 5978683 . PMID 29028110. , citando
a Amin MB, Edge SB, Greene FL, et al, eds. AJCC Cancer Staging Manual. 8.ª ed. Nueva York: Springer International Publishing; 2017:563‐585). - ^ Johansson M, Brodersen J, Gøtzsche PC, Jørgensen KJ, et al. (Grupo Cochrane de Piel) (junio de 2019). "Cribado para reducir la morbilidad y la mortalidad en el melanoma maligno". Base de datos Cochrane de revisiones sistemáticas . 2019 (6): CD012352. doi :10.1002/14651858.CD012352.pub2. PMC 6545529. PMID 31157404 .
- ^ Autier P (octubre de 2005). "Melanoma maligno cutáneo: datos sobre las camas solares y los protectores solares". Revisión experta de la terapia contra el cáncer . 5 (5): 821–833. doi :10.1586/14737140.5.5.821. PMID 16221052. S2CID 6091309.
- ^ Clough-Gorr KM, Titus-Ernstoff L, Perry AE, Spencer SK, Ernstoff MS (septiembre de 2008). "Exposición a lámparas solares, camas solares y riesgo de melanoma". Cancer Causes & Control . 19 (7): 659–669. doi :10.1007/s10552-008-9129-6. PMC 6367654 . PMID 18273687.
- ^ ab Shihab N, Lim HW (noviembre de 2018). "Potencial riesgo carcinogénico cutáneo de la exposición a la lámpara UV para uñas: una revisión". Fotodermatología, fotoinmunología y fotomedicina . 34 (6): 362–365. doi : 10.1111/phpp.12398 . PMID: 29882991. S2CID: 46958616.
- ^ ab O'Sullivan NA, Tait CP (mayo de 2014). "Uso de camas solares y lámparas de uñas y riesgo de neoplasias cutáneas: una revisión de la literatura". The Australasian Journal of Dermatology . 55 (2): 99–106. doi :10.1111/ajd.12145. PMID 24592921. S2CID 206984768.
- ^ Greinert R, de Vries E, Erdmann F, Espina C, Auvinen A, Kesminiene A, et al. (diciembre de 2015). "Código europeo contra el cáncer, 4.ª edición: radiación ultravioleta y cáncer". Epidemiología del cáncer . 39 (Supl. 1): S75–S83. doi : 10.1016/j.canep.2014.12.014 . hdl : 1765/86460 . PMID: 26096748.
- ^ "¿Se puede prevenir el melanoma?". Archivado desde el original el 27 de junio de 2006.
- ^ Burnett ME, Wang SQ (abril de 2011). "Controversias actuales sobre los protectores solares: una revisión crítica". Fotodermatología, fotoinmunología y fotomedicina . 27 (2): 58–67. doi :10.1111/j.1600-0781.2011.00557.x. PMID 21392107. S2CID 29173997.
- ^ Planta MB (1 de noviembre de 2011). "Protector solar y melanoma: ¿es correcto nuestro mensaje de prevención?". Journal of the American Board of Family Medicine . 24 (6): 735–739. doi : 10.3122/jabfm.2011.06.100178 . PMID 22086817. S2CID 1477485.
- ^ Dellavalle RP, Drake A, Graber M, Heilig LF, Hester EJ, Johnson KR, et al. (octubre de 2005). "Estatinas y fibratos para prevenir el melanoma" . Base de datos Cochrane de revisiones sistemáticas . 2014 (4): CD003697. doi :10.1002/14651858.CD003697.pub2. PMC 11102950. PMID 16235336. Archivado desde el original el 4 de julio de 2018. Consultado el 3 de julio de 2018 .
- ^ Freeman SR, Drake AL, Heilig LF, Graber M, McNealy K, Schilling LM, et al. (noviembre de 2006). "Estatinas, fibratos y riesgo de melanoma: una revisión sistemática y un metanálisis". Journal of the National Cancer Institute . 98 (21): 1538–1546. doi : 10.1093/jnci/djj412 . PMID 17077356.
- ^ "El procedimiento de biopsia del ganglio centinela en el melanoma no ofrece una ventaja en la supervivencia". Melanoma maligno. 8 de enero de 2008. Archivado desde el original el 11 de julio de 2012. Consultado el 13 de agosto de 2012 .
- ^ Kyrgidis A, Tzellos T, Mocellin S, Apalla Z, Lallas A, Pilati P, et al. (mayo de 2015). "Biopsia del ganglio linfático centinela seguida de disección del ganglio linfático para el melanoma cutáneo primario localizado". Base de datos Cochrane de revisiones sistemáticas . 2015 (5): CD010307. doi :10.1002/14651858.CD010307.pub2. PMC 6461196. PMID 25978975 .
- ^ Clark GS, Pappas-Politis EC, Cherpelis BS, Messina JL, Möller MG, Cruse CW, et al. (julio de 2008). "Tratamiento quirúrgico del melanoma in situ en piel crónicamente dañada por el sol". Cancer Control . 15 (3): 216–224. doi : 10.1177/107327480801500304 . PMID 18596673.
- ^ Balch CM, Urist MM, Karakousis CP, Smith TJ, Temple WJ, Drzewiecki K, et al. (septiembre de 1993). "Eficacia de márgenes quirúrgicos de 2 cm para melanomas de espesor intermedio (1 a 4 mm). Resultados de un ensayo quirúrgico aleatorizado multiinstitucional". Annals of Surgery . 218 (3): 262–7, discusión 267–9. doi :10.1097/00000658-199309000-00005. PMC 1242959 . PMID 8373269.
- ^ Sladden MJ, Balch C, Barzilai DA, Berg D, Freiman A, Handiside T, et al. (octubre de 2009). "Márgenes de escisión quirúrgica para el melanoma cutáneo primario". Base de datos Cochrane de revisiones sistemáticas . 129 (4): CD004835. doi :10.1002/14651858.CD004835.pub2. PMID 19821334.
- ^ ab Mohs FE, Mikhail GR (enero de 1991). Cirugía micrográfica de Mohs. WB Saunders. págs. 13-14. ISBN 978-0-7216-3415-9Archivado desde el original el 7 de enero de 2016.
- ^ ab Bene NI, Healy C, Coldiron BM (mayo de 2008). "La cirugía micrográfica de Mohs es precisa el 95,1 % de las veces para el melanoma in situ: un estudio prospectivo de 167 casos". Cirugía dermatológica . 34 (5): 660–664. doi :10.1111/j.1524-4725.2007.34124.x. PMID 18261099. S2CID 23386371.
Se ha informado de una tasa de curación de hasta el 98 % para el melanoma in situ pequeño y de hasta el 95 % para la variante maligna de lentigo de melanona in situ con
la cirugía de Mohs
.
- ^ "Ensayo de detección y vigilancia del melanoma mediante ecografía (SUNMEL)". Archivado desde el original el 6 de enero de 2009.
- ^ Crowson AN, Haskell H (octubre de 2013). "El papel de la biopsia del ganglio linfático centinela en el tratamiento del melanoma cutáneo". Giornale Italiano di Dermatologia e Venereologia . 148 (5): 493–499. PMID 24005142.
- ^ Ross MI, Gershenwald JE (mayo-junio de 2013). "Biopsia del ganglio linfático centinela para el melanoma: una actualización crítica para los dermatólogos después de dos décadas de experiencia". Clinics in Dermatology . 31 (3): 298–310. doi :10.1016/j.clindermatol.2012.08.004. PMID 23608449.
- ^ abcd American Academy of Dermatology (febrero de 2013), "Cinco cosas que los médicos y los pacientes deberían cuestionar", Choosing Wisely : an initiative of the ABIM Foundation , American Academy of Dermatology , archivado desde el original el 1 de diciembre de 2013 , consultado el 5 de diciembre de 2013, que cita:
- Bichakjian CK, Halpern AC, Johnson TM, Foote Hood A, Grichnik JM, Swetter SM, et al. (Academia Estadounidense de Dermatología) (noviembre de 2011). "Pautas de atención para el tratamiento del melanoma cutáneo primario. Academia Estadounidense de Dermatología". Revista de la Academia Estadounidense de Dermatología . 65 (5): 1032–1047. doi : 10.1016/j.jaad.2011.04.031 . hdl : 20.500.12749/1682 . PMID 21868127.
- Comité Conjunto Estadounidense sobre Cáncer (2010). Edge SB (ed.). Manual de estadificación del cáncer del AJCC (7.ª ed.). Springer. ISBN 978-0-387-88440-0.
- National Comprehensive Cancer Network (2012), Pautas de práctica clínica en oncología de la National Comprehensive Cancer Network (NCCN Guidelines): melanoma (PDF) , Fort Washington, Pennsylvania : National Comprehensive Cancer Network, archivado desde el original (PDF) el 28 de diciembre de 2013 , consultado el 5 de diciembre de 2013

- ^ ab van Kempen LC, Redpath M, Robert C, Spatz A (noviembre de 2014). "Patología molecular del melanoma cutáneo". Melanoma Management . 1 (2): 151–164. doi :10.2217/mmt.14.23. PMC 6094595 . PMID 30190820.
- ^ ab Brunner G, Reitz M, Heinecke A, Lippold A, Berking C, Suter L, et al. (febrero de 2013). "Una firma de nueve genes que predice el resultado clínico en el melanoma cutáneo". Revista de investigación del cáncer y oncología clínica . 139 (2): 249–258. doi :10.1007/s00432-012-1322-z. PMID 23052696. S2CID 20257709.
- ^ Swanson NA, Lee KK, Gorman A, Lee HN (octubre de 2002). "Técnicas de biopsia. Diagnóstico del melanoma". Clínicas dermatológicas . 20 (4): 677–680. doi :10.1016/S0733-8635(02)00025-6. PMID 12380054.
- ^ Thomas D, Bello DM (marzo de 2021). "Inmunoterapia adyuvante para el melanoma". Revista de oncología quirúrgica . 123 (3): 789–797. doi :10.1002/jso.26329. ISSN 0022-4790. PMID 33595889. S2CID 231943836.
- ^ Kirkwood JM, Strawderman MH, Ernstoff MS, Smith TJ, Borden EC, Blum RH (enero de 1996). "Terapia adyuvante con interferón alfa-2b del melanoma cutáneo resecado de alto riesgo: el ensayo EST 1684 del Eastern Cooperative Oncology Group". Journal of Clinical Oncology . 14 (1): 7–17. doi :10.1200/JCO.1996.14.1.7. PMID 8558223. S2CID 24020903.
- ^ Mocellin S, Lens MB, Pasquali S, Pilati P, Chiarion Sileni V (junio de 2013). "Interferón alfa para el tratamiento adyuvante del melanoma cutáneo". Base de datos Cochrane de revisiones sistemáticas . 2013 (6): CD008955. doi :10.1002/14651858.CD008955.pub2. PMC 10773707. PMID 23775773. Archivado desde el original el 12 de junio de 2018. Consultado el 11 de junio de 2018 .
- ^ Wheatley K, Ives N, Eggermont A, Kirkwood J, Cascinelli N, Markovic SN, et al. (2007). "Interferón-α como terapia adyuvante para el melanoma: un metaanálisis de ensayos aleatorizados en pacientes individuales". J Clin Oncol . 25 (18 Suppl): 8526. doi :10.1200/jco.2007.25.18_suppl.8526.
- ^ Kirkwood JM, Ibrahim JG, Sondak VK, Richards J, Flaherty LE, Ernstoff MS, et al. (junio de 2000). "Interferón alfa-2b en dosis altas y bajas en melanoma de alto riesgo: primer análisis del ensayo intergrupal E1690/S9111/C9190". Journal of Clinical Oncology . 18 (12): 2444–2458. doi :10.1200/JCO.2000.18.12.2444. PMID 10856105.
- ^ Kirkwood JM, Ibrahim JG, Sondak VK, Ernstoff MS, Ross M (marzo de 2002). "Interferón alfa-2a para metástasis de melanoma". Lancet . 359 (9310): 978–979. doi :10.1016/S0140-6736(02)08001-7. PMID 11918944. S2CID 33866115.
- ^ abcdefghijklm Pasquali S, Hadjinicolaou AV, Chiarion Sileni V, Rossi CR, Mocellin S (febrero de 2018). "Tratamientos sistémicos para el melanoma cutáneo metastásico". Base de Datos Cochrane de Revisiones Sistemáticas . 2 (2): CD011123. doi :10.1002/14651858.CD011123.pub2. PMC 6491081 . PMID 29405038.
- ^ Ryden V, El-Naggar AI, Koliadi A, Ladjevardi CO, Digkas E, Valachis A, et al. (29 de diciembre de 2023). "El papel de la terapia con dacarbazina y temozolomida después del tratamiento con inhibidores de puntos de control inmunitarios en pacientes con melanoma maligno: una serie de casos y un metanálisis". Pigment Cell & Melanoma Research . 37 (3): 352–362. doi : 10.1111/pcmr.13156 . ISSN 1755-1471. PMID 38158376.
- ^ Garbe C, Terheyden P, Keilholz U, Kölbl O, Hauschild A (5 de diciembre de 2008). "Tratamiento del Melanoma". Deutsches Ärzteblatt Internacional . 105 (49): 845–851. doi :10.3238/arztebl.2008.0845. ISSN 1866-0452. PMC 2689638 . PMID 19561811.
- ^ O'Donoghue C, Perez MC, Mullinax JE, Hardman D, Sileno S, Naqvi SM, et al. (diciembre de 2017). "Infusión aislada de miembros: una experiencia en un solo centro con más de 200 infusiones". Anales de oncología quirúrgica . 24 (13): 3842–3849. doi :10.1245/s10434-017-6107-9. PMC 7771340 . PMID 29019175. S2CID 28907006.
- ^ Giles MH, Coventry BJ (agosto de 2013). "Quimioterapia de infusión aislada en extremidades para el melanoma: una descripción general de la experiencia temprana en la Unidad de Melanoma de Adelaida". Cancer Management and Research . 5 : 243–249. doi : 10.2147/cmar.s45746 . PMC 3753062 . PMID 23990731.
- ^ Berger M, Richtig G, Kashofer K, Aigelsreiter A, Richtig E (junio de 2018). "La ventana de oportunidades para la terapia dirigida en el melanoma BRAFwt/NRASwt/KITwt: implicaciones biológicas y clínicas de las proteínas de fusión y otras mutaciones". Giornale Italiano di Dermatologia e Venereologia . 153 (3): 349–360. doi :10.23736/S0392-0488.18.05970-9. PMID 29600692.
- ^ Broussard L, Howland A, Ryu S, Song K, Norris D, Armstrong CA, et al. (septiembre de 2018). "Mecanismos de muerte celular en melanoma". Revista médica de Chonnam . 54 (3): 135–142. doi :10.4068/cmj.2018.54.3.135. PMC 6165917 . PMID 30288368.
- ^ abcd Maverakis E, Cornelius LA, Bowen GM, Phan T, Patel FB, Fitzmaurice S, et al. (mayo de 2015). "Melanoma metastásico: una revisión de las opciones de tratamiento actuales y futuras". Acta Dermato-Venereologica . 95 (5): 516–524. doi : 10.2340/00015555-2035 . PMID 25520039.
- ^ Kuske M, Westphal D, Wehner R, Schmitz M, Beissert S, Praetorius C, et al. (octubre de 2018). "Efectos inmunomoduladores de los inhibidores de BRAF y MEK: implicaciones para la terapia del melanoma". Investigación farmacológica . 136 : 151–159. doi : 10.1016/j.phrs.2018.08.019 . PMID 30145328. S2CID 207369519.
- ^ abc Rebecca VW, Herlyn M (2020). "Mecanismos no genéticos de resistencia a fármacos en el melanoma". Revisión anual de biología del cáncer . 4 : 315–330. doi : 10.1146/annurev-cancerbio-030419-033533 .
- ^ "La FDA aprueba la primera terapia celular para tratar a pacientes con melanoma irresecable o metastásico". Administración de Alimentos y Medicamentos de Estados Unidos (nota de prensa). 16 de febrero de 2024. Consultado el 18 de febrero de 2024 .
- ^ "Amtagvi (lifileucel) de Iovance recibe la aprobación acelerada de la FDA de EE. UU. para el melanoma avanzado" (Comunicado de prensa). Iovance Biotherapeutics Inc. 16 de febrero de 2024. Consultado el 18 de febrero de 2024 a través de GlobeNewswire.
- ^ abc Sanlorenzo M, Vujic I, Posch C, Dajee A, Yen A, Kim S, et al. (junio de 2014). "Inmunoterapia contra el melanoma". Cancer Biology & Therapy . 15 (6): 665–674. doi :10.4161/cbt.28555. PMC 4049781 . PMID 24651672.
- ^ Dranitsaris G, Zhu X, Adunlin G, Vincent MD (agosto de 2018). "Relación coste-eficacia frente a asequibilidad en la era de los fármacos inmunooncológicos contra el cáncer". Revisión experta de la investigación sobre farmacoeconomía y resultados . 18 (4): 351–357. doi :10.1080/14737167.2018.1467270. PMID 29681201. S2CID 5079628.
- ^ abcd West HJ (abril de 2015). "Página para pacientes de JAMA Oncology. Inhibidores de puntos de control inmunitario". JAMA Oncology . 1 (1): 115. doi :10.1001/jamaoncol.2015.0137. PMID 26182315.
- ^ "Interleucina-2 (IL2) para el melanoma metastásico". Melanoma Research Alliance . Consultado el 5 de octubre de 2022 .
- ^ Buzaid AC (octubre de 2004). "Manejo del melanoma cutáneo metastásico". Oncología . 18 (11): 1443–50, discusión 1457–9. PMID 15609471.
- ^ Rosenberg SA, Restifo NP (abril de 2015). "Transferencia celular adoptiva como inmunoterapia personalizada para el cáncer humano". Science . 348 (6230): 62–68. Bibcode :2015Sci...348...62R. doi :10.1126/science.aaa4967. PMC 6295668 . PMID 25838374.
- ^ Zang YW, Gu XD, Xiang JB, Chen ZY (junio de 2014). "Aplicación clínica de la terapia de células T adoptivas en tumores sólidos". Medical Science Monitor . 20 : 953–959. doi :10.12659/msm.890496. PMC 4063985 . PMID 24912947.
- ^ "La Administración de Alimentos y Medicamentos de Estados Unidos aprueba la primera combinación de anticuerpos bloqueadores de LAG-3, Opdualag (nivolumab y relatlimab-rmbw), como tratamiento para pacientes con melanoma irresecable o metastásico" (Comunicado de prensa). Bristol Myers Squibb . 18 de marzo de 2022. Archivado desde el original el 19 de marzo de 2022 . Consultado el 19 de marzo de 2022 – vía Business Wire.
- ^ ab Tzellos T, Kyrgidis A, Mocellin S, Chan AW, Pilati P, Apalla Z (diciembre de 2014). "Intervenciones para el melanoma in situ, incluido el lentigo maligno". Base de datos Cochrane de revisiones sistemáticas . 2016 (12): CD010308. doi :10.1002/14651858.CD010308.pub2. PMC 11005944. PMID 25526608 .
- ^ Johnson TM, Headington JT, Baker SR, Lowe L (noviembre de 1997). "Utilidad de la escisión por etapas para el lentigo maligno y el lentigo maligno melanoma: el procedimiento "cuadrado"". Revista de la Academia Americana de Dermatología . 37 (5 Pt 1): 758–764. doi :10.1016/S0190-9622(97)70114-2. PMID 9366823.
- ^ Hill R, Healy B, Holloway L, Kuncic Z, Thwaites D, Baldock C (marzo de 2014). "Avances en la dosimetría de rayos X de kilovoltaje". Física en Medicina y Biología . 59 (6): R183–R231. Bibcode :2014PMB....59R.183H. doi :10.1088/0031-9155/59/6/r183. PMID 24584183. S2CID 18082594.
- ^ Bastiaannet E, Beukema JC, Hoekstra HJ (febrero de 2005). "Radioterapia tras disección de ganglios linfáticos en pacientes con melanoma: tratamiento, resultados y complicaciones". Cancer Treatment Reviews . 31 (1): 18–26. doi :10.1016/j.ctrv.2004.09.005. PMID 15707701.
- ^ Ford MB, Mitchell MF, Boyer KL, Ford MB, Judkins AF, Levin B (1999). "Epidemiología del cáncer". Oncología de atención primaria . págs. 1–27.
- ^ Homsi J, Kashani-Sabet M, Messina JL, Daud A (octubre de 2005). "Melanoma cutáneo: factores pronósticos". Control del cáncer . 12 (4): 223–229. doi : 10.1177/107327480501200403 . PMID 16258493.
- ^ Balch CM, Buzaid AC, Soong SJ, Atkins MB, Cascinelli N, Coit DG, et al. (agosto de 2001). "Versión final del sistema de estadificación del American Joint Committee on Cancer para el melanoma cutáneo". Journal of Clinical Oncology . 19 (16): 3635–3648. CiteSeerX 10.1.1.475.6560 . doi :10.1200/JCO.2001.19.16.3635. PMID 11504745. Archivado desde el original el 5 de marzo de 2006 . Consultado el 31 de julio de 2006 .
- ^ Bae JM, Choi YY, Kim DS, Lee JH, Jang HS, Lee JH, et al. (enero de 2015). "Los melanomas metastásicos de origen primario desconocido muestran un mejor pronóstico que los de origen primario conocido: una revisión sistemática y un metaanálisis de estudios observacionales". Revista de la Academia Estadounidense de Dermatología . 72 (1): 59–70. doi :10.1016/j.jaad.2014.09.029. PMID 25440435.
- ^ Zhan H, Ma JY, Jian QC (septiembre de 2018). "Importancia pronóstica de la relación neutrófilos-linfocitos antes del tratamiento en pacientes con melanoma: un metaanálisis". Clinica Chimica Acta; Revista internacional de química clínica . 484 : 136–140. doi :10.1016/j.cca.2018.05.055. PMID 29856976. S2CID 44155588.
- ^ Wade RG, Robinson AV, Lo MC, Keeble C, Marples M, Dewar DJ, et al. (octubre de 2018). "Relaciones basales de neutrófilos y linfocitos y plaquetas como biomarcadores de supervivencia en el melanoma cutáneo: un estudio de cohorte multicéntrico". Anales de oncología quirúrgica . 25 (11): 3341–3349. doi : 10.1245/s10434-018-6660-x . PMC 6132419 . PMID 30066226.
- ^ Robinson AV, Keeble C, Lo MC, Thornton O, Peach H, Moncrieff MD, et al. (abril de 2020). "La relación neutrófilos-linfocitos y el melanoma locoregional: un estudio de cohorte multicéntrico". Inmunología del cáncer, inmunoterapia . 69 (4): 559–568. doi : 10.1007/s00262-019-02478-7 . PMC 7113207 . PMID 31974724.
- ^ "CANCERMondial (GLOBOCAN)". GLOBOCAN . 2010. Archivado desde el original el 17 de febrero de 2012 . Consultado el 12 de agosto de 2010 .
- ^ Berwick M, Wiggins C (mayo de 2006). "La epidemiología actual del melanoma maligno cutáneo". Frontiers in Bioscience . 11 : 1244–1254. doi : 10.2741/1877 . PMID 16368510.
- ^ "El cáncer en Australia: una visión general de 2012". AIHW. Archivado desde el original el 2 de junio de 2014. Consultado el 1 de junio de 2014 .
- ^ Grupo de trabajo sobre estadísticas del cáncer de EE. UU. Herramienta de visualización de datos de estadísticas del cáncer de EE. UU., basada en los datos presentados en 2020 (1999-2018): Departamento de Salud y Servicios Humanos de EE. UU., Centros para el Control y la Prevención de Enfermedades e Instituto Nacional del Cáncer; www.cdc.gov/cancer/dataviz, publicado en junio de 2021.
- ^ ab Guy GP, Thomas CC, Thompson T, Watson M, Massetti GM, Richardson LC (junio de 2015). "Signos vitales: tendencias y proyecciones de incidencia y mortalidad por melanoma - Estados Unidos, 1982-2030". MMWR. Informe semanal de morbilidad y mortalidad . 64 (21): 591–596. PMC 4584771. PMID 26042651. Archivado desde el original el 31 de mayo de 2017.
- ^ "CDC – Estadísticas de cáncer de piel". www.cdc.gov . Archivado desde el original el 10 de abril de 2017 . Consultado el 10 de abril de 2017 .
- ^ "Estadísticas clave para el cáncer de piel tipo melanoma". www.cancer.org . Archivado desde el original el 10 de abril de 2017 . Consultado el 10 de abril de 2017 .
- ^ Urteaga O, Pack GT (mayo de 1966). "Sobre la antigüedad del melanoma". Cáncer . 19 (5): 607–610. doi : 10.1002/1097-0142(196605)19:5<607::AID-CNCR2820190502>3.0.CO;2-8 . PMID 5326247.
- ^ Bodenham DC (octubre de 1968). "Un estudio de 650 melanomas malignos observados en la región suroeste". Anales del Real Colegio de Cirujanos de Inglaterra . 43 (4): 218–239. PMC 2312310. PMID 5698493 .
- ^ Laennec RT (1806). "Sobre las melanosis". Boletín de la Facultad de Medicina de París . 1 : 24–26.
- ^ Norris W (octubre de 1820). "Caso de enfermedad fungoide". Revista Médica y Quirúrgica de Edimburgo . 16 (65): 562–565. PMC 5830209 . PMID 30332089.
- ^ Norris W. Ocho casos de melanosis con observaciones patológicas y terapéuticas sobre esa enfermedad. Londres: Longman; 1857.
- ^ Cooper S (1844). Las primeras líneas de la teoría y la práctica de la cirugía: incluidas las operaciones principales. SS y W. Wood. Archivado desde el original el 4 de agosto de 2021. Consultado el 14 de diciembre de 2017 .
- ^ Merriam-Webster , Merriam-Webster's Collegiate Dictionary, Merriam-Webster, archivado desde el original el 10 de octubre de 2020 , consultado el 20 de julio de 2018
- ^ Liddell HG, Scott R. "μέλας". Un léxico griego-inglés . Perseo. Archivado desde el original el 5 de junio de 2011.
- ^ "Dorland's Illustrated Medical Dictionary". Elsevier. Archivado desde el original el 11 de enero de 2014. Consultado el 20 de julio de 2018 .
- ^ "The American Heritage Dictionary of the English Language". Houghton Mifflin Harcourt. Archivado desde el original el 25 de septiembre de 2015. Consultado el 20 de julio de 2018 .
- ^ "Medicamentos en desarrollo clínico para el melanoma". Medicina farmacéutica . 26 (3): 171–83. 23 de diciembre de 2012. doi :10.1007/BF03262391. S2CID 13247048. Archivado desde el original el 1 de enero de 2013 . Consultado el 12 de junio de 2012 .
- ^ Sotomayor MG, Yu H, Antonia S, Sotomayor EM, Pardoll DM (2002). "Avances en terapia génica para melanoma maligno". Cancer Control . 9 (1): 39–48. doi :10.1177/107327480200900106. PMID 11907465.
- ^ Dudley ME, Yang JC, Sherry R, Hughes MS, Royal R, Kammula U, et al. (noviembre de 2008). "Terapia celular adoptiva para pacientes con melanoma metastásico: evaluación de regímenes preparatorios de quimiorradiación mieloablativa intensiva". Journal of Clinical Oncology . 26 (32): 5233–5239. doi :10.1200/JCO.2008.16.5449. PMC 2652090 . PMID 18809613.
- ^ Besser MJ, Shapira-Frommer R, Treves AJ, Zippel D, Itzhaki O, Hershkovitz L, et al. (mayo de 2010). "Respuestas clínicas en un estudio de fase II utilizando transferencia adoptiva de linfocitos infiltrados tumorales cultivados a corto plazo en pacientes con melanoma metastásico" (PDF) . Clinical Cancer Research . 16 (9): 2646–2655. doi : 10.1158/1078-0432.CCR-10-0041 . PMID 20406835. S2CID 32568 . Consultado el 15 de agosto de 2011 .
- ^ "Un nuevo método de terapia génica altera las células inmunes para el tratamiento del melanoma avanzado; la técnica también podría aplicarse a otros tipos de cáncer comunes". 30 de diciembre de 2015. Archivado desde el original el 28 de septiembre de 2006.
- ^ "El sistema inmunológico se enseña a combatir el melanoma". CBSNews. 30 de mayo de 2009. Archivado desde el original el 29 de octubre de 2010.
- ^ Schwartzentruber DJ, Lawson DH, Richards JM, Conry RM, Miller DM, Treisman J, et al. (junio de 2011). "Vacuna de péptido gp100 e interleucina-2 en pacientes con melanoma avanzado". The New England Journal of Medicine . 364 (22): 2119–2127. doi :10.1056/NEJMoa1012863. PMC 3517182 . PMID 21631324.
- ^ Harmon A (21 de febrero de 2010). "A Roller Coaster Chase for a Cure". The New York Times . Archivado desde el original el 10 de febrero de 2017.
- ^ ab Pollack A (5 de junio de 2011). «Los fármacos parecen prometedores para frenar el melanoma avanzado». The New York Times . Archivado desde el original el 31 de enero de 2017.
- ^ Chapman PB, Hauschild A, Robert C, Haanen JB, Ascierto P, Larkin J, et al. (junio de 2011). "Mejora de la supervivencia con vemurafenib en el melanoma con mutación BRAF V600E". The New England Journal of Medicine . 364 (26): 2507–2516. doi :10.1056/NEJMoa1103782. PMC 3549296 . PMID 21639808.
- ^ "Los fármacos de GSK contra el melanoma se suman al total de aprobaciones de fármacos en Estados Unidos". Reuters. 30 de mayo de 2013. Archivado desde el original el 24 de septiembre de 2015.
- ^ "La combinación de dabrafenib y trametinib retrasa el desarrollo de resistencia al tratamiento en pacientes con MM". News Medical. 1 de octubre de 2012. Archivado desde el original el 14 de mayo de 2013.
- ^ Flaherty KT, Infante JR, Daud A, Gonzalez R, Kefford RF, Sosman J, et al. (noviembre de 2012). "Inhibición combinada de BRAF y MEK en melanoma con mutaciones BRAF V600". The New England Journal of Medicine . 367 (18): 1694–1703. doi :10.1056/NEJMoa1210093. PMC 3549295 . PMID 23020132.
- ^ "Combinación de dabrafenib y trametinib aprobada para el melanoma avanzado". OncLive. 9 de enero de 2014. Archivado desde el original el 25 de enero de 2014. Consultado el 4 de febrero de 2015 .
- ^ Shirley M (agosto de 2018). "Encorafenib y binimetinib: primeras aprobaciones globales". Drugs . 78 (12): 1277–1284. doi :10.1007/s40265-018-0963-x. PMID 30117021. S2CID 52020890.
- ^ "Cómo contrarrestar la resistencia a los fármacos en el melanoma". 2015. Archivado desde el original el 4 de febrero de 2015.
- ^ "Un fármaco de Bristol reduce el riesgo de muerte en el melanoma avanzado". Reuters . 5 de junio de 2010. Archivado desde el original el 9 de noviembre de 2010.
- ^ "El riesgo para Bristol". Forbes . Archivado desde el original el 15 de marzo de 2011.
- ^ "Estudio clínico de fase 3: el ipilimumab potencia y mantiene las respuestas del sistema inmunitario contra los tumores de melanoma". News-medical.net. 9 de junio de 2010. Archivado desde el original el 19 de octubre de 2012. Consultado el 13 de agosto de 2012 .
- ^ Jefferson E (25 de marzo de 2011). «La FDA aprueba un nuevo tratamiento para un tipo de cáncer de piel en etapa avanzada» (Comunicado de prensa). Administración de Alimentos y Medicamentos de Estados Unidos (FDA). Archivado desde el original el 27 de marzo de 2011. Consultado el 25 de marzo de 2011 .
- ^ Pollack A (25 de marzo de 2011). "Approval for Drug That Treats Melanoma". The New York Times . Archivado desde el original el 1 de abril de 2011. Consultado el 27 de marzo de 2011 .
- ^ "Yervoy". Drugs.com . Archivado desde el original el 9 de agosto de 2011.
- ^ Robert C, Thomas L, Bondarenko I, O'Day S, Weber J, Garbe C, et al. (junio de 2011). "Ipilimumab más dacarbazina para el melanoma metastásico no tratado previamente". The New England Journal of Medicine . 364 (26): 2517–2526. doi : 10.1056/NEJMoa1104621 . PMID 21639810.
- ^ Voit C, Van Akkooi AC, Schäfer-Hesterberg G, Schoengen A, Kowalczyk K, Roewert JC, et al. (febrero de 2010). "Los criterios de morfología ecográfica predicen la enfermedad metastásica de los ganglios centinela en pacientes con melanoma". Journal of Clinical Oncology . 28 (5): 847–852. doi : 10.1200/JCO.2009.25.7428 . PMID 20065175.
- ^ "malignant-melanoma.org". Archivado desde el original el 14 de octubre de 2011.
- ^ Forbes NE, Abdelbary H, Lupien M, Bell JC, Diallo JS (septiembre de 2013). "Explotación de la epigenética tumoral para mejorar la viroterapia oncolítica". Frontiers in Genetics . 4 : 184. doi : 10.3389/fgene.2013.00184 . PMC 3778850 . PMID 24062768.
- ^ Andtbacka RH, Kaufman HL, Collichio F, Amatruda T, Senzer N, Chesney J, et al. (septiembre de 2015). "Talimogene Laherparepvec mejora la tasa de respuesta duradera en pacientes con melanoma avanzado". Journal of Clinical Oncology . 33 (25): 2780–2788. doi : 10.1200/JCO.2014.58.3377 . PMID 26014293. S2CID 23663167.
- ^ Costa B, Vale N (septiembre de 2023). "Explorando la influencia de HERV-K (HML-2) en el cáncer y perspectivas de intervenciones terapéuticas". Revista internacional de ciencias moleculares . 24 (19): 1615. doi : 10.3390/ijms25031615 . PMC 10572383 . PMID 37834078.
- ^ Müller MD, Holst PJ, Nielsen KN (enero de 2022). "Una revisión sistemática de la expresión e inmunogenicidad de las proteínas retrovirales endógenas humanas en el cáncer y discusión de enfoques terapéuticos". Revista internacional de ciencias moleculares . 23 (3): 1330. doi : 10.3390/ijms23031330 . PMC 8836156 . PMID 35163254.
_at_thigh_Case_01.jpg/440px-Malignant_melanoma_(1)_at_thigh_Case_01.jpg)