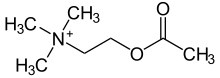
Acetilcolina
Este artículo necesita citas adicionales para su verificación . ( agosto de 2019 ) |
La acetilcolina ( ACh ) es un compuesto orgánico que funciona en el cerebro y el cuerpo de muchos tipos de animales (incluidos los humanos) como neurotransmisor . [1] Su nombre se deriva de su estructura química: es un éster de ácido acético y colina . [2] Las partes del cuerpo que usan o se ven afectadas por la acetilcolina se denominan colinérgicas .
La acetilcolina es el neurotransmisor que se utiliza en la unión neuromuscular , es decir, es la sustancia química que liberan las neuronas motoras del sistema nervioso para activar los músculos. Esta propiedad significa que los fármacos que afectan a los sistemas colinérgicos pueden tener efectos muy peligrosos que van desde la parálisis hasta las convulsiones . La acetilcolina también es un neurotransmisor del sistema nervioso autónomo , tanto como transmisor interno para el sistema nervioso simpático y parasimpático , como producto final liberado por el sistema nervioso parasimpático. [1] La acetilcolina es el neurotransmisor principal del sistema nervioso parasimpático. [2] [3]
En el cerebro, la acetilcolina funciona como neurotransmisor y neuromodulador . El cerebro contiene varias áreas colinérgicas, cada una con funciones distintas; como desempeñar un papel importante en la excitación , la atención , la memoria y la motivación . [4] También se ha encontrado acetilcolina en células de origen no neuronal, así como en microbios. Recientemente, se ha rastreado las enzimas relacionadas con su síntesis, degradación y captación celular hasta los orígenes tempranos de los eucariotas unicelulares. [5] Los patógenos protistas Acanthamoeba spp. han mostrado evidencia de la presencia de ACh, que proporciona señales de crecimiento y proliferación a través de un homólogo del receptor muscarínico M 1 ubicado en la membrana . [6]
En parte debido a la función activadora muscular de la acetilcolina, pero también debido a sus funciones en el sistema nervioso autónomo y el cerebro, muchos fármacos importantes ejercen sus efectos alterando la transmisión colinérgica. Numerosos venenos y toxinas producidas por plantas, animales y bacterias, así como agentes químicos nerviosos como el sarín , causan daño al inactivar o hiperactivar los músculos a través de sus influencias en la unión neuromuscular. Los fármacos que actúan sobre los receptores muscarínicos de acetilcolina , como la atropina , pueden ser venenosos en grandes cantidades, pero en dosis más pequeñas se usan comúnmente para tratar ciertas afecciones cardíacas y problemas oculares. [7] [8] La escopolamina o difenhidramina , que también actúan principalmente sobre los receptores muscarínicos de manera inhibidora en el cerebro (especialmente el receptor M 1 ) pueden causar delirio , alucinaciones y amnesia a través del antagonismo de los receptores en estos sitios. Hasta el año 2016, solo el subtipo de receptor M 1 se ha visto implicado en el delirio anticolinérgico. [9] Las cualidades adictivas de la nicotina se derivan de sus efectos sobre los receptores nicotínicos de acetilcolina en el cerebro.
Química
La acetilcolina es una molécula de colina que ha sido acetilada en el átomo de oxígeno . Debido al grupo amonio cargado , la acetilcolina no penetra las membranas lipídicas. Debido a esto, cuando la molécula se introduce externamente, permanece en el espacio extracelular y en la actualidad se considera que la molécula no atraviesa la barrera hematoencefálica.
Bioquímica
La acetilcolina se sintetiza en ciertas neuronas por la enzima colina acetiltransferasa a partir de los compuestos colina y acetil-CoA . Las neuronas colinérgicas son capaces de producir ACh. Un ejemplo de un área colinérgica central es el núcleo basal de Meynert en el prosencéfalo basal. [10] [11] La enzima acetilcolinesterasa convierte la acetilcolina en los metabolitos inactivos colina y acetato . Esta enzima es abundante en la hendidura sináptica, y su papel en la rápida limpieza de la acetilcolina libre de la sinapsis es esencial para el funcionamiento adecuado de los músculos. Ciertas neurotoxinas actúan inhibiendo la acetilcolinesterasa, lo que conduce a un exceso de acetilcolina en la unión neuromuscular , causando parálisis de los músculos necesarios para respirar y deteniendo los latidos del corazón.
Funciones

La acetilcolina actúa tanto en el sistema nervioso central (SNC) como en el sistema nervioso periférico (SNP). En el SNC, las proyecciones colinérgicas desde el prosencéfalo basal hasta la corteza cerebral y el hipocampo respaldan las funciones cognitivas de esas áreas objetivo. En el SNP, la acetilcolina activa los músculos y es un neurotransmisor importante en el sistema nervioso autónomo. [12] [2]
Efectos celulares
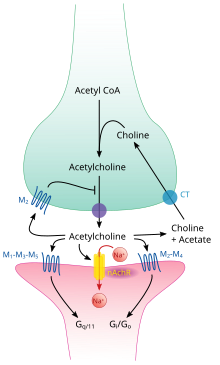
Al igual que muchas otras sustancias biológicamente activas, la acetilcolina ejerce sus efectos uniéndose a los receptores ubicados en la superficie de las células y activándolos. Existen dos clases principales de receptores de acetilcolina, los nicotínicos y los muscarínicos . Se denominan así por las sustancias químicas que pueden activar selectivamente cada tipo de receptor sin activar el otro: la muscarina es un compuesto que se encuentra en el hongo Amanita muscaria ; la nicotina se encuentra en el tabaco.
Los receptores nicotínicos de acetilcolina son canales iónicos regulados por ligando permeables a los iones de sodio , potasio y calcio . En otras palabras, son canales iónicos incrustados en las membranas celulares, capaces de cambiar de un estado cerrado a uno abierto cuando la acetilcolina se une a ellos; en el estado abierto permiten el paso de iones. Los receptores nicotínicos son de dos tipos principales, conocidos como de tipo muscular y de tipo neuronal. El de tipo muscular puede bloquearse selectivamente con curare , el de tipo neuronal con hexametonio . La ubicación principal de los receptores de tipo muscular es en las células musculares, como se describe con más detalle a continuación. Los receptores de tipo neuronal se encuentran en los ganglios autónomos (tanto simpáticos como parasimpáticos) y en el sistema nervioso central.
Los receptores muscarínicos de acetilcolina tienen un mecanismo más complejo y afectan a las células diana durante un período de tiempo más largo. En los mamíferos, se han identificado cinco subtipos de receptores muscarínicos, denominados M1 a M5. Todos ellos funcionan como receptores acoplados a proteína G , lo que significa que ejercen sus efectos a través de un sistema de segundo mensajero . Los subtipos M1, M3 y M5 están acoplados a G q ; aumentan los niveles intracelulares de IP 3 y calcio activando la fosfolipasa C. Su efecto sobre las células diana suele ser excitatorio. Los subtipos M2 y M4 están acoplados a G i /G o ; disminuyen los niveles intracelulares de AMPc inhibiendo la adenilato ciclasa . Su efecto sobre las células diana suele ser inhibidor. Los receptores muscarínicos de acetilcolina se encuentran tanto en el sistema nervioso central como en el sistema nervioso periférico del corazón, los pulmones, el tracto gastrointestinal superior y las glándulas sudoríparas.
Unión neuromuscular
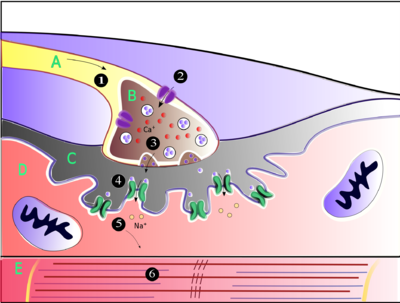
La acetilcolina es la sustancia que utiliza el sistema nervioso para activar los músculos esqueléticos , un tipo de músculo estriado. Estos son los músculos utilizados para todo tipo de movimiento voluntario, en contraste con el tejido muscular liso , que participa en una variedad de actividades involuntarias como el movimiento de los alimentos a través del tracto gastrointestinal y la constricción de los vasos sanguíneos. Los músculos esqueléticos están controlados directamente por neuronas motoras ubicadas en la médula espinal o, en algunos casos, el tronco encefálico . Estas neuronas motoras envían sus axones a través de los nervios motores , de los cuales emergen para conectarse a las fibras musculares en un tipo especial de sinapsis llamada unión neuromuscular .
Cuando una neurona motora genera un potencial de acción , este viaja rápidamente a lo largo del nervio hasta llegar a la unión neuromuscular, donde inicia un proceso electroquímico que hace que se libere acetilcolina en el espacio entre la terminal presináptica y la fibra muscular. Las moléculas de acetilcolina se unen entonces a los receptores de canales iónicos nicotínicos en la membrana de la célula muscular, lo que hace que los canales iónicos se abran. Los iones de sodio fluyen entonces hacia la célula muscular, iniciando una secuencia de pasos que finalmente producen la contracción muscular .
Factores que disminuyen la liberación de acetilcolina (y por lo tanto afectan los canales de calcio de tipo P ): [13]
- Antibióticos ( clindamicina , polimixina )
- Magnesio: antagoniza los canales de calcio tipo P
- Hipocalcemia
- Anticonvulsivos
- Diuréticos ( furosemida )
- Síndrome de Eaton-Lambert : inhibe los canales de calcio de tipo P
- Miastenia grave
- Toxina botulínica : inhibe las proteínas SNARE
Los bloqueadores de los canales de calcio (nifedipina, diltiazem) no afectan los canales P. Estos medicamentos afectan los canales de calcio de tipo L.
Sistema nervioso autónomo
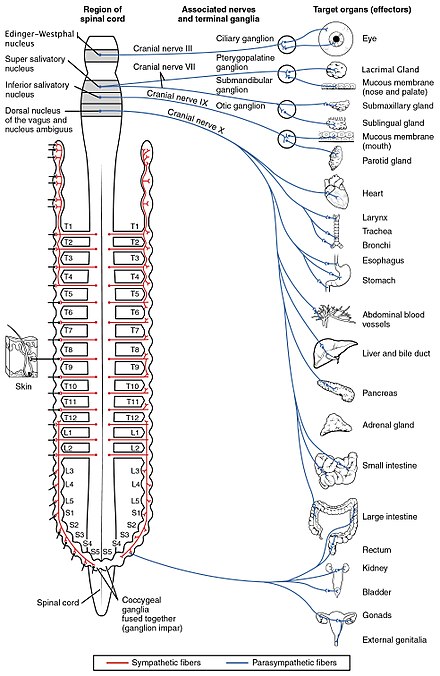
El sistema nervioso autónomo controla una amplia gama de funciones corporales involuntarias e inconscientes. Sus principales ramas son el sistema nervioso simpático y el sistema nervioso parasimpático . En términos generales, la función del sistema nervioso simpático es movilizar el cuerpo para la acción; la frase que a menudo se invoca para describirlo es lucha o huida . La función del sistema nervioso parasimpático es poner el cuerpo en un estado propicio para el descanso, la regeneración, la digestión y la reproducción; la frase que a menudo se invoca para describirlo es "descansar y digerir" o "alimentarse y reproducirse". Ambos sistemas mencionados anteriormente utilizan acetilcolina, pero de diferentes maneras.
A nivel esquemático, los sistemas nerviosos simpático y parasimpático están organizados esencialmente de la misma manera: las neuronas preganglionares del sistema nervioso central envían proyecciones a las neuronas situadas en los ganglios autónomos, que envían proyecciones de salida a prácticamente todos los tejidos del cuerpo. En ambas ramas, las conexiones internas, las proyecciones del sistema nervioso central a los ganglios autónomos, utilizan la acetilcolina como neurotransmisor para inervar (o excitar) las neuronas ganglionares. En el sistema nervioso parasimpático, las conexiones de salida, las proyecciones de las neuronas ganglionares a los tejidos que no pertenecen al sistema nervioso, también liberan acetilcolina pero actúan sobre los receptores muscarínicos. En el sistema nervioso simpático, las conexiones de salida liberan principalmente noradrenalina , aunque la acetilcolina se libera en unos pocos puntos, como la inervación sudomotora de las glándulas sudoríparas.
Efectos vasculares directos
La acetilcolina sérica ejerce un efecto directo sobre el tono vascular al unirse a los receptores muscarínicos presentes en el endotelio vascular . Estas células responden aumentando la producción de óxido nítrico , que envía señales al músculo liso circundante para que se relaje, lo que conduce a la vasodilatación . [14]
Sistema nervioso central

En el sistema nervioso central, la ACh tiene diversos efectos sobre la plasticidad, la excitación y la recompensa . La ACh tiene un papel importante en la mejora del estado de alerta cuando nos despertamos [15] , en el mantenimiento de la atención [16] y en el aprendizaje y la memoria [17] .
Se ha demostrado que el daño al sistema colinérgico (productor de acetilcolina) en el cerebro está asociado con los déficits de memoria asociados con la enfermedad de Alzheimer . [18] También se ha demostrado que la ACh promueve el sueño REM . [19]
En el tronco encefálico, la acetilcolina se origina en el núcleo pedunculopontino y el núcleo tegmental laterodorsal, conocidos colectivamente como área del tegmento mesopontino o complejo pontomesencefalotegmental. [20] [21] En el prosencéfalo basal, se origina en el núcleo basal de Meynert y el núcleo septal medial :
- El complejo pontomesencefalotegmental actúa principalmente sobre los receptores M1 en el tronco encefálico , núcleos cerebelosos profundos , núcleos pontinos , locus coeruleus , núcleo del rafe , núcleo reticular lateral y oliva inferior . [21] También se proyecta al tálamo , tectum , ganglios basales y prosencéfalo basal . [20]
- El núcleo basal de Meynert actúa principalmente sobre los receptores M1 en el neocórtex .
- El núcleo septal medial actúa principalmente sobre los receptores M1 en el hipocampo y partes de la corteza cerebral .
Además, la ACh actúa como un importante transmisor interno en el cuerpo estriado , que forma parte de los ganglios basales . Es liberada por interneuronas colinérgicas . En humanos, primates no humanos y roedores, estas interneuronas responden a estímulos ambientales salientes con respuestas que están alineadas temporalmente con las respuestas de las neuronas dopaminérgicas de la sustancia negra . [22] [23]
Memoria
La acetilcolina se ha relacionado con el aprendizaje y la memoria de varias maneras. El fármaco anticolinérgico escopolamina afecta la adquisición de nueva información en humanos [24] y animales [17] . En animales, la interrupción del suministro de acetilcolina al neocórtex afecta el aprendizaje de tareas de discriminación simples, comparable a la adquisición de información factual [25] y la interrupción del suministro de acetilcolina al hipocampo y áreas corticales adyacentes produce olvido, comparable a la amnesia anterógrada en humanos [26] .
Enfermedades y trastornos
Miastenia grave
La enfermedad miastenia gravis , caracterizada por debilidad muscular y fatiga, ocurre cuando el cuerpo produce de manera inapropiada anticuerpos contra los receptores nicotínicos de acetilcolina y, por lo tanto, inhibe la transmisión adecuada de la señal de acetilcolina. [27] Con el tiempo, la placa motora terminal se destruye. Los medicamentos que inhiben competitivamente la acetilcolinesterasa (p. ej., neostigmina , fisostigmina o principalmente piridostigmina ) son eficaces para tratar los síntomas de este trastorno. [28] Permiten que la acetilcolina liberada endógenamente tenga más tiempo para interactuar con su receptor respectivo antes de ser inactivada por la acetilcolinesterasa en la hendidura sináptica (el espacio entre el nervio y el músculo).
Farmacología
El bloqueo, la inhibición o la imitación de la acción de la acetilcolina tiene muchos usos en medicina. Los fármacos que actúan sobre el sistema de la acetilcolina son agonistas de los receptores, que estimulan el sistema, o antagonistas, que lo inhiben. Los agonistas y antagonistas del receptor de acetilcolina pueden tener un efecto directo sobre los receptores o ejercer sus efectos indirectamente, por ejemplo, al afectar a la enzima acetilcolinesterasa , que degrada el ligando del receptor. Los agonistas aumentan el nivel de activación del receptor; los antagonistas lo reducen.
La acetilcolina por sí sola no tiene valor terapéutico como fármaco de administración intravenosa debido a su acción multifacética (no selectiva) y a su rápida inactivación por la colinesterasa. Sin embargo, se utiliza en forma de colirio para provocar la constricción de la pupila durante la cirugía de cataratas, lo que facilita una rápida recuperación postoperatoria.
Receptores nicotínicos
La nicotina se une a los receptores nicotínicos de acetilcolina y los activa , imitando el efecto de la acetilcolina en estos receptores. La ACh abre un canal de Na + al unirse, de modo que el Na + fluye hacia la célula. Esto provoca una despolarización y da como resultado un potencial postsináptico excitatorio. Por lo tanto, la ACh es excitatoria en el músculo esquelético; la respuesta eléctrica es rápida y de corta duración. Los curares son venenos para flechas que actúan en los receptores nicotínicos y se han utilizado para desarrollar terapias clínicamente útiles.
Receptores muscarínicos
Los receptores muscarínicos forman complejos de receptores acoplados a la proteína G en las membranas celulares de las neuronas y otras células. La atropina es un antagonista competitivo no selectivo de la acetilcolina en los receptores muscarínicos.
Inhibidores de la colinesterasa
Muchos agonistas del receptor de ACh actúan indirectamente inhibiendo la enzima acetilcolinesterasa . La acumulación resultante de acetilcolina provoca una estimulación continua de los músculos, las glándulas y el sistema nervioso central, lo que puede provocar convulsiones fatales si la dosis es alta.
Son ejemplos de inhibidores enzimáticos , y aumentan la acción de la acetilcolina al retrasar su degradación; algunos se han utilizado como agentes nerviosos ( gases nerviosos Sarin y VX ) o pesticidas ( organofosforados y carbamatos ). Muchas toxinas y venenos producidos por plantas y animales también contienen inhibidores de la colinesterasa. En el uso clínico, se administran en dosis bajas [ ¿por qué? ] para revertir la acción de los relajantes musculares , para tratar la miastenia gravis y para tratar los síntomas de la enfermedad de Alzheimer ( rivastigmina , que aumenta la actividad colinérgica en el cerebro).
Inhibidores de síntesis
Los compuestos orgánicos mercuriales , como el metilmercurio , tienen una alta afinidad por los grupos sulfhidrilo , lo que provoca una disfunción de la enzima colina acetiltransferasa. Esta inhibición puede provocar una deficiencia de acetilcolina y tener consecuencias sobre la función motora.
Inhibidores de liberación
La toxina botulínica (Botox) actúa suprimiendo la liberación de acetilcolina, mientras que el veneno de la araña viuda negra ( alfa-latrotoxina ) tiene el efecto inverso. La inhibición de la ACh provoca parálisis . Cuando nos pica una araña viuda negra , experimentamos una pérdida de los suministros de ACh y los músculos comienzan a contraerse. Si se agota el suministro, se produce parálisis .
Biología comparada y evolución
La acetilcolina es utilizada por organismos en todos los dominios de la vida para una variedad de propósitos. Se cree que la colina , un precursor de la acetilcolina, fue utilizada por organismos unicelulares hace miles de millones de años [ cita requerida ] para sintetizar fosfolípidos de la membrana celular. [29] Después de la evolución de los transportadores de colina, la abundancia de colina intracelular allanó el camino para que la colina se incorporara a otras vías sintéticas, incluida la producción de acetilcolina. La acetilcolina es utilizada por bacterias, hongos y una variedad de otros animales. Muchos de los usos de la acetilcolina dependen de su acción sobre los canales iónicos a través de GPCR como proteínas de membrana.
Los dos tipos principales de receptores de acetilcolina, los receptores muscarínicos y nicotínicos, han evolucionado de manera convergente para responder a la acetilcolina. Esto significa que, en lugar de haber evolucionado a partir de un homólogo común, estos receptores evolucionaron a partir de familias de receptores separadas. Se estima que la familia de receptores nicotínicos se remonta a más de 2500 millones de años. [29] Asimismo, se cree que los receptores muscarínicos se separaron de otros GPCR hace al menos 500 millones de años. Ambos grupos de receptores han desarrollado numerosos subtipos con afinidades de ligando y mecanismos de señalización únicos. La diversidad de los tipos de receptores permite que la acetilcolina cree respuestas variables según los tipos de receptores que se activen, y permite que la acetilcolina regule dinámicamente los procesos fisiológicos. Los receptores de ACh están relacionados con los receptores 5-HT3 ( serotonina ), GABA y glicina , tanto en secuencia como en estructura, lo que sugiere firmemente que tienen un origen evolutivo común. [30]
Historia
En 1867, Adolf von Baeyer resolvió las estructuras de la colina y la acetilcolina y las sintetizó, refiriéndose a esta última como acetilneurina en el estudio. [31] [32] La colina es un precursor de la acetilcolina. La acetilcolina se observó por primera vez como biológicamente activa en 1906, cuando Reid Hunt (1870-1948) y René de M. Taveau descubrieron que reducía la presión arterial en dosis excepcionalmente pequeñas. [33] [32] [34] Esto fue después de que Frederick Walker Mott y William Dobinson Halliburton observaran en 1899 que las inyecciones de colina reducían la presión arterial de los animales. [35] [32]
En 1914, Arthur J. Ewins fue el primero en extraer acetilcolina de la naturaleza. La identificó como el contaminante que reduce la presión arterial de algunos extractos de cornezuelo de centeno de Claviceps purpurea , a pedido de Henry Hallett Dale . [32] Más tarde, en 1914, Dale describió los efectos de la acetilcolina en varios tipos de sinapsis periféricas y también señaló que reducía la presión arterial de los gatos mediante inyecciones subcutáneas incluso en dosis de un nanogramo . [36] [32]
El concepto de neurotransmisores era desconocido hasta 1921, cuando Otto Loewi notó que el nervio vago secretaba una sustancia que inhibía el músculo cardíaco mientras trabajaba como profesor en la Universidad de Graz . La llamó vagusstoff ("sustancia vaga"), notó que era un análogo estructural de la colina y sospechó que era acetilcolina. [37] [38] En 1926, Loewi y E. Navratil dedujeron que el compuesto es probablemente acetilcolina, ya que el vagusstoff y la acetilcolina sintética perdían su actividad de manera similar cuando entraban en contacto con lisados de tejido que contenían enzimas que degradaban la acetilcolina (ahora conocidas como colinesterasas ). [39] [40] Esta conclusión fue aceptada ampliamente. Estudios posteriores confirmaron la función de la acetilcolina como neurotransmisor . [38]
En 1936, HH Dale y O. Loewi compartieron el Premio Nobel de Fisiología o Medicina por sus estudios sobre la acetilcolina y los impulsos nerviosos. [32]
Referencias
- ^ ab Tiwari P, Dwivedi S, Singh MP, Mishra R, Chandy A (octubre de 2012). "Conceptos básicos y modernos sobre el receptor colinérgico: una revisión". Revista asiática del Pacífico de enfermedades tropicales . 3 (5): 413–420. doi :10.1016/S2222-1808(13)60094-8. PMC 4027320 .
- ^ abc Sam C, Bordoni B (2023). "Fisiología, acetilcolina". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 32491757 . Consultado el 6 de abril de 2023 .
- ^ Lott EL, Jones EB (junio de 2019). "Toxicidad colinérgica". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 30969605.
- ^ Kapalka GM (2010). "Sustancias implicadas en la neurotransmisión". Terapias nutricionales y herbarias para niños y adolescentes . Elsevier. págs. 71–99. doi :10.1016/b978-0-12-374927-7.00004-2. ISBN . 978-0-12-374927-7.
- ^ Baig AM, Rana Z, Tariq S, Lalani S, Ahmad HR (marzo de 2018). "Trazado en la línea de tiempo: descubrimiento de la acetilcolina y los componentes del sistema colinérgico humano en un eucariota unicelular primitivo Acanthamoeba spp". ACS Chem Neurosci . 9 (3): 494–504. doi :10.1021/acschemneuro.7b00254. PMID 29058403.
- ^ Baig AM, Ahmad HR (junio de 2017). "Evidencia de un homólogo de GPCR muscarínico M1 en eucariotas unicelulares: con modelos y experimentos bioinformáticos en 3D de Acanthamoeba spp". J. Recept. Signal Transduct. Res . 37 (3): 267–275. doi :10.1080/10799893.2016.1217884. PMID 27601178. S2CID 5234123.
- ^ Avetisov SE, Fisenko VP, Zhuravlev AS, Avetisov KS (2018). "Применение атропина для контроля прогрессирования миопии" [Uso de atropina para la prevención de la progresión de la miopía]. Vestnik Oftalmologii (en ruso). 134 (4): 84–90. doi : 10.17116/oftalma201813404184 . PMID 30166516.
- ^ Smulyan H (noviembre de 2018). "El ritmo continúa: la historia de cinco fármacos cardíacos eternos". The American Journal of the Medical Sciences . 356 (5): 441–450. doi :10.1016/j.amjms.2018.04.011. PMID 30055757.
- ^ Dawson AH, Buckley NA (marzo de 2016). "Manejo farmacológico del delirio anticolinérgico: teoría, evidencia y práctica". British Journal of Clinical Pharmacology . 81 (3): 516–524. doi :10.1111/bcp.12839. PMC 4767198 . PMID 26589572.
El delirio solo se asocia con el antagonismo de los receptores M1 postsinápticos y hasta la fecha no se han implicado otros subtipos de receptores.
- ^ Smythies J (2009). "Filosofía, percepción y neurociencia". Percepción . 38 (5): 638–51. doi :10.1068/p6025. PMID 19662940. S2CID 45579740.
- ^ Smythies J, d'Oreye de Lantremange M (2016). "La naturaleza y la función de los mecanismos de compresión de información digital en el cerebro y en la tecnología de televisión digital". Front Syst Neurosci . 10 : 40. doi : 10.3389/fnsys.2016.00040 . PMC 4858531 . PMID 27199688.
- ^ Waxenbaum JA, Reddy V, Varacallo M (2023). "Anatomía, sistema nervioso autónomo". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 30969667 . Consultado el 6 de abril de 2023 .
- ^ Miller RD, Eriksson LI, Fleisher LA, Wiener-Kronish JP, Young WL, eds. (1 de enero de 2009). Miller's Anesthesia (7.ª ed.). Elsevier Health Sciences. págs. 343–47. ISBN 978-0-443-06959-8.
- ^ Kellogg DL, Zhao JL, Coey U, Green JV (febrero de 2005). "La vasodilatación inducida por acetilcolina está mediada por óxido nítrico y prostaglandinas en la piel humana". J. Appl. Physiol . 98 (2): 629–32. doi :10.1152/japplphysiol.00728.2004. PMID 15649880. S2CID 293055.
- ^ Jones BE (noviembre de 2005). "De la vigilia al sueño: sustratos neuronales y químicos". Trends Pharmacol. Sci . 26 (11): 578–86. doi :10.1016/j.tips.2005.09.009. PMID 16183137.
- ^ Himmelheber AM, Sarter M, Bruno JP (junio de 2000). "Aumentos en la liberación de acetilcolina cortical durante el desempeño de atención sostenida en ratas". Brain Res Cogn Brain Res . 9 (3): 313–25. doi :10.1016/S0926-6410(00)00012-4. PMID 10808142.
- ^ ab Ridley RM, Bowes PM, Baker HF, Crow TJ (1984). "Una participación de la acetilcolina en el aprendizaje y la memoria de discriminación de objetos en el tití". Neuropsychologia . 22 (3): 253–63. doi :10.1016/0028-3932(84)90073-3. PMID 6431311. S2CID 7110504.
- ^ Francis PT, Palmer AM, Snape M, Wilcock GK (febrero de 1999). "La hipótesis colinérgica de la enfermedad de Alzheimer: una revisión del progreso". J. Neurol. Neurosurg. Psychiatry . 66 (2): 137–47. doi :10.1136/jnnp.66.2.137. PMC 1736202. PMID 10071091 .
- ^ Platt B, Riedel G (agosto de 2011). "El sistema colinérgico, EEG y sueño". Behav. Brain Res . 221 (2): 499–504. doi :10.1016/j.bbr.2011.01.017. PMID 21238497. S2CID 25323695.
- ^ ab Woolf NJ, Butcher LL (mayo de 1986). "Sistemas colinérgicos en el cerebro de la rata: III. Proyecciones desde el tegmento pontomesencefálico hasta el tálamo, el tectum, los ganglios basales y el prosencéfalo basal". Brain Res. Bull . 16 (5): 603–37. doi :10.1016/0361-9230(86)90134-6. PMID 3742247. S2CID 39665815.
- ^ ab Woolf NJ, Butcher LL (diciembre de 1989). "Sistemas colinérgicos en el cerebro de la rata: IV. Proyecciones descendentes del tegmento pontomesencefálico". Brain Res. Bull . 23 (6): 519–40. doi :10.1016/0361-9230(89)90197-4. PMID 2611694. S2CID 4721282.
- ^ Goldberg JA, Reynolds JN (diciembre de 2011). "Disparos espontáneos y pausas provocadas en las interneuronas colinérgicas tónicamente activas del cuerpo estriado". Neurociencia . 198 : 27–43. doi :10.1016/j.neuroscience.2011.08.067. PMID 21925242. S2CID 21908514.
- ^ Morris G, Arkadir D, Nevet A, Vaadia E, Bergman H (julio de 2004). "Mensajes coincidentes pero distintos de la dopamina del mesencéfalo y las neuronas tónicamente activas del cuerpo estriado". Neuron . 43 (1): 133–43. doi : 10.1016/j.neuron.2004.06.012 . PMID 15233923.
- ^ Crow TJ, Grove-White IG (octubre de 1973). "Análisis del déficit de aprendizaje tras la administración de hioscina al hombre". Br. J. Pharmacol . 49 (2): 322–7. doi :10.1111/j.1476-5381.1973.tb08379.x. PMC 1776392. PMID 4793334 .
- ^ Ridley RM, Murray TK, Johnson JA, Baker HF (junio de 1986). "Deterioro del aprendizaje tras una lesión del núcleo basal de Meynert en el tití: modificación mediante fármacos colinérgicos". Brain Res . 376 (1): 108–16. doi :10.1016/0006-8993(86)90904-2. PMID 3087582. S2CID 29182517.
- ^ Easton A, Ridley RM, Baker HF, Gaffan D (julio de 2002). "Las lesiones unilaterales del prosencéfalo basal colinérgico y el fórnix en un hemisferio y la corteza temporal inferior en el hemisferio opuesto producen graves trastornos del aprendizaje en los monos rhesus". Cereb. Cortex . 12 (7): 729–36. doi : 10.1093/cercor/12.7.729 . PMID 12050084.
- ^ Pasnoor M, Wolfe GI, Barohn RJ (2024). "Miastenia gravis". Canalopatías neurológicas . Manual de neurología clínica. Vol. 203. págs. 185-203. doi :10.1016/B978-0-323-90820-7.00006-9. ISBN 978-0-323-90820-7. Número PMID 39174248.
- ^ Crisafulli S, Boccanegra B, Carollo M, Bottani E, Mantuano P, Trifirò G, et al. (enero de 2024). "Tratamiento de la miastenia grave: de fármacos antiguos a terapias innovadoras con una mirada al futuro". CNS Drugs . 38 (1): 15–32. doi :10.1007/s40263-023-01059-8. PMID 38212553.
- ^ ab Dean B (noviembre de 2009). "Evolución del sistema colinérico del sistema nervioso central humano: ¿ha provocado la aparición de enfermedades psiquiátricas?". Aust NZJ Psychiatry . 43 (11): 1016–28. doi :10.3109/00048670903270431. PMID 20001397. S2CID 31059344.
- ^ Ortells MO, Lunt GG (marzo de 1995). "Historia evolutiva de la superfamilia de receptores de canales iónicos controlados por ligando". Tendencias en neurociencias . 18 (3): 121–127. doi :10.1016/0166-2236(95)93887-4. PMID 7754520. S2CID 18062185.
- ^ Baeyer A (1867). "I. Üeber das neurin". Justus Liebigs Ann Chem (en alemán). 142 (3): 322–326. doi :10.1002/jlac.18671420311.
- ^ abcdef Kawashima K, Fujii T, Moriwaki Y, Misawa H, Horiguchi K (2015). "Sistema colinérgico no neuronal en la regulación de la función inmune con un enfoque en los α7 nAChR". Inmunofarmacología internacional . 29 (1): 127–34. doi : 10.1016/j.intimp.2015.04.015 . PMID 25907239.
- ^ Hunt R, Taveau M (1906). "Sobre la acción fisiológica de ciertos derivados de la colina y nuevos métodos para detectar la colina". BMJ . 2 : 1788–1791.
- ^ Dorkins HR (abril de 1982). "Suxametonio: el desarrollo de un fármaco moderno desde 1906 hasta la actualidad". Historia médica . 26 (2): 145–68. doi :10.1017/s0025727300041132. PMC 1139149 . PMID 7047939.
- ^ Mott FW, Halliburton WD (1899). "VII. La acción fisiológica de la colina y la neurina". Philosophical Transactions of the Royal Society of London. Serie B, que contiene artículos de carácter biológico . 191 (2001): 211–267. doi : 10.1098/rstb.1899.0007 . PMC 2463419. PMID 20758460 .
- ^ Dale HH (1914). "La acción de ciertos ésteres y éteres de colina y su relación con la muscarina". J Pharmacol Exp Ther . 6 (2): 147–190.
- ^ Loewi O (1922). "Über humorale übertragbarkeit der herznervenwirkung". Pflug Arch Ges Phys (en alemán). 193 (1): 201–213. doi :10.1007/BF02331588. S2CID 34861770.
- ^ ab Zeisel SH (2012). "Una breve historia de la colina". Anales de nutrición y metabolismo . 61 (3): 254–8. doi :10.1159/000343120. PMC 4422379 . PMID 23183298.
- ^ Loewi O, Navratil E (1926). "Über humorale übertragbarkeit der herznervenwirkung". Pflug Arch Ges Phys (en alemán). 214 (1): 678–688. doi :10.1007/BF01741946. S2CID 43748121.
- ^ Zimmer HG (marzo de 2006). "Otto Loewi y la transmisión química de la estimulación del nervio vago en el corazón". Cardiología clínica . 29 (3): 135–6. doi :10.1002/clc.4960290313. PMC 6654523 . PMID 16596840.
Lectura adicional
- Brenner GM, Stevens CW (2006). Farmacología (2.ª ed.). Filadelfia, Pensilvania: WB Saunders. ISBN 1-4160-2984-2.
- Asociación Canadiense de Farmacéuticos (2000). Compendio de productos farmacéuticos y especialidades (25.ª edición). Toronto, Ontario: Webcom. ISBN 0-919115-76-4.
- Carlson NR (2001). Fisiología del comportamiento (7.ª ed.). Needham Heights, MA: Allyn and Bacon. ISBN 0-205-30840-6.
- Gershon MD (1998). El segundo cerebro . Nueva York, NY: HarperCollins. ISBN 0-06-018252-0.
- Siegal A, Sapru HN (2006). "Cap. 15" . Neurociencia esencial (1.ª edición revisada). Filadelfia: Lippincott, Williams & Wilkins. págs. 255–267.
- Hasselmo ME (febrero de 1995). "Neuromodulación y función cortical: modelado de la base fisiológica del comportamiento". Behav. Brain Res . 67 (1): 1–27. doi :10.1016/0166-4328(94)00113-T. PMID 7748496. S2CID 17594590.como PDF
- Yu AJ, Dayan P (mayo de 2005). "Incertidumbre, neuromodulación y atención". Neuron . 46 (4): 681–92. doi : 10.1016/j.neuron.2005.04.026 . PMID 15944135. S2CID 15980355.como PDF
Enlaces externos
- Advertencia sobre la combinación de medicamentos habituales para personas mayores