Ácido sórbico
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Ácido (2 E ,4 E )-hexa-2,4-dienoico | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.003.427 |
| Número E | E200 (conservantes) |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C6H8O2 | |
| Masa molar | 112,128 g·mol −1 |
| Densidad | 1,204 g/ cm3 |
| Punto de fusión | 135 °C (275 °F; 408 K) |
| Punto de ebullición | 228 °C (442 °F; 501 K) |
| 1,6 g/L a 20 °C | |
| Acidez (p K a ) | 4,76 a 25 °C |
| Peligros | |
| NFPA 704 (rombo cortafuegos) | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
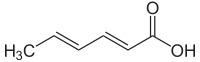
El ácido sórbico , o ácido 2,4-hexadienoico , es un compuesto orgánico natural que se utiliza como conservante de alimentos . Tiene la fórmula química CH 3 (CH) 4 CO 2 H y la estructura H 3 C −CH=CH−CH=CH− C(=O)OH . Es un sólido incoloro, ligeramente soluble en agua y que sublima fácilmente. Se aisló por primera vez de las bayas verdes del Sorbus aucuparia ( serbal ), de ahí su nombre. [1]
Producción
La ruta tradicional para obtener ácido sórbico implica la condensación de ácido malónico y crotonaldehído . [2] También se puede preparar a partir de ácidos hexadienoicos isoméricos, que están disponibles mediante una reacción catalizada por níquel de cloruro de alilo , acetileno y monóxido de carbono . Sin embargo, la ruta utilizada comercialmente es a partir de crotonaldehído y cetena . [3] Se estima que se producen 30.000 toneladas al año. [1]
Historia
El ácido sórbico fue aislado en 1859 por destilación de aceite de serbal por A. W. von Hofmann . [4] Esto produce ácido parasórbico , la lactona del ácido sórbico, que convirtió en ácido sórbico por hidrólisis. Sus actividades antimicrobianas se descubrieron a fines de la década de 1930 y 1940, y se comercializó a fines de la década de 1940 y 1950. A partir de la década de 1980, el ácido sórbico y sus sales se utilizaron como inhibidores de Clostridium botulinum en productos cárnicos para reemplazar el uso de nitritos , que pueden producir nitrosaminas cancerígenas . [5]
Propiedades y usos
Con un p K a de 4,76, el ácido sórbico es aproximadamente tan ácido como el ácido acético.
El ácido sórbico y sus sales, especialmente el sorbato de potasio y el sorbato de calcio , son agentes antimicrobianos que se utilizan a menudo como conservantes en alimentos y bebidas para prevenir el crecimiento de moho , levadura y hongos . En general, se prefieren las sales a la forma ácida porque son más solubles en agua, pero la forma activa es el ácido. El pH óptimo para la actividad antimicrobiana está por debajo de pH 6,5. Los sorbatos se utilizan generalmente en concentraciones de 0,025% a 0,10%. Sin embargo, añadir sales de sorbato a los alimentos aumentará ligeramente el pH de los mismos, por lo que puede ser necesario ajustarlo para garantizar la seguridad. Se encuentra en alimentos como varios tipos de queso, pan, muffins, donas, tartas, galletas, barras de proteínas, jarabes, limonadas, zumos de frutas, carnes secas, salchichas, nuggets, hamburguesas, sándwiches, tacos, pizzas, pescado ahumado, margarina, salsas, sopas y más. [6]
Los números E son:
- E200 Ácido sórbico
- E201 Sorbato de sodio
- E202 Sorbato de potasio
- E203 Sorbato de calcio
Algunos mohos (especialmente algunas cepas de Trichoderma y Penicillium ) y levaduras son capaces de desintoxicar los sorbatos mediante descarboxilación , produciendo trans -1,3-pentadieno . El pentadieno se manifiesta como un olor típico de queroseno o petróleo . Otras reacciones de desintoxicación incluyen la reducción a 4- hexenol y ácido 4-hexenoico. [7]
El ácido sórbico también se puede utilizar como aditivo para el caucho en frío y como intermedio en la fabricación de algunos plastificantes y lubricantes . [8]
Seguridad
El ácido sórbico y las sales de sorbato tienen una toxicidad y carcinogenicidad muy bajas para los mamíferos. [ 9] Se estima que su DL50 está entre 7,4 y 10 g/kg. [1]
Véase también
Referencias
- ^ abc Erich Lück, Martin Jager, Nico Raczek (2000). "Ácido sórbico". Enciclopedia de química industrial de Ullmann . Weinheim: Wiley-VCH. doi :10.1002/14356007.a24_507. ISBN 3-527-30673-0.
{{cite encyclopedia}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ CFH Allen; J. VanAllan (1944). "Ácido sórbico". Org. Sintetizador . 24 : 92. doi : 10.15227/orgsyn.024.0092.
- ^ Diccionario Ashford de productos químicos industriales , tercera edición, 2011, página 8482
- ^ Hofmann, AW (1859). "Neue flüchtige Säure der Vogelbeeren" [Nuevo ácido volátil de las bayas de serbal]. Annalen der Chemie und Pharmacie (en alemán). 110 (2): 129-140. doi :10.1002/jlac.18591100202. Hofmann nombró ácido sórbico en la p. 133: "Ich schlage für die krystallinische Säure den Namen Sorbinsäure vor, wodurch ein alter Name der in den Vogelbeeren gefundenen Aepfelsäure neue Bedeutung gewinnt". (Para el ácido cristalino, sugiero el nombre "ácido sórbico", por lo que el antiguo nombre del ácido málico que se encuentra en las bayas de serbal adquiere un nuevo significado).
- ^ AS Naidu, ed. (2000). Sistemas antimicrobianos alimentarios naturales. CRC Press. pág. 637. ISBN 0-8493-2047-X.
- ^ "Ácido sórbico (E200): descripción general, usos, efectos secundarios y más". HealthKnight. 21 de mayo de 2022. Consultado el 4 de agosto de 2022 .
- ^ Kinderlerer JL, Hatton PV (1990). "Metabolitos fúngicos del ácido sórbico". Food Addit Contam . 7 (5): 657–69. doi :10.1080/02652039009373931. PMID 2253810.
- ^ Bingham E, Cohrssen B (2012). Toxicología de Patty. John Wiley & Sons. pág. 547.
- ^ Piper JD, Piper PW (2017). "Sales de benzoato y sorbato: una revisión sistemática de los posibles peligros de estos conservantes invaluables y el espectro en expansión de usos clínicos del benzoato de sodio". Revisiones integrales en ciencia y seguridad alimentaria . 16 (5): 868–880. doi : 10.1111/1541-4337.12284 . PMID 33371618.
Enlaces externos
- Sórbico inchem.org



