Cáncer de próstata
| Cáncer de próstata | |
|---|---|
| Otros nombres | Carcinoma de próstata |
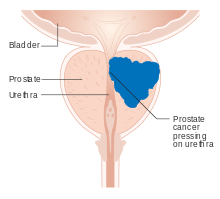 | |
| Diagrama de un tumor de próstata que presiona la uretra | |
| Especialidad | Oncología , urología |
| Síntomas | Generalmente ninguna. A veces, dificultad para orinar, disfunción eréctil o dolor en la espalda o la pelvis. |
| Inicio habitual | Edad mayor de 40 años |
| Factores de riesgo | Edad avanzada, antecedentes familiares, raza. |
| Método de diagnóstico | Prueba de PSA seguida de biopsia de tejido |
| Diagnóstico diferencial | Hiperplasia prostática benigna |
| Tratamiento | Vigilancia activa , prostatectomía , radioterapia , terapia hormonal , quimioterapia |
| Pronóstico | Las tasas de supervivencia a cinco años varían entre el 30 y el 99 %, según el estadio. [1] |
El cáncer de próstata es el crecimiento descontrolado de células en la próstata , una glándula del sistema reproductor masculino debajo de la vejiga . El crecimiento anormal del tejido prostático generalmente se detecta mediante pruebas de detección, generalmente análisis de sangre que verifican los niveles de antígeno prostático específico (PSA). Las personas con niveles altos de PSA en la sangre tienen un mayor riesgo de desarrollar cáncer de próstata. El diagnóstico requiere una biopsia de próstata. Si hay cáncer, el patólogo asigna una puntuación de Gleason y una puntuación más alta representa un tumor más peligroso. Se realizan imágenes médicas para buscar cáncer que se haya propagado fuera de la próstata. Según la puntuación de Gleason, los niveles de PSA y los resultados de las imágenes, a un caso de cáncer se le asigna un estadio 1 a 4. Un estadio más alto significa una enfermedad más avanzada y más peligrosa.
La mayoría de los tumores de próstata permanecen pequeños y no causan problemas de salud. Estos se manejan con vigilancia activa , controlando el tumor con pruebas regulares para asegurarse de que no haya crecido. Los tumores con más probabilidades de ser peligrosos se pueden destruir con radioterapia o extirpar quirúrgicamente mediante prostatectomía radical . Aquellos cuyo cáncer se propaga más allá de la próstata son tratados con terapia hormonal que reduce los niveles de andrógenos (hormonas sexuales masculinas) que las células de la próstata necesitan para sobrevivir. Con el tiempo, las células cancerosas pueden volverse resistentes a este tratamiento. Esta etapa más avanzada de la enfermedad, llamada cáncer de próstata resistente a la castración, se trata con terapia hormonal continua junto con el fármaco de quimioterapia docetaxel . Algunos tumores hacen metástasis (se propagan) a otras áreas del cuerpo, en particular los huesos y los ganglios linfáticos . Allí, los tumores causan dolor óseo intenso , debilidad o parálisis en las piernas y, finalmente, la muerte. El pronóstico del cáncer de próstata depende de qué tan lejos se haya propagado el cáncer en el momento del diagnóstico. La mayoría de los hombres diagnosticados tienen tumores confinados a la próstata; el 99% de ellos sobreviven más de 10 años desde sus diagnósticos. Los tumores que han hecho metástasis en zonas distantes del cuerpo son los más peligrosos, con tasas de supervivencia a cinco años del 30 al 40%.
El riesgo de desarrollar cáncer de próstata aumenta con la edad; la edad promedio de diagnóstico es de 67 años. Aquellos con antecedentes familiares de cualquier cáncer tienen más probabilidades de tener cáncer de próstata, particularmente aquellos que heredan variantes asociadas al cáncer del gen BRCA2 . Cada año se diagnostican 1,2 millones de casos de cáncer de próstata y 350.000 mueren de la enfermedad, [2] lo que la convierte en la segunda causa principal de cáncer y muerte por cáncer en hombres. Uno de cada ocho hombres es diagnosticado con cáncer de próstata en su vida y uno de cada cuarenta muere de la enfermedad. [3] Los tumores de próstata se describieron por primera vez a mediados del siglo XIX, durante cirugías en hombres con obstrucciones urinarias. Inicialmente, la prostatectomía era el tratamiento primario para el cáncer de próstata. A mediados del siglo XX, se desarrollaron tratamientos de radiación y terapias hormonales para mejorar el tratamiento del cáncer de próstata. La invención de terapias hormonales para el cáncer de próstata fue reconocida con el Premio Nobel de 1966 a Charles B. Huggins y el Premio de 1977 a Andrzej W. Schally .
Signos y síntomas
El cáncer de próstata en etapa temprana no suele causar síntomas. A medida que el cáncer avanza, puede causar disfunción eréctil , sangre en la orina o el semen , o problemas para orinar, que suelen incluir micción frecuente y chorro de orina lento o débil. [4] Más de la mitad de los hombres mayores de 50 años experimentan algún tipo de problema para orinar, [5] generalmente debido a problemas distintos del cáncer de próstata, como la hiperplasia prostática benigna (agrandamiento no canceroso de la próstata). [4]
Los tumores de próstata avanzados pueden hacer metástasis en los ganglios linfáticos y los huesos cercanos, en particular en la pelvis, las caderas, la columna vertebral, las costillas, la cabeza y el cuello. [6] Allí pueden causar fatiga , pérdida de peso inexplicable y dolor de espalda o de huesos que no mejora con el descanso. [7] [8] Las metástasis pueden dañar los huesos que las rodean, y alrededor de una cuarta parte de las personas con cáncer de próstata metastásico desarrollan una fractura ósea . [9] Las metástasis en crecimiento también pueden comprimir la médula espinal causando debilidad en las piernas y los pies, o parálisis de las extremidades. [10] [11]
Cribado
La mayoría de los casos de cáncer de próstata se diagnostican mediante pruebas de detección, cuando los tumores son demasiado pequeños para causar algún síntoma. [4] Esto se hace a través de análisis de sangre para medir los niveles de la proteína antígeno prostático específico (PSA), que están elevados en aquellos con próstatas agrandadas, ya sea debido al cáncer de próstata o hiperplasia prostática benigna . [12] [13] La sangre del hombre típico tiene alrededor de 1 nanogramo (ng) de PSA por mililitro (mL) de sangre analizada. [14] Aquellos con niveles de PSA por debajo del promedio tienen muy pocas probabilidades de desarrollar un cáncer de próstata peligroso en los próximos 8 a 10 años. [14] Los hombres con niveles de PSA superiores a 4 ng/mL tienen un mayor riesgo (alrededor de 1 de cada 4 desarrollará cáncer de próstata) y a menudo son remitidos para una biopsia de próstata. [15] [16] Los niveles de PSA superiores a 10 ng/mL indican un riesgo aún mayor: más de la mitad de los hombres de este grupo desarrollan cáncer de próstata. [15] A los hombres con niveles altos de PSA se les suele recomendar que repitan el análisis de sangre cuatro a seis semanas después, ya que los niveles de PSA pueden fluctuar sin relación con el cáncer de próstata. [17] La hiperplasia prostática benigna , la infección de próstata , la eyaculación reciente y algunos procedimientos urológicos pueden aumentar los niveles de PSA; tomar inhibidores de la 5α-reductasa puede disminuir los niveles de PSA. [15]
Las personas con un PSA elevado pueden someterse a análisis de sangre de detección secundarios que miden los subtipos de PSA y otras moléculas para predecir mejor la probabilidad de que una persona desarrolle un cáncer de próstata agresivo. Muchos miden el "PSA libre", la fracción de PSA no unido a otras proteínas de la sangre, generalmente alrededor del 10% al 30%. Los hombres que tienen un porcentaje menor de PSA libre tienen más probabilidades de tener cáncer de próstata. [18] Varias pruebas comunes detectan con mayor precisión los casos de cáncer de próstata al medir también los subtipos de PSA libre, incluido el índice de salud de la próstata (mide un fragmento llamado −2proPSA) y la puntuación 4K (mide el PSA libre intacto). [19] [20] Otras pruebas miden los niveles en sangre de proteínas adicionales relacionadas con la próstata, como la calicreína-2 (también medida por la puntuación 4K), o los niveles en orina de moléculas de ARNm comunes a los tumores de próstata como PCA3 y TMPRSS2 fusionadas a ERG . [21]
Varios estudios a gran escala han demostrado que los hombres sometidos a pruebas de detección de cáncer de próstata tienen un riesgo reducido de morir a causa de la enfermedad; [22] sin embargo, la detección de casos de cáncer que de otro modo no habrían afectado a la salud puede causar ansiedad y dar lugar a biopsias y tratamientos innecesarios, los cuales pueden causar complicaciones no deseadas. [12] Las principales organizaciones nacionales de salud ofrecen diferentes recomendaciones, intentando equilibrar los beneficios del diagnóstico temprano con los posibles daños de tratar a personas cuyos tumores es poco probable que afecten a la salud. [12] La mayoría de las pautas médicas recomiendan que los hombres con alto riesgo de cáncer de próstata (debido a la edad, antecedentes familiares, origen étnico o evidencia previa de altos niveles de PSA en sangre) sean asesorados sobre los riesgos y beneficios de las pruebas de PSA y se les ofrezca acceso a pruebas de detección. [12] Las pautas médicas generalmente recomiendan no realizar pruebas de detección a los hombres mayores de 70 años o con una expectativa de vida de menos de 10 años, ya que es poco probable que un cáncer de próstata recién diagnosticado afecte su esperanza de vida natural. [12] [22] La aceptación de las pruebas de detección varía según la geografía: más del 80% de los hombres se someten a pruebas de detección en los EE. UU. y Europa occidental, el 20% de los hombres en Japón, y las pruebas de detección son poco frecuentes en regiones con un índice de desarrollo humano bajo . [22]
Diagnóstico

Los hombres con sospecha de cáncer de próstata pueden someterse a varias pruebas para evaluar la próstata. Un procedimiento común es el examen rectal digital , en el que un médico inserta un dedo lubricado en el recto para palpar la próstata cercana. [23] [24] Los tumores se sienten como bultos rígidos de forma irregular contra el resto de la próstata. El endurecimiento de la próstata también puede deberse a la hiperplasia prostática benigna ; alrededor del 20-25% de aquellos con hallazgos anormales en sus exámenes rectales tienen cáncer de próstata. [25] Las pautas de varias sociedades urológicas recomiendan la resonancia magnética (MRI) para evaluar la próstata en busca de tumores potenciales en hombres con altos niveles de PSA. Los resultados de la MRI pueden ayudar a distinguir a aquellos que tienen tumores potencialmente peligrosos de aquellos que no los tienen. [26]
Un diagnóstico definitivo de cáncer de próstata requiere una biopsia de la próstata. Las biopsias de próstata se toman típicamente con una aguja que pasa a través del recto o el perineo , guiada por ecografía transrectal , resonancia magnética o una combinación de las dos. [27] [24] Se toman de diez a doce muestras de varias regiones de la próstata para mejorar las posibilidades de encontrar tumores. [24] Las biopsias se envían para un diagnóstico histopatológico de cáncer de próstata , en el que son examinadas bajo un microscopio por un patólogo , que determina el tipo y la extensión de las células cancerosas presentes. Los cánceres se clasifican primero según su apariencia bajo un microscopio. Más del 95% de los cánceres de próstata se clasifican como adenocarcinomas (que se asemejan al tejido glandular ), y el resto en gran parte carcinoma de células escamosas (que se asemeja a las células escamosas , un tipo de célula epitelial ) y carcinoma de células transicionales (que se asemeja a las células transicionales ). [28]

A continuación, las muestras tumorales se clasifican en función de cuánto difiere el tejido tumoral del tejido prostático normal; cuanto más diferente parezca el tumor, más rápido es probable que crezca. El sistema de clasificación de Gleason se utiliza comúnmente, donde el patólogo asigna números que van desde 3 (más similar al tejido prostático sano) a 5 (menos similar) a diferentes regiones del tejido biopsiado. Luego calculan una "puntuación de Gleason" sumando los dos números que representan las áreas más grandes de la muestra de biopsia. [28] La puntuación de Gleason más baja posible de 6 representa una biopsia más similar a la próstata sana; la puntuación de Gleason más alta de 10 representa el cáncer más grave. [nota 1] Las puntuaciones de Gleason se agrupan comúnmente en "grupos de grado de Gleason", que predicen el pronóstico de la enfermedad: una puntuación de Gleason de 6 es el grupo de grado de Gleason 1 (mejor pronóstico). Una puntuación de 7 (con puntuaciones de Gleason 4 + 3, o puntuaciones de Gleason 3 + 4, con la más prominente listada primero) puede ser grupo de grado 2 o 3; es grupo de grado 2 si la puntuación de Gleason menos grave (3) cubrió más área; grupo de grado 3 si la puntuación de Gleason más grave (4) cubrió más área. Una puntuación de 8 es grupo de grado 4. Una puntuación de 9 o 10 es grupo de grado 5 (peor pronóstico). [28]
La extensión de la propagación del cáncer se evalúa mediante una resonancia magnética o una tomografía por emisión de positrones ( PSMA ) , una técnica de obtención de imágenes en la que se utiliza un marcador radiactivo que se une a la proteína prostática , el antígeno prostático específico de membrana, para detectar metástasis distantes de la próstata. [30] [24] También se pueden utilizar tomografías computarizadas , pero son menos capaces de detectar la propagación fuera de la próstata que la resonancia magnética. La gammagrafía ósea se utiliza para evaluar la propagación del cáncer a los huesos. [30]
Puesta en escena

Después del diagnóstico, el tumor se estadifica para determinar la extensión de su crecimiento y propagación. El cáncer de próstata generalmente se estadifica utilizando el sistema TNM de tres componentes del Comité Conjunto Estadounidense sobre Cáncer (AJCC) , con puntajes asignados para la extensión del tumor (T), la propagación a cualquier ganglio linfático (N) y la presencia de metástasis (M). [31] Los puntajes de T1 y T2 representan tumores que permanecen dentro de la próstata: T1 es para tumores no detectables por imágenes o examen rectal digital; T2 es para tumores detectables por imágenes o examen rectal, pero aún confinados dentro de la próstata. [32] T3 es para tumores que crecen más allá de la próstata - T3a para tumores con cualquier extensión fuera de la próstata; T3b para tumores que invaden las vesículas seminales adyacentes . T4 es para tumores que han crecido en órganos más allá de las vesículas seminales. [32] Los puntajes N y M son binarios (sí o no). N1 representa cualquier propagación a los ganglios linfáticos cercanos. M1 representa cualquier metástasis a otros sitios del cuerpo. [32]
El AJCC combina entonces las puntuaciones TNM, el grupo de grado de Gleason y los resultados del análisis de sangre de PSA para categorizar los casos de cáncer en uno de cuatro estadios y sus subdivisiones. Los casos de cáncer con tumores localizados (T1 o T2), sin propagación (N0 y M0), grupo de grado de Gleason 1 y PSA inferior a 10 ng/mL se designan como estadio I. Aquellos con tumores localizados y PSA entre 10 y 20 ng/mL se designan como estadio II, subdividido en IIA para el grupo de grado de Gleason 1, IIB para el grupo de grado 2 y IIC para el grupo de grado 3 o 4. El estadio III es la designación para cualquiera de los tres factores de riesgo más altos: IIIA es para un nivel de PSA de alrededor de 20 ng/mL; IIIB es para tumores T3 o T4; IIIC es para un grupo de grado de Gleason de 5. El estadio IV es para cánceres que se han propagado a los ganglios linfáticos (N1, estadio IVA) u otros órganos (M1, estadio IVB). [31]
| Etapa AJCC | Puntuaciones TNM | Grupo de grado Gleason | Anuncio de servicio público |
|---|---|---|---|
| Etapa I | T1 o T2, N0, M0 | 1 | <10 ng/ml |
| Estadio IIA | T1 o T2, N0, M0 | 1 | 10-20 ng/ml |
| Estadio IIB | 2 | ||
| Estadio IIC | 3 o 4 | ||
| Estadio IIIA | T1 o T2, N0, M0 | 3 o 4 | > 20 ng/ml |
| Estadio IIIB | T3 o T3, N0, M0 | 10–20 ng/ml | |
| Estadio IIIC | T1 o T2, N0, M0 | 5 | |
| Estadio IVA | Cualquier T, N1 | Cualquier grupo | Cualquier anuncio de PSA |
| Estadio IVB | Cualquier T, M1 |
El Instituto Nacional para la Excelencia en la Salud y la Atención del Reino Unido recomienda un sistema de cinco etapas basado en el pronóstico de la enfermedad llamado Grupo Pronóstico de Cambridge, con grupos pronósticos CPG 1 a CPG 5. [33] CPG 1 es el mismo que el estadio I de AJCC. Los casos con tumores localizados (T1 o T2) y grupo de grado Gleason 2 o niveles de PSA superiores (10 a 20 ng/mL) se designan CPG 2. CPG 3 representa el grupo de grado Gleason 3 o la combinación de los criterios CPG 2. CPG 4 es similar al estadio 3 de AJCC: cualquiera del grupo de grado Gleason 4, niveles de PSA superiores a 20 ng/mL o un tumor que ha crecido más allá de la próstata (T3). CPG 5 es para los casos de mayor riesgo: un tumor T4, grupo de grado Gleason 5 o cualquiera de los dos criterios CPG 4. [34]
Prevención
Las agencias reguladoras no han aprobado ningún medicamento ni vacuna para la prevención del cáncer de próstata. Varios estudios han demostrado que los inhibidores de la 5α-reductasa reducen la incidencia total del cáncer de próstata; sin embargo, a fecha de 2022 no está claro si reducen los casos de esta enfermedad peligrosa. [35]
Gestión
El tratamiento del cáncer de próstata varía según el grado de avance del cáncer, el riesgo de que se propague y la salud y las preferencias personales de la persona afectada. [36] Las personas con enfermedad localizada con bajo riesgo de propagación suelen tener más probabilidades de sufrir daños por los efectos secundarios del tratamiento que por la enfermedad en sí, por lo que se les realizan pruebas periódicas para detectar un empeoramiento de la enfermedad. [37] Las personas con mayor riesgo pueden recibir tratamiento para eliminar el tumor, normalmente prostatectomía (cirugía para extirpar la próstata) o radioterapia , a veces junto con terapia hormonal . [38] Las personas con enfermedad metastásica reciben tratamiento con quimioterapia , así como con radiación u otros agentes para aliviar los síntomas de los tumores metastásicos. [38] Los niveles de PSA en sangre se controlan cada pocos meses para evaluar la eficacia de los tratamientos y si la enfermedad está recurriendo o avanzando. [39]
Enfermedad localizada

Los hombres a los que se les diagnostica un caso de cáncer de próstata de bajo riesgo suelen posponer el tratamiento y son controlados regularmente para detectar la progresión del cáncer mediante una vigilancia activa , que implica la realización de pruebas para detectar el crecimiento del tumor a intervalos fijos mediante pruebas de PSA (aproximadamente cada seis meses), examen rectal digital (anualmente) y resonancia magnética o biopsias repetidas (cada uno a tres años). [40] Este programa continúa hasta que los aumentos en los niveles de PSA, el grado de Gleason o el tamaño del tumor indiquen un tumor de mayor riesgo que puede requerir intervención. [41] Al menos la mitad de los hombres permanecen en vigilancia activa y nunca requieren un tratamiento más directo para sus tumores de próstata. [42]
Aquellos que eligen recibir terapia reciben radioterapia o prostatectomía ; estas tienen tasas similares de control del cáncer, pero diferentes efectos secundarios. [43] [44] La radiación se puede administrar mediante radioterapia de intensidad modulada (IMRT), que permite administrar dosis altas (superiores a 80 Gy ) a la próstata con relativamente poca radiación a otros órganos, o mediante braquiterapia , donde se inserta quirúrgicamente una fuente radiactiva en la próstata. [45] [46] La IMRT se administra en varias sesiones, y los tratamientos se repiten cinco días a la semana durante varias semanas. La braquiterapia generalmente se realiza en una sola sesión, con la fuente radiactiva implantada permanentemente en la próstata, donde gasta su radiactividad en los próximos meses. [47] Con cualquiera de las técnicas, el daño por radiación a los órganos cercanos puede aumentar el riesgo de cáncer de vejiga posterior y causar disfunción eréctil , infertilidad , plexopatía lumbar irreversible [48] y proctitis por radiación : daño al recto que puede causar diarrea , heces con sangre , incontinencia fecal y dolor. [49]

La prostatectomía radical tiene como objetivo extirpar quirúrgicamente la parte cancerosa de la próstata, junto con las vesículas seminales y el extremo del conducto deferente (el conducto que transporta los espermatozoides desde los testículos). [50] En los países más ricos, esto generalmente se realiza mediante cirugía asistida por robot , donde las herramientas robóticas insertadas a través de pequeños orificios en el abdomen permiten al cirujano realizar movimientos pequeños y exactos durante la cirugía. [51] Este método da como resultado estadías hospitalarias más cortas, menos pérdida de sangre y menos complicaciones que la cirugía abierta tradicional. [51] En lugares donde la cirugía asistida por robot no está disponible, la prostatectomía se puede realizar por vía laparoscópica (usando una cámara y herramientas manuales a través de pequeños orificios en el abdomen) o mediante cirugía abierta tradicional con una incisión por encima del pene (abordaje retropúbico) o por debajo del escroto (abordaje perineal). [52] [51] Los cuatro enfoques dan como resultado tasas similares de control del cáncer. [52] El daño al tejido cercano durante la cirugía puede resultar en disfunción eréctil e incontinencia urinaria . La disfunción eréctil es más probable en personas mayores o que han tenido problemas de erección previamente. [52] La incontinencia es más común en personas mayores y que tienen uretras más cortas . [52] Tanto para los resultados de la progresión del cáncer como para los efectos secundarios quirúrgicos, la habilidad y la experiencia del cirujano individual que realiza el procedimiento se encuentran entre los mayores determinantes del éxito. [52]
Después de la prostatectomía, los niveles de PSA caen rápidamente, alcanzando niveles muy bajos o indetectables en dos meses. La radioterapia también reduce sustancialmente los niveles de PSA, pero más lentamente y de forma menos completa, y los niveles de PSA alcanzan su punto más bajo dos años después de la radioterapia. [53] Después de cualquiera de los tratamientos, los niveles de PSA se controlan regularmente. Hasta la mitad de los tratados eventualmente tendrán un aumento en los niveles de PSA, lo que sugiere que el tumor o las pequeñas metástasis están creciendo nuevamente. [54] A las personas con niveles altos o en aumento de PSA a menudo se les ofrece otra ronda de radioterapia dirigida al sitio anterior del tumor. Esto reduce el riesgo de una mayor progresión en un 75%. [55] A las personas sospechosas de metástasis se les puede realizar una tomografía por emisión de positrones con radiotrazadores sensibles C-11 colina, F-18 fluciclovina y F-18 o Ga-68 unidos a un fármaco dirigido al PSMA, cada uno de los cuales es capaz de detectar pequeñas metástasis con mayor sensibilidad que los métodos de diagnóstico por imagen alternativos. [56] [55]
Enfermedad metastásica

Para aquellos con enfermedad metastásica, el estándar de atención es la terapia de privación de andrógenos (también llamada "castración química"), medicamentos que reducen los niveles de andrógenos (hormonas sexuales masculinas) que las células de la próstata requieren para crecer. [57] Se utilizan varios medicamentos para reducir los niveles de andrógenos al bloquear la síntesis o acción de la testosterona , el andrógeno primario. La primera línea de tratamiento generalmente implica agonistas de GnRH como leuprolida , goserelina o triptorelina mediante inyección mensual o con menor frecuencia según sea necesario. [58] [57] Los agonistas de GnRH causan un breve aumento en los niveles de testosterona al inicio del tratamiento, lo que puede empeorar la enfermedad en personas con síntomas significativos de metástasis. [59] En estas personas, se administran antagonistas de GnRH como degarelix o relugolix , y también pueden reducir rápidamente los niveles de testosterona. [59] La reducción de testosterona puede causar varios efectos secundarios, incluyendo sofocos , reducción de la masa muscular y densidad ósea, disminución del deseo sexual, fatiga, cambios de personalidad y un mayor riesgo de diabetes, enfermedades cardiovasculares y depresión. [59] La terapia hormonal detiene el crecimiento del tumor en más del 95% de los tratados, [60] y los niveles de PSA vuelven a la normalidad en hasta el 70%. [61]
A pesar de los niveles reducidos de testosterona, los tumores de próstata metastásicos continúan creciendo, lo que se manifiesta por el aumento de los niveles de PSA en sangre y metástasis en los huesos cercanos. [62] [63] Esta es la etapa más avanzada de la enfermedad, llamada cáncer de próstata resistente a la castración (CRPC). Los tumores CRPC desarrollan continuamente resistencia a los tratamientos, lo que requiere varias líneas de terapia, cada una utilizada en secuencia para prolongar la supervivencia. El estándar de atención es la quimioterapia docetaxel junto con medicamentos antiandrógenos , a saber, los antagonistas del receptor de andrógenos enzalutamida , apalutamida y darolutamida , así como el inhibidor de la producción de testosterona acetato de abiraterona . [64] [62] [65] Una alternativa es el procedimiento de terapia celular Sipuleucel-T , donde se eliminan las células inmunes de la persona afectada, se tratan para atacar de manera más efectiva las células de cáncer de próstata y se vuelven a inyectar. [62] Los tumores que desarrollan resistencia al docetaxel pueden recibir el fármaco taxano de segunda generación cabazitaxel . [62]
Algunos tratamientos para el CRPC se utilizan solo en hombres cuyos tumores tienen ciertas características que hacen que la terapia tenga más probabilidades de ser efectiva. Los hombres cuyos tumores expresan la proteína PSMA pueden recibir el radiofármaco Lu-177 PSMA , que se une a las células positivas para PSMA y las destruye. [66] [62] Aquellos cuyos tumores tienen una reparación defectuosa del daño del ADN se benefician del tratamiento con el fármaco inhibidor del punto de control inmunitario pembrolizumab e inhibidores de PARP , a saber, olaparib , rucaparib o niraparib . [62]
Cuidados de apoyo
Las metástasis óseas, presentes en alrededor del 85% de las personas con cáncer de próstata metastásico, son la causa principal de los síntomas y la muerte por cáncer de próstata metastásico. [67] [7] A las personas con dolor constante se les prescriben medicamentos antiinflamatorios no esteroides . [68] Sin embargo, las personas con metástasis óseas pueden experimentar "dolor irruptivo", ráfagas repentinas de dolor intenso que se resuelven en unos 15 minutos, antes de que los analgésicos puedan hacer efecto. [68] Los sitios únicos de dolor se pueden tratar con radioterapia de haz externo para reducir los tumores cercanos. [69] El dolor óseo más disperso se puede tratar con compuestos radiactivos que se acumulan desproporcionadamente en el hueso, como el radio-223 y el samario-153-EDTMP , que ayudan a reducir el tamaño de los tumores óseos. De manera similar, los quimioterapéuticos sistémicos utilizados para el cáncer de próstata metastásico pueden reducir el dolor a medida que reducen los tumores. [69] Otros agentes modificadores óseos como el ácido zoledrónico y el denosumab pueden reducir el dolor óseo del cáncer de próstata, aunque tienen poco efecto en el tamaño del tumor. [69] Las metástasis comprimen la médula espinal en hasta el 12% de los pacientes con cáncer de próstata metastásico, lo que causa dolor, debilidad, entumecimiento y parálisis. [70] [ 71] La inflamación en la columna vertebral se puede tratar con esteroides en dosis altas, así como con cirugía y radioterapia para reducir los tumores espinales y aliviar la presión sobre la médula espinal. [70] [71]
Las personas con cáncer de próstata avanzado sufren fatiga, letargo y una debilidad generalizada. Esto es causado en parte por problemas gastrointestinales, con pérdida de apetito , pérdida de peso, náuseas y estreñimiento , todos comunes. Estos generalmente se tratan con medicamentos que aumentan el apetito ( acetato de megestrol o corticosteroides) , antieméticos o tratamientos que se centran en los problemas gastrointestinales subyacentes. [72] La debilidad general también puede ser causada por anemia , causada por una combinación de la propia enfermedad, mala nutrición y daño a la médula ósea por tratamientos contra el cáncer o metástasis óseas. [73] La anemia se puede tratar de varias formas según la causa, o se puede abordar directamente con transfusiones de sangre . [73] El daño orgánico y las metástasis en los ganglios linfáticos pueden provocar una acumulación incómoda de líquido (llamado linfedema ) en los genitales o las extremidades inferiores. Estas hinchazones pueden ser extremadamente dolorosas y limitar la capacidad de la persona afectada para orinar, tener relaciones sexuales o caminar normalmente. El linfedema se puede tratar aplicando presión para facilitar el drenaje, drenando quirúrgicamente el líquido estancado y limpiando y tratando la piel dañada cercana. [74]
Las personas con cáncer de próstata tienen aproximadamente el doble de probabilidades de experimentar ansiedad o depresión en comparación con aquellas que no padecen cáncer. [75] Cuando se agregan a los tratamientos normales para el cáncer de próstata, las intervenciones psicológicas como la psicoeducación y la terapia cognitiva conductual pueden ayudar a reducir la ansiedad, la depresión y la angustia general. [76]
A medida que las personas gravemente enfermas de cáncer de próstata metastásico se acercan al final de sus vidas, la mayoría experimenta confusión y puede alucinar o tener problemas para reconocer a sus seres queridos. [77] [78] La confusión es causada por varias afecciones, que incluyen insuficiencia renal , sepsis , deshidratación y como efecto secundario de varios medicamentos, especialmente opioides . [77] La mayoría de las personas duermen durante períodos prolongados y algunas se sienten somnolientas cuando están despiertas. [78] La inquietud también es común, a veces causada por malestar físico por estreñimiento o retención urinaria , a veces causada por ansiedad. [78] En sus últimos días, la respiración de los hombres afectados puede volverse superficial y lenta, con largas pausas entre respiraciones. La respiración puede estar acompañada de un ruido de traqueteo a medida que el líquido permanece en la garganta, pero esto no es incómodo para la persona afectada. [78] [79] Sus manos y pies pueden enfriarse al tacto y la piel se vuelve manchada o azul debido a una circulación sanguínea más débil. Muchas personas dejan de comer y beber, lo que les produce una sensación de sequedad en la boca, que se puede aliviar humedeciéndose la boca y los labios. [78] La persona se vuelve cada vez menos receptiva y, finalmente, el corazón y la respiración se detienen. [79]
Pronóstico
El pronóstico del cáncer de próstata diagnosticado varía ampliamente en función del grado y la etapa del cáncer en el momento del diagnóstico; aquellos con enfermedad en etapa más baja tienen pronósticos enormemente mejorados. Alrededor del 80% de los diagnósticos de cáncer de próstata se dan en hombres cuyo cáncer todavía está confinado a la próstata. Estos hombres pueden sobrevivir mucho tiempo después del diagnóstico, y hasta el 99% sigue vivo 10 años después del diagnóstico. [80] Los hombres cuyo cáncer ha hecho metástasis en una parte cercana del cuerpo (alrededor del 15% de los diagnósticos) tienen pronósticos peores, con tasas de supervivencia a cinco años del 60 al 80%. [1] Aquellos con metástasis en sitios corporales distantes (alrededor del 5% de los diagnósticos) tienen pronósticos relativamente malos, con tasas de supervivencia a cinco años del 30 al 40%. [1]
Los pacientes que tienen niveles bajos de PSA en sangre al momento del diagnóstico y cuyos tumores tienen un grado de Gleason bajo y una etapa clínica menos avanzada tienden a tener mejores pronósticos. [81] Después de la prostatectomía o radioterapia, aquellos que tienen un corto tiempo entre el tratamiento y un aumento posterior en los niveles de PSA, o niveles de PSA que aumentan rápidamente, tienen más probabilidades de morir a causa de sus cánceres. [54] El cáncer de próstata metastásico resistente a la castración es incurable, [82] y mata a la mayoría de aquellos cuya enfermedad llega a esta etapa. [62]
Causa
El cáncer de próstata es causado por la acumulación de mutaciones genéticas en el ADN de las células de la próstata. Estas mutaciones afectan a los genes implicados en el crecimiento celular, la replicación, la muerte celular y la reparación del daño del ADN . [83] Con estos procesos desregulados, algunas células se replican de forma anormal, formando un grupo de células llamado tumor. [84] A medida que el tumor crece, sus células acumulan más mutaciones, lo que le permite estimular el crecimiento de nuevos vasos sanguíneos para apoyar un mayor crecimiento. [85] Con el tiempo, un tumor puede crecer lo suficiente como para invadir órganos cercanos, como las vesículas seminales o la vejiga . [86] En los tumores avanzados, las células pueden desarrollar la capacidad de desprenderse de su sitio de tejido original y evadir el sistema inmunológico . [85] Estas células pueden propagarse a través del sistema linfático a los ganglios linfáticos cercanos , o a través del torrente sanguíneo a la médula ósea y (más raramente) a otros sitios del cuerpo. [85] En estos nuevos sitios, las células cancerosas alteran la función corporal normal y continúan creciendo. Las metástasis causan la mayor parte de las molestias asociadas con el cáncer de próstata y eventualmente pueden matar a la persona afectada. [85]
Fisiopatología
La mayoría de los tumores de próstata comienzan en la zona periférica, la parte más externa de la próstata. [87] A medida que las células comienzan a crecer sin control, forman un pequeño grupo de células desreguladas llamado neoplasia intraepitelial prostática (PIN). [88] Algunas PIN continúan creciendo, formando capas de tejido que dejan de expresar genes comunes a su ubicación tisular original ( p63 , citoqueratina 5 y citoqueratina 14 ) y, en su lugar, comienzan a expresar genes típicos de las células en el revestimiento más interno del conducto pancreático ( citoqueratina 8 y citoqueratina 18) . [87] Estas PIN multicapa también sobreexpresan a menudo el gen AMACR , que está asociado con la progresión del cáncer de próstata. [87]
Algunos PIN pueden eventualmente convertirse en tumores. [88] Esto suele ir acompañado de cambios a gran escala en el genoma , con secuencias cromosómicas reorganizadas o copiadas repetidamente. Algunas alteraciones genómicas son particularmente comunes en el cáncer de próstata en etapa temprana, a saber, la fusión genética entre TMPRSS2 y el oncogén ERG (hasta el 60% de los tumores de próstata), mutaciones que desactivan SPOP (hasta el 15% de los tumores) y mutaciones que hiperactivan FOXA1 (hasta el 5% de los tumores). [87]
El cáncer de próstata metastásico tiende a tener más mutaciones genéticas que la enfermedad localizada. [89] Muchas de estas mutaciones se encuentran en genes que protegen del daño al ADN, como p53 (mutado en el 8% de los tumores localizados, más del 27% de los metastásicos) y RB1 (1% de los tumores localizados, más del 5% de los metastásicos). [89] De manera similar, las mutaciones en los genes relacionados con la reparación del ADN BRCA2 y ATM son raras en la enfermedad localizada, pero se encuentran en al menos el 7% y el 5% de los casos de enfermedad metastásica respectivamente. [89]
La transición del cáncer de próstata sensible a la castración al resistente a la castración también va acompañada de la adquisición de varias mutaciones genéticas. En la enfermedad resistente a la castración, más del 70% de los tumores tienen mutaciones en la vía de señalización del receptor de andrógenos : amplificaciones y mutaciones de ganancia de función en el propio gen del receptor, amplificación de sus activadores (por ejemplo, FOXA1) o mutaciones inactivadoras en sus reguladores negativos (por ejemplo, ZBTB16 y NCOR1 ). [89] Estas alteraciones del receptor de andrógenos solo se encuentran en hasta el 6% de las biopsias de enfermedad metastásica sensible a la castración. [89] De forma similar, las deleciones del supresor tumoral PTEN se albergan en el 12-17% de los tumores sensibles a la castración, pero en más del 40% de los tumores resistentes a la castración. [89] Con menos frecuencia, los tumores tienen una activación aberrante de la vía de señalización de Wnt a través de la alteración de los miembros APC (9% de los tumores) o CTNNB1 (4% de los tumores); o desregulación de la vía PI3K a través de mutaciones PI3KCA/PI3KCB (6% de los tumores) o AKT1 (2% de los tumores). [89]
Epidemiología

El cáncer de próstata es el segundo cáncer diagnosticado con mayor frecuencia en hombres y la segunda causa más frecuente de muerte por cáncer en hombres (después del cáncer de pulmón ). [2] [3] Cada año se diagnostican alrededor de 1,2 millones de nuevos casos de cáncer de próstata y más de 350 000 personas mueren a causa de la enfermedad anualmente. [2] Uno de cada ocho hombres es diagnosticado con cáncer de próstata en su vida y alrededor de uno de cada cuarenta muere a causa de la enfermedad. [3] Las tasas de cáncer de próstata aumentan con la edad. Debido a esto, las tasas de cáncer de próstata son generalmente más altas en partes del mundo con mayor esperanza de vida, que también tienden a ser áreas con mayor producto interno bruto y mayor índice de desarrollo humano . [2] Australia, Europa, América del Norte, Nueva Zelanda y partes de América del Sur tienen la incidencia más alta. Asia meridional, Asia central y África subsahariana tienen la incidencia más baja de cáncer de próstata; aunque la incidencia está aumentando rápidamente en estas regiones. [2] El cáncer de próstata es el cáncer más diagnosticado en hombres en más de la mitad de los países del mundo y la principal causa de muerte por cáncer en hombres en alrededor de una cuarta parte de los países. [91]
El cáncer de próstata es poco frecuente en personas menores de 40 años [92] y la mayoría de los casos se dan en personas mayores de 60 años [2] , siendo la edad media de diagnóstico de la enfermedad 67 años [93]. La edad media de los que mueren de cáncer de próstata es 77 años [93] . Sólo una minoría de los casos de cáncer de próstata son diagnosticados. Las autopsias de hombres que murieron a distintas edades han demostrado cáncer de próstata en más del 40% de los hombres mayores de 50 años. La incidencia aumenta con la edad y casi el 70% de los hombres a los que se les realizó una autopsia a los 80-89 años tenían cáncer de próstata [94] .
Genética
El cáncer de próstata es más común en familias con antecedentes de cualquier cáncer. [95] Los hombres con un familiar de primer grado afectado (padre o hermano) tienen más del doble de riesgo de desarrollar cáncer de próstata, y aquellos con dos familiares de primer grado tienen un riesgo cinco veces mayor en comparación con los hombres sin antecedentes familiares. [96] El mayor riesgo también se presenta en algunos grupos étnicos, con hombres de ascendencia africana y afrocaribeña con un riesgo particularmente alto: tienen cáncer de próstata en tasas más altas y tienen cánceres de próstata más agresivos que se desarrollan a edades más tempranas. [97] Grandes estudios de asociación de todo el genoma han identificado más de 100 variantes genéticas asociadas con un mayor riesgo de cáncer de próstata. [95] El mayor aumento del riesgo está asociado con variaciones en BRCA2 (hasta un riesgo ocho veces mayor) y HOXB13 (riesgo tres veces mayor), ambos involucrados en la reparación del daño del ADN . [95] Las variantes en otros genes involucrados en la reparación del daño del ADN también se han asociado con un mayor riesgo de desarrollar cáncer de próstata, particularmente cáncer de próstata de aparición temprana, incluyendo BRCA1 , ATM , NBS1 , MSH2 , MSH6 , PMS2 , CHEK2 , RAD51D y PALB2 . [95] Además, las variantes en el genoma cerca del oncogén MYC se asocian con un mayor riesgo. [95] Al igual que los polimorfismos de un solo nucleótido en el receptor de vitamina D común en afroamericanos, y en el receptor de andrógenos , CYP3A4 y CYP17 involucrados en la síntesis y señalización de testosterona . [96] En conjunto, se estima que las variantes genéticas conocidas causan alrededor del 25% de los casos de cáncer de próstata, incluido el 40% de los cánceres de próstata de aparición temprana. [96]
Cuerpo y estilo de vida
Los hombres más altos tienen un riesgo ligeramente mayor de desarrollar cáncer de próstata, al igual que los hombres obesos . [98] Los niveles altos de colesterol en sangre también se asocian con un mayor riesgo de cáncer de próstata; en consecuencia, quienes toman medicamentos para reducir el colesterol, estatinas , tienen un riesgo reducido de cáncer de próstata avanzado. [99] La inflamación crónica puede causar varios tipos de cáncer. Se han estudiado posibles vínculos entre la infección (u otras fuentes de inflamación) y el cáncer de próstata, pero no se ha encontrado ninguno definitivo, y un estudio a gran escala no encontró ningún vínculo entre el cáncer de próstata y antecedentes de gonorrea , sífilis , clamidia o infección con varios virus del papiloma humano . [100]
El ejercicio vigoroso regular puede reducir la probabilidad de desarrollar cáncer de próstata avanzado, al igual que varias intervenciones dietéticas. [101] Aquellos con una dieta rica en vegetales crucíferos (ciertas verduras de hoja verde, brócoli y coliflor), pescado , genisteína (presente en la soja ) o licopeno (presente en los tomates) tienen un riesgo reducido de cáncer de próstata sintomático. [96] [102] Por el contrario, aquellos que consumen altos niveles de grasas dietéticas, hidrocarburos aromáticos policíclicos (de la cocción de carnes rojas) o calcio pueden tener un mayor riesgo de desarrollar cáncer de próstata avanzado. [96] [103] Se han estudiado varios suplementos dietéticos y se ha descubierto que no afectan el riesgo de cáncer de próstata, incluidos el selenio , la vitamina C , la vitamina D y la vitamina E. [ 35] [103]
Poblaciones especiales
Las mujeres transgénero y las personas no conformes con su género que tienen próstata pueden desarrollar cáncer de próstata. Aquellas que se han sometido a terapia hormonal de afirmación de género o cirugía de afirmación de género tienen un riesgo reducido de desarrollar cáncer de próstata, en relación con los hombres cisgénero de edad similar. [104] Las pruebas de detección en este grupo son complicadas, ya que las mujeres transgénero pueden tener niveles de PSA más bajos que los hombres cisgénero debido a sus niveles reducidos de testosterona. [105] Los especialistas en atención de género generalmente consideran que los niveles de PSA superiores a 1 ng/mL están por encima de lo normal. [106] Los exámenes rectales digitales de la próstata a menudo son imposibles en mujeres que se han sometido a vaginoplastia , ya que la longitud y la rigidez de la nueva vagina pueden obstruir el acceso a la próstata desde el recto. [106]
Historia

El cirujano inglés George Langstaff describió por primera vez una masa prostática en 1817, tras la autopsia de un hombre que había muerto a los 68 años con dolor en la parte inferior del cuerpo y problemas urinarios. [107] [108] En 1853, el cirujano del Hospital de Londres John Adams describió otro tumor de próstata de un hombre que había muerto con problemas urinarios; Adams hizo que un patólogo examinara el tumor, proporcionando el primer caso confirmado de un tumor canceroso en la próstata. [107] [109] Al principio, la enfermedad rara vez se describía; un informe de 1893 encontró solo 50 casos descritos en la literatura médica. [110] A principios del siglo XIX, la cirugía de próstata para aliviar la obstrucción urinaria se volvió más común, lo que permitió a los cirujanos y patólogos examinar el tejido prostático extirpado. Dos estudios realizados en la época encontraron cáncer en hasta el 10% de las muestras quirúrgicas, lo que sugiere que el cáncer de próstata era una causa bastante común de agrandamiento de próstata. [110]
Durante gran parte del siglo XX, la terapia principal para el cáncer de próstata fue la cirugía para extirpar la próstata. La prostatectomía perineal fue realizada por primera vez en 1904 por Hugh H. Young en el Hospital Johns Hopkins . [111] [112] El método de Young se convirtió en el estándar generalizado, inicialmente realizado principalmente para aliviar los síntomas de bloqueo urinario. [111] En 1931, un nuevo método quirúrgico, la resección transuretral de la próstata , estuvo disponible, reemplazando a la prostatectomía perineal para el alivio sintomático de la obstrucción. [110] En 1945, Terence Millin describió un abordaje de prostatectomía retropúbica, que proporcionó un acceso más fácil a los ganglios linfáticos pélvicos para ayudar a estadificar la extensión de la enfermedad, y era más fácil de aprender para los cirujanos. [111] Esto fue mejorado por la descripción de Patrick C. Walsh en 1983 de un abordaje de prostatectomía retropúbica que evitaba dañar los nervios cerca de la próstata, preservando la función eréctil. [111] [113]
La radioterapia para el cáncer de próstata se utilizó ocasionalmente a principios del siglo XX, con radio implantado en la uretra o el recto para reducir el tamaño del tumor y los síntomas asociados. [114] En la década de 1950, la llegada de máquinas de radiación más potentes permitió que la radioterapia de haz externo llegara a la próstata. En la década de 1960, esto a menudo se combinaba con terapia hormonal para mejorar la potencia de la terapia. [114] En la década de 1970, Willet Whitmore fue pionero en una técnica de cirugía abierta en la que se colocaban agujas de yodo-125 directamente en la próstata. Henrik H. Holm mejoró esto en 1983 utilizando ecografía transrectal para guiar la implantación de material radiactivo. [114]
La observación de que los testículos (y las hormonas que secretan) influyen en el tamaño de la próstata se hizo ya a finales del siglo XVIII a través de experimentos de castración en animales. Sin embargo, la experimentación ocasional durante el siglo siguiente arrojó resultados mixtos, probablemente debido a la incapacidad de separar los tumores de próstata de las próstatas agrandadas debido a la hiperplasia prostática benigna. En 1941, Charles B. Huggins y Clarence V. Hodges publicaron dos estudios que usaban la castración quirúrgica o el estrógeno oral para reducir los niveles de andrógenos y mejorar los síntomas del cáncer de próstata. Huggins recibió el Premio Nobel de Fisiología o Medicina de 1966 por este descubrimiento, la primera terapia sistémica para el cáncer de próstata. [115] [116] En la década de 1960, grandes estudios demostraron que la terapia con estrógenos era tan efectiva como la castración quirúrgica para tratar el cáncer de próstata, pero que quienes recibían terapia con estrógenos tenían un mayor riesgo de sufrir coágulos sanguíneos . [115] Durante la década de 1980, los estudios de Andrzej W. Schally sobre GnRH condujeron al desarrollo de agonistas de GnRH, que resultaron ser tan eficaces como el estrógeno sin el mayor riesgo de coagulación. [115] [117] Schally recibió el Premio Nobel de Fisiología o Medicina en 1977 por su trabajo sobre GnRH y cáncer de próstata. [115]
La quimioterapia sistémica para el cáncer de próstata se ha estudiado desde la década de 1950, pero los ensayos clínicos no han logrado demostrar beneficios en la mayoría de las personas que reciben los medicamentos. [118] En 1996, la Administración de Alimentos y Medicamentos de los EE. UU. aprobó la quimioterapia sistémica mitoxantrona para aquellos con cáncer de próstata resistente a la castración basándose en ensayos que mostraban que mejoraba los síntomas, aunque no mejoraba la supervivencia. [119] En 2004, se aprobó docetaxel como la primera quimioterapia para aumentar la supervivencia en aquellos con cáncer de próstata resistente a la castración. [119] Después de ensayos adicionales en 2015, el uso de docetaxel se extendió a aquellos con cáncer de próstata sensible a la castración. [120]
Sociedad y cultura
La detección y la concientización sobre el cáncer de próstata se han promovido ampliamente desde principios de la década de 2000 con el Mes de Concientización sobre el Cáncer de Próstata en septiembre y Movember en noviembre. [121] Sin embargo, un análisis de búsquedas en Internet sugiere que ninguno de los dos eventos cambia mucho el nivel de interés o discusión sobre el cáncer de próstata, en contraste con el más establecido Mes de Concientización sobre el Cáncer de Mama . [121]
Investigación
El cáncer de próstata es un tema importante de investigación en curso. Entre 2016 y 2020, se invirtieron más de 1260 millones de dólares en investigación sobre el cáncer de próstata, lo que representa alrededor del 5 % de los fondos mundiales para la investigación del cáncer. [122] Esto coloca al cáncer de próstata en el décimo lugar entre los 18 tipos de cáncer más comunes en cuanto a financiación por muerte por cáncer, y en el noveno lugar en cuanto a financiación por año de vida ajustado por discapacidad perdido. [123]
La investigación sobre el cáncer de próstata se basa en una serie de modelos de laboratorio para probar aspectos de la enfermedad. Varias líneas celulares inmortalizadas de próstata se utilizan ampliamente, a saber, las líneas clásicas DU145 , PC-3 y LNCaP , así como las líneas celulares más recientes 22Rv1, LAPC-4 , VCaP y MDA-PCa-2a y −2b. [124] La investigación que requiere modelos más complejos de la próstata utiliza organoides : grupos de células de próstata que se pueden cultivar a partir de tumores de próstata humanos o células madre. [125] El modelado del crecimiento y la metástasis del tumor requiere un organismo modelo , normalmente un ratón. Los investigadores pueden implantar quirúrgicamente tumores de próstata humanos en ratones inmunodeprimidos (una técnica llamada xenoinjerto derivado del paciente ), [126] o inducir tumores de próstata en ratones con ingeniería genética . [127] Estos modelos de ratón modificados genéticamente suelen utilizar un sistema de recombinasa Cre para alterar los supresores tumorales o activar oncogenes específicamente en las células de la próstata. [128]
Notas
- ^ El sistema de clasificación de Gleason original de 1966 permitía puntuaciones patológicas de 1 a 5, lo que daba como resultado puntuaciones de Gleason de 2 a 10; sin embargo, una actualización de 2005 realizada por la Sociedad Internacional de Patología Urológica eliminó en gran medida las puntuaciones patológicas de 1 y 2. En la práctica común, los tumores ahora se puntúan de 3 a 5, lo que da como resultado puntuaciones de Gleason de 6 a 10. [29]
- ^ La incidencia del cáncer a menudo se estabiliza o disminuye en los grupos de mayor edad debido a la reducción del diagnóstico en personas que ya tienen mala salud. [90]
Referencias
- ^ abc Rebello et al. 2021, "Figura 3: Estadios y progresión del cáncer de próstata".
- ^ abcdef Rebello et al. 2021, "Epidemiología".
- ^ abc Scher & Eastham 2022, "Cáncer de próstata".
- ^ abc "Signos y síntomas del cáncer de próstata". Sociedad Estadounidense del Cáncer. 1 de agosto de 2019. Consultado el 21 de mayo de 2023 .
- ^ Merriel, Funston y Hamilton 2018, "Síntomas y signos".
- ^ Rebello et al. 2021, "Figura 3: Estadios y progresión del cáncer de próstata".
- ^ ab Coleman et al. 2020, "Prevalencia de SRE".
- ^ "Síntomas del cáncer de próstata". Cancer Research UK. 15 de marzo de 2022. Consultado el 21 de mayo de 2023 .
- ^ Coleman et al. 2020, "Cáncer de próstata".
- ^ Panorama clínico 2022, "Presentación clínica".
- ^ Scher & Eastham 2022, "Enfermedad metastásica: no castrada".
- ^ abcde Rebello et al. 2021, "Detección temprana y cribado".
- ^ "¿Qué es la detección del cáncer de próstata?". Centros para el Control y la Prevención de Enfermedades de EE. UU. 25 de agosto de 2022. Consultado el 17 de mayo de 2023 .
- ^ de Carlsson & Vickers 2020, "3. Adaptar la frecuencia de detección en función del nivel de PSA".
- ^ abc «Pruebas de detección del cáncer de próstata». Sociedad Estadounidense del Cáncer. 4 de enero de 2021. Consultado el 11 de diciembre de 2023 .
- ^ Scher & Eastham 2022, "Antígeno prostático específico".
- ^ Carlsson & Vickers 2020, "4. Para los hombres con PSA elevado (≥3 ng/mL), repita el PSA".
- ^ Duffy 2020, "Porcentaje de PSA libre".
- ^ Duffy 2020, "Índice de salud de la próstata (PHI)".
- ^ Duffy 2020, "Puntuación 4K".
- ^ Duffy 2020, Tabla 2.
- ^ abc Rebello et al. 2021, "Cuadro 1: Detección del cáncer de próstata en diferentes regiones".
- ^ "Pruebas para diagnosticar y estadificar el cáncer de próstata". Sociedad Estadounidense del Cáncer. 21 de febrero de 2023. Consultado el 18 de mayo de 2023 .
- ^ abcd Rebello et al. 2021, “Diagnóstico”.
- ^ Scher & Eastham 2022, "Examen físico".
- ^ Maffei, Giganti y Moore 2023, "La resonancia magnética como prueba para hombres remitidos clínicamente con un PSA elevado o un examen rectal digital anormal.
- ^ Scher & Eastham 2022, "Biopsia de próstata".
- ^ abc Scher & Eastham 2022, "Patología".
- ^ Epstein 2018, "Antecedentes históricos", "Conferencias de clasificación ISUP de 2005 y 2014" y "Patrones de Gleason".
- ^ de Scher & Eastham 2022, "Estadificación del cáncer de próstata".
- ^ ab "Estadificación del cáncer de próstata". Sociedad Estadounidense del Cáncer. 8 de octubre de 2021. Consultado el 14 de mayo de 2023 .
- ^ abc Scher & Eastham 2022, "Tabla 87-1 Clasificación TNM".
- ^ "Cáncer de próstata: diagnóstico y tratamiento. Guía NICE [NG131]". Instituto Nacional para la Excelencia en la Salud y la Atención (NICE) . 9 de mayo de 2019. Consultado el 3 de octubre de 2022 .
- ^ "Grupos de riesgo de cáncer de próstata y el Cambridge Prognostic Group (CPG)". Cancer Research UK. 24 de mayo de 2022. Consultado el 25 de junio de 2023 .
- ^ ab Scher & Eastham 2022, "Sin diagnóstico de cáncer".
- ^ Rebello y col. 2021, "Gestión".
- ^ Scher & Eastham 2022, "Vigilancia activa".
- ^ ab "Tratamiento inicial del cáncer de próstata, por estadio y grupo de riesgo". Sociedad Estadounidense del Cáncer. 9 de agosto de 2022. Consultado el 28 de mayo de 2023 .
- ^ "Seguimiento de los niveles de PSA durante y después del tratamiento del cáncer de próstata". Sociedad Estadounidense del Cáncer. 1 de agosto de 2019. Consultado el 28 de mayo de 2023 .
- ^ "Observación o vigilancia activa del cáncer de próstata". Sociedad Estadounidense del Cáncer. 22 de noviembre de 2023. Consultado el 16 de abril de 2024 .
- ^ Liu et al. 2021, "Reclasificación y progresión".
- ^ Liu y otros. 2021, "Resumen".
- ^ Rebello et al. 2021, "Enfermedad localizada".
- ^ Scher & Eastham 2022, "Cáncer de próstata clínicamente localizado".
- ^ Scher & Eastham 2022, "Radioterapia de haz externo".
- ^ Scher & Eastham 2022, "Braquiterapia".
- ^ "Radioterapia para el cáncer de próstata". Sociedad Estadounidense del Cáncer. 13 de febrero de 2023. Consultado el 5 de diciembre de 2023 .
- ^ Brejt N, Berry J, Nisbet A, Bloomfield D, Burkill G (30 de diciembre de 2013). "Radiculopatías pélvicas, plexopatías lumbosacras y neuropatías en la enfermedad oncológica: un enfoque multidisciplinario para un desafío diagnóstico". Cancer Imaging . 13 (4): 591–601. doi :10.1102/1470-7330.2013.0052. PMC 3893894 . PMID 24433993 . Consultado el 14 de octubre de 2024 .
- ^ Brawley, Mohan y Nein 2018, "Radioterapia".
- ^ Dall'Era 2023, "Prostatectomía radical".
- ^ abc Costello 2020, "El auge de la cirugía robótica".
- ^ abcde Scher & Eastham 2022, "Prostatectomía radical".
- ^ "Seguimiento de los niveles de PSA durante y después del tratamiento del cáncer de próstata". Sociedad Estadounidense del Cáncer. 1 de agosto de 2019. Consultado el 5 de diciembre de 2023 .
- ^ ab Rebello et al. 2021, "Recurrencia bioquímica y enfermedad residual".
- ^ ab Rebello et al. 2021, "Recurrencia bioquímica y enfermedad residual".
- ^ Scher & Eastham 2022, "Aumento del PSA después de la terapia local definitiva".
- ^ ab Rebello et al. 2021, "Cáncer de próstata metastásico sensible a las hormonas".
- ^ "Terapia hormonal para el cáncer de próstata". Sociedad Estadounidense del Cáncer. 9 de agosto de 2022. Consultado el 15 de mayo de 2023 .
- ^ abc Scher & Eastham 2022, "Agentes reductores de testosterona".
- ^ Achard y col. 2022, "Introducción".
- ^ Scher & Eastham 2022, "Resultados de la privación de andrógenos".
- ^ abcdefg Scher & Eastham 2022, "Enfermedad metastásica: castrar".
- ^ Rebello et al. 2021, "Cáncer de próstata metastásico resistente a la castración".
- ^ Teo, Rathkopf y Kantoff 2019, "Manejo del cáncer de próstata metastásico resistente a la castración".
- ^ Teo, Rathkopf y Kantoff 2019, "Acetato de abiraterona".
- ^ "La FDA aprueba Pluvicto para el cáncer de próstata metastásico resistente a la castración". Administración de Alimentos y Medicamentos de Estados Unidos. 23 de marzo de 2022. Consultado el 9 de enero de 2024 .
- ^ Coleman et al. 2020, "Prevalencia de metástasis óseas".
- ^ ab Coleman et al. 2020, "Analgésicos utilizados en CIBP".
- ^ abc Scher & Eastham 2022, "Manejo del dolor".
- ^ ab Thompson, Wood & Feuer 2007, "Compresión del cordón".
- ^ ab "¿Qué es la compresión metastásica de la médula espinal (MSCC)?". Prostate Cancer UK. Junio de 2022. Consultado el 25 de junio de 2023 .
- ^ Thompson, Wood y Feuer 2007, "Síntomas gastrointestinales".
- ^ ab Thompson, Wood & Feuer 2007, "Debilidad general".
- ^ Thompson, Wood y Feuer 2007, "Linfoedema".
- ^ Mundle, Afenya y Agarwal 2021, "Estimaciones de ansiedad, depresión y angustia".
- ^ Mundle, Afenya & Agarwal 2021, "Resumen".
- ^ por Thompson, Wood y Feuer 2007, "Delirio".
- ^ abcde «Morir de cáncer de próstata: qué esperar». Prostate Cancer UK. Julio de 2018. Consultado el 25 de junio de 2023 .
- ^ ab "Atención durante los últimos días". Sociedad Estadounidense de Oncología Clínica. Noviembre de 2022. Consultado el 25 de junio de 2023 .
- ^ Rebello et al. 2021, "Pronóstico y supervivencia".
- ^ Pilie et al. 2022, Cuadro 45-2.
- ^ Rebello y col. 2021, "Resumen".
- ^ Rebello y col. 2021, "Genética".
- ^ "¿Qué causa el cáncer de próstata?". Sociedad Estadounidense del Cáncer. 1 de agosto de 2019. Consultado el 17 de mayo de 2023 .
- ^ abcd Rebello et al. 2021, "Progresión de la enfermedad".
- ^ "Cáncer de próstata localmente avanzado". Cancer Research UK. 31 de mayo de 2022. Consultado el 21 de mayo de 2023 .
- ^ abcd Sandhu et al. 2021, "La biología del cáncer de próstata".
- ^ ab "Comprensión de su informe patológico: neoplasia intraepitelial prostática (NIP) y carcinoma intraductal". Sociedad Estadounidense del Cáncer . Consultado el 25 de mayo de 2023 .
- ^ abcdefg Rebello et al. 2021, "Enfermedad metastásica".
- ^ "Estadísticas de incidencia del cáncer de próstata". Cancer Research UK. 15 de mayo de 2015. Consultado el 2 de abril de 2024 .
- ^ Bergengren y col. 2023, "3.1 Epidemiología".
- ^ Pernar et al. 2018, "Factores de riesgo para el cáncer de próstata total".
- ^ ab Stephenson, Abouassaly & Klein 2021, "Edad en el momento del diagnóstico".
- ^ Dall'Era 2023, "Consideraciones generales".
- ^ abcde Rebello et al. 2021, "Predisposición genética".
- ^ abcde Scher & Eastham 2022, "Epidemiología".
- ^ McHugh et al. 2022, "Introducción".
- ^ Pernar et al. 2018, "Factores de riesgo de cáncer de próstata avanzado y mortal".
- ^ Pernar y col. 2018, "Estatinas".
- ^ Stephenson, Abouassaly y Klein 2021, "Inflamación e infección".
- ^ Pernar y col. 2018, "Ejercicio".
- ^ Pernar et al. 2018, "Pescado".
- ^ ab Pernar et al. 2018, "Calcio, productos lácteos y vitamina D".
- ^ Bertoncelli Tanaka et al. 2022, "Conclusiones".
- ^ Bertoncelli Tanaka y col. 2022, "Interpretación del PSA en mujeres transgénero en GAHT".
- ^ ab Bertoncelli Tanaka et al. 2022, "Detección del cáncer de próstata en mujeres transgénero".
- ^ ab Valier 2016, págs. 15-18.
- ^ Lawrence W (1817). "Casos de hongos hematopos, con observaciones, por George Langstaff, Esq. y un apéndice que contiene dos casos de afecciones análogas". Med Chir Trans . 8 : 272–314. doi :10.1177/095952871700800114. PMC 2129005 . PMID 20895322.
- ^ Adams J (1853). "El caso de escirrosis de la glándula prostática con afección correspondiente de los ganglios linfáticos en la región lumbar y en la pelvis". Lancet . 1 (1547): 393–94. doi :10.1016/S0140-6736(02)68759-8.
- ^ abc Lytton 2001, pág. 1859.
- ^ abcd Denmeade & Isaacs 2002, "Prostatectomía".
- ^ Young HH (1905). "Cuatro casos de prostatectomía radical". Johns Hopkins Bull . 16 .
- ^ Walsh PC, Lepor H, Eggleston JC (1983). "Prostatectomía radical con preservación de la función sexual: consideraciones anatómicas y patológicas". La próstata . 4 (5): 473–485. doi :10.1002/pros.2990040506. PMID 6889192. S2CID 30740301.
- ^ abc Denmeade & Isaacs 2002, "Radioterapia".
- ^ abcd Denmeade & Isaacs 2002, "Terapia de ablación de andrógenos".
- ^ Huggins CB, Hodges CV (1941). «Estudios sobre el cáncer de próstata: 1. Los efectos de la castración, de la inyección de estrógenos y andrógenos sobre las fosfatasas séricas en el carcinoma metastásico de próstata». Cancer Res . 1 (4): 293. Archivado desde el original el 30 de junio de 2017. Consultado el 2 de septiembre de 2015 .
- ^ Tolis G, Ackman D, Stellos A, Mehta A, Labrie F, Fazekas AT, et al. (marzo de 1982). "Inhibición del crecimiento tumoral en pacientes con carcinoma prostático tratados con agonistas de la hormona liberadora de hormona luteinizante". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 79 (5): 1658–1662. Bibcode :1982PNAS...79.1658T. doi : 10.1073/pnas.79.5.1658 . PMC 346035 . PMID 6461861.
- ^ Denmeade & Isaacs 2002, "Quimioterapia citotóxica".
- ^ ab Desai, McManus & Sharifi 2021, "Evolución del tratamiento".
- ^ Teo, Rathkopf y Kantoff 2019, "Figura 1".
- ^ ab Patel et al. 2020, pág. 64.
- ^ McIntosh et al. 2023, Tabla 1.
- ^ McIntosh et al. 2023, Tabla 2.
- ^ Mai et al. 2022, "2.1 Líneas celulares de cáncer de próstata humano".
- ^ Mai y col. 2022, "2.4. Organoides".
- ^ Mai y col. 2022, "2.2 líneas PDX".
- ^ Mai et al. 2022, "2.3 Modelo de ratón genéticamente modificado (GEMM)".
- ^ Ittmann et al. 2013, "Introducción".
Obras citadas
- Achard V, Putora PM, Omlin A, Zilli T, Fischer S (2022). "Cáncer de próstata metastásico: opciones de tratamiento". Oncología . 100 (1): 48–59. doi :10.1159/000519861. PMID 34781285. S2CID 244132770.
- Bergengren O, Pekala KR, Matsoukas K, Fainberg J, Mungovan SF, Bratt O, et al. (mayo de 2023). "Actualización de 2022 sobre la epidemiología y los factores de riesgo del cáncer de próstata: una revisión sistemática". Eur Urol . 84 (2): 191–206. doi : 10.1016/j.eururo.2023.04.021 . PMC 10851915 . PMID 37202314. S2CID 258780321.
- Bertoncelli Tanaka M, Sahota K, Burn J, Falconer A, Winkler M, Ahmed HU, et al. (enero de 2022). "Cáncer de próstata en mujeres transgénero: ¿qué debe saber un urólogo?". BJU Int . 129 (1): 113–122. doi :10.1111/bju.15521. PMID 34157213.
- Brawley S, Mohan R, Nein CD (junio de 2018). "Cáncer de próstata localizado: opciones de tratamiento". American Family Physician . 97 (12): 798–805. PMID 30216009.
- Carlsson SV, Vickers AJ (noviembre de 2020). "Detección del cáncer de próstata". Med Clin North Am . 104 (6): 1051–1062. doi :10.1016/j.mcna.2020.08.007. PMC 8287565 . PMID 33099450.
- Coleman RE, Croucher PI, Padhani AR, Clézardin P, Chow E, Fallon M, et al. (octubre de 2020). "Metástasis óseas". Nat Rev Dis Primers . 6 (1): 83. doi :10.1038/s41572-020-00216-3. hdl : 20.500.11820/6bac9e59-0afa-4b4a-bebf-4e747b889917 . PMID 33060614. S2CID 222350837.
- Costello AJ (marzo de 2020). "Consideración del papel de la prostatectomía radical en el tratamiento del cáncer de próstata en el siglo XXI". Nat Rev Urol . 17 (3): 177–188. doi :10.1038/s41585-020-0287-y. PMID 32086498. S2CID 211234353.
- Dall'Era MA (2023). "39-17: Cáncer de próstata". En Papadakis MA, McPhee SJ, Rabow MW, McQuaid KR (eds.). Diagnóstico y tratamiento médico actual 2023 (62.ª ed.). McGraw Hill. ISBN 978-1-264-68734-3.
- Denmeade SR, Isaacs JT (mayo de 2002). "Una historia del tratamiento del cáncer de próstata". Nature Reviews. Cancer . 2 (5): 389–396. doi :10.1038/nrc801. PMC 4124639 . PMID 12044015.
- Desai K, McManus JM, Sharifi N (mayo de 2021). "Terapia hormonal para el cáncer de próstata". Endocr Rev . 42 (3): 354–373. doi :10.1210/endrev/bnab002. PMC 8152444 . PMID 33480983.
- Duffy MJ (febrero de 2020). "Biomarcadores para el cáncer de próstata: antígeno prostático específico y más allá". Clin Chem Lab Med . 58 (3): 326–339. doi : 10.1515/cclm-2019-0693 . PMID 31714881.
- Epstein JI (enero de 2018). "Clasificación del cáncer de próstata: una década después del sistema modificado de 2005". Mod Pathol . 31 (S1): S47–63. doi : 10.1038/modpathol.2017.133 . PMID 29297487.
- Hessen MT, ed. (agosto de 2022). "Cáncer de próstata". Reseñas clínicas . Punto de atención. Elsevier.
- Ittmann M, Huang J, Radaelli E, Martin P, Signoretti S, Sullivan R, et al. (mayo de 2013). "Modelos animales de cáncer de próstata humano: informe de consenso de la reunión de Nueva York del Comité de Patología de Próstata del Consorcio de Modelos de Ratón de Cánceres Humanos". Cancer Res . 73 (9): 2718–36. doi :10.1158/0008-5472.CAN-12-4213. PMC 3644021 . PMID 23610450.
- Liu JL, Patel HD, Haney NM, Epstein JI, Partin AW (abril de 2021). "Avances en la selección de pacientes con cáncer de próstata para vigilancia activa". Nat Rev Urol . 18 (4): 197–208. doi :10.1038/s41585-021-00432-w. PMID 33623103. S2CID 232024016.
- Lytton B (junio de 2001). "Cáncer de próstata: una breve historia y el descubrimiento del tratamiento de ablación hormonal". The Journal of Urology . 165 (6 Pt 1): 1859–1862. doi :10.1016/S0022-5347(05)66228-3. PMID 11371867.
- Maffei D, Giganti F, Moore CM (febrero de 2023). "Seminario: Revisando el valor de la detección del cáncer de próstata basada en el PSA Ensayo n.º 5: ¿Los hombres deberían someterse a una resonancia magnética antes de una biopsia de próstata? (Pro)". Urol Oncol . 41 (2): 88–91. doi :10.1016/j.urolonc.2022.04.016. PMID 35871993.
- Mai CW, Chin KY, Foong LC, Pang KL, Yu B, Shu Y, et al. (septiembre de 2022). "Modelado del cáncer de próstata: ¿qué se necesita para construir un modelo tumoral ideal?". Cancer Lett . 543 : 215794. doi :10.1016/j.canlet.2022.215794. PMID 35718268. S2CID 249831438.
- McHugh J, Saunders EJ, Dadaev T, McGrowder E, Bancroft E, Kote-Jarai Z, et al. (junio de 2022). "Riesgo de cáncer de próstata en hombres de diferente ascendencia genética y enfoques para la detección y el tratamiento de la enfermedad en estos grupos". Br J Cancer . 126 (10): 1366–1373. doi :10.1038/s41416-021-01669-3. PMC 9090767 . PMID 34923574.
- McIntosh SA, Alam F, Adams L, Boon IS, Callaghan J, Conti I, et al. (junio de 2023). "Financiación global para la investigación del cáncer entre 2016 y 2020: un análisis de contenido de las inversiones públicas y filantrópicas". Lancet Oncol . 24 (6): 636–645. doi :10.1016/S1470-2045(23)00182-1. PMID 37269844.
- Merriel SW, Funston G, Hamilton W (septiembre de 2018). "Cáncer de próstata en atención primaria". Adv Ther . 35 (9): 1285–1294. doi :10.1007/s12325-018-0766-1. PMC 6133140 . PMID 30097885.
- Mundle R, Afenya E, Agarwal N (septiembre de 2021). "La eficacia de la intervención psicológica para la depresión, la ansiedad y la angustia en el cáncer de próstata: una revisión sistemática de la literatura". Cáncer de próstata Dis . 24 (3): 674–687. doi :10.1038/s41391-021-00342-3. PMID 33750905. S2CID 232325496.
- Patel MS, Halpern JA, Desai AS, Keeter MK, Bennett NE, Brannigan RE (mayo de 2020). "Éxito de las campañas de concienciación sobre el cáncer de próstata y testículo en comparación con el mes de concienciación sobre el cáncer de mama según los volúmenes de búsqueda en Internet: un análisis de Google Trends". Urología . 139 : 64–70. doi :10.1016/j.urology.2019.11.062. PMID 32001306. S2CID 210982209.
- Pernar CH, Ebot EM, Wilson KM, Mucci LA (diciembre de 2018). "La epidemiología del cáncer de próstata". Cold Spring Harb Perspect Med . 8 (12): a030361. doi :10.1101/cshperspect.a030361. PMC 6280714 . PMID 29311132.
- Pilié P, Viscuse P, Logothetis CJ, Corn PG (2022). "45: Cáncer de próstata". En Kantarjian HM, Wolff RA, Rieber AG (eds.). Manual MD Anderson de oncología médica (4.ª edición). McGraw Hill. ISBN 978-1-260-46764-2.
- Rebello RJ, Oing C, Knudsen KE, Loeb S, Johnson DC, Reiter RE, et al. (febrero de 2021). "Cáncer de próstata". Nat Rev Dis Primers . 7 (1): 9. doi :10.1038/s41572-020-00243-0. PMID 33542230. S2CID 231794303.
- Scher HI, Eastham JA (2022). "87: Enfermedades benignas y malignas de la próstata". En Loscalzo J, Fauci A, Kasper D, et al. (eds.). Principios de medicina interna de Harrison (21.ª ed.). McGraw Hill. ISBN 978-1-264-26850-4.
- Stephenson AJ, Abouassaly R, Klein EA (2021). "Epidemiología, etiología y prevención del cáncer de próstata". En Partin AW, Dmochowski RR, Kavoussi LR, Peters CA (eds.). Urología de Cambell-Walsh-Wein (12.ª ed.). Elsevier. págs. 3457–3477. ISBN 978-0-323-54642-3.
- Sandhu S, Moore CM, Chiong E, Beltran H, Bristow RG, Williams SG (septiembre de 2021). "Cáncer de próstata". Lancet . 398 (10305): 1075–1090. doi : 10.1016/S0140-6736(21)00950-8 . PMID 34370973. S2CID 236941733.
- Teo MY, Rathkopf DE, Kantoff P (enero de 2019). "Tratamiento del cáncer de próstata avanzado". Annu Rev Med . 70 : 479–499. doi :10.1146/annurev-med-051517-011947. PMC 6441973 . PMID 30691365.
- Thompson JC, Wood J, Feuer D (2007). "Cáncer de próstata: cuidados paliativos y alivio del dolor". Br Med Bull . 83 : 341–354. doi : 10.1093/bmb/ldm018 . PMID: 17628024.
- Valier H (2016). "La problemática prehistoria del cáncer de próstata". Una historia del cáncer de próstata . Springer Nature. págs. 15–42. ISBN 978-1-4039-8803-4.






