Dinucleótido de nicotinamida y adenina
 | |
 | |
| Nombres | |
|---|---|
| Otros nombres Nucleótido de difosfopiridina (DPN + ), coenzima I | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh | |
| Química biológica | |
| Araña química | |
| Banco de medicamentos | |
| Tarjeta informativa de la ECHA | 100.000.169 |
| |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| |
| |
| Propiedades | |
| C21H28N7O14P2 [ 1 ] [ 2 ] | |
| Masa molar | 663,43 g/mol |
| Apariencia | Polvo blanco |
| Punto de fusión | 160 °C (320 °F; 433 K) |
| Peligros | |
| Seguridad y salud en el trabajo (SST/OHS): | |
Principales peligros | No es peligroso |
| NFPA 704 (rombo cortafuegos) | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
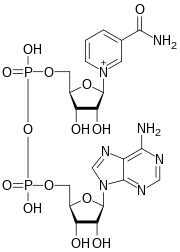
El dinucleótido de nicotinamida y adenina ( NAD ) es una coenzima fundamental para el metabolismo . [3] Presente en todas las células vivas , el NAD se denomina dinucleótido porque consta de dos nucleótidos unidos a través de sus grupos fosfato . Un nucleótido contiene una nucleobase de adenina y el otro, nicotinamida . El NAD existe en dos formas: una forma oxidada y otra reducida , abreviadas como NAD + y NADH (H por hidrógeno ), respectivamente.
En el metabolismo celular, el NAD interviene en reacciones redox, transportando electrones de una reacción a otra, por lo que se encuentra en dos formas: el NAD + es un agente oxidante , aceptando electrones de otras moléculas y reduciéndose; con H + , esta reacción forma NADH, que puede utilizarse como agente reductor para donar electrones. Estas reacciones de transferencia de electrones son la función principal del NAD. También se utiliza en otros procesos celulares, sobre todo como sustrato de enzimas en la adición o eliminación de grupos químicos a o desde proteínas , en modificaciones postraduccionales . Debido a la importancia de estas funciones, las enzimas implicadas en el metabolismo del NAD son dianas para el descubrimiento de fármacos .
En los organismos, el NAD puede sintetizarse a partir de bloques de construcción simples ( de novo ) a partir de triptófano o ácido aspártico , cada uno de los cuales es un caso de aminoácido . Alternativamente, los componentes más complejos de las coenzimas se toman de compuestos nutritivos como la niacina ; compuestos similares se producen mediante reacciones que descomponen la estructura del NAD, lo que proporciona una vía de recuperación que los recicla nuevamente a su forma activa respectiva.
Parte del NAD se convierte en la coenzima nicotinamida adenina dinucleótido fosfato (NADP), cuya química es en gran medida paralela a la del NAD, aunque su función predominante es la de coenzima en el metabolismo anabólico .
En el nombre NAD + , el signo más superíndice indica la carga formal positiva en uno de sus átomos de nitrógeno.
Propiedades físicas y químicas
El dinucleótido de nicotinamida y adenina consta de dos nucleósidos unidos por pirofosfato . Cada uno de los nucleósidos contiene un anillo de ribosa , uno con adenina unida al primer átomo de carbono ( posición 1' ) ( difosfato de adenosina ribosa ) y el otro con nicotinamida en esta posición. [4] [5]

El compuesto acepta o dona el equivalente de H − . [6] Tales reacciones (resumidas en la fórmula a continuación) implican la eliminación de dos átomos de hidrógeno del reactivo (R), en forma de un ion hidruro (H − ), y un protón (H + ). El protón se libera en solución, mientras que el reductor RH 2 se oxida y NAD + se reduce a NADH por transferencia del hidruro al anillo de nicotinamida.
- RH 2 + NAD + → NADH + H + + R;
Del par de electrones hidruro, un electrón es atraído hacia el átomo ligeramente más electronegativo del anillo de nicotinamida de NAD + , pasando a formar parte de la fracción de nicotinamida. El segundo electrón y el átomo de protón se transfieren al átomo de carbono adyacente al átomo de N. El potencial de punto medio del par redox NAD + /NADH es de -0,32 voltios , lo que hace que el NADH sea un agente reductor moderadamente fuerte . [7] La reacción es fácilmente reversible, cuando el NADH reduce otra molécula y se reoxida a NAD + . Esto significa que la coenzima puede ciclar continuamente entre las formas NAD + y NADH sin consumirse. [5]
En apariencia, todas las formas de esta coenzima son polvos amorfos blancos que son higroscópicos y altamente solubles en agua. [8] Los sólidos son estables si se almacenan secos y en la oscuridad. Las soluciones de NAD + son incoloras y estables durante aproximadamente una semana a 4 °C y pH neutro , pero se descomponen rápidamente en soluciones ácidas o alcalinas. Al descomponerse, forman productos que son inhibidores de la enzima . [9]

Tanto el NAD + como el NADH absorben fuertemente la luz ultravioleta debido a la adenina. Por ejemplo, la absorción máxima del NAD + se produce a una longitud de onda de 259 nanómetros (nm), con un coeficiente de extinción de 16.900 M −1 cm −1 . El NADH también absorbe a longitudes de onda más altas, con un segundo pico de absorción de UV a 339 nm con un coeficiente de extinción de 6.220 M −1 cm −1 . [10] Esta diferencia en los espectros de absorción ultravioleta entre las formas oxidadas y reducidas de las coenzimas a longitudes de onda más altas hace que sea sencillo medir la conversión de una a otra en ensayos enzimáticos , midiendo la cantidad de absorción de UV a 340 nm utilizando un espectrofotómetro . [10]
El NAD + y el NADH también difieren en su fluorescencia . El NADH que se difunde libremente en solución acuosa, cuando se excita a la absorbancia de nicotinamida de ~335 nm (UV cercano), emite fluorescencia a 445–460 nm (violeta a azul) con un tiempo de vida de fluorescencia de 0,4 nanosegundos , mientras que el NAD + no emite fluorescencia. [11] [12] Las propiedades de la señal de fluorescencia cambian cuando el NADH se une a las proteínas , por lo que estos cambios se pueden utilizar para medir las constantes de disociación , que son útiles en el estudio de la cinética enzimática . [12] [13] Estos cambios en la fluorescencia también se utilizan para medir los cambios en el estado redox de las células vivas, a través de la microscopía de fluorescencia . [14]
El NADH puede convertirse en NAD+ en una reacción catalizada por el cobre, que requiere peróxido de hidrógeno. Por lo tanto, el suministro de NAD+ en las células requiere cobre(II) mitocondrial. [15] [16]
Concentración y estado en las células
En el hígado de rata, la cantidad total de NAD + y NADH es de aproximadamente 1 μmol por gramo de peso húmedo, aproximadamente 10 veces la concentración de NADP + y NADPH en las mismas células. [17] La concentración real de NAD + en el citosol celular es más difícil de medir, con estimaciones recientes en células animales que oscilan alrededor de 0,3 mM , [18] [19] y aproximadamente de 1,0 a 2,0 mM en levadura . [20] Sin embargo, más del 80% de la fluorescencia de NADH en las mitocondrias proviene de la forma ligada, por lo que la concentración en solución es mucho menor. [21]
Las concentraciones de NAD + son más altas en las mitocondrias, constituyendo entre el 40% y el 70% del NAD + celular total . [22] El NAD + en el citosol es transportado a la mitocondria por una proteína de transporte de membrana específica , ya que la coenzima no puede difundirse a través de las membranas. [23] Una revisión afirmó que la vida media intracelular del NAD + era de entre 1 y 2 horas, [24] mientras que otra revisión dio estimaciones variables según el compartimento: intracelular 1-4 horas, citoplasmático 2 horas y mitocondrial 4-6 horas. [25]
El equilibrio entre las formas oxidadas y reducidas del dinucleótido de nicotinamida y adenina se denomina proporción NAD + /NADH. Esta proporción es un componente importante de lo que se denomina estado redox de una célula, una medida que refleja tanto las actividades metabólicas como la salud de las células. [26] Los efectos de la proporción NAD + /NADH son complejos y controlan la actividad de varias enzimas clave, incluidas la gliceraldehído 3-fosfato deshidrogenasa y la piruvato deshidrogenasa . En los tejidos de mamíferos sanos, las estimaciones de la proporción de NAD + libre a NADH en el citoplasma suelen rondar los 700:1; por tanto, la proporción es favorable para las reacciones oxidativas. [27] [28] La proporción de NAD + /NADH total es mucho menor, con estimaciones que oscilan entre 3 y 10 en los mamíferos. [29] Por el contrario, la proporción NADP + /NADPH normalmente es de alrededor de 0,005, por lo que el NADPH es la forma dominante de esta coenzima. [30] Estas diferentes proporciones son clave para las diferentes funciones metabólicas del NADH y el NADPH.
Biosíntesis
El NAD + se sintetiza a través de dos vías metabólicas. Se produce en una vía de novo a partir de aminoácidos o en vías de recuperación mediante el reciclaje de componentes preformados como la nicotinamida de nuevo a NAD + . Aunque la mayoría de los tejidos sintetizan NAD + mediante la vía de recuperación en los mamíferos, se produce una síntesis mucho mayor de novo en el hígado a partir del triptófano, y en el riñón y los macrófagos a partir del ácido nicotínico . [31]
De nuevoproducción
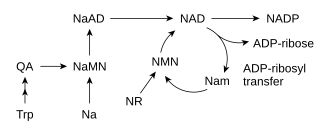
La mayoría de los organismos sintetizan NAD + a partir de componentes simples. [6] El conjunto específico de reacciones difiere entre organismos, pero una característica común es la generación de ácido quinolínico (QA) a partir de un aminoácido, ya sea triptófano (Trp) en animales y algunas bacterias, o ácido aspártico (Asp) en algunas bacterias y plantas. [32] [33] El ácido quinolínico se convierte en ácido nicotínico mononucleótido (NaMN) mediante la transferencia de una fracción de fosforribosa. Luego se transfiere una fracción de adenilato para formar ácido nicotínico adenina dinucleótido (NaAD). Finalmente, la fracción de ácido nicotínico en NaAD se amida a una fracción de nicotinamida (Nam), formando nicotinamida adenina dinucleótido. [6]
En un paso posterior, parte del NAD + se convierte en NADP + por la NAD + quinasa , que fosforila el NAD + . [34] En la mayoría de los organismos, esta enzima utiliza el trifosfato de adenosina (ATP) como fuente del grupo fosfato, aunque varias bacterias como Mycobacterium tuberculosis y una arquea hipertermófila Pyrococcus horikoshii , utilizan polifosfato inorgánico como donante alternativo de fosforilo. [35] [36]
Vías de salvamento
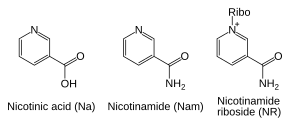
A pesar de la presencia de la vía de novo , las reacciones de rescate son esenciales en los seres humanos; la falta de niacina en la dieta causa la enfermedad por deficiencia de vitaminas llamada pelagra . [37] Este alto requerimiento de NAD + resulta del consumo constante de la coenzima en reacciones como las modificaciones postraduccionales, ya que el ciclo de NAD + entre formas oxidadas y reducidas en reacciones redox no cambia los niveles generales de la coenzima. [6] La principal fuente de NAD + en los mamíferos es la vía de rescate que recicla la nicotinamida producida por enzimas que utilizan NAD + . [38] El primer paso, y la enzima limitante de la velocidad en la vía de rescate es la nicotinamida fosforribosiltransferasa (NAMPT), que produce nicotinamida mononucleótido (NMN). [38] NMN es el precursor inmediato de NAD+ en la vía de rescate. [39]
Además de ensamblar NAD + de novo a partir de precursores de aminoácidos simples, las células también recuperan compuestos preformados que contienen una base de piridina. Los tres precursores de vitaminas utilizados en estas vías metabólicas de recuperación son el ácido nicotínico (NA), la nicotinamida (Nam) y el ribósido de nicotinamida (NR). [6] Estos compuestos pueden absorberse de la dieta y se denominan vitamina B3 o niacina . Sin embargo, estos compuestos también se producen dentro de las células y por digestión del NAD + celular . Algunas de las enzimas involucradas en estas vías de recuperación parecen estar concentradas en el núcleo celular , lo que puede compensar el alto nivel de reacciones que consumen NAD + en este orgánulo . [40] Hay algunos informes de que las células de mamíferos pueden absorber NAD + extracelular de su entorno, [41] y tanto la nicotinamida como el ribósido de nicotinamida pueden absorberse desde el intestino. [42]
Las vías de recuperación utilizadas en los microorganismos difieren de las de los mamíferos . [43] Algunos patógenos, como la levadura Candida glabrata y la bacteria Haemophilus influenzae son auxótrofos del NAD + – no pueden sintetizar NAD + – pero poseen vías de recuperación y por lo tanto dependen de fuentes externas de NAD + o sus precursores. [44] [45] Aún más sorprendente es el patógeno intracelular Chlamydia trachomatis , que carece de candidatos reconocibles para cualquier gen involucrado en la biosíntesis o recuperación tanto de NAD + como de NADP + , y debe adquirir estas coenzimas de su huésped . [46]
Funciones

El dinucleótido de nicotinamida y adenina tiene varias funciones esenciales en el metabolismo . Actúa como coenzima en reacciones redox , como donante de fracciones de ADP-ribosa en reacciones de ADP-ribosilación , como precursor de la molécula de segundo mensajero ADP-ribosa cíclica , además de actuar como sustrato para las ligasas de ADN bacterianas y un grupo de enzimas llamadas sirtuinas que utilizan NAD + para eliminar grupos acetilo de las proteínas. Además de estas funciones metabólicas, el NAD + surge como un nucleótido de adenina que puede liberarse de las células de forma espontánea y mediante mecanismos regulados, [48] [49] y, por lo tanto, puede tener importantes funciones extracelulares . [49]
Unión de NAD por oxidorreductasa
La función principal del NAD + en el metabolismo es la transferencia de electrones de una molécula a otra. Las reacciones de este tipo son catalizadas por un gran grupo de enzimas llamadas oxidorreductasas . Los nombres correctos para estas enzimas contienen los nombres de ambos sustratos: por ejemplo, la NADH-ubiquinona oxidorreductasa cataliza la oxidación del NADH por la coenzima Q. [50] Sin embargo, estas enzimas también se denominan deshidrogenasas o reductasas , siendo la NADH-ubiquinona oxidorreductasa comúnmente llamada NADH deshidrogenasa o, a veces, coenzima Q reductasa . [51]
Existen muchas superfamilias diferentes de enzimas que se unen a NAD + /NADH. Una de las superfamilias más comunes incluye un motivo estructural conocido como pliegue de Rossmann . [52] [53] El motivo recibe su nombre de Michael Rossmann , quien fue el primer científico en notar lo común que es esta estructura dentro de las proteínas que se unen a los nucleótidos. [54]
Un ejemplo de una enzima bacteriana que se une a NAD e interviene en el metabolismo de aminoácidos y que no tiene el pliegue de Rossmann se encuentra en Pseudomonas syringae pv. tomate ( PDB : 2CWH ; InterPro : IPR003767 ). [55]

Cuando se une al sitio activo de una oxidorreductasa, el anillo de nicotinamida de la coenzima se posiciona de manera que pueda aceptar un hidruro del otro sustrato. Dependiendo de la enzima, el donante de hidruro se coloca "encima" o "debajo" del plano del carbono C4 planar, como se define en la figura. Las oxidorreductasas de clase A transfieren el átomo desde arriba; las enzimas de clase B lo transfieren desde abajo. Dado que el carbono C4 que acepta el hidrógeno es proquiral , esto se puede explotar en la cinética enzimática para brindar información sobre el mecanismo de la enzima. Esto se hace mezclando una enzima con un sustrato que tiene átomos de deuterio sustituidos por los hidrógenos, por lo que la enzima reducirá NAD + transfiriendo deuterio en lugar de hidrógeno. En este caso, una enzima puede producir uno de los dos estereoisómeros de NADH. [56]
A pesar de la similitud en la forma en que las proteínas se unen a las dos coenzimas, las enzimas casi siempre muestran un alto nivel de especificidad para NAD + o NADP + . [57] Esta especificidad refleja los distintos papeles metabólicos de las respectivas coenzimas, y es el resultado de distintos conjuntos de residuos de aminoácidos en los dos tipos de bolsillos de unión de coenzimas. Por ejemplo, en el sitio activo de las enzimas dependientes de NADP, se forma un enlace iónico entre una cadena lateral de aminoácido básico y el grupo fosfato ácido de NADP + . Por el contrario, en las enzimas dependientes de NAD la carga en este bolsillo se invierte, lo que impide la unión de NADP + . Sin embargo, hay algunas excepciones a esta regla general, y enzimas como la aldosa reductasa , la glucosa-6-fosfato deshidrogenasa y la metilentetrahidrofolato reductasa pueden utilizar ambas coenzimas en algunas especies. [58]
Papel en el metabolismo redox

Las reacciones redox catalizadas por las oxidorreductasas son vitales en todas las partes del metabolismo, pero un área particularmente importante donde ocurren estas reacciones es en la liberación de energía de los nutrientes. Aquí, los compuestos reducidos como la glucosa y los ácidos grasos se oxidan, liberando así energía. Esta energía se transfiere a NAD + por reducción a NADH, como parte de la beta oxidación , la glucólisis y el ciclo del ácido cítrico . En los eucariotas, los electrones transportados por el NADH que se produce en el citoplasma se transfieren a la mitocondria (para reducir el NAD + mitocondrial ) mediante lanzaderas mitocondriales , como la lanzadera de malato-aspartato . [59] El NADH mitocondrial luego se oxida a su vez por la cadena de transporte de electrones , que bombea protones a través de una membrana y genera ATP a través de la fosforilación oxidativa . [60] Estos sistemas de lanzadera también tienen la misma función de transporte en los cloroplastos . [61]
Dado que tanto las formas oxidadas como reducidas del dinucleótido de nicotinamida y adenina se utilizan en estos conjuntos vinculados de reacciones, la célula mantiene concentraciones significativas tanto de NAD + como de NADH, y la alta relación NAD + /NADH permite que esta coenzima actúe como agente oxidante y reductor. [62] Por el contrario, la función principal del NADPH es la de agente reductor en el anabolismo , y esta coenzima participa en vías como la síntesis de ácidos grasos y la fotosíntesis . Dado que el NADPH es necesario para impulsar las reacciones redox como un fuerte agente reductor, la relación NADP + /NADPH se mantiene muy baja. [62]
Aunque es importante en el catabolismo, el NADH también se utiliza en reacciones anabólicas, como la gluconeogénesis . [63] Esta necesidad de NADH en el anabolismo plantea un problema para los procariotas que crecen con nutrientes que liberan solo una pequeña cantidad de energía. Por ejemplo, las bacterias nitrificantes como Nitrobacter oxidan el nitrito a nitrato, que libera suficiente energía para bombear protones y generar ATP, pero no lo suficiente para producir NADH directamente. [64] Como el NADH todavía es necesario para las reacciones anabólicas, estas bacterias utilizan una nitrito oxidorreductasa para producir suficiente fuerza protomomotriz para ejecutar parte de la cadena de transporte de electrones en sentido inverso, generando NADH. [65]
Funciones no redox
La coenzima NAD + también se consume en reacciones de transferencia de ADP-ribosa. Por ejemplo, las enzimas llamadas ADP-ribosiltransferasas añaden la fracción ADP-ribosa de esta molécula a las proteínas, en una modificación postraduccional llamada ADP-ribosilación . [66] La ADP-ribosilación implica la adición de una única fracción ADP-ribosa, en mono-ADP-ribosilación , o la transferencia de ADP-ribosa a proteínas en cadenas largas ramificadas, lo que se llama poli(ADP-ribosilación) . [67] La mono-ADP-ribosilación se identificó por primera vez como el mecanismo de un grupo de toxinas bacterianas , en particular la toxina del cólera , pero también está implicada en la señalización celular normal . [68] [69] La poli(ADP-ribosilación) se lleva a cabo por las poli(ADP-ribosa) polimerasas . [67] [70] La estructura de poli(ADP-ribosa) está involucrada en la regulación de varios eventos celulares y es más importante en el núcleo celular , en procesos como la reparación del ADN y el mantenimiento de los telómeros . [70] Además de estas funciones dentro de la célula, recientemente se ha descubierto un grupo de ADP-ribosiltransferasas extracelulares , pero sus funciones siguen siendo oscuras. [71] El NAD + también se puede agregar al ARN celular como una modificación 5'-terminal. [72]

Otra función de esta coenzima en la señalización celular es como precursora de la ADP-ribosa cíclica , que se produce a partir del NAD + por las ADP-ribosil ciclasas, como parte de un sistema de segundo mensajero . [73] Esta molécula actúa en la señalización del calcio liberando calcio de los depósitos intracelulares. [74] Lo hace uniéndose y abriendo una clase de canales de calcio llamados receptores de rianodina , que se encuentran en las membranas de los orgánulos , como el retículo endoplasmático , e induciendo la activación del factor de transcripción NAFC3 [75]
El NAD + también es consumido por diferentes enzimas que consumen NAD+, como CD38 , CD157 , PARP y las desacetilasas dependientes de NAD ( sirtuinas , como Sir2 . [76] ). [77] Estas enzimas actúan transfiriendo un grupo acetilo de su proteína sustrato a la fracción ADP-ribosa del NAD + ; esto escinde la coenzima y libera nicotinamida y O-acetil-ADP-ribosa. Las sirtuinas parecen estar involucradas principalmente en la regulación de la transcripción a través de la desacetilación de histonas y la alteración de la estructura del nucleosoma . [78] Sin embargo, las proteínas no histonas también pueden ser desacetiladas por las sirtuinas. Estas actividades de las sirtuinas son particularmente interesantes debido a su importancia en la regulación del envejecimiento . [79] [80]
Otras enzimas dependientes de NAD incluyen las ligasas de ADN bacterianas , que unen dos extremos de ADN utilizando NAD + como sustrato para donar una fracción de monofosfato de adenosina (AMP) al fosfato 5' de un extremo de ADN. Este intermediario es luego atacado por el grupo hidroxilo 3' del otro extremo de ADN, formando un nuevo enlace fosfodiéster . [81] Esto contrasta con las ligasas de ADN eucariotas , que utilizan ATP para formar el intermediario ADN-AMP. [82]
Li et al. han descubierto que el NAD + regula directamente las interacciones proteína-proteína. [83] También muestran que una de las causas del declive relacionado con la edad en la reparación del ADN puede ser el aumento de la unión de la proteína DBC1 (Deleted in Breast Cancer 1) a PARP1 (poli[ADP–ribosa] polimerasa 1) a medida que los niveles de NAD + disminuyen durante el envejecimiento. [83] La disminución de las concentraciones celulares de NAD + durante el envejecimiento probablemente contribuye al proceso de envejecimiento y a la patogénesis de las enfermedades crónicas del envejecimiento. [84] Por lo tanto, la modulación del NAD + puede proteger contra el cáncer, la radiación y el envejecimiento. [83]
Acciones extracelulares del NAD+
En los últimos años, el NAD + también ha sido reconocido como una molécula de señalización extracelular involucrada en la comunicación de célula a célula. [49] [85] [86] El NAD + se libera de las neuronas en los vasos sanguíneos , [48] la vejiga urinaria , [48] [87] el intestino grueso , [88] [89] de las células neurosecretoras, [90] y de los sinaptosomas cerebrales , [91] y se propone que sea un nuevo neurotransmisor que transmite información de los nervios a las células efectoras en los órganos de músculo liso . [88] [89] En las plantas, el dinucleótido de nicotinamida y adenina extracelular induce resistencia a la infección por patógenos y se ha identificado el primer receptor extracelular de NAD. [92] Se necesitan más estudios para determinar los mecanismos subyacentes de sus acciones extracelulares y su importancia para la salud humana y los procesos de vida en otros organismos.
Importancia clínica
Las enzimas que producen y utilizan NAD + y NADH son importantes tanto en farmacología como en la investigación de futuros tratamientos para enfermedades. [93] El diseño y desarrollo de fármacos explota el NAD + de tres maneras: como objetivo directo de los fármacos, mediante el diseño de inhibidores o activadores enzimáticos basados en su estructura que cambian la actividad de las enzimas dependientes de NAD, y tratando de inhibir la biosíntesis de NAD + . [94]
Debido a que las células cancerosas utilizan una mayor glucólisis , y debido a que el NAD mejora la glucólisis, la nicotinamida fosforribosiltransferasa (vía de rescate del NAD) a menudo se amplifica en las células cancerosas. [95] [96]
Se ha estudiado por su posible uso en la terapia de enfermedades neurodegenerativas como el Alzheimer y el Parkinson, así como la esclerosis múltiple . [6] [80] [97] [77] Un ensayo clínico controlado con placebo de NADH (que excluyó los precursores de NADH) en personas con Parkinson no mostró ningún efecto. [98]
El NAD + también es un objetivo directo del fármaco isoniazida , que se utiliza en el tratamiento de la tuberculosis , una infección causada por Mycobacterium tuberculosis . La isoniazida es un profármaco y una vez que ha entrado en la bacteria, es activada por una enzima peroxidasa , que oxida el compuesto en forma de radical libre . [99] Este radical reacciona entonces con el NADH, para producir aductos que son inhibidores muy potentes de las enzimas proteína transportadora de enoil-acilo reductasa , [100] y dihidrofolato reductasa . [101]
Dado que muchas oxidorreductasas utilizan NAD + y NADH como sustratos, y se unen a ellos utilizando un motivo estructural altamente conservado, la idea de que los inhibidores basados en NAD + podrían ser específicos de una enzima es sorprendente. [102] Sin embargo, esto puede ser posible: por ejemplo, los inhibidores basados en los compuestos ácido micofenólico y tiazofurina inhiben la IMP deshidrogenasa en el sitio de unión de NAD + . Debido a la importancia de esta enzima en el metabolismo de las purinas , estos compuestos pueden ser útiles como fármacos anticancerígenos, antivirales o inmunosupresores . [102] [103] Otros fármacos no son inhibidores de enzimas, sino que activan enzimas implicadas en el metabolismo de NAD + . Las sirtuinas son un objetivo particularmente interesante para dichos fármacos, ya que la activación de estas desacetilasas dependientes de NAD extiende la vida útil en algunos modelos animales. [104] Compuestos como el resveratrol aumentan la actividad de estas enzimas, lo que puede ser importante en su capacidad para retrasar el envejecimiento tanto en organismos modelo vertebrados como invertebrados . [105] [106] [ 107] En un experimento, los ratones a los que se les administró NAD durante una semana mejoraron la comunicación nuclear-mitocondrial. [108]
Debido a las diferencias en las vías metabólicas de la biosíntesis de NAD + entre organismos, como entre bacterias y humanos, esta área del metabolismo es un área prometedora para el desarrollo de nuevos antibióticos . [109] [110] Por ejemplo, la enzima nicotinamidasa , que convierte la nicotinamida en ácido nicotínico, es un objetivo para el diseño de fármacos, ya que esta enzima está ausente en humanos pero presente en levaduras y bacterias. [43]
En bacteriología, el NAD, a veces denominado factor V, se utiliza como complemento de los medios de cultivo para algunas bacterias exigentes . [111]
Historia

La coenzima NAD + fue descubierta por primera vez por los bioquímicos británicos Arthur Harden y William John Young en 1906. [112] Observaron que añadir extracto de levadura hervido y filtrado aceleraba en gran medida la fermentación alcohólica en extractos de levadura sin hervir. Llamaron al factor no identificado responsable de este efecto cofermento . A través de una purificación larga y difícil a partir de extractos de levadura, este factor termoestable fue identificado como un fosfato de azúcar nucleótido por Hans von Euler-Chelpin . [113] En 1936, el científico alemán Otto Heinrich Warburg mostró la función de la coenzima nucleótido en la transferencia de hidruro e identificó la porción de nicotinamida como el sitio de las reacciones redox. [114]
Los precursores vitamínicos del NAD + se identificaron por primera vez en 1938, cuando Conrad Elvehjem demostró que el hígado tiene una actividad "antilengua negra" en forma de nicotinamida. [115] Luego, en 1939, proporcionó la primera evidencia sólida de que la niacina se utiliza para sintetizar NAD + . [116] A principios de la década de 1940, Arthur Kornberg fue el primero en detectar una enzima en la vía biosintética. [117] En 1949, los bioquímicos estadounidenses Morris Friedkin y Albert L. Lehninger demostraron que el NADH vinculaba vías metabólicas como el ciclo del ácido cítrico con la síntesis de ATP en la fosforilación oxidativa. [118] En 1958, Jack Preiss y Philip Handler descubrieron los intermediarios y enzimas involucrados en la biosíntesis de NAD + ; [119] [120] La síntesis de rescate a partir del ácido nicotínico se denomina vía de Preiss-Handler. En 2004, Charles Brenner y sus colaboradores descubrieron la vía de la nicotinamida ribósido quinasa hacia el NAD + . [121]
Las funciones no redox del NAD(P) se descubrieron más tarde. [5] La primera en identificarse fue el uso de NAD + como donante de ADP-ribosa en reacciones de ADP-ribosilación, observado a principios de los años 1960. [122] Estudios realizados en los años 1980 y 1990 revelaron las actividades de los metabolitos NAD + y NADP + en la señalización celular, como la acción de la ADP-ribosa cíclica , que se descubrió en 1987. [123]
El metabolismo del NAD + siguió siendo un área de intensa investigación hasta el siglo XXI, con un interés acentuado tras el descubrimiento de las desacetilasas proteicas dependientes del NAD + llamadas sirtuinas en 2000, por Shin-ichiro Imai y colaboradores en el laboratorio de Leonard P. Guarente . [124] En 2009, Imai propuso la hipótesis del "Mundo NAD" de que los reguladores clave del envejecimiento y la longevidad en los mamíferos son la sirtuina 1 y la enzima sintetizadora primaria de NAD +, la nicotinamida fosforribosiltransferasa (NAMPT). [125] En 2016, Imai amplió su hipótesis al "Mundo NAD 2.0", que postula que la NAMPT extracelular del tejido adiposo mantiene el NAD + en el hipotálamo (el centro de control) junto con las mioquinas de las células del músculo esquelético . [126] En 2018, se formó Napa Therapeutics para desarrollar medicamentos contra un nuevo objetivo relacionado con el envejecimiento basado en la investigación sobre el metabolismo del NAD realizada en el laboratorio de Eric Verdin . [127]
Véase también
Referencias
- ^ "NAD+ | C21H28N7O14P2 | ChemSpider". www.chemspider.com .
- ^ "Dinucleótido de nicotinamida-adenina". pubchem.ncbi.nlm.nih.gov .
- ^ Nelson, David L.; Cox, Michael M. (2005). Principios de bioquímica (4.ª ed.). Nueva York: W. H. Freeman. ISBN 0-7167-4339-6.
- ^ El grupo nicotinamida puede unirse en dos orientaciones al átomo de carbono anomérico de la ribosa. Debido a estas dos posibles estructuras, el NAD+ podría existir como cualquiera de los dos diastereómeros . El diastereómero β-nicotinamida del NAD + es el que se encuentra en la naturaleza.
- ^ abc Pollak N, Dölle C, Ziegler M (2007). "El poder de reducir: nucleótidos de piridina: pequeñas moléculas con una multitud de funciones". Biochem. J. 402 ( 2): 205–218. doi :10.1042/BJ20061638. PMC 1798440. PMID 17295611 .
- ^ abcdef Belenky, Peter; Bogan, Katrina L.; Brenner, Charles (enero de 2007). "Metabolismo de NAD+ en la salud y la enfermedad". Tendencias en ciencias bioquímicas . 32 (1): 12–19. doi :10.1016/j.tibs.2006.11.006. PMID 17161604.
- ^ Unden G, Bongaerts J (1997). "Vías respiratorias alternativas de Escherichia coli: regulación energética y transcripcional en respuesta a aceptores de electrones". Biochim. Biophys. Acta . 1320 (3): 217–234. doi : 10.1016/S0005-2728(97)00034-0 . PMID 9230919.
- ^ Windholz, Martha (1983). El índice Merck: una enciclopedia de productos químicos, fármacos y productos biológicos (10.ª ed.). Rahway, NJ: Merck. pág. 909. ISBN 978-0-911910-27-8.
- ^ Biellmann JF, Lapinte C, Haid E, Weimann G (1979). "Estructura del inhibidor de la lactato deshidrogenasa generado a partir de la coenzima". Bioquímica . 18 (7): 1212–1217. doi :10.1021/bi00574a015. PMID 218616.
- ^ ab Dawson, R. Ben (1985). Datos para la investigación bioquímica (3.ª ed.). Oxford: Clarendon Press. pág. 122. ISBN 978-0-19-855358-8.
- ^ Blacker, Thomas S.; Mann, Zoe F.; Gale, Jonathan E.; Ziegler, Mathias; Bain, Angus J.; Szabadkai, Gyorgy; Duchen, Michael R. (29 de mayo de 2014). "Separación de la fluorescencia de NADH y NADPH en células y tejidos vivos utilizando FLIM". Nature Communications . 5 (1). Springer Science and Business Media LLC: 3936. Bibcode :2014NatCo...5.3936B. doi :10.1038/ncomms4936. ISSN 2041-1723. PMC 4046109 . PMID 24874098.
- ^ ab Lakowicz JR, Szmacinski H, Nowaczyk K, Johnson ML (1992). "Imágenes de fluorescencia de la vida útil del NADH libre y unido a proteínas". Proc. Natl. Sci. EE. UU . . 89 (4): 1271–1275. Bibcode :1992PNAS...89.1271L. doi : 10.1073/pnas.89.4.1271 . PMC 48431 . PMID 1741380.
- ^ Jameson DM, Thomas V, Zhou DM (1989). "Estudios de fluorescencia con resolución temporal sobre NADH unido a la malato deshidrogenasa mitocondrial". Biochim. Biophys. Acta . 994 (2): 187–190. doi :10.1016/0167-4838(89)90159-3. PMID 2910350.
- ^ Kasimova MR, Grigiene J, Krab K, Hagedorn PH, Flyvbjerg H, Andersen PE, Møller IM (2006). "La concentración de NADH libre se mantiene constante en las mitocondrias de las plantas en diferentes condiciones metabólicas". Plant Cell . 18 (3): 688–698. doi :10.1105/tpc.105.039354. PMC 1383643 . PMID 16461578.
- ^ Chan, PC; Kesner, L (septiembre de 1980). "Oxidación de NADH catalizada por complejo de cobre (II) mediante peróxido de hidrógeno". Biol Trace Elem Res . 2 (3): 159–174. Bibcode :1980BTER....2..159C. doi :10.1007/BF02785352. PMID 24271266. S2CID 24264851.
- ^ Solier, Stéphanie; Müller, Sebastián; Tatiana, Cañeque; Antonio, Versini; Arnaud, Mansart; Fabien, Sindikubwabo; Leeroy, barón; Laila, Emán; Pierre, Gestraud; G. Dan, Pantoș; Vicente, Gandón; Cristina, Gaillet; Ting-Di, Wu; Florent, Dingli; Damarys, Loew; Sylvain, Baulande; Sylvère, Durand; Valentín, Sencio; Cirilo, Robil; François, Trottein; David, Pericat; Emmanuelle, Näser; Céline, Cougoule; Etienne, Meunier; Anne-Laure, Bègue; Hélène, Salmón; Nicolás, Manel; Alain, Puisieux; Sara, Watson; Mark A., Dawson; Nicolás, sirviente; Guido, Kroemer; Djillali, Annane; Raphaël, Rodriguez (2023). "Una vía de señalización del cobre que se puede tratar con fármacos y que impulsa la inflamación". Nature . 617 (7960): 386–394. Bibcode :2023Natur.617..386S. doi :10.1038/s41586-023-06017-4 . PMC 10131557 . PMID 37100912. S2CID 258353949.
- ^ Reiss PD, Zuurendonk PF, Veech RL (1984). "Medición de purina tisular, pirimidina y otros nucleótidos mediante cromatografía líquida de alta resolución con compresión radial". Anal. Biochem . 140 (1): 162–71. doi :10.1016/0003-2697(84)90148-9. PMID 6486402.
- ^ Yamada K, Hara N, Shibata T, Osago H, Tsuchiya M (2006). "La medición simultánea de nicotinamida adenina dinucleótido y compuestos relacionados mediante cromatografía líquida/espectrometría de masas en tándem con ionización por electrospray". Anal. Biochem . 352 (2): 282–5. doi :10.1016/j.ab.2006.02.017. PMID 16574057.
- ^ Yang H, Yang T, Baur JA, Pérez E, Matsui T, Carmona JJ, Lamming DW, Souza-Pinto NC, Bohr VA, Rosenzweig A, de Cabo R, Sauve AA, Sinclair DA (2007). "Los niveles de NAD+ mitocondrial sensible a los nutrientes dictan la supervivencia celular". Celúla . 130 (6): 1095–107. doi :10.1016/j.cell.2007.07.035. PMC 3366687 . PMID 17889652.
- ^ Belenky P, Racette FG, Bogan KL, McClure JM, Smith JS, Brenner C (2007). "El ribósido de nicotinamida promueve el silenciamiento de Sir2 y extiende la vida útil a través de las vías Nrk y Urh1/Pnp1/Meu1 hacia NAD+". Cell . 129 (3): 473–84. doi : 10.1016/j.cell.2007.03.024 . PMID 17482543. S2CID 4661723.
- ^ Blinova K, Carroll S, Bose S, Smirnov AV, Harvey JJ, Knutson JR, Balaban RS (2005). "Distribución de los tiempos de vida de la fluorescencia del NADH mitocondrial: cinética de estado estable de las interacciones del NADH de la matriz". Bioquímica . 44 (7): 2585–94. doi :10.1021/bi0485124. PMID 15709771.
- ^ Hopp A, Grüter P, Hottiger MO (2019). "Regulación del metabolismo de la glucosa por NAD+ y ADP-ribosilación". Cells . 8 (8): 890. doi : 10.3390/cells8080890 . PMC 6721828 . PMID 31412683.
- ^ Todisco S, Agrimi G, Castegna A, Palmieri F (2006). "Identificación del transportador mitocondrial de NAD+ en Saccharomyces cerevisiae". J. Biol. Chem . 281 (3): 1524–31. doi : 10.1074/jbc.M510425200 . PMID: 16291748.
- ^ Srivastava S (2016). "Funciones terapéuticas emergentes para el metabolismo del NAD(+) en trastornos mitocondriales y relacionados con la edad". Medicina clínica y traslacional . 5 (1): 25. doi : 10.1186/s40169-016-0104-7 . PMC 4963347 . PMID 27465020.
- ^ Zhang, Ning; Sauve, Anthony A. (2018). "Efectos reguladores de las vías metabólicas del NAD+ en la actividad de las sirtuinas". Sirtuinas en la salud y la enfermedad . Progreso en biología molecular y ciencia traslacional. Vol. 154. págs. 71–104. doi :10.1016/bs.pmbts.2017.11.012. ISBN . 9780128122617. Número de identificación personal 29413178.
- ^ Schafer FQ, Buettner GR (2001). "Entorno redox de la célula visto a través del estado redox de la pareja glutatión disulfuro/glutatión". Free Radic Biol Med . 30 (11): 1191–212. doi :10.1016/S0891-5849(01)00480-4. PMID 11368918.
- ^ Williamson DH, Lund P, Krebs HA (1967). "El estado redox del dinucleótido de nicotinamida-adenina libre en el citoplasma y las mitocondrias del hígado de rata". Biochem. J . 103 (2): 514–27. doi :10.1042/bj1030514. PMC 1270436 . PMID 4291787.
- ^ Zhang Q, Piston DW, Goodman RH (2002). "Regulación de la función correpresora por NADH nuclear". Science . 295 (5561): 1895–7. doi : 10.1126/science.1069300 . PMID 11847309. S2CID 31268989.
- ^ Lin SJ, Guarente L (abril de 2003). "Nicotinamida adenina dinucleótido, un regulador metabólico de la transcripción, la longevidad y la enfermedad". Curr. Opin. Cell Biol . 15 (2): 241–6. doi :10.1016/S0955-0674(03)00006-1. PMID 12648681.
- ^ Veech RL, Eggleston LV, Krebs HA (1969). "El estado redox del fosfato de dinucleótido de nicotinamida-adenina libre en el citoplasma del hígado de rata". Biochem. J . 115 (4): 609–19. doi :10.1042/bj1150609a. PMC 1185185 . PMID 4391039.
- ^ McReynolds MR, Chellappa K, Baur JA (2020). "Disminución de NAD+ relacionada con la edad". Gerontología experimental . 134 : 110888. doi :10.1016/j.exger.2020.110888. PMC 7442590. PMID 32097708 .
- ^ Katoh A, Uenohara K, Akita M, Hashimoto T (2006). "Los primeros pasos en la biosíntesis de NAD en Arabidopsis comienzan con aspartato y ocurren en el plástido". Plant Physiol . 141 (3): 851–857. doi :10.1104/pp.106.081091. PMC 1489895 . PMID 16698895.
- ^ Foster JW, Moat AG (1 de marzo de 1980). "Biosíntesis de nicotinamida adenina dinucleótido y metabolismo del ciclo de nucleótidos de piridina en sistemas microbianos". Microbiol. Rev. 44 ( 1): 83–105. doi :10.1128/MMBR.44.1.83-105.1980. PMC 373235. PMID 6997723 .
- ^ Magni G, Orsomando G, Raffaelli N (2006). "Propiedades estructurales y funcionales de la quinasa NAD, una enzima clave en la biosíntesis de NADP". Mini Reviews in Medicinal Chemistry . 6 (7): 739–746. doi :10.2174/138955706777698688. PMID 16842123.
- ^ Sakuraba H, Kawakami R, Ohshima T (2005). "Primera quinasa de NAD dependiente de ATP/polifosfato inorgánico arqueal, de la arqueona hipertermófila Pyrococcus horikoshii: clonación, expresión y caracterización". Appl. Environ. Microbiol . 71 (8): 4352–4358. Bibcode :2005ApEnM..71.4352S. doi :10.1128/AEM.71.8.4352-4358.2005. PMC 1183369 . PMID 16085824.
- ^ Raffaelli N, Finaurini L, Mazzola F, Pucci L, Sorci L, Amici A, Magni G (2004). "Caracterización de la quinasa NAD de Mycobacterium tuberculosis: análisis funcional de la enzima de longitud completa mediante mutagénesis dirigida al sitio". Bioquímica . 43 (23): 7610–7617. doi :10.1021/bi049650w. PMID 15182203.
- ^ Henderson LM (1983). "Niacina". Año. Rev. Nutr . 3 : 289–307. doi : 10.1146/annurev.nu.03.070183.001445. PMID 6357238.
- ^ ab Rajman L, Chwalek K, Sinclair DA (2018). "Potencial terapéutico de las moléculas potenciadoras de NAD: evidencia in vivo". Metabolismo celular . 27 (3): 529–547. doi :10.1016/j.cmet.2018.02.011. PMC 6342515. PMID 29514064 .
- ^ "¿Qué es NMN?". www.nmn.com . Consultado el 8 de enero de 2021 .
- ^ Anderson RM, Bitterman KJ, Wood JG, Medvedik O, Cohen H, Lin SS, Manchester JK, Gordon JI, Sinclair DA (2002). "La manipulación de una vía de recuperación de NAD+ nuclear retrasa el envejecimiento sin alterar los niveles de NAD+ en estado estacionario". J. Biol. Chem . 277 (21): 18881–18890. doi : 10.1074/jbc.M111773200 . PMC 3745358. PMID 11884393 .
- ^ Billington RA, Travelli C, Ercolano E, Galli U, Roman CB, Grolla AA, Canonico PL, Condorelli F, Genazzani AA (2008). "Caracterización de la captación de NAD en células de mamíferos". J. Biol. química . 283 (10): 6367–6374. doi : 10.1074/jbc.M706204200 . PMID 18180302.
- ^ Trammell SA, Schmidt MS, Weidemann BJ, Redpath P, Jaksch F, Dellinger RW, Li Z, Abel ED, Migaud ME, Brenner C (2016). "El ribósido de nicotinamida es biodisponible de forma única y oral en ratones y humanos". Nature Communications . 7 : 12948. Bibcode :2016NatCo...712948T. doi :10.1038/ncomms12948. PMC 5062546 . PMID 27721479.
- ^ ab Rongvaux A, Andris F, Van Gool F, Leo O (2003). "Reconstrucción del metabolismo eucariota del NAD". BioEssays . 25 (7): 683–690. doi :10.1002/bies.10297. PMID 12815723.
- ^ Ma B, Pan SJ, Zupancic ML, Cormack BP (2007). "Asimilación de precursores de NAD+ en Candida glabrata". Mol. Microbiol . 66 (1): 14–25. doi : 10.1111/j.1365-2958.2007.05886.x . PMID 17725566. S2CID 22282128.
- ^ Reidl J, Schlör S, Kraiss A, Schmidt-Brauns J, Kemmer G, Soleva E (2000). "Utilización de NADP y NAD en Haemophilus influenzae ". Mol. Microbiol . 35 (6): 1573–1581. doi :10.1046/j.1365-2958.2000.01829.x. PMID 10760156. S2CID 29776509.
- ^ Gerdes SY, Scholle MD, D'Souza M, Bernal A, Baev MV, Farrell M, Kurnasov OV, Daugherty MD, Mseeh F, Polanuyer BM, Campbell JW, Anantha S, Shatalin KY, Chowdhury SA, Fonstein MY, Osterman AL (2002). "De la huella genética a los objetivos de los fármacos antimicrobianos: ejemplos de vías biosintéticas de cofactores". J. Bacteriol . 184 (16): 4555–4572. doi :10.1128/JB.184.16.4555-4572.2002. PMC 135229 . PMID 12142426.
- ^ Senkovich O, Speed H, Grigorian A, et al. (2005). "Cristalización de tres enzimas glucolíticas clave del patógeno oportunista Cryptosporidium parvum ". Biochim. Biophys. Acta . 1750 (2): 166–72. doi :10.1016/j.bbapap.2005.04.009. PMID 15953771.
- ^ abc Smyth LM, Bobalova J, Mendoza MG, Lew C, Mutafova-Yambolieva VN (2004). "Liberación de beta-nicotinamida adenina dinucleótido tras estimulación de terminales nerviosas posganglionares en vasos sanguíneos y vejiga urinaria". J Biol Chem . 279 (47): 48893–903. doi : 10.1074/jbc.M407266200 . PMID 15364945.
- ^ abc Billington RA, Bruzzone S, De Flora A, Genazzani AA, Koch-Nolte F, Ziegler M, Zocchi E (2006). "Funciones emergentes de los nucleótidos de piridina extracelulares". Mol. Med . 12 (11–12): 324–7. doi :10.2119/2006-00075.Billington. PMC 1829198. PMID 17380199 .
- ^ "Nomenclatura enzimática, recomendaciones para los nombres de enzimas del Comité de Nomenclatura de la Unión Internacional de Bioquímica y Biología Molecular". Archivado desde el original el 5 de diciembre de 2007. Consultado el 6 de diciembre de 2007 .
- ^ "NiceZyme View of ENZYME: EC 1.6.5.3". Expasy . Consultado el 16 de diciembre de 2007 .
- ^ Hanukoglu I (2015). "Proteopedia: Pliegue de Rossmann: un pliegue beta-alfa-beta en sitios de unión de dinucleótidos". Biochem Mol Biol Educ . 43 (3): 206–209. doi : 10.1002/bmb.20849 . PMID: 25704928. S2CID : 11857160.
- ^ Lesk AM (1995). "Dominios de unión a NAD de las deshidrogenasas". Curr. Opin. Struct. Biol . 5 (6): 775–83. doi :10.1016/0959-440X(95)80010-7. PMID 8749365.
- ^ Rao ST, Rossmann MG (1973). "Comparación de estructuras supersecundarias en proteínas". J Mol Biol . 76 (2): 241–56. doi :10.1016/0022-2836(73)90388-4. PMID 4737475.
- ^ Goto M, Muramatsu H, Mihara H, Kurihara T, Esaki N, Omi R, Miyahara I, Hirotsu K (2005). "Estructuras cristalinas de la delta1-piperideína-2-carboxilato/delta1-pirrolina-2-carboxilato reductasa perteneciente a una nueva familia de oxidorreductasas dependientes de NAD(P)H: cambio conformacional, reconocimiento de sustrato y estereoquímica de la reacción". J. Biol. Chem . 280 (49): 40875–84. doi : 10.1074/jbc.M507399200 . PMID 16192274.
- ^ ab Bellamacina CR (1 de septiembre de 1996). "El motivo de unión del dinucleótido de nicotinamida: una comparación de proteínas de unión a nucleótidos". FASEB J . 10 (11): 1257–69. doi : 10.1096/fasebj.10.11.8836039 . PMID 8836039. S2CID 24189316.
- ^ Carugo O, Argos P (1997). "Enzimas dependientes de NADP. I: Estereoquímica conservada de la unión de cofactores". Proteins . 28 (1): 10–28. doi :10.1002/(SICI)1097-0134(199705)28:1<10::AID-PROT2>3.0.CO;2-N. PMID 9144787. S2CID 23969986.
- ^ Vickers TJ, Orsomando G, de la Garza RD, Scott DA, Kang SO, Hanson AD, Beverley SM (2006). "Análisis bioquímico y genético de la metilentetrahidrofolato reductasa en el metabolismo y la virulencia de Leishmania". J. Biol. Chem . 281 (50): 38150–8. doi : 10.1074/jbc.M608387200 . PMID 17032644.
- ^ Bakker BM, Overkamp KM, Kötter P, Luttik MA, Pronk JT (2001). "Estequiometría y compartimentación del metabolismo de NADH en Saccharomyces cerevisiae". FEMS Microbiol. Rev. 25 ( 1): 15–37. doi : 10.1111/j.1574-6976.2001.tb00570.x . PMID 11152939.
- ^ Rich, PR (1 de diciembre de 2003). "La maquinaria molecular de la cadena respiratoria de Keilin". Biochemical Society Transactions . 31 (6): 1095–1105. doi :10.1042/bst0311095. PMID 14641005. S2CID 32361233.
- ^ Heineke D, Riens B, Grosse H, Hoferichter P, Peter U, Flügge UI, Heldt HW (1991). "Transferencia redox a través de la membrana de la envoltura interna del cloroplasto". Fisiol vegetal . 95 (4): 1131-1137. doi : 10.1104/pp.95.4.1131. PMC 1077662 . PMID 16668101.
- ^ de Nicholls DG; Ferguson SJ (2002). Bioenergética 3 (1.ª ed.). Academic Press. ISBN 978-0-12-518121-1.
- ^ Sistare, FD; Haynes, RC (octubre de 1985). "La interacción entre el potencial redox del nucleótido de piridina citosólica y la gluconeogénesis a partir de lactato/piruvato en hepatocitos de rata aislados. Implicaciones para las investigaciones de la acción hormonal". Journal of Biological Chemistry . 260 (23): 12748–12753. doi : 10.1016/S0021-9258(17)38940-8 . PMID 4044607.
- ^ Freitag A, Bock E (1990). "Conservación de energía en Nitrobacter". FEMS Microbiology Letters . 66 (1–3): 157–62. doi : 10.1111/j.1574-6968.1990.tb03989.x .
- ^ Starkenburg SR, Chain PS, Sayavedra-Soto LA, Hauser L, Land ML, Larimer FW, Malfatti SA, Klotz MG, Bottomley PJ, Arp DJ, Hickey WJ (2006). "Secuencia del genoma de la bacteria quimiolitoautotrófica oxidante de nitrito Nitrobacter winogradskyi Nb-255". Appl. Environ. Microbiol . 72 (3): 2050–63. Bibcode :2006ApEnM..72.2050S. doi : 10.1128/AEM.72.3.2050-2063.2006. PMC 1393235. PMID 16517654.
- ^ Ziegler M (2000). "Nuevas funciones de una molécula conocida desde hace mucho tiempo. Funciones emergentes del NAD en la señalización celular". Eur. J. Biochem . 267 (6): 1550–64. doi : 10.1046/j.1432-1327.2000.01187.x . PMID: 10712584.
- ^ ab Diefenbach J, Bürkle A (2005). "Introducción al metabolismo de la poli(ADP-ribosa)". Cell. Mol. Life Sci . 62 (7–8): 721–30. doi :10.1007/s00018-004-4503-3. PMID 15868397.
- ^ Berger F, Ramírez-Hernández MH, Ziegler M (2004). "La nueva vida de un centenario: funciones de señalización de NAD(P)". Tendencias Bioquímica. Ciencia . 29 (3): 111–8. doi :10.1016/j.tibs.2004.01.007. PMID 15003268. S2CID 8820773.
- ^ Corda D, Di Girolamo M (2003). "Revisión de un nuevo miembro de Embo: aspectos funcionales de la mono-ADP-ribosilación de proteínas". EMBO J . 22 (9): 1953–8. doi :10.1093/emboj/cdg209. PMC 156081 . PMID 12727863.
- ^ ab Bürkle A (2005). "Poli(ADP-ribosa). El metabolito más elaborado de NAD+". FEBS J . 272 (18): 4576–89. doi : 10.1111/j.1742-4658.2005.04864.x . PMID 16156780. S2CID 22975714.
- ^ Seman M, Adriouch S, Haag F, Koch-Nolte F (2004). "Ecto-ADP-ribosiltransferasas (ART): actores emergentes en la comunicación y señalización celular". Curr. Med. Chem . 11 (7): 857–72. doi :10.2174/0929867043455611. PMID 15078170.
- ^ Chen YG, Kowtoniuk WE, Agarwal I, Shen Y, Liu DR (diciembre de 2009). "El análisis LC/MS del ARN celular revela ARN ligado a NAD". Nat Chem Biol . 5 (12): 879–881. doi :10.1038/nchembio.235. PMC 2842606 . PMID 19820715.
- ^ Guse AH (2004). "Bioquímica, biología y farmacología de la adenosina difosforibosa cíclica (cADPR)". Curr. Med. Chem . 11 (7): 847–55. doi :10.2174/0929867043455602. PMID 15078169.
- ^ Guse AH (2004). "Regulación de la señalización del calcio por el segundo mensajero adenosina difosforibosa cíclica (cADPR)". Curr. Mol. Med . 4 (3): 239–48. doi :10.2174/1566524043360771. PMID 15101682.
- ^ Guse AH (2005). "Función del segundo mensajero y relación estructura-actividad de la adenosina difosforibosa cíclica (cADPR)". FEBS J . 272 (18): 4590–7. doi : 10.1111/j.1742-4658.2005.04863.x . PMID 16156781. S2CID 21509962.
- ^ North BJ, Verdin E (2004). "Sirtuinas: desacetilasas de proteínas dependientes de NAD relacionadas con Sir2". Genome Biol . 5 (5): 224. doi : 10.1186/gb-2004-5-5-224 . PMC 416462 . PMID 15128440.
- ^ ab Verdin, Eric (4 de diciembre de 2015). "NAD⁺ en el envejecimiento, el metabolismo y la neurodegeneración". Science . 350 (6265): 1208–1213. Bibcode :2015Sci...350.1208V. doi :10.1126/science.aac4854. ISSN 1095-9203. PMID 26785480. S2CID 27313960.
- ^ Blander, Gil; Guarente, Leonard (junio de 2004). "La familia Sir2 de proteínas desacetilasas". Revisión anual de bioquímica . 73 (1): 417–435. doi :10.1146/annurev.biochem.73.011303.073651. PMID 15189148. S2CID 27494475.
- ^ Trapp J, Jung M (2006). "El papel de las histonas desacetilasas dependientes de NAD+ (sirtuinas) en el envejecimiento". Curr Drug Targets . 7 (11): 1553–60. doi :10.2174/1389450110607011553. PMID 17100594.
- ^ ab Meyer, Tom; Shimon, Dor; Youssef, Sawsan; Yankovitz, Gal; Tessler, Adi; Chernobylsky, Tom; Gaoni-Yogev, Anat; Perelroizen, Rita; Budick-Harmelin, Noga; Steinman, Lawrence; Mayo, Lior (30 de agosto de 2022). "El metabolismo de NAD+ impulsa la reprogramación proinflamatoria de los astrocitos en la autoinmunidad del sistema nervioso central". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 119 (35): e2211310119. Bibcode :2022PNAS..11911310M. doi : 10.1073/pnas.2211310119 . ISSN 1091-6490. PMC 9436380 . PMID 35994674.
- ^ Wilkinson A, Day J, Bowater R (2001). "Ligasas de ADN bacterianas". Mol. Microbiol . 40 (6): 1241–8. doi : 10.1046/j.1365-2958.2001.02479.x . PMID: 11442824. S2CID : 19909818.
- ^ Schär P, Herrmann G, Daly G, Lindahl T (1997). "Una ligasa de ADN recientemente identificada de Saccharomyces cerevisiae involucrada en la reparación independiente de RAD52 de roturas de doble cadena de ADN". Genes & Development . 11 (15): 1912–24. doi :10.1101/gad.11.15.1912. PMC 316416 . PMID 9271115.
- ^ abc Li, Jun; Bonkowski, Michael S.; Moniot, Sébastien; Zhang, Dapeng; Hubbard, Basil P.; Ling, Alvin JY; Rajman, Luis A.; Qin, Bo; Lou, Zhenkun; Gorbunova, Vera; Aravind, L.; Steegborn, Clemens; Sinclair, David A. (23 de marzo de 2017). "Un bolsillo de unión de NAD conservado que regula las interacciones proteína-proteína durante el envejecimiento". Science . 355 (6331): 1312–1317. Bibcode :2017Sci...355.1312L. doi :10.1126/science.aad8242. PMC 5456119 . PMID 28336669.
- ^ Verdin E. NAD⁺ en el envejecimiento, el metabolismo y la neurodegeneración. Science. 4 de diciembre de 2015;350(6265):1208-13. doi: 10.1126/science.aac4854. PMID 26785480
- ^ Ziegler M, Niere M (2004). "NAD+ vuelve a aparecer en la superficie". Biochem. J . 382 (Pt 3): e5–6. doi :10.1042/BJ20041217. PMC 1133982 . PMID 15352307.
- ^ Koch-Nolte F, Fischer S, Haag F, Ziegler M (2011). "Compartimentación de la señalización dependiente de NAD+". FEBS Lett . 585 (11): 1651–6. Código Bibliográfico :2011FEBSL.585.1651K. doi : 10.1016/j.febslet.2011.03.045 . PMID 21443875. S2CID 4333147.
- ^ Breen, Leanne T.; Smyth, Lisa M.; Yamboliev, Ilia A.; Mutafova-Yambolieva, Violeta N. (febrero de 2006). "β-NAD es un nuevo nucleótido liberado al estimular las terminales nerviosas en el músculo detrusor de la vejiga urinaria humana". Revista estadounidense de fisiología. Fisiología renal . 290 (2): F486–F495. doi :10.1152/ajprenal.00314.2005. PMID 16189287. S2CID 11400206.
- ^ ab Mutafova-Yambolieva VN, Hwang SJ, Hao X, Chen H, Zhu MX, Wood JD, Ward SM, Sanders KM (2007). "El dinucleótido de beta-nicotinamida y adenina es un neurotransmisor inhibidor en el músculo liso visceral". Proc. Natl. Sci. EE. UU . . 104 (41): 16359–64. Bibcode :2007PNAS..10416359M. doi : 10.1073/pnas.0705510104 . PMC 2042211 . PMID 17913880.
- ^ ab Hwang SJ, Durnin L, Dwyer L, Rhee PL, Ward SM, Koh SD, Sanders KM, Mutafova-Yambolieva VN (2011). "El dinucleótido de adenina β-nicotinamida es un neurotransmisor inhibidor entérico en colones de primates humanos y no humanos". Gastroenterología . 140 (2): 608–617.e6. doi :10.1053/j.gastro.2010.09.039. PMC 3031738 . PMID 20875415.
- ^ Yamboliev IA, Smyth LM, Durnin L, Dai Y, Mutafova-Yambolieva VN (2009). "Almacenamiento y secreción de beta-NAD, ATP y dopamina en células PC12 de feocromocitoma de rata diferenciadas por NGF". Eur. J. Neurosci . 30 (5): 756–68. doi :10.1111/j.1460-9568.2009.06869.x. PMC 2774892 . PMID 19712094.
- ^ Durnin L, Dai Y, Aiba I, Shuttleworth CW, Yamboliev IA, Mutafova-Yambolieva VN (2012). "Liberación, efectos neuronales y eliminación de β-nicotinamida adenina dinucleótido extracelular (β-NAD+) en el cerebro de la rata". Eur. J. Neurosci . 35 (3): 423–35. doi :10.1111/j.1460-9568.2011.07957.x. PMC 3270379 . PMID 22276961.
- ^ Wang C, Zhou M, Zhang X, Yao J, Zhang Y, Mou Z (2017). "Una quinasa del receptor de lectina como un sensor potencial para el dinucleótido de nicotinamida y adenina extracelular en Arabidopsis thaliana". eLife . 6 : e25474. doi : 10.7554/eLife.25474 . PMC 5560858 . PMID 28722654.
- ^ Sauve AA (marzo de 2008). "NAD + y vitamina B3: del metabolismo a las terapias". Revista de farmacología y terapéutica experimental . 324 (3): 883–893. doi :10.1124/jpet.107.120758. PMID 18165311. S2CID 875753.
- ^ Khan JA, Forouhar F, Tao X, Tong L (2007). "Metabolismo del dinucleótido de nicotinamida y adenina como un objetivo atractivo para el descubrimiento de fármacos". Opinión de expertos. Objetivos terapéuticos . 11 (5): 695–705. doi :10.1517/14728222.11.5.695. PMID 17465726. S2CID 6490887.
- ^ Yaku K, Okabe K, Hikosaka K, Nakagawa T (2018). "Metabolismo de NAD en la terapéutica del cáncer". Frontiers in Microbiology . 8 : 622. doi : 10.3389/fonc.2018.00622 . PMC 6315198 . PMID 30631755.
- ^ Pramono AA, Rather GM, Herman H (2020). "Enzimas que contribuyen al NAD y al NADPH como objetivos terapéuticos en el cáncer: una descripción general". Biomolecules . 10 (3): 358. doi : 10.3390/biom10030358 . PMC 7175141 . PMID 32111066.
- ^ Penberthy, W. Todd; Tsunoda, Ikuo (2009). "La importancia del NAD en la esclerosis múltiple". Current Pharmaceutical Design . 15 (1): 64–99. doi :10.2174/138161209787185751. ISSN 1873-4286. PMC 2651433 . PMID 19149604.
- ^ Swerdlow RH (1998). "¿Es eficaz el NADH en el tratamiento de la enfermedad de Parkinson?". Drugs Aging . 13 (4): 263–268. doi :10.2165/00002512-199813040-00002. PMID 9805207. S2CID 10683162.
- ^ Timmins GS, Deretic V (2006). "Mecanismos de acción de la isoniazida". Mol. Microbiol . 62 (5): 1220–1227. doi : 10.1111/j.1365-2958.2006.05467.x . PMID: 17074073. S2CID : 43379861.
- ^ Rawat R, Whitty A, Tonge PJ (2003). "El aducto de isoniazida-NAD es un inhibidor lento y de unión estrecha de InhA, la enoil reductasa de Mycobacterium tuberculosis: afinidad del aducto y resistencia a fármacos". Proc. Natl. Sci. USA . 100 (24): 13881–13886. Bibcode :2003PNAS..10013881R. doi : 10.1073/pnas.2235848100 . PMC 283515 . PMID 14623976.
- ^ Argyrou A, Vetting MW, Aladegbami B, Blanchard JS (2006). "La dihidrofolato reductasa de Mycobacterium tuberculosis es un objetivo de la isoniazida". Nat. Struct. Mol. Biol . 13 (5): 408–413. doi :10.1038/nsmb1089. PMID 16648861. S2CID 7721666.
- ^ ab Pankiewicz KW, Patterson SE, Black PL, Jayaram HN, Risal D, Goldstein BM, Stuyver LJ, Schinazi RF (2004). "Cofactores imitadores como inhibidores selectivos de la inosina monofosfato deshidrogenasa dependiente de NAD (IMPDH): el principal objetivo terapéutico". Curr. Med. Chem . 11 (7): 887–900. doi :10.2174/0929867043455648. PMID 15083807.
- ^ Franchetti P, Grifantini M (1999). "Inhibidores nucleósidos y no nucleósidos de la IMP deshidrogenasa como agentes antitumorales y antivirales". Curr. Med. Chem . 6 (7): 599–614. doi :10.2174/092986730607220401123801. PMID 10390603. S2CID 247868867.
- ^ Kim EJ, Um SJ (2008). "SIRT1: funciones en el envejecimiento y el cáncer". BMB Rep . 41 (11): 751–756. doi : 10.5483/BMBRep.2008.41.11.751 . PMID 19017485.
- ^ Valenzano DR, Terzibasi E, Genade T, Cattaneo A, Domenici L, Cellerino A (2006). "El resveratrol prolonga la vida útil y retarda la aparición de marcadores relacionados con la edad en un vertebrado de vida corta". Curr. Biol . 16 (3): 296–300. Bibcode :2006CBio...16..296V. doi : 10.1016/j.cub.2005.12.038 . hdl : 11384/14713 . PMID 16461283. S2CID 1662390.
- ^ Howitz KT, Bitterman KJ, Cohen HY, Lamming DW, Lavu S, Wood JG, Zipkin RE, Chung P, Kisielewski A, Zhang LL, Scherer B, Sinclair DA (2003). "Los activadores de sirtuinas de moléculas pequeñas extienden la vida útil de Saccharomyces cerevisiae ". Nature . 425 (6954): 191–196. Bibcode :2003Natur.425..191H. doi :10.1038/nature01960. PMID 12939617. S2CID 4395572.
- ^ Wood JG, Rogina B, Lavu S, Howitz K, Helfand SL, Tatar M, Sinclair D (2004). "Los activadores de sirtuinas imitan la restricción calórica y retrasan el envejecimiento en metazoos". Nature . 430 (7000): 686–689. Bibcode :2004Natur.430..686W. doi :10.1038/nature02789. PMID 15254550. S2CID 52851999.
- ^ Gomes AP, Price NL, Ling AJ, Moslehi JJ, Montgomery MK, Rajman L, White JP, Teodoro JS, Wrann CD, Hubbard BP, Mercken EM, Palmeira CM, de Cabo R, Rolo AP, Turner N, Bell EL, Sinclair DA (19 de diciembre de 2013). "La disminución de NAD+ induce un estado pseudohipóxico que altera la comunicación nuclear-mitocondrial durante el envejecimiento". Cell . 155 (7): 1624–1638. doi :10.1016/j.cell.2013.11.037. PMC 4076149 . PMID 24360282.
- ^ Rizzi M, Schindelin H (2002). "Biología estructural de las enzimas implicadas en la biosíntesis de NAD y cofactores de molibdeno". Curr. Opin. Struct. Biol . 12 (6): 709–720. doi :10.1016/S0959-440X(02)00385-8. PMID 12504674.
- ^ Begley, Tadhg P.; Kinsland, Cynthia; Mehl, Ryan A.; Osterman, Andrei; Dorrestein, Pieter (2001). "La biosíntesis de los dinucleótidos de nicotinamida y adenina en bacterias". Biosíntesis de cofactores . Vitaminas y hormonas. Vol. 61. págs. 103–119. doi :10.1016/S0083-6729(01)61003-3. ISBN 9780127098616. Número de identificación personal 11153263.
- ^ "Manual de laboratorio de meningitis: identificación y caracterización de Hib | CDC". www.cdc.gov . 30 de marzo de 2021.
- ^ Harden, A; Young, WJ (24 de octubre de 1906). "La fermentación alcohólica del jugo de levadura Parte II.--La cofermentación del jugo de levadura". Actas de la Royal Society de Londres . Serie B, que contiene artículos de carácter biológico. 78 (526): 369–375. doi : 10.1098/rspb.1906.0070 . JSTOR 80144.
- ^ "Fermentación de azúcares y enzimas fermentativas" (PDF) . Conferencia Nobel, 23 de mayo de 1930. Fundación Nobel. Archivado desde el original (PDF) el 27 de septiembre de 2007. Consultado el 30 de septiembre de 2007 .
- ^ Warburg O, Christian W (1936). "Pyridin, der wasserstoffübertragende bestandteil von gärungsfermenten (piridin-nucleótido)" [Piridina, el componente transferidor de hidrógeno de las enzimas de fermentación (piridina nucleótido)]. Biochemische Zeitschrift (en alemán). 287 : 291. doi : 10.1002/hlca.193601901199.
- ^ Elvehjem CA, Madden RJ, Strong FM, Woolley DW (1938). "El aislamiento y la identificación del factor antilengua negra". J. Biol. Chem . 123 (1): 137–49. doi : 10.1016/S0021-9258(18)74164-1 .
- ^ Axelrod AE, Madden RJ, Elvehjem CA (1939). "El efecto de una deficiencia de ácido nicotínico sobre el contenido de coenzima I de los tejidos animales". J. Biol. Chem . 131 (1): 85–93. doi : 10.1016/S0021-9258(18)73482-0 .
- ^ Kornberg A (1948). "La participación del pirofosfato inorgánico en la síntesis enzimática reversible del nucleótido difosfopiridina". J. Biol. Chem . 176 (3): 1475–76. doi : 10.1016/S0021-9258(18)57167-2 . PMID 18098602.
- ^ Friedkin M, Lehninger AL (1 de abril de 1949). "Esterificación de fosfato inorgánico acoplada al transporte de electrones entre el nucleótido dihidrodifosfopiridina y el oxígeno". J. Biol. Chem . 178 (2): 611–23. doi : 10.1016/S0021-9258(18)56879-4 . PMID 18116985.
- ^ Preiss J, Handler P (1958). "Biosíntesis del nucleótido de difosfopiridina. I. Identificación de intermediarios". J. Biol. Chem . 233 (2): 488–92. doi : 10.1016/S0021-9258(18)64789-1 . PMID: 13563526.
- ^ Preiss J, Handler P (1958). "Biosíntesis del nucleótido de difosfopiridina. II. Aspectos enzimáticos". J. Biol. Chem . 233 (2): 493–500. doi : 10.1016/S0021-9258(18)64790-8 . PMID: 13563527.
- ^ Bieganowski, P; Brenner, C (2004). "Descubrimientos de la nicotinamida ribósido como nutriente y genes NRK conservados establecen una ruta independiente del controlador de Preiss hacia NAD+ en hongos y humanos". Cell . 117 (4): 495–502. doi : 10.1016/S0092-8674(04)00416-7 . PMID 15137942. S2CID 4642295.
- ^ Chambon P, Weill JD, Mandel P (1963). "Activación del nuevo enzima nuclear sintetizador de ácido poliadenílico dependiente de ADN mediante mononucleótido de nicotinamida". Biochem. Biophys. Res. Commun . 11 : 39–43. doi :10.1016/0006-291X(63)90024-X. PMID 14019961.
- ^ Clapper DL, Walseth TF, Dargie PJ, Lee HC (15 de julio de 1987). "Los metabolitos de nucleótidos de piridina estimulan la liberación de calcio de los microsomas de huevos de erizo de mar desensibilizados al trifosfato de inositol". J. Biol. Chem . 262 (20): 9561–8. doi : 10.1016/S0021-9258(18)47970-7 . PMID 3496336.
- ^ Imai S, Armstrong CM, Kaeberlein M, Guarente L (2000). "Silenciamiento transcripcional y proteína de longevidad Sir2 es una histona desacetilasa dependiente de NAD". Nature . 403 (6771): 795–800. Bibcode :2000Natur.403..795I. doi :10.1038/35001622. PMID 10693811. S2CID 2967911.
- ^ Imai S (2009). "El mundo del NAD: una nueva red reguladora sistémica para el metabolismo y el envejecimiento: Sirt1, biosíntesis sistémica del NAD y su importancia". Bioquímica y biofísica celular . 53 (2): 65–74. doi :10.1007/s12013-008-9041-4. PMC 2734380 . PMID 19130305.
- ^ Imai S (2016). "El mundo NAD 2.0: la importancia de la comunicación intertisular mediada por NAMPT/NAD+/SIRT1 en el control del envejecimiento y la longevidad de los mamíferos". npj Systems Biology and Applications . 2 : 16018. doi :10.1038/npjsba.2016.18. PMC 5516857 . PMID 28725474.
- ^ "Se formó Napa Therapeutics para desarrollar fármacos que influyan en el metabolismo del NAD". ¡Combate el envejecimiento! . 17 de agosto de 2018 . Consultado el 29 de noviembre de 2023 .
Lectura adicional
Función
- Nelson DL; Cox MM (2004). Principios de bioquímica de Lehninger (4.ª ed.). WH Freeman. ISBN 978-0-7167-4339-2.
- Bugg T (2004). Introducción a la química de enzimas y coenzimas (2.ª ed.). Blackwell Publishing Limited. ISBN 978-1-4051-1452-3.
- Lee HC (2002). ADP-ribosa cíclica y NAADP: estructura, metabolismo y funciones . Kluwer Academic Publishers. ISBN 978-1-4020-7281-9.
- Levine OS, Schuchat A, Schwartz B, Wenger JD, Elliott J (1997). "Protocolo genérico para la vigilancia poblacional de Haemophilus influenzae tipo B" (PDF) . Organización Mundial de la Salud. Centros para el Control y Prevención de Enfermedades. pág. 13. WHO/VRD/GEN/95.05. Archivado desde el original (PDF) el 1 de julio de 2004.
- Kim, Jinhyun; Lee, Sahng Ha; Tieves, Florian; Paul, Caroline E.; Hollmann, Frank; Park, Chan Beum (5 de julio de 2019). "Nicotinamida adenina dinucleótido como fotocatalizador". Science Advances . 5 (7): eaax0501. Bibcode :2019SciA....5..501K. doi :10.1126/sciadv.aax0501. PMC 6641943 . PMID 31334353.
Historia
- Cornish-Bowden, Athel (1997). Cerveza nueva en una botella vieja. Eduard Buchner y el crecimiento del conocimiento bioquímico. Valencia: Universitat de Valencia. ISBN 978-84-370-3328-0Archivado desde el original el 13 de diciembre de 2010 . Consultado el 8 de diciembre de 2007 ., Una historia de la enzimología temprana.
- Williams, Henry Smith (1904). Desarrollo moderno de las ciencias químicas y biológicas. Una historia de la ciencia: en cinco volúmenes. Vol. IV. Nueva York: Harper and Brothers., un libro de texto del siglo XIX.
Enlaces externos
- NAD unido a proteínas en el Banco de Datos de Proteínas
- Animación NAD (se requiere Flash)
- Ficha técnica química de β-nicotinamida adenina dinucleótido (NAD+, oxidado) y NADH (reducido) de Sigma-Aldrich
- Vía de síntesis de NAD+, NADH y NAD en la base de datos MetaCyc
- Lista de oxidorreductasas Archivado el 30 de noviembre de 2010 en Wayback Machine en la base de datos SWISS-PROT
- NAD+
- NAD+ La molécula de la juventud




