Evolución molecular
| Parte de una serie sobre |
| Biología evolutiva |
|---|
 |
La evolución molecular describe cómo el ADN y/o ARN heredados cambian a lo largo del tiempo evolutivo , y las consecuencias de esto para las proteínas y otros componentes de las células y los organismos . La evolución molecular es la base de los enfoques filogenéticos para describir el árbol de la vida . La evolución molecular se superpone con la genética de poblaciones , especialmente en escalas de tiempo más cortas. Los temas de la evolución molecular incluyen los orígenes de nuevos genes, la naturaleza genética de los rasgos complejos , la base genética de la adaptación y la especiación , la evolución del desarrollo y los patrones y procesos subyacentes a los cambios genómicos durante la evolución.
Historia
La historia de la evolución molecular comienza a principios del siglo XX con la bioquímica comparativa y el uso de métodos de "huella digital" como los ensayos inmunológicos, la electroforesis en gel y la cromatografía en papel en la década de 1950 para explorar proteínas homólogas . [1] [2] El advenimiento de la secuenciación de proteínas permitió a los biólogos moleculares crear filogenias basadas en la comparación de secuencias y utilizar las diferencias entre secuencias homólogas como un reloj molecular para estimar el tiempo desde el ancestro común más reciente . [3] [1] La sorprendentemente gran cantidad de divergencia molecular dentro y entre especies inspiró la teoría neutral de la evolución molecular a fines de la década de 1960. [4] [5] [6] La teoría neutral también proporcionó una base teórica para el reloj molecular , aunque esto no es necesario para la validez del reloj. Después de la década de 1970, la secuenciación de ácidos nucleicos permitió que la evolución molecular llegara más allá de las proteínas hasta secuencias de ARN ribosómico altamente conservadas , la base de una reconceptualización de la historia temprana de la vida . [1] La Sociedad de Biología Molecular y Evolución se fundó en 1982.
Filogenética molecular
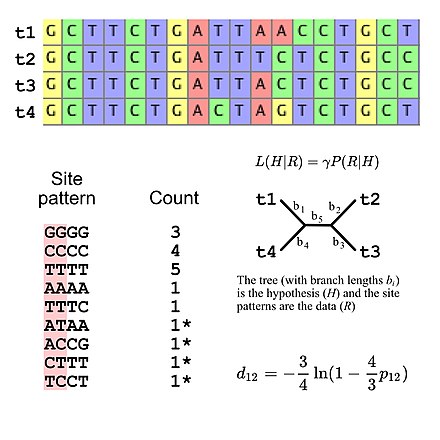
La filogenética molecular utiliza secuencias de ADN , ARN o proteínas para resolver cuestiones de sistemática , es decir, sobre su correcta clasificación científica desde el punto de vista de la historia evolutiva . El resultado de un análisis filogenético molecular se expresa en un árbol filogenético . La inferencia filogenética se lleva a cabo utilizando datos de secuenciación de ADN . Esto se alinea para identificar qué sitios son homólogos . Un modelo de sustitución describe qué patrones se espera que sean comunes o raros. Luego se utiliza una inferencia computacional sofisticada para generar uno o más árboles plausibles.
Algunos métodos filogenéticos dan cuenta de la variación entre sitios y entre ramas de árboles . Diferentes genes, p. ej., hemoglobina vs. citocromo c , generalmente evolucionan a diferentes velocidades . [7] Estas velocidades son relativamente constantes a lo largo del tiempo (p. ej., la hemoglobina no evoluciona a la misma velocidad que el citocromo c, pero las hemoglobinas de humanos, ratones, etc. tienen velocidades de evolución comparables), aunque la evolución rápida a lo largo de una rama puede indicar una mayor selección direccional en esa rama. [8] La selección purificadora hace que las regiones funcionalmente importantes evolucionen más lentamente, y las sustituciones de aminoácidos que involucran aminoácidos similares ocurren con más frecuencia que las sustituciones diferentes. [7]

Evolución de la familia genética

La duplicación de genes puede producir múltiples proteínas homólogas (parálogos) dentro de la misma especie. El análisis filogenético de las proteínas ha revelado cómo evolucionan y cambian su estructura y función con el tiempo. [9] [10]
Por ejemplo, la ribonucleótido reductasa (RNR) ha desarrollado una multitud de variantes estructurales y funcionales. Las RNR de clase I utilizan una subunidad de ferritina y se diferencian por el metal que utilizan como cofactor. En las RNR de clase II , el radical tiilo se genera utilizando un cofactor de adenosilcobalamina y estas enzimas no requieren subunidades adicionales (a diferencia de la clase I que sí las requiere). En las RNR de clase III , el radical tiilo se genera utilizando S-adenosilmetionina unida a un grupo [ 4Fe-4S ]. Es decir, dentro de una única familia de proteínas pueden evolucionar numerosos mecanismos estructurales y funcionales. [11]
En un estudio de prueba de concepto, Bhattacharya y sus colegas convirtieron la mioglobina , una proteína de almacenamiento de oxígeno no enzimático, en una eliminasa de Kemp altamente eficiente utilizando solo tres mutaciones . Esto demuestra que solo se necesitan unas pocas mutaciones para cambiar radicalmente la función de una proteína. [12] La evolución dirigida es el intento de diseñar proteínas utilizando métodos inspirados en la evolución molecular.
Evolución molecular en un sitio
El cambio en un locus comienza con una nueva mutación , que podría volverse fija debido a alguna combinación de selección natural , deriva genética y conversión genética .
Mutación

Las mutaciones son cambios permanentes y transmisibles en el material genético ( ADN o ARN ) de una célula o un virus . Las mutaciones son resultado de errores en la replicación del ADN durante la división celular y por la exposición a la radiación , sustancias químicas, otros factores estresantes ambientales, virus o elementos transponibles . Cuando las mutaciones puntuales en un solo par de bases del ADN caen dentro de una región que codifica una proteína , se caracterizan por ser sinónimas (no cambian la secuencia de aminoácidos) o no sinónimas. Otros tipos de mutaciones modifican segmentos más grandes de ADN y pueden causar duplicaciones, inserciones, deleciones, inversiones y translocaciones. [13]
La distribución de las tasas de diversos tipos de mutaciones se denomina "espectro de mutación" (véase el Apéndice B de [14] ). Las mutaciones de diferentes tipos se producen a tasas muy variables. Las tasas de mutación puntual para la mayoría de los organismos son muy bajas, aproximadamente de 10 −9 a 10 −8 por sitio por generación, [15] aunque algunos virus tienen tasas de mutación más altas, del orden de 10 −6 por sitio por generación. [16] Las transiciones (A ↔ G o C ↔ T) son más comunes que las transversiones ( purina (adenina o guanina)) ↔ pirimidina (citosina o timina, o en el ARN, uracilo)). [17] Quizás el tipo de mutación más común en los seres humanos es un cambio en la longitud de una repetición corta en tándem (por ejemplo, las repeticiones CAG subyacentes a varias mutaciones asociadas a enfermedades). Estas mutaciones STR pueden ocurrir a tasas del orden de 10 −3 por generación. [18]
Diferentes frecuencias de diferentes tipos de mutaciones pueden desempeñar un papel importante en la evolución a través del sesgo en la introducción de variación (sesgo de llegada), contribuyendo al paralelismo, las tendencias y las diferencias en la navegabilidad de paisajes adaptativos. [19] [20] El sesgo de mutación hace contribuciones sistemáticas o predecibles a la evolución paralela . [14] Desde la década de 1960, se ha pensado que el contenido genómico de GC refleja tendencias mutacionales. [21] [22] Los sesgos mutacionales también contribuyen al sesgo de uso de codones . [23] Aunque tales hipótesis a menudo se asocian con la neutralidad, resultados teóricos y empíricos recientes han establecido que las tendencias mutacionales pueden influir tanto en la evolución neutral como en la adaptativa a través del sesgo en la introducción de variación (sesgo de llegada).
Selección
La selección puede ocurrir cuando un alelo confiere mayor aptitud , es decir, mayor capacidad para sobrevivir o reproducirse, al individuo promedio que el que lo porta. Un enfoque seleccionista enfatiza, por ejemplo, que los sesgos en el uso de codones se deben al menos en parte a la capacidad de una selección incluso débil para dar forma a la evolución molecular. [24]
La selección también puede operar a nivel genético a expensas de la aptitud del organismo, lo que da como resultado un conflicto intragenómico . Esto se debe a que puede haber una ventaja selectiva para los elementos genéticos egoístas a pesar de un costo para el anfitrión. Ejemplos de tales elementos egoístas incluyen elementos transponibles , impulsores meióticos y mitocondrias egoístas .
La selección se puede detectar mediante la relación Ka/Ks y la prueba de McDonald–Kreitman . A menudo se encuentra una rápida evolución adaptativa en genes implicados en el conflicto intragenómico , la coevolución antagónica sexual y el sistema inmunológico .
Deriva genética
La deriva genética es el cambio de frecuencias alélicas de una generación a la siguiente debido a los efectos estocásticos del muestreo aleatorio en poblaciones finitas. Estos efectos pueden acumularse hasta que una mutación se fija en una población . En el caso de las mutaciones neutras, la tasa de fijación por generación es igual a la tasa de mutación por replicación. Por lo tanto, una tasa de mutación relativamente constante produce una tasa de cambio constante por generación (reloj molecular).
También pueden ser reparables las mutaciones ligeramente perjudiciales con un coeficiente de selección inferior a un valor umbral de 1/el tamaño efectivo de la población . Muchas características genómicas se han atribuido a la acumulación de mutaciones perjudiciales casi neutrales como resultado de tamaños efectivos de población pequeños. [25] Con un tamaño efectivo de población menor, una mayor variedad de mutaciones se comportará como si fueran neutrales debido a la ineficiencia de la selección.
Conversión genética
La conversión génica ocurre durante la recombinación, cuando el daño de nucleótidos se repara utilizando una región genómica homóloga como plantilla. Puede ser un proceso sesgado, es decir, un alelo puede tener una mayor probabilidad de ser el donante que el otro en un evento de conversión génica. En particular, la conversión génica sesgada por GC tiende a aumentar el contenido de GC de los genomas, particularmente en regiones con tasas de recombinación más altas. [26] También hay evidencia de sesgo de GC en el proceso de reparación de desajustes. [27] Se cree que esto puede ser una adaptación a la alta tasa de desaminación de metilcitosina que puede conducir a transiciones C→T.
La dinámica de la conversión genética sesgada se asemeja a la de la selección natural, en el sentido de que un alelo favorecido tenderá a aumentar exponencialmente en frecuencia cuando sea raro.
Arquitectura del genoma
Tamaño del genoma
El tamaño del genoma está influenciado por la cantidad de ADN repetitivo, así como por el número de genes en un organismo. Algunos organismos, como la mayoría de las bacterias, Drosophila y Arabidopsis tienen genomas particularmente compactos con poco contenido repetitivo o ADN no codificante. Otros organismos, como los mamíferos o el maíz, tienen grandes cantidades de ADN repetitivo, intrones largos y un espaciamiento sustancial entre genes. La paradoja del valor C se refiere a la falta de correlación entre la "complejidad" del organismo y el tamaño del genoma. Las explicaciones para la llamada paradoja son dobles. Primero, los elementos genéticos repetitivos pueden comprender grandes porciones del genoma de muchos organismos, inflando así el contenido de ADN del genoma haploide. Los elementos genéticos repetitivos a menudo descienden de elementos transponibles .
En segundo lugar, la cantidad de genes no es necesariamente indicativa de la cantidad de etapas de desarrollo o tipos de tejidos de un organismo. Un organismo con pocas etapas de desarrollo o tipos de tejidos puede tener una gran cantidad de genes que influyen en fenotipos no relacionados con el desarrollo, lo que infla el contenido genético en relación con las familias de genes relacionados con el desarrollo.
Las explicaciones neutrales sobre el tamaño del genoma sugieren que cuando el tamaño de las poblaciones es pequeño, muchas mutaciones se vuelven casi neutrales. Por lo tanto, en poblaciones pequeñas, el contenido repetitivo y otro ADN "basura" pueden acumularse sin colocar al organismo en desventaja competitiva. Hay poca evidencia que sugiera que el tamaño del genoma está sujeto a una fuerte selección generalizada en los eucariotas multicelulares. El tamaño del genoma, independientemente del contenido genético, se correlaciona mal con la mayoría de los rasgos fisiológicos y muchos eucariotas, incluidos los mamíferos, albergan cantidades muy grandes de ADN repetitivo.
Sin embargo, es probable que las aves hayan experimentado una fuerte selección para reducir el tamaño de su genoma, en respuesta a las cambiantes necesidades energéticas para volar. Las aves, a diferencia de los humanos, producen glóbulos rojos nucleados, y los núcleos más grandes conducen a niveles más bajos de transporte de oxígeno. El metabolismo de las aves es mucho más alto que el de los mamíferos, debido en gran medida al vuelo, y las necesidades de oxígeno son altas. Por lo tanto, la mayoría de las aves tienen genomas pequeños y compactos con pocos elementos repetitivos. La evidencia indirecta sugiere que los dinosaurios terópodos ancestros no aviares de las aves modernas [28] también tenían tamaños de genoma reducidos, en consonancia con la endotermia y las altas necesidades energéticas para correr a gran velocidad. Muchas bacterias también han experimentado una selección para un tamaño de genoma pequeño, ya que el tiempo de replicación y el consumo de energía están tan estrechamente correlacionados con la aptitud física.
Número y organización de los cromosomas
La hormiga Myrmecia pilosula tiene un solo par de cromosomas [29], mientras que el helecho lengua de víbora Ophioglossum reticulatum tiene hasta 1260 cromosomas. [30] La cantidad de cromosomas en el genoma de un organismo no se correlaciona necesariamente con la cantidad de ADN en su genoma. La cantidad de recombinación en todo el genoma está controlada directamente por la cantidad de cromosomas, con un cruce por cromosoma o por brazo cromosómico, según la especie. [31]
Los cambios en el número de cromosomas pueden desempeñar un papel clave en la especiación , ya que los diferentes números de cromosomas pueden servir como una barrera para la reproducción en híbridos. El cromosoma humano 2 se creó a partir de una fusión de dos cromosomas de chimpancé y todavía contiene telómeros centrales, así como un segundo centrómero vestigial . La poliploidía , especialmente la alopoliploidía, que ocurre a menudo en las plantas, también puede dar lugar a incompatibilidades reproductivas con las especies parentales. Las mariposas azules Agrodiatus tienen diversos números de cromosomas que van desde n = 10 a n = 134 y, además, tienen una de las tasas más altas de especiación identificadas hasta la fecha. [32]
Los genomas ciliados albergan cada gen en cromosomas individuales.
Organelos
Además del genoma nuclear , los orgánulos endosimbiontes contienen su propio material genético. El ADN mitocondrial y del cloroplasto varía entre taxones, pero las proteínas unidas a la membrana , especialmente los componentes de la cadena de transporte de electrones , se codifican con mayor frecuencia en el orgánulo. Los cloroplastos y las mitocondrias se heredan por vía materna en la mayoría de las especies, ya que los orgánulos deben pasar a través del óvulo . En una rara desviación, se sabe que algunas especies de mejillones heredan las mitocondrias de padre a hijo.
Orígenes de nuevos genes
Los genes nuevos surgen de varios mecanismos genéticos diferentes, entre ellos la duplicación de genes , el nacimiento de genes de novo , la retrotransposición , la formación de genes quiméricos , el reclutamiento de una secuencia no codificante en un gen existente y el truncamiento de genes.
La duplicación de genes inicialmente conduce a redundancia. Sin embargo, las secuencias de genes duplicadas pueden mutar para desarrollar nuevas funciones o especializarse de modo que el nuevo gen realice un subconjunto de las funciones ancestrales originales. La retrotransposición duplica los genes copiando el ARNm en ADN e insertándolo en el genoma. Los retrogenes generalmente se insertan en nuevas ubicaciones genómicas, carecen de intrones y, a veces, desarrollan nuevos patrones de expresión y funciones.
Los genes quiméricos se forman cuando la duplicación, la deleción o la retrotransposición incompleta combinan partes de dos secuencias codificantes diferentes para producir una secuencia genética nueva. Las quimeras suelen provocar cambios regulatorios y pueden reorganizar dominios proteicos para producir nuevas funciones adaptativas.
El nacimiento de genes de novo puede dar lugar a genes codificadores de proteínas y genes no codificadores a partir de ADN previamente no funcional. [33] Por ejemplo, Levine y sus colegas informaron del origen de cinco nuevos genes en el genoma de D. melanogaster . [34] [35] También se ha demostrado un origen de genes de novo similar en otros organismos como la levadura, [36] el arroz [37] y los humanos. [38] Los genes de novo pueden evolucionar a partir de transcripciones espurias que ya se expresan en niveles bajos. [39]
Evolución neutral constructiva
La evolución neutral constructiva (ENC) explica que los sistemas complejos pueden surgir y propagarse en una población a través de transiciones neutrales con los principios de exceso de capacidad, presupresión y trinquete, [40] [41] [42] y se ha aplicado en áreas que van desde los orígenes del espliceosoma hasta la interdependencia compleja de las comunidades microbianas . [43] [44] [45]
Revistas y sociedades
La Sociedad de Biología Molecular y Evolución publica las revistas "Molecular Biology and Evolution" y "Genome Biology and Evolution" y celebra una reunión internacional anual. Otras revistas dedicadas a la evolución molecular son Journal of Molecular Evolution y Molecular Phylogenetics and Evolution . Las investigaciones sobre evolución molecular también se publican en revistas de genética , biología molecular , genómica , sistemática y biología evolutiva .
Véase también
- Evolución
- Experimento de evolución a largo plazo de E. coli
- Fisiología evolutiva
- Organización genómica
- Evolución del genoma
- Heterotaquia
- Historia de la evolución molecular
- Transferencia horizontal de genes
- Evolución humana
- Reloj molecular
- Paleontología molecular
- Teoría casi neutral de la evolución molecular
- Teoría neutral de la evolución molecular
- Diversidad de nucleótidos
- Métodos comparativos filogenéticos
- Filogenética
- Genética de poblaciones
- Selección
Referencias
- ^ abc Dietrich MR (1998). "Paradoja y persuasión: negociando el lugar de la evolución molecular dentro de la biología evolutiva". Revista de Historia de la Biología . 31 (1): 85–111. doi :10.1023/A:1004257523100. PMID 11619919. S2CID 29935487.
- ^ Hagen JB (1999). "Naturalistas, biólogos moleculares y los desafíos de la evolución molecular". Revista de Historia de la Biología . 32 (2): 321–341. doi :10.1023/A:1004660202226. PMID 11624208. S2CID 26994015.
- ^ Zuckerkandl, Emile; Pauling, Linus (marzo de 1965). "Las moléculas como documentos de la historia evolutiva". Revista de biología teórica . 8 (2): 357–366. Bibcode :1965JThBi...8..357Z. doi :10.1016/0022-5193(65)90083-4. PMID 5876245.
- ^ Kimura M (febrero de 1968). "Tasa evolutiva a nivel molecular". Nature . 217 (5129): 624–626. Bibcode :1968Natur.217..624K. doi :10.1038/217624a0. PMID 5637732. S2CID 4161261.
- ^ King JL, Jukes TH (mayo de 1969). «Evolución no darwiniana». Science . 164 (3881): 788–798. Bibcode :1969Sci...164..788L. doi :10.1126/science.164.3881.788. PMID 5767777.
- ^ Kimura, M. (1983). La teoría neutral de la evolución molecular . Cambridge University Press , Cambridge. ISBN 0-521-23109-4.
- ^ ab Fay JC, Wu CI (2003). "Divergencia de secuencias, restricción funcional y selección en la evolución de proteínas". Revisión anual de genómica y genética humana . 4 : 213–235. doi : 10.1146/annurev.genom.4.020303.162528 . PMID 14527302. S2CID 6360375.
- ^ Álvarez-Carretero, Sandra; Kapli, Paschalia; Yang, Ziheng (4 de abril de 2023). "Guía para principiantes sobre el uso de PAML para detectar la selección positiva". Biología molecular y evolución . 40 (4). doi :10.1093/molbev/msad041. PMC 10127084 . PMID 37096789.
- ^ Hanukoglu I (febrero de 2017). "Canales de sodio de tipo ASIC y ENaC: estados conformacionales y estructuras de los filtros de selectividad iónica". The FEBS Journal . 284 (4): 525–545. doi :10.1111/febs.13840. PMID 27580245. S2CID 24402104.
- ^ Hanukoglu I, Hanukoglu A (abril de 2016). "Familia de canales de sodio epiteliales (ENaC): filogenia, estructura-función, distribución tisular y enfermedades hereditarias asociadas". Gene . 579 (2): 95–132. doi :10.1016/j.gene.2015.12.061. PMC 4756657 . PMID 26772908.
- ^ Burnim AA, Spence MA, Xu D, Jackson CJ, Ando N (septiembre de 2022). Ben-Tal N, Weigel D, Ben-Tal N, Stubbe J, Hofer A (eds.). "Un análisis filogenético exhaustivo de la familia de la ribonucleótido reductasa revela un clado ancestral". eLife . 11 : e79790. doi : 10.7554/eLife.79790 . PMC 9531940 . PMID 36047668.
- ^ Bhattacharya S, Margheritis EG, Takahashi K, Kulesha A, D'Souza A, Kim I, et al. (octubre de 2022). "Evolución dirigida guiada por RMN". Nature . 610 (7931): 389–393. Código Bibliográfico :2022Natur.610..389B. doi :10.1038/s41586-022-05278-9. PMC 10116341 . PMID 36198791. S2CID 245067145.
- ^ Yang, J. (23 de marzo de 2016). ¿Qué son las mutaciones genéticas? Recuperado de https://www.singerinstruments.com/resource/what-are-genetic-mutation/ .
- ^ ab A. Stoltzfus (2021). Mutación, aleatoriedad y evolución . Oxford, Oxford.
- ^ Wang, Yiguan; Obbard, Darren J (19 de julio de 2023). "Estimaciones experimentales de la tasa de mutación de la línea germinal en eucariotas: un metaanálisis filogenético". Evolution Letters . 7 (4): 216–226. doi :10.1093/evlett/qrad027. hdl : 20.500.11820/8ffd5b76-77ae-4764-ae31-de2fb8aa35cf . PMC 10355183 . PMID 37475753.
- ^ Peck, Kayla M.; Lauring, Adam S. (15 de julio de 2018). "Complejidades de las tasas de mutación viral". Journal of Virology . 92 (14): e01031-17. doi :10.1128/JVI.01031-17. PMC 6026756 . PMID 29720522.
- ^ "Transiciones vs transversiones".
- ^ JL Weber y C. Wong (1993). "Mutación de repeticiones cortas en tándem humanas". Hum Mol Genet . 2 (8): 1123–8. doi :10.1093/hmg/2.8.1123. PMID 8401493.
- ^ AV Cano y JL Payne (2020). "El sesgo de mutación interactúa con el sesgo de composición para influir en la evolución adaptativa". PLOS Computational Biology . 16 (9): e1008296. Bibcode :2020PLSCB..16E8296C. doi : 10.1371/journal.pcbi.1008296 . PMC 7571706 . PMID 32986712.
- ^ M. Nei (2013). Evolución impulsada por mutaciones . Oxford University Press.
- ^ E. Freese (1962). "Sobre la evolución de la composición de bases del ADN". J. Theor. Biol . 3 (1): 82–101. Bibcode :1962JThBi...3...82F. doi :10.1016/S0022-5193(62)80005-8.
En este sentido, no tiene importancia si la selección ha sido insignificante o autoanulada.
- ^ N. Sueoka (1962). "Sobre la base genética de la variación y la heterogeneidad de la composición de bases del ADN". Proc. Natl. Sci. USA . 48 (4): 582–592. Bibcode :1962PNAS...48..582S. doi : 10.1073/pnas.48.4.582 . PMC 220819 . PMID 13918161.
- ^ A. Stoltzfus y LY Yampolsky (2009). "Probable escalada: la mutación como causa de la no aleatoriedad en la evolución". J Hered . 100 (5): 637–47. doi : 10.1093/jhered/esp048 . PMID 19625453.
- ^ Hershberg R, Petrov DA (diciembre de 2008). "Selección por sesgo de codón". Revisión anual de genética . 42 (1): 287–299. doi :10.1146/annurev.genet.42.110807.091442. PMID 18983258. S2CID 7085012.
- ^ Lynch M (2007). Los orígenes de la arquitectura del genoma . Sinauer. ISBN 978-0-87893-484-3.
- ^ Duret L, Galtier N (2009). "Conversión genética sesgada y evolución de los paisajes genómicos de los mamíferos". Revisión anual de genómica y genética humana . 10 : 285–311. doi :10.1146/annurev-genom-082908-150001. PMID 19630562.
- ^ Galtier N, Piganeau G, Mouchiroud D, Duret L (octubre de 2001). "Evolución del contenido de GC en genomas de mamíferos: la hipótesis de la conversión génica sesgada". Genética . 159 (2): 907–911. doi :10.1093/genetics/159.2.907. PMC 1461818 . PMID 11693127.
- ^ Organ CL, Shedlock AM, Meade A, Pagel M, Edwards SV (marzo de 2007). "Origen del tamaño y la estructura del genoma aviar en dinosaurios no aviares". Nature . 446 (7132): 180–184. Bibcode :2007Natur.446..180O. doi :10.1038/nature05621. PMID 17344851. S2CID 3031794.
- ^ Crosland MW, Crozier RH (marzo de 1986). "Myrmecia pilosula, una hormiga con un solo par de cromosomas". Science . 231 (4743): 1278. Bibcode :1986Sci...231.1278C. doi :10.1126/science.231.4743.1278. PMID 17839565. S2CID 25465053.
- ^ Gerardus JH Grubben (2004). Verduras. PROTA. pag. 404.ISBN 978-90-5782-147-9. Recuperado el 10 de marzo de 2013 .
- ^ Pardo-Manuel de Villena, Fernando; Sapienza, Carmen (abril de 2001). "La recombinación es proporcional al número de brazos cromosómicos en los mamíferos". Genoma de los mamíferos . 12 (4): 318–322. doi :10.1007/s003350020005. PMID 11309665.
- ^ Kandul NP, Lukhtanov VA, Pierce NE (marzo de 2007). "Diversidad cariotípica y especiación en mariposas Agrodiaetus". Evolución; Revista internacional de evolución orgánica . 61 (3): 546–559. doi : 10.1111/j.1558-5646.2007.00046.x . PMID 17348919.
- ^ McLysaght A, Guerzoni D (septiembre de 2015). "Nuevos genes a partir de secuencias no codificantes: el papel de los genes codificantes de proteínas de novo en la innovación evolutiva eucariota". Philosophical Transactions of the Royal Society of London. Serie B, Ciencias Biológicas . 370 (1678): 20140332. doi :10.1098/rstb.2014.0332. PMC 4571571 . PMID 26323763.
- ^ Levine MT, Jones CD, Kern AD, Lindfors HA, Begun DJ (junio de 2006). "Los genes nuevos derivados del ADN no codificante en Drosophila melanogaster están frecuentemente ligados al cromosoma X y exhiben una expresión sesgada en los testículos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (26): 9935–9939. Bibcode :2006PNAS..103.9935L. doi : 10.1073/pnas.0509809103 . PMC 1502557 . PMID 16777968.
- ^ Zhou Q, Zhang G, Zhang Y, Xu S, Zhao R, Zhan Z, et al. (septiembre de 2008). "Sobre el origen de nuevos genes en Drosophila". Genome Research . 18 (9): 1446–1455. doi :10.1101/gr.076588.108. PMC 2527705 . PMID 18550802.
- ^ Cai J, Zhao R, Jiang H, Wang W (mayo de 2008). "Origen de novo de un nuevo gen codificador de proteínas en Saccharomyces cerevisiae". Genética . 179 (1): 487–496. doi :10.1534/genética.107.084491. PMC 2390625 . PMID 18493065.
- ^ Xiao W, Liu H, Li Y, Li X, Xu C, Long M, Wang S (2009). El-Shemy HA (ed.). "Un gen del arroz de origen de novo regula negativamente la respuesta de defensa inducida por patógenos". PLOS ONE . 4 (2): e4603. Bibcode :2009PLoSO...4.4603X. doi : 10.1371/journal.pone.0004603 . PMC 2643483 . PMID 19240804.
- ^ Knowles DG, McLysaght A (octubre de 2009). "Origen reciente de novo de genes codificadores de proteínas humanas". Genome Research . 19 (10): 1752–1759. doi :10.1101/gr.095026.109. PMC 2765279 . PMID 19726446.
- ^ Wilson BA, Masel J (2011). "Las transcripciones supuestamente no codificantes muestran una amplia asociación con los ribosomas". Genome Biology and Evolution . 3 : 1245–1252. doi :10.1093/gbe/evr099. PMC 3209793 . PMID 21948395.
- ^ Stoltzfus A (agosto de 1999). "Sobre la posibilidad de una evolución neutral constructiva". Journal of Molecular Evolution . 49 (2): 169–181. Bibcode :1999JMolE..49..169S. doi :10.1007/PL00006540. PMID 10441669. S2CID 1743092.
- ^ Stoltzfus A (octubre de 2012). "Evolución neutral constructiva: exploración de la curiosa desconexión de la teoría evolutiva". Biology Direct . 7 (1): 35. doi : 10.1186/1745-6150-7-35 . PMC 3534586 . PMID 23062217.
- ^ Muñoz-Gómez SA, Bilolikar G, Wideman JG, Geiler-Samerotte K (abril de 2021). "Evolución neutral constructiva 20 años después". Journal of Molecular Evolution . 89 (3): 172–182. Bibcode :2021JMolE..89..172M. doi :10.1007/s00239-021-09996-y. PMC 7982386 . PMID 33604782.
- ^ Lukeš J, Archibald JM, Keeling PJ, Doolittle WF, Gray MW (julio de 2011). "Cómo un mecanismo evolutivo neutral puede generar complejidad celular". IUBMB Life . 63 (7): 528–537. doi :10.1002/iub.489. PMID 21698757. S2CID 7306575.
- ^ Vosseberg J, Snel B (diciembre de 2017). "Domesticación de intrones autoempalmables durante la eucariogénesis: el auge de la compleja maquinaria espliceosómica". Biology Direct . 12 (1): 30. doi : 10.1186/s13062-017-0201-6 . PMC 5709842 . PMID 29191215.
- ^ Brunet TD, Doolittle WF (19 de marzo de 2018). "La generalidad de la evolución neutral constructiva". Biología y filosofía . 33 (1): 2. doi :10.1007/s10539-018-9614-6. ISSN 1572-8404. S2CID 90290787.
Lectura adicional
- Li WH (2006). Evolución molecular . Sinauer. ISBN 0-87893-480-4.
- Lynch M (2007). Los orígenes de la arquitectura del genoma . Sinauer. ISBN 978-0-87893-484-3.
- Meyer A, van de Peer Y, eds. (2003). Evolución del genoma: duplicaciones de genes y genomas y el origen de nuevas funciones genéticas . Dordrecht: Kluwer Academic Pub. ISBN 978-1-4020-1021-7.
- Gregory TR (2005). La evolución del genoma . Burlington, MA: Elsevier Academic. ISBN 978-0-12-301463-4.
- Levinson G (2020). Repensando la evolución: la revolución que se esconde a simple vista . Londres: World Scientific. ISBN 978-1-78634-726-8.
- Graur D , Li WH (2000). Fundamentos de la evolución molecular . Sinauer. ISBN 0-87893-266-6.
- Graur D (2016). Evolución molecular y genómica . Sunderland (Massachusetts): Sinauer Associates, Inc. ISBN 978-1605354699.
Categoría: evolución molecular (kimura 1968)



