Hepatitis D
| Hepatitis D | |
|---|---|
| Otros nombres | Hepatitis delta |
| Especialidad | Gastroenterología , enfermedades infecciosas |
| Síntomas | Sensación de cansancio, náuseas y vómitos [1] |
| Complicaciones | Cirrosis [1] |
| Causas | Virus de la hepatitis D [1] |
| Método de diagnóstico | Inmunoglobulina G [2] |
| Tratamiento | Antivirales, interferón alfa pegilado [2] |
| Medicamento | Bulevirtida |
La hepatitis D es un tipo de hepatitis viral [3] causada por el virus de la hepatitis delta ( HDV ). [4] [5] El HDV es uno de los cinco virus de hepatitis conocidos : A , B , C , D y E . El HDV se considera un satélite (un tipo de agente subviral ) porque puede propagarse solo en presencia del virus de la hepatitis B ( VHB ). [6] La transmisión del HDV puede ocurrir a través de una infección simultánea con el VHB ( coinfección ) o superpuesta a la hepatitis B crónica o al estado de portador de la hepatitis B ( superinfección ).
La infección por HDV de una persona con hepatitis B crónica (superinfección) se considera el tipo más grave de hepatitis viral debido a la gravedad de sus complicaciones. [7] Estas complicaciones incluyen una mayor probabilidad de sufrir insuficiencia hepática en infecciones agudas y una rápida progresión a cirrosis hepática , con un mayor riesgo de desarrollar cáncer de hígado en infecciones crónicas. [8] En combinación con el virus de la hepatitis B, la hepatitis D tiene la tasa de mortalidad más alta de todas las infecciones por hepatitis, con un 20%. Una estimación reciente de 2020 sugiere que actualmente 48 millones de personas están infectadas con este virus. [9]
| Hepatitis D | |
|---|---|
| Sinónimo | Hepatitis delta |
| Tipo de virus | ARN de cadena corta |
| Período de incubación | 2–12 semanas |
| Transmisión | Parenteral |
| Estado del transportista | Sí |
| Inmunidad Inmunización pasiva Inmunización activa | Globulina hiperinmune Vacuna contra la hepatitis B |
Virología
| Virus de la hepatitis delta | |
|---|---|
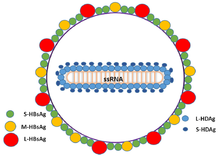 | |
| Representación esquemática del virión del virus de la hepatitis delta | |
| Clasificación de virus | |
| (sin clasificar): | Virus |
| Reino : | Ribozivira |
| Familia: | Colmioviridae |
| Género: | Deltavirus |
| Especies [10] | |
| |
Estructura y genoma
Los virus de la hepatitis delta, o HDV, son ocho especies de virus de ARN monocatenario de sentido negativo (o partículas similares a virus) clasificados juntos como el género Deltavirus , dentro del reino Ribozyviria . [11] El virión HDV es una partícula pequeña, esférica y envuelta con un diámetro de 36 nm; su envoltura viral contiene fosfolípidos del huésped, así como tres proteínas tomadas del virus de la hepatitis B: los antígenos de superficie de la hepatitis B grande, mediano y pequeño. Este conjunto rodea una partícula de ribonucleoproteína (RNP) interna, que contiene el genoma rodeado por aproximadamente 200 moléculas de antígeno de la hepatitis D (HDAg) para cada genoma. Se ha demostrado que la región central de HDAg se une al ARN. [12] Varias interacciones también están mediadas por una región de bobina enrollada en el extremo N de HDAg. [13] [14]
El genoma del HDV es un ARN circular cerrado , monocatenario, de sentido negativo ; con un genoma de aproximadamente 1700 nucleótidos, el HDV es el "virus" más pequeño conocido que infecta animales. Se ha propuesto que el HDV puede haberse originado a partir de una clase de patógenos vegetales llamados viroides , que son mucho más pequeños que los virus. [15] [16] Su genoma es único entre los virus animales debido a su alto contenido de nucleótidos GC. Su secuencia de nucleótidos es aproximadamente un 70% autocomplementaria, lo que permite que el genoma forme una estructura de ARN parcialmente bicatenaria, similar a una varilla. [17] Las cepas del HDV son altamente divergentes; existen fusiones de diferentes cepas y se han depositado secuencias en bases de datos públicas que emplean diferentes sitios de inicio para el ARN viral circular involucrado. Esto había resultado en algo de caos con respecto a la clasificación molecular de este virus, una situación que se ha resuelto recientemente con la adopción de un genoma de referencia propuesto y un sistema de clasificación uniforme. [18]
Ciclo vital
Al igual que la hepatitis B, el HDV ingresa a las células hepáticas a través del transportador biliar polipéptido cotransportador de taurocolato de sodio (NTCP) [19] . El HDV reconoce su receptor a través del dominio N-terminal del antígeno de superficie grande de la hepatitis B, HBsAg . [20] El mapeo por mutagénesis de este dominio ha demostrado que los residuos de aminoácidos 9-15 conforman el sitio de unión al receptor. [21] Después de ingresar al hepatocito, el virus queda sin cubierta y la nucleocápside se transloca al núcleo debido a una señal en HDAg [22] Dado que el genoma del HDV no codifica una ARN polimerasa para replicar el genoma del virus, el virus hace uso de las ARN polimerasas celulares del huésped . Inicialmente se pensó que usaba solo la ARN polimerasa II, [23] [24] ahora se ha demostrado que las ARN polimerasas I y III también están involucradas en la replicación del HDV. [25] Normalmente, la ARN polimerasa II utiliza el ADN como plantilla y produce ARN mensajero. En consecuencia, si el HDV utiliza efectivamente la ARN polimerasa II durante la replicación, sería el único patógeno animal conocido capaz de utilizar una polimerasa dependiente del ADN como polimerasa dependiente del ARN. [ cita requerida ]
Las ARN polimerasas tratan el genoma del ARN como ADN de doble cadena debido a la estructura en forma de varilla plegada que tiene. Se crean tres formas de ARN: ARN genómico circular, ARN antigénico complementario circular y un ARN antigénico poliadenilado lineal, que es el ARNm que contiene el marco de lectura abierto para el HDAg. La síntesis de ARN antigénico ocurre en el nucléolo, mediada por la ARN polimerasa I, mientras que la síntesis de ARN genómico tiene lugar en el nucleoplasma, mediada por la ARN polimerasa II. [26] El ARN del HDV se sintetiza primero como ARN lineal que contiene muchas copias del genoma. El ARN genómico y antigénico contiene una secuencia de 85 nucleótidos, la ribozima del virus de la hepatitis delta , que actúa como una ribozima , que autoescinde el ARN lineal en monómeros. Estos monómeros luego se ligan para formar ARN circular. [27] [28]
Antígenos delta
| Antígeno delta del virus de la hepatitis delta | |||||||||
|---|---|---|---|---|---|---|---|---|---|
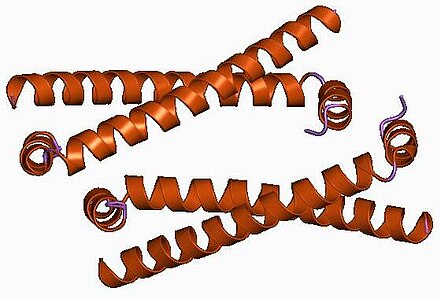 dominio de oligomerización del antígeno delta de la hepatitis | |||||||||
| Identificadores | |||||||||
| Símbolo | HDV_ag | ||||||||
| Pfam | PF01517 | ||||||||
| Interprofesional | IPR002506 | ||||||||
| SCOP2 | 1a92 / ALCANCE / SUPFAM | ||||||||
| |||||||||
Una diferencia significativa entre los viroides y el HDV es que, mientras que los viroides no producen proteínas, se sabe que el HDV produce una proteína, llamada HDAg. Viene en dos formas: una HDAg grande de 27 kDa y una HDAg pequeña de 24 kDa. Los extremos N-terminales de las dos formas son idénticos, difieren en 19 aminoácidos más en el extremo C-terminal de la HDAg grande. [29] Ambas isoformas se producen a partir del mismo marco de lectura que contiene un codón de terminación UAG en el codón 196, que normalmente produce solo la HDAg pequeña. Sin embargo, la edición por la enzima celular adenosina deaminasa que actúa sobre el ARN (ADAR) cambia el codón de terminación a UGG, lo que permite que se produzca la HDAg grande. [29] [30] A pesar de tener secuencias idénticas en un 90%, estas dos proteínas desempeñan funciones divergentes durante el curso de una infección. HDAg-S se produce en las primeras etapas de una infección y entra en el núcleo y apoya la replicación viral. HDAg-L, por el contrario, se produce durante las últimas etapas de una infección, actúa como un inhibidor de la replicación viral y es necesario para el ensamblaje de partículas virales. [31] [32] [33] Por lo tanto, la edición de ARN por las enzimas celulares es fundamental para el ciclo de vida del virus porque regula el equilibrio entre la replicación viral y el ensamblaje del virión. [ cita requerida ]
Infectividad del bucle antigénico
La proteína de la envoltura del VHD tiene ancladas tres de las proteínas de la superficie del VHB. La región S del genoma es la más comúnmente expresada y su función principal es ensamblar partículas subvirales. Las proteínas antigénicas del VHD se combinan con el genoma viral para formar una ribonucleoproteína (RNP) que, cuando se envuelve con las partículas subvirales, puede formar partículas similares a las virales que son casi idénticas al VHD maduro, pero no son infecciosas. Los investigadores habían llegado a la conclusión de que el determinante de la infectividad del VHD se encontraba dentro del dominio pre-S1 N-terminal de la proteína grande (L). Se descubrió que era un mediador en la unión al receptor celular. Los investigadores Georges Abou Jaoudé y Camille Sureau publicaron un artículo en 2005 que estudiaba el papel del bucle antigénico, que se encuentra en las proteínas de la envoltura del VHD, en la infectividad del virus. El bucle antigénico, al igual que el dominio pre-S1 N-terminal de la proteína grande, está expuesto en la superficie del virión. El estudio de Jaoudé y Sureau proporcionó evidencia de que el bucle antigénico puede ser un factor importante en la entrada del HDV a la célula huésped y que al mutar partes del bucle antigénico, se puede minimizar la infectividad del HDV. [34]
Transmisión
Las vías de transmisión de la hepatitis D son similares a las de la hepatitis B. La infección se limita en gran medida a las personas con alto riesgo de infección por hepatitis B, en particular los usuarios de drogas inyectables y las personas que reciben concentrados de factores de coagulación. En todo el mundo, más de 15 millones de personas están coinfectadas. El VHD es poco frecuente en la mayoría de los países desarrollados y se asocia principalmente al consumo de drogas intravenosas . Sin embargo, el VHD es mucho más común en la región mediterránea inmediata, el África subsahariana, Oriente Medio y la parte norte de América del Sur. [35] En total, alrededor de 20 millones de personas pueden estar infectadas con el VHD. [36]
Personas en riesgo
Como se mencionó anteriormente, los pacientes previamente diagnosticados con hepatitis B corren el riesgo de contraer una infección por hepatitis D. El riesgo de contraer hepatitis D aumenta si una persona consume drogas inyectables, es hemofílica, es paciente de hemodiálisis o tiene contacto sexual con otras personas infectadas.
Prevención
La vacunación contra la hepatitis B protege contra la infección viral de la hepatitis D, ya que la hepatitis D requiere que la infección viral de la hepatitis B esté presente para infectar y replicarse en las personas. [37] [38] La Organización Mundial de la Salud recomienda la vacunación universal contra el virus de la hepatitis B. La vacuna contra la hepatitis B se administra de manera rutinaria poco después del nacimiento (generalmente dentro de las 24 horas) para proteger contra la infección viral de las hepatitis B y D. [39]
Se ha demostrado que los condones de látex o poliuretano previenen la transmisión de la hepatitis B y, muy probablemente, la infección viral de la hepatitis D. [40]
Las mujeres embarazadas o que estén intentando quedarse embarazadas deben hacerse la prueba del VHB para saber si son portadoras del virus, lo que permitirá implementar estrategias de prevención durante el nacimiento del niño. Los CDC recomiendan que todas las mujeres embarazadas se hagan la prueba de la infección por el virus de la hepatitis B y que todos los bebés de mujeres infectadas con el VHB reciban inmunoglobulina contra la hepatitis B (HBIG) y la vacuna contra la hepatitis B dentro de las 12 horas posteriores al nacimiento para prevenir la transmisión del virus de la madre al niño. [41]
Quienes se hagan tatuajes o perforaciones corporales deben hacerlo utilizando material esterilizado para evitar la transmisión de las hepatitis B y D a través de fluidos corporales infectados. Las hepatitis B y D también pueden transmitirse a través de agujas contaminadas, por lo que quienes se inyectan drogas deben buscar ayuda para dejar de consumir drogas o utilizar agujas esterilizadas y evitar compartirlas con otras personas. [40] Quienes padecen hepatitis B o D tampoco deben compartir cuchillas de afeitar u otros artículos de cuidado personal que puedan haber sido contaminados por fluidos corporales potencialmente infecciosos. [40]
Diagnóstico
La detección de la hepatitis D requiere la realización de pruebas de anticuerpos anti-VHD, que indican una exposición previa al virus o una infección actual. Si hay anticuerpos anti-VHD, la infección activa por VHD se confirma midiendo los niveles de ARN del virus de la hepatitis D. [42] La prueba del VHD solo está indicada en aquellos que son positivos al antígeno de superficie de la hepatitis B (aquellos que han tenido una infección previa o activa con el virus de la hepatitis B), ya que el VHD requiere la infección viral del virus de la hepatitis B para infectar a las personas. [42] Las medidas no invasivas de la fibrosis hepática, como el FibroTest basado en biomarcadores o las imágenes hepáticas no invasivas como la elastografía transitoria (también conocida como FibroScan) no se han validado como medidas cuantitativas de la fibrosis hepática en aquellos con infección crónica por hepatitis D. En aquellos en los que se sospecha fibrosis hepática o cirrosis, generalmente se necesita una biopsia hepática. [42]
Tratamiento
Los tratamientos establecidos actualmente para la hepatitis D crónica incluyen la terapia convencional o con interferón alfa pegilado . [43] La evidencia sugiere que el interferón alfa pegilado es eficaz para reducir la carga viral y el efecto de la enfermedad durante el tiempo en que se administra el medicamento, pero el beneficio generalmente se detiene si se suspende el medicamento. [44] La eficiencia de este tratamiento no suele superar el 20%, y se han reportado recaídas tardías después de la terapia. [45] [46]
En mayo de 2020, el Comité de Medicamentos de Uso Humano de la Agencia Europea de Medicamentos aprobó el antiviral Hepcludex ( bulevirtida ) para tratar la hepatitis D. [47] La bulevirtida se une e inactiva el cotransportador de sodio/ácidos biliares , impidiendo que el virus de la hepatitis D (así como el virus de la hepatitis B) entren en los hepatocitos . [48] [49] La bulevirtida se puede administrar con interferón alfa pegilado, ya que se cree que ambos tienen un efecto sinérgico, lo que conduce a mayores tasas de respuesta al tratamiento. [42] [50]
En pacientes con cirrosis compensada relacionada con HDV e hipertensión portal clínicamente significativa, el tratamiento con ( bulevirtida ) fue seguro, bien tolerado y ha conducido a una mejoría significativa en las variables bioquímicas y un aumento en los parámetros de función hepática. [51]
Otros tratamientos para la hepatitis D que se encuentran actualmente en desarrollo incluyen el interferón lambda pegilado (λ), que se une a los receptores en la superficie del hepatocito y genera una cascada de señalización intracelular a través de la vía de señalización JAK-STAT y la activación de la inmunidad antiviral mediada por células. [52] El inhibidor de prenilación lonafarnib previene el ensamblaje de partículas virales de la hepatitis D al inhibir la farnesilación del L-HDAg. [53] REP2139-Ca es un polímero de ácido nucleico que previene la liberación del antígeno de superficie de la hepatitis B (que es necesario para el ensamblaje de partículas virales de la hepatitis D). [54]
Pronóstico
Las superinfecciones, en las que la infección viral de la hepatitis D ocurre en alguien que tiene hepatitis B crónica (a diferencia de la coinfección, en la que una persona está infectada con hepatitis B y D simultáneamente), tienen más probabilidades de progresar a hepatitis D crónica y están asociadas con un peor pronóstico. [42] Se cree que el 90% de los casos de infección crónica de hepatitis D se deben a la superinfección en aquellos que ya tienen hepatitis B. [42] La coinfección de hepatitis B y D es probable que conduzca a hepatitis aguda, pero generalmente es autolimitada con respecto a la infección de hepatitis D. [42] La hepatitis B y D crónicas se asocia con un peor pronóstico que la hepatitis B crónica sola. [42] La infección con ambos virus se caracteriza por un mal pronóstico, ya que el 75% de los que tienen hepatitis D crónica desarrollan cirrosis hepática dentro de los 15 años y un riesgo mucho mayor de desarrollar cáncer de hígado. [42] La viremia persistente por HDV es el factor de riesgo más importante para la progresión de la enfermedad en aquellos con coinfección o superinfección. [42] Otros factores que son responsables de un mal pronóstico en la hepatitis D crónica incluyen el sexo masculino, la edad avanzada en el momento de la infección, el consumo de alcohol, la diabetes , la obesidad y la inmunodeficiencia . [42]
Epidemiología

El VHD es una enfermedad muy extendida en todo el mundo, pero su prevalencia está disminuyendo en muchos países de altos ingresos gracias a los programas de vacunación contra la hepatitis B (aunque las tasas siguen siendo altas en algunos grupos, como los consumidores de drogas inyectables o los inmigrantes de regiones endémicas del VHD). [42] [56] La infección por VHD es un problema médico grave en las regiones de bajos ingresos del mundo, en las que la prevalencia del VHB sigue siendo alta. [56] En la actualidad, la cuenca del Amazonas y las regiones de bajos ingresos de Asia y África tienen tasas altas de VHD, debido a tasas simultáneamente altas de VHB. A nivel mundial, el cinco por ciento de las personas con infección crónica por hepatitis B también tienen hepatitis D y el 12,5% de las personas con VIH también están coinfectadas con hepatitis D. [57] [42]
Historia
El virus de la hepatitis D se informó por primera vez en 1977 como un antígeno nuclear en pacientes infectados con VHB que tenían una enfermedad hepática grave. [58] Entonces se pensó que este antígeno nuclear era un antígeno de la hepatitis B y se lo llamó antígeno delta. Experimentos posteriores en chimpancés mostraron que el antígeno delta de la hepatitis (HDAg) era una parte estructural de un patógeno que requería la infección por VHB para producir una partícula viral completa. [59] El genoma completo fue clonado y secuenciado en 1986. Posteriormente se lo colocó en su propio género: Deltavirus . [60] [61]
Fiebre de Lábrea
| Fiebre de Lábrea | |
|---|---|
| Otros nombres | Fiebre negra de Lábrea, Hepatitis de Lábrea, Fiebre de Santa Marta |
| Especialidad | Enfermedad infecciosa |
| Inicio habitual | repentino |
| Duración | aprox. 1 semana |
| Prevención | Vacunación contra el VHB |
| Pronóstico | muerte |
La fiebre de Lábrea es una infección tropical letal descubierta en la década de 1950 en la ciudad de Lábrea , en la cuenca amazónica brasileña , donde se presenta principalmente en el área al sur del río Amazonas, en los estados de Acre , Amazonas y Rondônia . La enfermedad también ha sido diagnosticada en Colombia y Perú. Ahora se sabe que es una coinfección o superinfección de la hepatitis B (VHB) con la hepatitis D. [62]
La fiebre de Lábrea tiene un inicio repentino, con ictericia , anorexia (falta de apetito), hematemesis ( vómitos de sangre), dolor de cabeza , fiebre y postración severa . La muerte se produce por insuficiencia hepática aguda (ALF). En la última fase, aparecen comúnmente síntomas neurológicos como agitación, delirio , convulsiones y coma hemorrágico . Estos síntomas surgen de una hepatitis fulminante que puede matar en menos de una semana, y que afecta característicamente a niños y adultos jóvenes, y más a varones que a mujeres. Se acompaña también de encefalitis en muchos casos. La enfermedad es altamente letal: en un estudio realizado en 1986 en Boca do Acre , también en la Amazonia, 39 pacientes de 44 murieron en la fase aguda de la enfermedad. [62] Los sobrevivientes pueden desarrollar enfermedad crónica . [ cita requerida ]
El principal descubrimiento de la asociación entre el virus delta y el VHB fue realizado por Gilberta Bensabath, del Instituto Evandro Chagas , de Belém , estado de Pará , y sus colaboradores. [63]
Los pacientes infectados muestran una destrucción extensa del tejido hepático , con esteatosis de un tipo particular (microesteatosis, caracterizada por pequeñas gotitas de grasa dentro de las células) e infiltración de un gran número de células inflamatorias llamadas células de mórula , compuestas principalmente por macrófagos que contienen antígenos del virus delta . [64]
En el estudio de Boca do Acre de 1987, los científicos realizaron una encuesta epidemiológica y reportaron infección por el virus delta en el 24% de los portadores asintomáticos del VHB, el 29% de los casos de hepatitis B aguda no fulminante, el 74% de los casos de hepatitis B fulminante y el 100% de los casos de hepatitis B crónica. [62] El virus delta parece ser endémico en la región amazónica. [65]
Evolución
Originalmente se describieron tres genotipos (I–III). El genotipo I se ha aislado en Europa, América del Norte, África y algunas partes de Asia. El genotipo II se ha encontrado en Japón, Taiwán y Yakutia (Rusia). El genotipo III se ha encontrado exclusivamente en América del Sur (Perú, Colombia y Venezuela). Algunos genomas de Taiwán y las islas de Okinawa han sido difíciles de tipificar, pero se han ubicado en el genotipo 2. Sin embargo, ahora se sabe que existen al menos 8 genotipos de este virus (HDV-1 a HDV-8). [66] Los estudios filogenéticos sugieren un origen africano para este patógeno. [35]
Un análisis de 36 cepas del genotipo 3 estimó que el ancestro común más reciente de estas cepas se originó alrededor de 1930. [67] Este genotipo se extendió exponencialmente desde principios de la década de 1950 hasta la década de 1970 en América del Sur. La tasa de sustitución se estimó en 1,07 × 10 −3 sustituciones por sitio por año. Otro estudio [68] encontró una tasa de evolución general de 3,18 × 10 −3 sustituciones por sitio por año. La tasa de mutación varió con la posición: la región hipervariable evolucionó más rápido (4,55 × 10 −3 sustituciones por sitio por año) que la región codificante del antígeno de la hepatitis delta (2,60 × 10 −3 sustituciones por sitio por año) y la región autocatalítica (1,11 × 10 −3 sustituciones por sitio por año). Un tercer estudio sugirió una tasa de mutación entre 9,5 × 10 −3 y 1,2 × 10 −3 sustituciones/sitio/año. [69]
Los genotipos, con excepción del tipo 1, parecen estar restringidos a ciertas áreas geográficas: HDV-2 (anteriormente HDV-IIa) se encuentra en Japón, Taiwán y Yakutia; HDV-4 (anteriormente HDV-IIb) en Japón y Taiwán; HDV-3 en la región amazónica; HDV-5, HDV-6, HDV-7 y HDV-8 en África. [70] El genotipo 8 también se ha aislado de América del Sur. Este genotipo generalmente solo se encuentra en África y puede haber sido importado a América del Sur durante el comercio de esclavos. [71]
Las células T CD8+ específicas del HDV pueden controlar el virus, pero se ha descubierto que el HDV muta para escapar a la detección de las células T CD8+. [72]
Especies relacionadas
Se han descrito otros virus similares al HDV en especies distintas de los humanos. A diferencia del HDV, ninguno de ellos depende de un virus Hepadnaviridae (familia del VHB) para replicarse. Estos agentes tienen una estructura similar a una varilla, un antígeno delta y una ribozima. [73] El HDV y todos sus parientes están clasificados en su propio reino , Ribozyviria , por el Comité Internacional de Taxonomía de Virus . [11]
Referencias
- ^ abc «Hepatitis D | NIDDK». Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales . Consultado el 10 de septiembre de 2019 .
- ^ ab "Hepatitis D". www.who.int . Consultado el 10 de septiembre de 2019 .
- ^ "Hepatitis (vírica) NIDDK". Instituto Nacional de Diabetes y Enfermedades Digestivas y Renales . Consultado el 19 de junio de 2020 .
- ^ Farci P (2003). "Hepatitis delta: una actualización". Revista de hepatología . 39 (Supl 1): S212–9. doi :10.1016/s0168-8278(03)00331-3. PMID 14708706.
- ^ Magnius L, Taylor J, Mason WS, Sureau C, Dény P, Norder H (diciembre de 2018). "Perfil de taxonomía del virus ICTV: Deltavirus". The Journal of General Virology . 99 (12): 1565–1566. doi : 10.1099/jgv.0.001150 . PMID 30311870.
- ^ Makino S, Chang MF, Shieh CK, Kamahora T, Vannier DM, Govindarajan S, Lai MM (1987). "Clonación molecular y secuenciación de un ARN del virus de la hepatitis delta (delta) humana". Nature . 329 (6137): 343–6. Bibcode :1987Natur.329..343M. doi :10.1038/329343a0. PMID 3627276. S2CID 4368061.
- ^ "Hepatitis D". www.who.int . Consultado el 20 de septiembre de 2020 .
- ^ Fattovich G, Giustina G, Christensen E, Pantalena M, Zagni I, Realdi G, Schalm SW (marzo de 2000). "Influencia de la infección por el virus de la hepatitis delta en la morbilidad y la mortalidad en la cirrosis compensada de tipo B. La Acción Concertada Europea sobre la Hepatitis Vírica (Eurohep)". Gut . 46 (3): 420–6. doi :10.1136/gut.46.3.420. PMC 1727859 . PMID 10673308.
- ^ Miao Z, Zhang S, Ou X, Li S, Ma Z, Wang W, Peppelenbosch MP, Liu J, Pan Q (abril de 2020). "Estimación de la prevalencia global, la progresión de la enfermedad y el resultado clínico de la infección por el virus de la hepatitis delta". The Journal of Infectious Diseases . 221 (10): 1677–1687. doi :10.1093/infdis/jiz633. PMC 7184909 . PMID 31778167.
- ^ "ICTV 9th Report (2011) Deltavirus". Comité Internacional de Taxonomía de Virus (ICTV) . Archivado desde el original el 30 de enero de 2019. Consultado el 30 de enero de 2019 .
- ^ ab "Taxonomía de virus: publicación de 2020". Comité Internacional de Taxonomía de Virus (ICTV). Marzo de 2021. Consultado el 5 de agosto de 2021 .
- ^ Poisson F, Roingeard P, Baillou A, Dubois F, Bonelli F, Calogero RA, Goudeau A (noviembre de 1993). "Caracterización de los dominios de unión al ARN del antígeno delta de la hepatitis". The Journal of General Virology . 74 (Pt 11): 2473–8. doi : 10.1099/0022-1317-74-11-2473 . PMID 8245865.
- ^ Zuccola HJ, Rozzelle JE, Lemon SM, Erickson BW, Hogle JM (julio de 1998). "Base estructural de la oligomerización del antígeno delta de la hepatitis". Structure . 6 (7): 821–30. doi : 10.1016/S0969-2126(98)00084-7 . PMID 9687364.
- ^
- ^ Elena SF, Dopazo J, Flores R, Diener TO, Moya A (julio de 1991). "Filogenia de viroides, ARN satélite similares a viroides y el dominio similar a viroides del ARN del virus de la hepatitis delta". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 88 (13): 5631–4. Bibcode :1991PNAS...88.5631E. doi : 10.1073/pnas.88.13.5631 . PMC 51931 . PMID 1712103.
- ^ Sureau C (2006). "El papel de las proteínas de la envoltura del VHB en el ciclo de replicación del VHD". Virus de la hepatitis delta . Temas actuales en microbiología e inmunología. Vol. 307. págs. 113–31. doi :10.1007/3-540-29802-9_6. ISBN 978-3-540-29801-4. Número de identificación personal 16903223.
- ^ Saldanha JA, Thomas HC, Monjardino JP (julio de 1990). "Clonación y secuenciación del ARN del virus de la hepatitis delta aislado del suero humano". The Journal of General Virology . 71 (7): 1603–6. doi : 10.1099/0022-1317-71-7-1603 . PMID 2374010.
- ^ Miao Z, Zhang S, Ma Z, Hakim MS, Wang W, Peppelenbosch MP, Pan Q (enero de 2019). "Identificación recombinante, clasificación molecular y genomas de referencia propuestos para el virus de la hepatitis delta". Journal of Viral Hepatitis . 26 (1): 183–190. doi : 10.1111/jvh.13010 . PMC 7379554 . PMID 30260538.
- ^ Yan H, Zhong G, Xu G, He W, Jing Z, Gao Z, Huang Y, Qi Y, Peng B, Wang H, Fu L, Song M, Chen P, Gao W, Ren B, Sun Y, Cai T, Feng X, Sui J, Li W (noviembre de 2012). "El polipéptido cotransportador de taurocolato de sodio es un receptor funcional para el virus de la hepatitis B y D humana". eLife . 1 : e00049. doi : 10.7554/eLife.00049 . PMC 3485615 . PMID 23150796.
- ^ Engelke M, Mills K, Seitz S, Simon P, Gripon P, Schnölzer M, Urban S (abril de 2006). "Caracterización de un sitio de unión al receptor del virus de la hepatitis B y del virus de la hepatitis delta". Hepatología . 43 (4): 750–60. doi : 10.1002/hep.21112 . PMID 16557545. S2CID 23549907.
- ^ Schulze A, Schieck A, Ni Y, Mier W, Urban S (febrero de 2010). "Mapeo preciso de los requisitos de la secuencia pre-S para la interacción con el receptor mediada por la proteína de envoltura grande del virus de la hepatitis B". Journal of Virology . 84 (4): 1989–2000. doi :10.1128/JVI.01902-09. PMC 2812397 . PMID 20007265.
- ^ Xia YP, Yeh CT, Ou JH, Lai MM (febrero de 1992). "Caracterización de la señal de orientación nuclear del antígeno de la hepatitis delta: transporte nuclear como un complejo proteico". Journal of Virology . 66 (2): 914–21. doi :10.1128/JVI.66.2.914-921.1992. PMC 240792 . PMID 1731113.
- ^ Lehmann E, Brueckner F, Cramer P (noviembre de 2007). "Base molecular de la actividad de la ARN polimerasa II dependiente de ARN". Nature . 450 (7168): 445–9. Bibcode :2007Natur.450..445L. doi :10.1038/nature06290. hdl : 11858/00-001M-0000-0015-7EE1-9 . PMID 18004386. S2CID 4393153.
- ^ Filipovska J, Konarska MM (enero de 2000). "Transcripción específica de HDV basada en ARN por pol II in vitro". ARN . 6 (1): 41–54. doi :10.1017/S1355838200991167. PMC 1369892 . PMID 10668797.
- ^ Greco-Stewart VS, Schissel E, Pelchat M (marzo de 2009). "El genoma de ARN del virus de la hepatitis delta interactúa con las ARN polimerasas humanas I y III". Virology . 386 (1): 12–5. doi : 10.1016/j.virol.2009.02.007 . PMID 19246067.
- ^ Li YJ, Macnaughton T, Gao L, Lai MM (julio de 2006). "Replicación del virus de la hepatitis delta con plantilla de ARN: ARN genómico y antigénico asociado con diferentes cuerpos nucleares". Journal of Virology . 80 (13): 6478–86. doi :10.1128/JVI.02650-05. PMC 1488965 . PMID 16775335.
- ^ Branch AD, Benenfeld BJ, Baroudy BM, Wells FV, Gerin JL, Robertson HD (febrero de 1989). "Un elemento estructural del ARN sensible a la luz ultravioleta en un dominio similar al viroide del virus de la hepatitis delta". Science . 243 (4891): 649–52. Bibcode :1989Sci...243..649B. doi :10.1126/science.2492676. PMID 2492676.
- ^ Wu HN, Lin YJ, Lin FP, Makino S, Chang MF, Lai MM (marzo de 1989). "Los subfragmentos de ARN del virus de la hepatitis delta humano contienen una actividad de autoescisión". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 86 (6): 1831–5. Bibcode :1989PNAS...86.1831W. doi : 10.1073/pnas.86.6.1831 . PMC 286798 . PMID 2648383.
- ^ ab Weiner AJ, Choo QL, Wang KS, Govindarajan S, Redeker AG, Gerin JL, Houghton M (febrero de 1988). "Un único marco de lectura abierto antigénico del virus de la hepatitis delta codifica el/los epítopo(s) de ambos polipéptidos del antígeno de la hepatitis delta p24 delta y p27 delta". Journal of Virology . 62 (2): 594–9. doi :10.1128/JVI.62.2.594-599.1988. PMC 250573 . PMID 2447291.
- ^ Jayan GC, Casey JL (diciembre de 2002). "Inhibición de la edición del ARN del virus de la hepatitis delta mediante la inhibición de la expresión de ADAR1, pero no de ADAR2, mediada por ARN inhibidor de corta duración". Journal of Virology . 76 (23): 12399–404. doi :10.1128/JVI.76.23.12399-12404.2002. PMC 136899 . PMID 12414985.
- ^ Sato S, Cornillez-Ty C, Lazinski DW (agosto de 2004). "Al inhibir la replicación, el antígeno de hepatitis delta grande puede regular indirectamente la edición de ámbar/W y su propia expresión". Journal of Virology . 78 (15): 8120–34. doi :10.1128/JVI.78.15.8120-8134.2004. PMC 446097 . PMID 15254184.
- ^ Taylor JM (2006). "Estructura y replicación del ARN del virus de la hepatitis delta". Virus de la hepatitis delta . Temas actuales en microbiología e inmunología. Vol. 307. págs. 1–23. doi :10.1007/3-540-29802-9_1. ISBN 978-3-540-29801-4. Número de identificación personal 16903218.
- ^ Chang MF, Chen CJ, Chang SC (febrero de 1994). "Análisis mutacional del antígeno delta: efecto sobre el ensamblaje y la replicación del virus de la hepatitis delta". Journal of Virology . 68 (2): 646–53. doi :10.1128/JVI.68.2.646-653.1994. PMC 236498 . PMID 8289368.
- ^ Jaoudé GA, Sureau C (agosto de 2005). "El papel del bucle antigénico de las proteínas de la envoltura del virus de la hepatitis B en la infectividad del virus de la hepatitis delta". Journal of Virology . 79 (16): 10460–6. CiteSeerX 10.1.1.570.4147 . doi :10.1128/jvi.79.16.10460-10466.2005. PMC 1182656 . PMID 16051838.
- ^ ab Radjef N, Gordien E, Ivaniushina V, Gault E, Anaïs P, Drugan T, Trinchet JC, Roulot D, Tamby M, Milinkovitch MC, Dény P (marzo de 2004). "Los análisis filogenéticos moleculares indican una radiación amplia y antigua del virus delta de la hepatitis africana, lo que sugiere un género de deltavirus de al menos siete clados principales". Revista de Virología . 78 (5): 2537–44. doi :10.1128/JVI.78.5.2537-2544.2004. PMC 369207 . PMID 14963156.
- ^ Taylor JM (enero de 2006). "Virus de la hepatitis delta". Virología . 344 (1): 71–6. doi : 10.1016/j.virol.2005.09.033 . PMID 16364738.
- ^ "Biblioteca Nacional de Medicina de EE. UU. "Agente Delta (hepatitis D)"".
- ^ Tayor JM (2009). Enciclopedia de escritorio de virología humana y médica . Boston: Academic Press. pág. 121. ISBN 978-0-12-375147-8.
- ^ "Hepatitis B". www.who.int .
- ^ abc "Hepatitis D - Fundación Estadounidense del Hígado". liverfoundation.org . 23 de mayo de 2022.
- ^ Schillie, Sarah (2018). "Prevención de la infección por el virus de la hepatitis B en los Estados Unidos: recomendaciones del Comité Asesor sobre Prácticas de Inmunización". MMWR. Recomendaciones e informes . 67 (1): 1–31. doi :10.15585/mmwr.rr6701a1. PMC 5837403 . PMID 29939980.
- ^ abcdefghijklm Asselah, Tarik; Rizzetto, Mario (6 de julio de 2023). "Infección por el virus de la hepatitis D". New England Journal of Medicine . 389 (1): 58–70. doi :10.1056/NEJMra2212151. PMID 37407002. S2CID 259354401.
- ^ Yurdaydin C, Idilman R (agosto de 2015). "Terapia de la hepatitis delta". Cold Spring Harbor Perspectives in Medicine . 5 (10): a021543. doi :10.1101/cshperspect.a021543. PMC 4588130 . PMID 26253093.
- ^ Abbas Z, Khan MA, Salih M, Jafri W (diciembre de 2011). Abbas Z (ed.). "Interferón alfa para la hepatitis D crónica". Base de datos Cochrane de revisiones sistemáticas . 2011 (12): CD006002. doi :10.1002/14651858.CD006002.pub2. PMC 6823236. PMID 22161394 .
- ^ Heidrich B, Yurdaydın C, Kabaçam G, Ratsch BA, Zachou K, Bremer B, Dalekos GN, Erhardt A, Tabak F, Yalcin K, Gürel S, Zeuzem S, Cornberg M, Bock CT, Manns MP, Wedemeyer H (julio de 2014). "Recaída tardía del ARN del HDV después de la terapia basada en peginterferón alfa de la hepatitis delta crónica". Hepatología . 60 (1): 87–97. doi : 10.1002/hep.27102 . PMID 24585488. S2CID 205892640.
- ^ Pascarella S, Negro F (enero de 2011). "Virus de la hepatitis D: una actualización". Liver International . 31 (1): 7–21. doi : 10.1111/j.1478-3231.2010.02320.x . PMID 20880077. S2CID 29142477.
- ^ "Hepcludex". Agencia Europea de Medicamentos . 26 de mayo de 2020.
- ^ Francisco EM (2020-05-29). «Hepcludex». Agencia Europea de Medicamentos . Archivado desde el original el 2020-06-15 . Consultado el 2020-08-06 .
- ^ "Bulevirtide - MYR Pharma". AdisInsight . Springer Nature Switzerland AG . Consultado el 6 de agosto de 2020 .
MYR Pharmaceuticals recibe la autorización de comercialización condicional de la Comisión Europea para bulevirtide en la Unión Europea para el tratamiento de la hepatitis B y D
- ^ Asselah, Tarik; Chulanov, Vladimir; Lampertico, Pietro; Wedemeyer, Heiner; Streinu-Cercel, Adrián; Pântea, Víctor; Lazar, Stefan; Placinta, Gheorghe; Gherlan, George S.; Bogomolov, Pavel; Stepanova, Tatiana; Morózov, Viacheslav; Syutkin, Vladimir; Sagalova, Olga; Manuilov, Dmitry (11 de julio de 2024). "Bulevirtida combinada con interferón pegilado para la hepatitis D crónica". Revista de Medicina de Nueva Inglaterra . 391 (2): 133-143. doi :10.1056/NEJMoa2314134. ISSN 0028-4793.
- ^ Degasperi E, Anolli MP, Uceda Renteria SC, et al. Monoterapia con bulevirtida durante 48 semanas en pacientes con cirrosis compensada relacionada con HDV e hipertensión portal clínicamente significativa. J Hepatol. 2022;77(6):1525-1531. doi:10.1016/j.jhep.2022.07.016
- ^ Sandmann, Lisa; Cornberg, Markus (abril de 2021). "Medicamentos experimentales para el tratamiento de la hepatitis D". Revista de farmacología experimental . 13 : 461–468. doi : 10.2147/JEP.S235550 . PMC 8057838 . PMID 33889032.
- ^ Koh, Christopher; Canini, Laetitia; Dahari, Harel; Zhao, Xiongce; Uprichard, Susan L.; Haynes-Williams, Vanessa; Winters, Mark A.; Subramanya, Gitanjali; Cooper, Stewart L.; Pinto, Peter; Wolff, Erin F.; Bishop, Rachel; Ai Thanda Han, Ma; Cotler, Scott J.; Kleiner, David E.; Keskin, Onur; Idilman, Ramazan; Yurdaydin, Cihan; Glenn, Jeffrey S.; Heller, Theo (octubre de 2015). "Inhibición de la prenilación oral con lonafarnib en la infección crónica por hepatitis D: un ensayo de fase 2A aleatorizado, doble ciego y controlado con placebo de prueba de concepto". The Lancet. Enfermedades infecciosas . 15 (10): 1167–1174. doi :10.1016/S1473-3099(15)00074-2. PMC 4700535. PMID 26189433 .
- ^ Vaillant, Andrew (10 de mayo de 2019). "REP 2139: Mecanismos antivirales y aplicaciones para lograr el control funcional de la infección por VHB y VHD". ACS Infectious Diseases . 5 (5): 675–687. doi :10.1021/acsinfecdis.8b00156. PMID 30199230. S2CID 52183556.
- ^ Rizzetto M (2020). "Epidemiología del virus de la hepatitis D". WikiJournal of Medicine . 7 : 7. doi : 10.15347/wjm/2020.001 .
- ^ ab Rizzetto M (julio de 2015). "Virus de la hepatitis D: introducción y epidemiología". Cold Spring Harbor Perspectives in Medicine . 5 (7): a021576. doi :10.1101/cshperspect.a021576. PMC 4484953 . PMID 26134842.
- ^ "Hepatitis D". www.who.int .
- ^ Rizzetto M , Canese MG, Aricò S, Crivelli O, Trepo C, Bonino F, Verme G (diciembre de 1977). "Detección por inmunofluorescencia de un nuevo sistema antígeno-anticuerpo (delta/anti-delta) asociado al virus de la hepatitis B en el hígado y en el suero de portadores de HBsAg". Gut . 18 (12): 997–1003. doi :10.1136/gut.18.12.997. PMC 1411847. PMID 75123 .
- ^ Rizzetto M, Canese MG, Purcell RH, London WT, Sly LD, Gerin JL (noviembre-diciembre de 1981). "Infecciones experimentales de chimpancés por VHB y delta: aparición y significado de los complejos inmunes intrahepáticos de HBcAg y antígeno delta". Hepatología . 1 (6): 567–74. doi :10.1002/hep.1840010602. PMID 7030907. S2CID 83892580.
- ^ Wang KS, Choo QL, Weiner AJ, Ou JH, Najarian RC, Thayer RM, Mullenbach GT, Denniston KJ, Gerin JL, Houghton M (9-15 de octubre de 1986). "Estructura, secuencia y expresión del genoma viral de la hepatitis delta (delta)". Nature . 323 (6088): 508-14. Bibcode :1986Natur.323..508W. doi : 10.1038/323508a0 . PMID 3762705. S2CID 4265339.
- ^ Fauquet CM, Mayo MA, Maniloff J, Desselberger U, Ball LA (2005). "Deltavirus". Octavo informe del Comité Internacional de Taxonomía de Virus. Londres : 735–8.
- ^ abc Bensabath G, Hadler SC, Soares MC, Fields H, Dias LB, Popper H, Maynard JE (1987). "Infección por el virus de la hepatitis delta y hepatitis Labrea. Prevalencia y papel en la hepatitis fulminante en la cuenca del Amazonas". JAMA . 258 (4): 479–83. doi :10.1001/jama.1987.03400040077025. PMID 3599343.
- ^ Gomes-Gouvêa MS, Soares MC, Bensabath G, de Carvalho-Mello IM, Brito EM, Souza OS, et al. (noviembre de 2009). "Genotipos del virus de la hepatitis B y del virus de la hepatitis delta en brotes de hepatitis fulminante (fiebre negra de Labrea) en la región amazónica occidental brasileña". The Journal of General Virology . 90 (Pt 11): 2638–2643. doi : 10.1099/vir.0.013615-0 . PMID 19605587.
- ^ Tommolino E, Piper MH, Sears D (3 de abril de 2021). Anand BS (ed.). "Hígado graso: descripción general, etiología y epidemiología". Medscape .
- ^ Cabezas C, Braga W (septiembre de 2020). "Virus de la hepatitis B e infección por virus delta: consideraciones especiales en poblaciones indígenas y aisladas ribereñas de la región amazónica". Clinical Liver Disease . 16 (3): 117–122. doi :10.1002/cld.1009. PMC 7508778 . PMID 33005393.
- ^ Celik I, Karatayli E, Cevik E, Kabakçi SG, Karatayli SC, Dinç B, et al. (diciembre de 2011). "Secuencias genómicas completas y análisis filogenético de los virus de la hepatitis delta aislados de nueve pacientes turcos". Archivos de Virología . 156 (12): 2215–20. doi :10.1007/s00705-011-1120-y. PMID 21984217. S2CID 31356.
- ^ Alvarado-Mora MV, Romano CM, Gomes-Gouvêa MS, Gutierrez MF, Carrilho FJ, Pinho JR (agosto de 2011). "Dinámica del genotipo 3 del virus de la hepatitis D (delta) en la región amazónica de América del Sur". Infección, genética y evolución . 11 (6): 1462–8. Código Bib : 2011InfGE..11.1462A. doi : 10.1016/j.meegid.2011.05.020 . PMID 21645647.
- ^ Chao YC, Tang HS, Hsu CT (agosto de 1994). "Tasa de evolución del ARN del virus de la hepatitis delta aislado en Taiwán". Revista de Virología Médica . 43 (4): 397–403. doi :10.1002/jmv.1890430414. PMID 7964650. S2CID 22539505.
- ^ Homs M, Rodríguez-Frías F, Gregori J, Ruiz A, Reimundo P, Casillas R, Tabernero D, Godoy C, Barakat S, Quer J, Riveiro-Barciela M, Roggendorf M, Esteban R, Buti M (2016). "Evidencia de un patrón de decadencia exponencial de la tasa de evolución del virus de la hepatitis delta y fluctuaciones en la complejidad de las cuasiespecies en estudios a largo plazo de la infección crónica por delta". MÁS UNO . 11 (6): e0158557. Código Bib : 2016PLoSO..1158557H. doi : 10.1371/journal.pone.0158557 . PMC 4928832 . PMID 27362848.
- ^ Le Gal F, Gault E, Ripault MP, Serpaggi J, Trinchet JC, Gordien E, Dény P (septiembre de 2006). "Octavo clado principal del virus de la hepatitis delta". Enfermedades Infecciosas Emergentes . 12 (9): 1447–50. doi : 10.3201/eid1209.060112. PMC 3294742 . PMID 17073101.
- ^ Barros LM, Gomes-Gouvêa MS, Pinho JR, Alvarado-Mora MV, Dos Santos A, Mendes-Corrêa MC, Caldas AJ, Sousa MT, Santos MD, Ferreira AS (septiembre de 2011). "Infección por el genotipo 8 del virus de la hepatitis Delta en el noreste de Brasil: ¿herencia de los esclavos africanos?". Investigación de virus . 160 (1–2): 333–9. doi : 10.1016/j.virusres.2011.07.006 . PMID 21798297.
- ^ Karimzadeh H, Kiraithe MM, Oberhardt V, Salimi Alizei E, Bockmann J, Schulze Zur Wiesch J, et al. (mayo de 2019). "Las mutaciones en el virus de la hepatitis D le permiten escapar a la detección por parte de las células T CD8+ y evolucionar a nivel de población". Gastroenterología . 156 (6): 1820–1833. doi :10.1053/j.gastro.2019.02.003. PMC 6486497 . PMID 30768983.
- ^ Paraskevopoulou S, Pirzer F, Goldmann N, Schmid J, Corman VM, Gottula LT, et al. (julio de 2020). "Deltavirus de mamíferos sin coinfección con hepadnavirus en el roedor neotropical Proechimys semispinosus". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 117 (30): 17977–17983. Bibcode :2020PNAS..11717977P. doi : 10.1073/pnas.2006750117 . PMC 7395443 . PMID 32651267.
Bibliografía
- Specter SC, ed. (1999). Hepatitis viral: diagnóstico, tratamiento y prevención . Humana Press. ISBN 0-89603-424-0.
- da Fonseca JC (2004). "[Hepatitis fulminante en la Amazonia brasileña]". Revista da Sociedade Brasileira de Medicina Tropical . 37. 37 (Suplemento 2): 93–5. doi : 10.1590/s0037-86822004000700015 . PMID 15586904.
- Bensabath G, Soares M (2004). "[La evolución del conocimiento sobre las hepatitis virales en la región amazónica: de la epidemiología y la etiología a la profilaxis]". Revista da Sociedade Brasileira de Medicina Tropical . 37 (Suppl 2): 14–26. doi : 10.1590/S0037-86822004000700003 . PMID 15586892.
- Fonseca JC, Souza RA, Brasil LM, Araújo JR, Ferreira LC (2004). "Insuficiencia hepática fulminante en niños y adolescentes del norte de Brasil". Revista da Sociedade Brasileira de Medicina Tropical . 37 (1): 67–9. doi : 10.1590/S0037-86822004000100019 . PMID 15042190.
Enlaces externos
- Hoja informativa de la Organización Mundial de la Salud sobre la hepatitis D
- Informe de ICTV: Deltavirus
- Zona viral: Deltavirus
- "Virus de la hepatitis delta". Navegador de taxonomía del NCBI . 12475.