Gabaculina
 | |
| Nombres | |
|---|---|
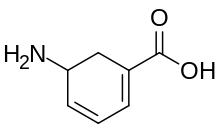
| Nombre IUPAC Ácido 5-aminociclohexa-1,3-dieno-1-carboxílico | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C7H9NO2 | |
| Masa molar | 139,154 g·mol −1 |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La gabaculina es una neurotoxina natural aislada por primera vez de la bacteria Streptomyces toyacaensis , [1] que actúa como un potente e irreversible inhibidor de la transaminasa GABA , [2] [3] y también como un inhibidor de la recaptación de GABA . [4] [5] La gabaculina también se conoce como clorhidrato de ácido 3-amino-2,3-dihidrobenzoico [6] y ácido 5-amino ciclohexa-1,3 dienil carboxílico. [7] La gabaculina aumentó los niveles de GABA en el cerebro y tuvo un efecto sobre la convulsión en ratones. [7]
Mecanismo de acción
La gabaculina incluye una estructura comparable a la del GABA y un anillo de dihidrobenceno. Esta estructura comparable al GABA se utiliza para poder sustituir al GABA durante los primeros pasos de la transaminación, incluida la transaldiminación y el cambio 1,3-prototrófico a la imina de piridoxamina. [8] A continuación, una base enzimática extrae un protón del anillo de dihidrobenceno, lo que hace que el anillo se vuelva aromático. [8] La energía de estabilización aromática del anillo aromático es lo que hace que esta reacción sea irreversible, lo que hace que el complejo no reaccione más. [8]
Estudios preclínicos
Los estudios en animales para determinar el efecto de la gabaculina sobre los niveles de GABA en el cerebro se llevaron a cabo en gran medida alrededor de la década de 1970. [9] Estos estudios in vivo implicaron principalmente el uso de ratones que se sometieron a la administración intravenosa de este fármaco. Cada uno de estos estudios concluyó que la gabaculina tiene un gran potencial para aumentar los niveles de GABA en el cerebro de estos ratones de una manera dependiente del tiempo. [7] Junto con la determinación del efecto de los niveles de GABA, se realizaron estudios in vivo para investigar la capacidad de la gabaculina para inhibir las convulsiones en ratones. Los resultados indicaron que la gabaculina proporcionó un claro efecto anticonvulsivo contra las convulsiones inducidas por altas dosis de quimioconvulsivos o electroshock. [10] La toxicidad de este compuesto también se investigó utilizando modelos animales de ratón. Este estudio mostró que en dosis anticonvulsivas, la gabaculina es extremadamente potente y tóxica en comparación con otros inhibidores de la transaminasa GABA, con una ED50 de 35 mg/kg y una LD50 de 86 mg/kg . [10] Debido a este efecto letal potencial, se demostró que la gabaculina era demasiado tóxica para su uso como fármaco; sin embargo, [8] aún se puede utilizar como compuesto para alterar los niveles de GABA en estudios de epilepsia experimental . [10]
Regulación
La gabaculina no ha sido aprobada por la FDA como una entidad farmacéutica; sin embargo, puede usarse como un compuesto químico solo con fines de investigación. [11] Este compuesto no se considera una sustancia peligrosa según OSHA 29 CFR 1910.1200. [6]
Referencias
- ^ Kobayashi K, Miyazawa S, Endo A (abril de 1977). "Aislamiento y actividad inhibidora de la gabaculina, un nuevo inhibidor potente de la gamma-aminobutirato aminotransferasa producida por un Streptomyces". FEBS Letters . 76 (2): 207–10. doi : 10.1016/0014-5793(77)80153-1 . PMID 862902.
- ^ Rando RR (octubre de 1977). "Mecanismo de inhibición irreversible de la transaminasa del ácido gamma-aminobutírico-alfa-cetoglutárico por la neurotoxina gabaculina". Bioquímica . 16 (21): 4604–10. doi :10.1021/bi00640a012. PMID 410442.
- ^ Irifune M, Katayama S, Takarada T, et al. (diciembre de 2007). "MK-801 mejora la pérdida del reflejo de enderezamiento inducida por gabaculina en ratones, pero no la inmovilidad". Can J Anaesth . 54 (12): 998–1005. doi : 10.1007/BF03016634 . PMID 18056209.
- ^ Allan RD, Johnston GAR, Twitchin B. Efectos de la gabaculina en la captación, unión y metabolismo del GABA. Neuroscience Letters . 1977;4:51-54.
- ^ Høg S, Greenwood JR, Madsen KB, Larsson OM, Frølund B, Schousboe A, Krogsgaard-Larsen P, Clausen RP (2006). "Relaciones estructura-actividad de inhibidores selectivos de la captación de GABA". Temas actuales en química medicinal . 6 (17): 1861–82. doi :10.2174/156802606778249801. PMID 17017962. Archivado desde el original el 14 de abril de 2013.
{{cite journal}}: CS1 maint: URL no apta ( enlace ) - ^ ab Santa Cruz Biotechnology, Inc. "Ficha técnica de seguridad de gabaculina" . Consultado el 5 de diciembre de 2014 .
- ^ abc Mutsui, Yoshiki; Deguchi, Takehiko (1977). "Efectos de la gabaculina, un nuevo potente inhibidor de la gamma-aminobutirato transaminasa, sobre el contenido de gamma-aminobutirato en el cerebro y las convulsiones en ratones". Ciencias de la vida . 20 (7): 1291-1296. doi :10.1016/0024-3205(77)90505-7. PMID 850479.
- ^ abcd Frey, Perry; Ables, Robert; Hegeman, Adrian (29 de diciembre de 2006). Mecanismo de reacción enzimática. Nueva York: Oxford University Press Inc., págs. 262-263. ISBN 0195122585. Recuperado el 4 de diciembre de 2014 .
- ^ Rando, Robert; Bangerter, FW (13 de mayo de 1977). "La inhibición in vivo de la GABA-transaminasa por gabaculina". Comunicaciones de investigación bioquímica y biofísica . 76 (4): 1276–1281. doi :10.1016/0006-291X(77)90993-7. PMID 901477.
- ^ abc Loscher, Wolfgang (1980). "Un estudio comparativo de la farmacología de los inhibidores del metabolismo de GABA". Naunyn-Schmiedeberg's Arch. Pharmacol . 315 (2): 119–128. doi :10.1007/BF00499254. PMID 6782493. S2CID 26483388.
- ^ PubChem. "Gabaculine". pubchem.ncbi.nlm.nih.gov/ . Centro Nacional de Información Biotecnológica . Consultado el 9 de diciembre de 2014 .


