Difenilcetena
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido 2,2-Difenileten-1-ona | |
| Otros nombres Difeniletenona | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C14H10O | |
| Masa molar | 194,233 g·mol −1 |
| Apariencia | Aceite rojo anaranjado |
| Punto de fusión | 8 a 9 °C (46 a 48 °F; 281 a 282 K) |
| Punto de ebullición | 118 a 120 a 1 mmHg |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La difenilcetena es una sustancia química de la familia de las cetenas . La difenilcetena, como la mayoría de las cetenas disustituidas estables , es un aceite rojo anaranjado a temperatura y presión ambiente . Debido a los dobles enlaces sucesivos en la estructura de la cetena R 1 R 2 C=C=O, la difenilcetena es un heterocumuleno . La reacción más importante de la difenilcetena es la cicloadición [2+2] en los enlaces múltiples CC, CN, CO y CS. [1]
Historia
La difenilcetena fue aislada por primera vez por Hermann Staudinger en 1905 e identificada como el primer ejemplo de la clase excepcionalmente reactiva de cetenos [2] con la fórmula general R 1 R 2 C=C=O (R 1 =R 2 =grupo fenilo). [3]
Preparación
La primera síntesis de H. Staudinger se basó en el cloruro de 2-clorodifenilacetilo (preparado a partir de ácido bencílico y cloruro de tionilo [4] ) del que se escinden dos átomos de cloro con zinc en una reacción de deshalogenación : [2]

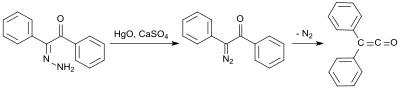
Una síntesis temprana utiliza benzilmonohidrazona (a partir de difeniletanodiona e hidrato de hidrazina [5] ), que se oxida con óxido de mercurio (II) y sulfato de calcio para formar mono-diazocetona, y luego se convierte en difenilcetena a 100 °C bajo eliminación de nitrógeno con un rendimiento del 58 %: [6]
Otra síntesis temprana de difenilcetena se origina de Eduard Wedekind, quien ya había obtenido difenilcetena en 1901 mediante la deshidrohalogenación de cloruro de difenilacetilo con trietilamina , sin embargo sin aislamiento ni caracterización. [7] Esta variante también fue descrita en 1911 por H. Staudinger. [8]
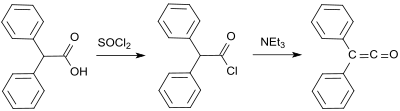
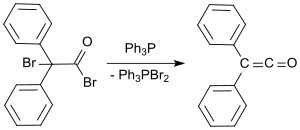
Un protocolo de laboratorio estándar se basa en el método de Staudinger y produce difenilcetena en forma de aceite anaranjado con rendimientos de entre el 53 y el 57 %. [9] En un proceso más reciente, el bromuro de 2-bromo-2,2-difenilacetilo se hace reaccionar con trifenilfosfina para producir difenilcetena con rendimientos de hasta el 81 %. [10]
Recientemente, se ha informado de una síntesis de difenilcetena a partir de ácido difenilacético y el reactivo de Hendrickson (anhídrido de trifenilfosfonio-trifluorometanosulfonato) [11] con eliminación de agua con un rendimiento del 72%. [12]

Propiedades
El difenilceteno es a temperatura ambiente un aceite de color naranja a rojo (con el color de una solución concentrada de dicromato de potasio [2] ) que es miscible con disolventes orgánicos no polares (como éter dietílico , acetona , benceno , tetrahidrofurano , cloroformo ) [13] y se solidifica en frío formando cristales amarillos. [2] El compuesto se oxida fácilmente con el aire, pero se puede almacenar en recipientes bien cerrados a 0 °C durante varias semanas sin descomponerse [9] o en una atmósfera de nitrógeno con la adición de una pequeña cantidad de hidroquinona como inhibidor de la polimerización. [6]
Reactividad
La difenilcetena puede sufrir ataques de una gran cantidad de nucleófilos , incluidos alcoholes , aminas y enolatos , a velocidades bastante lentas. Estas velocidades pueden aumentar en presencia de catalizadores . En la actualidad, se desconoce el mecanismo de ataque, pero se está trabajando para determinar el mecanismo exacto.
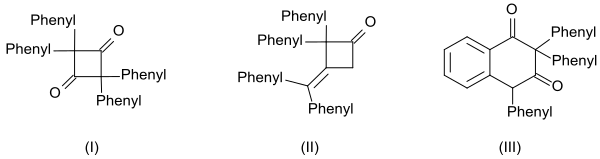
La alta reactividad de la difenilcetena también se evidencia en la formación de tres dímeros: [14]
- La dicetona cíclica 2,2,4,4-tetrafenilciclobutano-1,3-diona (I) se obtiene calentando con quinolina.
- la β-lactona 4-(difenilmetileno)-3,3-difeniloxetan-2-ona (II) por calentamiento con metóxido de sodio y
- el derivado de tetralina 2,2,4-trifenilnaftaleno-1,3-(2 H ,4 H )-diona (III) por calentamiento con cloruro de benzoilo
y oligómeros producidos a partir de ellos.
Solicitud
Las cetenas (de fórmula general R 1 R 2 C=C=O) tienen muchos paralelos con los isocianatos (de fórmula general RN=C=O) en su constitución así como en su reactividad.
La difenilcetena reacciona con agua en una reacción de adición para formar ácido difenilacético, con etanol para formar éster etílico de difenilacético o con amoníaco para formar la amida correspondiente. [2] Los ácidos carboxílicos producen anhídridos mixtos de ácido difenilacético, que pueden usarse para activar aminoácidos protegidos para el enlace peptídico .
De este modo, se obtiene el dipéptido protegido Z-Leu-Phe-OEt (éster etílico de N-benciloxicarbonil-L-leucil-L-fenilalanina) con un rendimiento del 59 % mediante la activación de Z-leucina con difenilcetena y la posterior reacción con éster etílico de fenilalanina. [15]
La difenilcetena es propensa a la autooxidación , en la que el poliéster correspondiente se forma a temperaturas superiores a 60 °C a través de un intermedio llamado difenilacetolactona. [16]

En una reacción de Wittig , se pueden preparar alenos a partir de difenilcetena. [17]

Con trifenilfosfina, difenilmetileno y difenilceteno, a, por ejemplo, 140 °C y bajo presión, se forman tetrafenilalenos con un rendimiento del 70 %. [18]
Las reacciones sintéticamente más interesantes del difenilceteno son las [2+2]cicloadiciones, por ejemplo la reacción con ciclopentadieno que produce un aducto de Diels-Alder. [19]

Las iminas como la benzalanilina forman β-lactamas con difenilcetena.
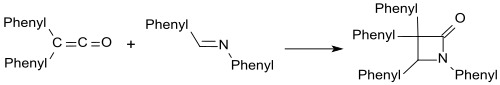
Con los compuestos carbonílicos se forman de forma análoga las β-lactonas. [19]
La [2+2]cicloadición de difenilcetena con fenilacetileno conduce primero a una ciclobutenona que se aromatiza térmicamente a una fenilvinilcetena y se cicla en una [4+2]cicloadición a 3,4-difenil-1-naftol con un rendimiento del 81%. [20]

A partir de esta reacción denominada Smith-Hoehn se ha desarrollado un método de síntesis general para fenoles y quinonas sustituidos. [3]
Referencias
- ^ Ulrich, H. (1967), Reacciones de cicloadición de heterocumulenos , Nueva York: Academic Press, pág. 374
- ^ abcde Staudinger, H. (1905). "Ketene, una nueva clase de clase Körperklasse". Ber. Alemán. Química. Ges. (en alemán). 38 (2): 1735-1739. doi :10.1002/cber.19050380283.
- ^ ab Tidwell, TT (2005), "El primer siglo de las cetenas (1905-2005): el nacimiento de una familia versátil de intermediarios reactivos", Angew. Chem. , vol. 44, núm. 36, págs. 5778-5785, doi : 10.1002/anie.200500098 , PMID 16149113
- ^ King, FE; Holmes, D. (1947), "Midriáticos sintéticos. Cloruro de difenilcloroacetilo como reactivo para la preparación de ésteres bencílicos de aminoalcoholes terciarios", J. Chem. Soc. , págs. 164-168, doi :10.1039/JR9470000164, PMID 20238643
- ^ Curtius, T.; Thun, K. (1891), "Einwirkung von Hydrazinhydrat auf Monoketone und Orthodiketone", J. Prakt. Química. , vol. 44, núm. 2, págs. 161–186, doi :10.1002/prac.18910440121
- ^ ab Smith, LI; Hoehn, HH (1940). "Difenilcetena [Cetena, difenil-]". Organic Syntheses . 20 : 47. doi :10.15227/orgsyn.020.0047; Volúmenes recopilados , vol. 3, pág. 356.
- ^ Wedekind, E. (1901), "Ueber die Gewinnung von Säureanhydriden mit Hülfe von tertiären Aminen", Ber. Alemán. Química. Ges. , vol. 34, núm. 2, págs. 2070–2077, doi :10.1002/cber.190103402122
- ^ Staudinger, H. (1911), "Über Ketene.XIX. Über Bildung und Darstellung des Difenilketens", Ber. Alemán. Química. Ges. , vol. 44, núm. 2, págs. 1619-1623, doi :10.1002/cber.19110440258
- ^ ab Taylor, EC; McKillop, A; Hawks, GH (1972). "Difenilceteno [Etenona, difenil-]". Organic Syntheses . 52 : 36. doi :10.15227/orgsyn.052.0036; Volúmenes recopilados , vol. 6, pág. 549.
- ^ Darling, SD; Kidwell, RL (1968), "Difenilcetena. Deshalogenación con trifenilfosfina del bromuro de alfa-bromodifenilacetilo", J. Org. Chem. , vol. 33, núm. 10, págs. 3974–3975, doi :10.1021/jo01274a074
- ^ McCauley, JI (2012), "Reactivo de Hendrickson (trifluorometano sulfonato de anhídrido de trifenilfosfonio", Synlett , vol. 23, núm. 20, págs. 2999–3000, doi : 10.1055/s-0032-1317486
- ^ Moussa, Z. (2012), "El reactivo 'POP' de Hendrickson y sus análogos: síntesis, estructura y aplicación en síntesis orgánica", Arkivoc , 2012 (1): 432–490, doi : 10.3998/ark.5550190.0013.111 , hdl : 2027/spo.5550190.0013.111
- ^ Leahy, JW (2001). "Difenilcetena". Enciclopedia de reactivos para síntesis orgánica . doi :10.1002/047084289X.rd421. ISBN 0471936235.
- ^ Das, H.; Kooyman, CE (1965). "Oligómeros de difenilceteno". Recueil des Travaux Chimiques des Pays-Bas . 84 (8): 965–978. doi :10.1002/recl.19650840802.
- ^ Pérdida, G.; Demuth, E. (1961), "Difenilketen als Reagens zur Knüpfung von Peptidbindungen", Ber. Alemán. Química. Ges. (en alemán), vol. 94, núm. 7, págs. 1762-1766, doi :10.1002/cber.19610940713
- ^ Staudinger, H.; Dyckerhoff, K.; Klever, HW; Ruzicka, L. (1925), "Über Autoxidation organischer Verbindungen. IV.: Über Autoxidation der Ketene", Ber. Alemán. Química. Ges. (en alemán), vol. 58, núm. 6, págs. 1079–1087, doi :10.1002/cber.19250580618
- ^ Wittig, G.; Haag, A. (1963), "Über Phosphin-alquilene als olefinbildende Reagenzien, VIII. Allelderivate aus Ketenen", Ber. Alemán. Química. Ges. (en alemán), vol. 96, núm. 6, págs. 1535-1543, doi :10.1002/cber.19630960609
- ^ Lüscher, G. (1922). Beitrag zur Konstitution der alifatischen Diazokörper und Hydrazone. Neue organische Phosphorverbindungen (PDF) (Tesis doctoral) (en alemán). Eidgenössische Technische Hochschule Zurich. doi : 10.3929/ethz-a-000096667. hdl : 20.500.11850/134328.
- ^ ab Staudinger, H. (1907), "Zur Kenntnis der Ketene. Difenilketen", Liebigs Ann. Química. (en alemán), vol. 356, núm. 1–2, págs. 51–123, doi :10.1002/jlac.19073560106
- ^ Smith, LI; Hoehn, HH (1939), "La reacción de difenilceteno y fenilacetileno", J. Am. Chem. Soc. , vol. 61, núm. 10, págs. 2619–2624, doi :10.1021/ja01265a015



2CO-O-CO-{}}}{\text{Z -Leu }}{\ce {->[{} \atop {\ce {H-Phe-OEt}}]}}{\text{ Z-Leu}}{\ce {-Phe-OEt}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a7b4b915bc917b7c77143009ead9cc799bd83acc)