Ciclooxigenasa
| Sintetasa de endoperóxido de prostaglandina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identificadores | |||||||||
| N.º CE | 1.14.99.1 | ||||||||
| N.º CAS | 9055-65-6 | ||||||||
| Bases de datos | |||||||||
| IntEnz | Vista de IntEnz | ||||||||
| BRENDA | Entrada de BRENDA | ||||||||
| Expasí | Vista de NiceZyme | ||||||||
| BARRIL | Entrada de KEGG | ||||||||
| MetaCiclo | vía metabólica | ||||||||
| PRIAMO | perfil | ||||||||
| Estructuras del PDB | RCSB AP APBE APSUMA | ||||||||
| Ontología genética | AmiGO / QuickGO | ||||||||
| |||||||||
| Ciclooxigenasa 1 | |||||||
|---|---|---|---|---|---|---|---|
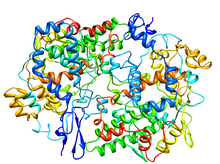 Estructura cristalográfica del complejo de prostaglandina H2 sintasa-1 con flurbiprofeno [1] | |||||||
| Identificadores | |||||||
| Símbolo | PTGS1 | ||||||
| Símbolos alternativos | COX-1 | ||||||
| Gen NCBI | 5742 | ||||||
| HGNC | 9604 | ||||||
| OMI | 176805 | ||||||
| AP | 1CQE | ||||||
| Secuencia de referencia | Número nuevo_080591 | ||||||
| Protección unificada | P23219 | ||||||
| Otros datos | |||||||
| Número CE | 1.14.99.1 | ||||||
| Lugar | Crónica 9 q32-q33.3 | ||||||
| |||||||
| Ciclooxigenasa 2 | |||||||
|---|---|---|---|---|---|---|---|
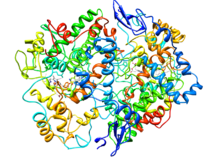 Ciclooxigenasa-2 (prostaglandina sintetasa-2) en complejo con un inhibidor selectivo de la COX-2 [2] | |||||||
| Identificadores | |||||||
| Símbolo | PTGS2 | ||||||
| Símbolos alternativos | COX-2 | ||||||
| Gen NCBI | 5743 | ||||||
| HGNC | 9605 | ||||||
| OMI | 600262 | ||||||
| AP | 6COX | ||||||
| Secuencia de referencia | NM_000963 | ||||||
| Protección unificada | P35354 | ||||||
| Otros datos | |||||||
| Número CE | 1.14.99.1 | ||||||
| Lugar | Crónica 1 q25.2-25.3 | ||||||
| |||||||
La ciclooxigenasa ( COX ), oficialmente conocida como prostaglandina-endoperóxido sintasa ( PTGS ), es una enzima (específicamente, una familia de isoenzimas , EC 1.14.99.1) que es responsable de la biosíntesis de prostanoides , incluyendo tromboxano y prostaglandinas como la prostaciclina , a partir del ácido araquidónico . Miembro de la familia de las hemoperoxidasas de tipo animal , también se la conoce como prostaglandina G/H sintasa . La reacción específica catalizada es la conversión de ácido araquidónico a prostaglandina H2 a través de un intermediario de prostaglandina G2 de vida corta . [3] [4]
La inhibición farmacéutica de la COX puede proporcionar alivio de los síntomas de inflamación y dolor . [3] Los fármacos antiinflamatorios no esteroideos (AINE), como la aspirina y el ibuprofeno , ejercen sus efectos a través de la inhibición de la COX. Aquellos que son específicos de la isoenzima COX-2 se denominan inhibidores de la COX-2 . El metabolito activo ( AM404 ) del paracetamol es un inhibidor de la COX, hecho al que se ha atribuido parte o la totalidad de su efecto terapéutico . [5]
En medicina, el símbolo de raíz "COX" se encuentra con más frecuencia que "PTGS". En genética , "PTGS" se utiliza oficialmente para esta familia de genes y proteínas porque el símbolo de raíz "COX" ya se utilizaba para la familia de la citocromo c oxidasa . Por lo tanto, las dos isoenzimas que se encuentran en los seres humanos, PTGS1 y PTGS2 , se denominan con frecuencia COX-1 y COX-2 en la literatura médica. Los nombres "prostaglandina sintasa (PHS)", "prostaglandina sintetasa (PHS)" y "prostaglandina-endoperóxido sintetasa (PES)" son términos más antiguos que todavía se utilizan a veces para referirse a la COX.
Biología
En términos de su biología molecular, la COX-1 y la COX-2 tienen un peso molecular similar, aproximadamente 70 y 72 kDa , respectivamente, y tienen una homología de secuencia de aminoácidos del 65% y sitios catalíticos casi idénticos. Ambas proteínas tienen tres dominios: un dominio similar al EGF N-terminal , un pequeño ancla de membrana de 4 hélices y un dominio catalítico central de hemo-peroxidasa. Ambos forman dímeros. [6] El ancla de membrana fija las proteínas en el retículo endoplasmático (RE) y la membrana del microsoma . [7]
Farmacología
La COX es un objetivo común de los fármacos antiinflamatorios. La diferencia más significativa entre las isoenzimas, que permite la inhibición selectiva, es la sustitución de la isoleucina en la posición 523 en la COX-1 por valina en la COX-2. El residuo Val 523 más pequeño en la COX-2 permite el acceso a un bolsillo lateral hidrofóbico en la enzima (que la Ile 523 impide estéricamente). Las moléculas de fármacos, como DuP-697 y los coxibs derivados de ella, se unen a este sitio alternativo y se consideran inhibidores selectivos de la COX-2. [2]
AINE clásicos
Los principales inhibidores de la COX son los antiinflamatorios no esteroides .
Los inhibidores clásicos de la COX no son selectivos e inhiben todos los tipos de COX. La inhibición resultante de la síntesis de prostaglandinas y tromboxanos tiene el efecto de reducir la inflamación, así como efectos antipiréticos, antitrombóticos y analgésicos. El efecto adverso más frecuente de los AINE es la irritación de la mucosa gástrica, ya que las prostaglandinas normalmente tienen un papel protector en el tracto gastrointestinal. Algunos AINE también son ácidos, lo que puede causar daños adicionales al tracto gastrointestinal.
Nuevos AINE
La selectividad por la COX-2 es la característica principal del celecoxib , etoricoxib y otros miembros de esta clase de fármacos. Debido a que la COX-2 suele ser específica del tejido inflamado, hay mucha menos irritación gástrica asociada con los inhibidores de la COX-2, con un menor riesgo de úlcera péptica. La selectividad de la COX-2 no parece anular otros efectos secundarios de los AINE, en particular un mayor riesgo de insuficiencia renal , y hay evidencia que indica un aumento del riesgo de ataque cardíaco , trombosis y accidente cerebrovascular a través de un aumento del tromboxano desequilibrado por la prostaciclina (que se reduce por la inhibición de la COX-2). [8] El rofecoxib (nombre comercial Vioxx ) se retiró en 2004 debido a estas preocupaciones. Algunos otros AINE selectivos de la COX-2, como el celecoxib y el etoricoxib, todavía están en el mercado.
Inhibición natural de la COX
Los hongos culinarios, como el maitake , pueden inhibir parcialmente la COX-1 y la COX-2. [9] [10]
Se ha descubierto que una variedad de flavonoides inhiben la COX-2. [11]
Los aceites de pescado proporcionan ácidos grasos alternativos al ácido araquidónico. Estos ácidos pueden ser transformados en prostaciclinas antiinflamatorias por la COX en lugar de prostaglandinas proinflamatorias . [12]
Se ha demostrado que la hiperforina inhibe la COX-1 entre 3 y 18 veces más que la aspirina. [13]
El calcitriol ( vitamina D ) inhibe significativamente la expresión del gen COX-2. [14]
Se debe tener precaución al combinar dosis bajas de aspirina con inhibidores de la COX-2 debido al posible aumento del daño a la mucosa gástrica. La COX-2 aumenta cuando la COX-1 se suprime con aspirina, lo que se cree que es importante para mejorar los mecanismos de defensa de la mucosa y reducir la erosión causada por la aspirina. [15]
Efectos secundarios cardiovasculares de los inhibidores de la COX
Se ha descubierto que los inhibidores de la COX-2 aumentan el riesgo de aterotrombosis incluso con un uso a corto plazo. Un análisis de 2006 de 138 ensayos aleatorizados y casi 150.000 participantes [16] mostró que los inhibidores selectivos de la COX-2 se asocian con un riesgo moderadamente mayor de eventos vasculares, principalmente debido a un riesgo dos veces mayor de infarto de miocardio , y también que los regímenes de dosis altas de algunos AINE tradicionales (como diclofenaco e ibuprofeno , pero no naproxeno ) se asocian con un aumento similar en el riesgo de eventos vasculares.
Sin embargo, esta evidencia ha sido contradicha por el ensayo PRECISION (Evaluación aleatorizada prospectiva de la seguridad integrada de Celecoxib versus Ibuprofeno o Naproxeno) de 2016 [17] de 24.081 participantes, que muestra una menor incidencia de muerte cardiovascular (incluida muerte hemorrágica), infarto de miocardio no fatal o accidente cerebrovascular no fatal para Celecoxib en comparación con Naproxeno e Ibuprofeno.
Los aceites de pescado (por ejemplo, el aceite de hígado de bacalao ) se han propuesto como una alternativa razonable para el tratamiento de la artritis reumatoide y otras afecciones como consecuencia del hecho de que proporcionan un menor riesgo cardiovascular que otros tratamientos, incluidos los AINE. [12]
Efectos de la COX sobre el sistema inmunológico
Se ha demostrado que la inhibición de COX-2 con celecoxib reduce la expresión inmunosupresora de TGFβ en los hepatocitos, atenuando la EMT en el carcinoma hepatocelular humano [18].
Véase también
- Ciclooxigenasa-1
- Ciclooxigenasa-2
- Ciclooxigenasa-3 (no funcional en humanos)
- Descubrimiento y desarrollo de inhibidores selectivos de COX-2
Referencias
- ^ PDB : 1CQE ; Picot D, Loll PJ, Garavito RM (enero de 1994). "La estructura cristalina de rayos X de la proteína de membrana prostaglandina H2 sintasa-1". Nature . 367 (6460): 243–9. Bibcode :1994Natur.367..243P. doi :10.1038/367243a0. PMID 8121489. S2CID 4340064.
- ^ ab PDB : 6COX ; Kurumbail RG, Stevens AM, Gierse JK, McDonald JJ, Stegeman RA, Pak JY, Gildehaus D, Miyashiro JM, Penning TD, Seibert K, Isakson PC, Stallings WC (1996). "Base estructural para la inhibición selectiva de la ciclooxigenasa-2 por agentes antiinflamatorios". Nature . 384 (6610): 644–8. Bibcode :1996Natur.384..644K. doi :10.1038/384644a0. PMID 8967954. S2CID 4326310.
- ^ ab Litalien C, Beaulieu P (2011). "Capítulo 117 – Mecanismos moleculares de las acciones de los fármacos: de los receptores a los efectores". En Fuhrman BP, Zimmerman JJ (eds.). Cuidados intensivos pediátricos (4.ª ed.). Filadelfia, PA: Elsevier Saunders. págs. 1553–1568. doi :10.1016/B978-0-323-07307-3.10117-X. ISBN 978-0-323-07307-3El ácido araquidónico
es un componente de los fosfolípidos de membrana que se libera en un proceso de un solo paso, después de la acción de la fosfolipasa A2 (PLA2), o en un proceso de dos pasos, después de las acciones de la fosfolipasa C y la lipasa DAG. El ácido araquidónico es metabolizado luego por la ciclooxigenasa (COX) y la 5-lipoxigenasa, lo que da como resultado la síntesis de prostaglandinas y leucotrienos, respectivamente. Estos mensajeros intracelulares desempeñan un papel importante en la regulación de la transducción de señales implicada en el dolor y las respuestas inflamatorias.
- ^ Liu J, Seibold SA, Rieke CJ, Song I, Cukier RI, Smith WL (junio de 2007). "Endoperóxido de prostaglandina H sintasas: especificidad de la hidroperóxido de peroxidasa y activación de la ciclooxigenasa". The Journal of Biological Chemistry . 282 (25): 18233–44. doi : 10.1074/jbc.M701235200 . PMID 17462992.
- ^ Högestätt ED, Jönsson BA, Ermund A, Andersson DA, Björk H, Alexander JP, Cravatt BF, Basbaum AI, Zygmunt PM (septiembre de 2005). "Conversión de acetaminofeno en la N-acilfenolamina bioactiva AM404 a través de la conjugación con ácido araquidónico dependiente de la amida hidrolasa de ácidos grasos en el sistema nervioso" (PDF) . The Journal of Biological Chemistry . 280 (36): 31405–12. doi : 10.1074/jbc.M501489200 . PMID 15987694. S2CID 10837155.
- ^ Nina M, Bernèche S, Roux B (2000). "Anclaje de una proteína de membrana monotópica: la unión de la prostaglandina H2 sintasa-1 a la superficie de una bicapa de fosfolípidos". Revista Europea de Biofísica . 29 (6): 439–54. doi :10.1007/PL00006649. PMID 11081405. S2CID 6317524.
- ^ P23219 , P35354 .UniProt
- ^ Kumar, V., Abbas, AK y Aster, JC (2017). Robbins Basic Pathology (10.ª ed.). Elsevier - División de Ciencias de la Salud.
- ^ Zhang Y, Mills GL, Nair MG (diciembre de 2002). "Compuestos antioxidantes e inhibidores de la ciclooxigenasa de los micelios del hongo comestible Grifola frondosa". Journal of Agricultural and Food Chemistry . 50 (26): 7581–5. doi :10.1021/jf0257648. PMID 12475274.
- ^ Zhang Y, Mills GL, Nair MG (2003). "Compuestos antioxidantes e inhibidores de la ciclooxigenasa del cuerpo fructífero de un hongo comestible, Agrocybe aegerita". Fitomedicina . 10 (5): 386–90. doi :10.1078/0944-7113-00272. PMID 12834003.
- ^ O'Leary KA, de Pascual-Teresa S, de Pascual-Tereasa S, Needs PW, Bao YP, O'Brien NM, Williamson G (julio de 2004). "Efecto de los flavonoides y la vitamina E en la transcripción de la ciclooxigenasa-2 (COX-2)". Mutation Research . 551 (1–2): 245–54. doi :10.1016/j.mrfmmm.2004.01.015. PMID 15225597.
- ^ ab Cleland LG, James MJ, Proudman SM (2006). "Aceite de pescado: lo que el médico debe saber". Arthritis Research & Therapy . 8 (1): 202. doi : 10.1186/ar1876 . PMC 1526555 . PMID 16542466.
- ^ Albert D, Zündorf I, Dingermann T, Müller WE, Steinhilber D, Werz O (diciembre de 2002). "La hiperforina es un inhibidor dual de la ciclooxigenasa-1 y la 5-lipoxigenasa". Farmacología bioquímica . 64 (12): 1767–75. doi :10.1016/s0006-2952(02)01387-4. PMID 12445866.
- ^ Moreno J, Krishnan AV, Peehl DM, Feldman D (julio-agosto de 2006). "Mecanismos de inhibición del crecimiento mediada por vitamina D en células de cáncer de próstata: inhibición de la vía de las prostaglandinas". Anticancer Research . 26 (4A): 2525–30. PMID 16886660.
- ^ Wallace JL (octubre de 2008). "Prostaglandinas, AINE y protección de la mucosa gástrica: ¿por qué el estómago no se digiere a sí mismo?". Physiological Reviews . 88 (4): 1547–65. doi :10.1152/physrev.00004.2008. PMID 18923189. S2CID 448875.
- ^ Kearney PM, Baigent C, Godwin J, Halls H, Emberson JR, Patrono C (junio de 2006). "¿Los inhibidores selectivos de la ciclooxigenasa-2 y los fármacos antiinflamatorios no esteroideos tradicionales aumentan el riesgo de aterotrombosis? Metaanálisis de ensayos aleatorizados". BMJ . 332 (7553): 1302–8. doi :10.1136/bmj.332.7553.1302. PMC 1473048 . PMID 16740558.
- ^ Nissen SE, Yeomans ND, Solomon DH, Luscher TF, Libby P, Husni ME, Graham DY, Borer JS, Wisniewski LM, Wolski KE, Qiuqing W, Menon V, Ruschitzka F, Gaffney M, Beckerman B, Berger MF, Weihang B, Lincoff AM (diciembre de 2016). "Seguridad cardiovascular de celecoxib, naproxeno o ibuprofeno para la artritis". NEJM . 375 (26). doi :10.1056/NEJMoa1611593. PMID 27959716.
- ^ Ogunwobi OO, Wang T, Zhang L, Liu C (marzo de 2012). "La ciclooxigenasa-2 y Akt median la transición epitelial-mesenquimal inducida por múltiples factores de crecimiento en el carcinoma hepatocelular humano". Revista de Gastroenterología y Hepatología . 27 (3): 566–78. doi :10.1111/j.1440-1746.2011.06980.x. PMC 3288221 . PMID 22097969.
Enlaces externos
- La proteína ciclooxigenasa
- Ciclooxigenasa en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Página de GONUTS: Ciclooxigenasa
- Ciclooxigenasa: Proteopedia, la vida en 3D
- Una discusión del mecanismo enzimático, incluyendo modelos 3D interactivos
