Di-GMP cíclico
 | |
| Nombres | |
|---|---|
| Nombre sistemático de la IUPAC ( 2R ,3R , 3aS , 7aR , 9R , 10R , 10aS , 14aR ) -2,9-Bis(2-amino-6-oxo-1,6-dihidro- 9H -purin-9-il)-3,5,10,12-tetrahidroxioctahidro- 2H , 5H , 7H , 12H - 5λ5,12λ5 - difuro [3,2- d :3′,2′- j ][1,3,7,9,2,8]tetraoxadifosfaciclododecina-5,12-diona | |
| Otros nombres Diguanilato cíclico; ácido diguanílico cíclico 3',5'; c-di-GMP; 5GP-5GP | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Araña química | |
Identificador de centro de PubChem |
|
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C20H24N10O14P2 | |
| Masa molar | 690,09 g/mol |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
El di-GMP cíclico (también llamado diguanilato cíclico y c-di- GMP ) es un segundo mensajero utilizado en la transducción de señales en una amplia variedad de bacterias . [1] No se sabe que las arqueas utilicen di-GMP cíclico , y solo se ha observado en eucariotas en Dictyostelium . [2] El papel biológico del di-GMP cíclico se descubrió por primera vez cuando se identificó como un activador alostérico de una sintasa de celulosa encontrada en Gluconacetobacter xylinus para producir celulosa microbiana . [3]
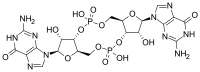
En estructura, es un ciclo que contiene sólo dos bases de guanina unidas por ribosa y fosfato .
Función
El contacto con superficies aumenta el c-di-GMP, lo que aumenta la transcripción , la traducción y la postraducción de los exopolisacáridos (EPS) y otros componentes de la matriz de sustancias poliméricas extracelulares (consulte la revisión de Jenal et al. 2017). [4] En las bacterias, ciertas señales se comunican sintetizando o degradando el di-GMP cíclico. El di-GMP cíclico es sintetizado por proteínas con actividad de diguanilato ciclasa . Estas proteínas suelen tener un motivo GGDEF característico , que se refiere a una secuencia conservada de cinco aminoácidos . La degradación del di-GMP cíclico se ve afectada por proteínas con actividad de fosfodiesterasa . Estas proteínas tienen un motivo de aminoácidos EAL o HD-GYP. Los procesos que se sabe que están regulados por el di-GMP cíclico, al menos en algunos organismos, incluyen la formación de biopelículas (como las matrices EPS encontradas por Steiner et al 2013), [4] la motilidad (especialmente la transición de móvil a sésil, consulte la revisión de Jenal et al 2017) [4] y la producción de factores de virulencia .
Regulación
Los niveles de di-GMP cíclico se regulan mediante una variedad de mecanismos. Muchas proteínas con dominios GGDEF, EAL o HD-GYP se encuentran con otros dominios que pueden recibir señales, como los dominios PAS . Se cree que las enzimas que degradan o sintetizan di-GMP cíclico están localizadas en regiones específicas de la célula, donde influyen en los receptores en un espacio restringido. [1] En Gluconacetobacter xylinus, c-di-GMP estimula la polimerización de la glucosa en celulosa como un activador alostérico de alta afinidad de la enzima celulosa sintasa. [3] Algunas enzimas diguanilato ciclasa son inhibidas alostéricamente por di-GMP cíclico.
Los niveles de di-GMP cíclico regulan otros procesos a través de varios mecanismos. La sintasa de celulosa de Gluconacetobacter xylinus es estimulada alostéricamente por el di-GMP cíclico, lo que presenta un mecanismo por el cual el di-GMP cíclico puede regular la actividad de la sintasa de celulosa. Se ha demostrado que el dominio PilZ se une al di-GMP cíclico y se cree que está involucrado en la regulación dependiente del di-GMP cíclico, pero se desconoce el mecanismo por el cual lo hace. Estudios estructurales recientes de los dominios PilZ de dos especies bacterianas han demostrado que los dominios PilZ cambian drásticamente de conformación al unirse al di-GMP cíclico. [5] [6] Esto lleva a la fuerte inferencia de que los cambios conformacionales en los dominios PilZ permiten que la actividad de las proteínas efectoras específicas (como la sintasa de celulosa) sea regulada por el di-GMP cíclico. Los riboswitches llamados riboswitch di-GMP-I cíclico y riboswitch di-GMP-II cíclico regulan la expresión genética en respuesta a concentraciones de di-GMP cíclico en una variedad de bacterias, pero no en todas las bacterias que se sabe que utilizan di-GMP cíclico.
Asociación de anfitriones
El di-GMP cíclico se ha relacionado con la asociación con el hospedador en múltiples especies de Pseudomonas . En un experimento en el que se cultivó Pseudomonas lurida en asociación con el hospedador nematodo Caenorhabditis elegans, se observaron mutaciones genéticas en ciertos genes que regulaban positivamente el c-di-GMP, lo que provocó que surgiera un morfotipo especialista en hospedador. Las mutaciones que afectan la regulación del c-di-GMP se descubrieron con la secuenciación del genoma completo. Los genes wspE y wspF del operón wsp exhibieron mutaciones que regulaban positivamente el c-di-GMP. Además, se determinó que las mutaciones en el gen rph también afectan la expresión del c-di-GMP, lo que es un descubrimiento novedoso porque el rph no se había relacionado anteriormente con la regulación del c-di-GMP. [7]
Para una revisión de las funciones de c-di-GMP en Caulobacter crescentus , Pseudomonas aeruginosa , Komagataeibacter xylinus / Gluconacetobacter xylinus , Myxococcus xanthus , Bdellovibrio bacteriovorus y Pseudomonas fluorescens, consulte Jenal et al 2017. [4]
Véase también
Referencias
- ^ ab Tamayo R, Pratt JT, Camilli A (2007). "Funciones del diguanilato cíclico en la regulación de la patogénesis bacteriana". Revisión anual de microbiología . 61 : 131–148. doi :10.1146/annurev.micro.61.080706.093426. PMC 2776827. PMID 17480182 .
- ^ Chen ZH, Schaap P (agosto de 2012). "El mensajero procariota c-di-GMP desencadena la diferenciación de células madre en Dictyostelium". Nature . 488 (7413): 680–683. Bibcode :2012Natur.488..680C. doi :10.1038/nature11313. PMC 3939355 . PMID 22864416.
- ^ ab Ross P, Weinhouse H, Aloni Y, Michaeli D, Weinberger-Ohana P, Mayer R, et al. (1987). "Regulación de la síntesis de celulosa en Acetobacter xylinum por ácido diguanílico cíclico". Nature . 325 (6101): 279–281. Bibcode :1987Natur.325..279R. doi :10.1038/325279a0. PMID 18990795. S2CID 4305512.
- ^ abcd Laventie BJ, Jenal U (septiembre de 2020). "Detección de superficies y adaptación en bacterias". Revisión anual de microbiología . 74 (1). Revisiones anuales : 735–760. doi :10.1146/annurev-micro-012120-063427. PMID 32905753. S2CID 221622525.
- ^ Benach J, Swaminathan SS, Tamayo R, Handelman SK, Folta-Stogniew E, Ramos JE, et al. (diciembre de 2007). "La base estructural de la transducción de señales de diguanilato cíclico por dominios PilZ". The EMBO Journal . 26 (24). Organización Europea de Biología Molecular: 5153–5166. doi :10.1038/sj.emboj.7601918. PMC 2140105 . PMID 18034161.
- ^ Ko J, Ryu KS, Kim H, Shin JS, Lee JO, Cheong C, et al. (abril de 2010). "La estructura de PP4397 revela la base molecular de los diferentes modos de unión de c-di-GMP por las proteínas del dominio Pilz". Journal of Molecular Biology . 398 (1): 97–110. doi :10.1016/j.jmb.2010.03.007. PMID 20226196.
- ^ Obeng N, Czerwinski A, Schütz D, Michels J, Leipert J, Bansept F, et al. (octubre de 2023). "El c-di-GMP bacteriano tiene un papel clave en el establecimiento de la simbiosis entre el huésped y el microbio". Nature Microbiology . 8 (10): 1809–1819. doi :10.1038/s41564-023-01468-x. PMC 10522488 . PMID 37653009.


