Extracción ácido-base
La extracción ácido-base es una subclase de extracciones líquido-líquido e implica la separación de especies químicas de otros compuestos ácidos o básicos . [1] Por lo general, se realiza durante el paso de procesamiento posterior a una síntesis química para purificar compuestos crudos [2] y da como resultado un producto que está prácticamente libre de impurezas ácidas o básicas. Un embudo de decantación se utiliza comúnmente para realizar una extracción ácido-base. [3]
La extracción ácido-base utiliza la diferencia de solubilidad de un compuesto en su forma ácida o básica para inducir la separación. [4] Normalmente, el compuesto deseado se transforma en su forma ácida o básica cargada, lo que hace que se vuelva soluble en solución acuosa y, por lo tanto, se extraiga de la capa no acuosa (orgánica). [5] La extracción ácido-base es una alternativa sencilla a métodos más complejos como la cromatografía . No es posible separar ácidos o bases químicamente similares utilizando este método simple. [6]
Teoría de fondo
La extracción ácido-base funciona según el principio fundamental de que las sales son compuestos iónicos con una alta solubilidad en agua, mientras que las moléculas neutras normalmente carecen de solubilidad en agua. [1]
Considere una mezcla de compuestos ácidos y básicos disueltos en un solvente orgánico . Agregar ácido acuoso hará que el componente ácido permanezca sin carga, mientras que el componente básico se protonará para formar una sal. [6] El componente ácido sin carga permanecerá disuelto en el solvente orgánico, mientras que la sal básica altamente cargada migrará al solvente acuoso. [3] Dado que los componentes ácidos y básicos ahora están en dos capas diferentes, se pueden separar fácilmente.

Alternativamente, agregar una base acuosa hará que el componente ácido se desprotone y forme una sal, mientras que el componente básico permanecerá sin carga. [6] En este caso, la base sin carga permanecerá en la capa orgánica, mientras que la sal ácida altamente cargada migrará a la capa acuosa.
Si el componente de ácido orgánico es relativamente débil y tiene un valor de pKa de ~5 (como un ácido carboxílico ), la adición de ácido adicional puede mejorar aún más la separación al reducir el pH de la solución. Esto minimiza la autoionización del componente de ácido orgánico y limita su tendencia a entrar en la capa acuosa. [6] Este principio también es aplicable a una base orgánica cuando es una base relativamente débil. [6]
Aunque las extracciones ácido-base se utilizan con mayor frecuencia para separar ácidos de bases, también se pueden utilizar para separar dos ácidos o dos bases entre sí. Sin embargo, los ácidos y las bases deben diferir mucho en fuerza, por ejemplo, un ácido fuerte y un ácido muy débil. [1] Por lo tanto, los dos ácidos deben tener una diferencia de pKa ( o pKa b ) lo más grande posible. Por ejemplo, se pueden separar los siguientes:
- Ácidos muy débiles como los fenoles (pKa alrededor de 10) y ácidos más fuertes como los ácidos carboxílicos [1] (pKa alrededor de 4-5).
- Bases muy débiles (pK b alrededor de 13-14) a partir de bases más fuertes (pK b alrededor de 3-4). Esto se utiliza con frecuencia en la purificación del suelo para determinar la concentración de metales traza. [7]
Al separar dos ácidos o dos bases, el pH se ajusta generalmente a un valor aproximado entre las constantes pK a (o pK b ). [1] La separación se produce a este pH intermedio porque un componente está completamente ionizado, mientras que el otro está completamente en su forma neutra. A menudo, las soluciones utilizadas para extraer los ácidos o bases también se pueden utilizar para controlar el pH. Al separar dos ácidos, la mezcla se lava primero con una base débil (por ejemplo, bicarbonato de sodio ) para extraer el ácido fuerte, luego se lava con una base fuerte (por ejemplo, hidróxido de sodio ) para extraer el ácido débil. [8] Para separar componentes básicos, primero se utiliza un ácido débil (por ejemplo, ácido acético diluido ) para extraer la base más fuerte, luego se utiliza un ácido más concentrado (por ejemplo, ácido clorhídrico o ácido nítrico ) para crear valores de pH fuertemente ácidos y separar la base más débil. [3] [7]
Técnica
El siguiente procedimiento se suele seguir cuando se realiza una extracción ácido-base para una mezcla que contiene un compuesto ácido y/o básico:
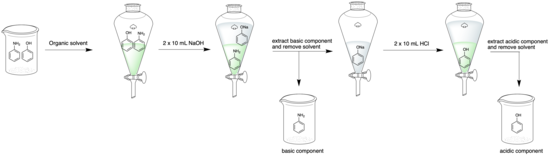
- La mezcla de compuestos se disuelve en un disolvente orgánico adecuado, como diclorometano o éter dietílico .

Ejemplo de extracción ácido-base de dos componentes: fenol ácido y fenilamina básica. Primero se recoge la fenilamina en la capa orgánica y luego se recoge el fenol de la capa acuosa. La capa verde en el embudo de decantación indica la capa orgánica, mientras que la capa incolora indica la capa acuosa. - La solución se añade a un embudo de decantación. Si el compuesto deseado es básico, la solución se lavará con ácido acuoso (por ejemplo, HCl al 5%); si es ácido, la solución se lavará con base acuosa (por ejemplo, NaOH al 5%). [9]
- Luego se agitan las fracciones y se separan las dos fases. El embudo de decantación debe purgarse con frecuencia para aliviar la acumulación de presión, especialmente cuando contiene soluciones acuosas que desprenden gas de dióxido de carbono al neutralizarse (como el bicarbonato de sodio ). [9]
- A continuación se recoge la fracción que contiene el analito de interés. Normalmente, se trata de la capa acuosa, ya que la adición de ácido o base ha provocado que el analito se cargue y sea muy soluble en la capa acuosa. [9] La identidad de la capa acuosa depende fundamentalmente de la densidad del disolvente orgánico. Los disolventes orgánicos con una densidad superior a 1,00 g/ml (por ejemplo, diclorometano) hacen que la capa acuosa flote hacia la superficie, mientras que los disolventes con una densidad inferior a 1,00 g/ml (por ejemplo, éter) hacen que la capa acuosa se hunda hasta el fondo. [9]
- La fracción orgánica se vuelve a añadir al embudo de decantación y los pasos 2 a 4 se repiten dos veces más para maximizar el rendimiento de la extracción. En el enjuague final, una solución de salmuera elimina cualquier solución acuosa restante de la capa orgánica. [10]
- Si la capa orgánica restante no contiene analitos de interés, se descarta; de lo contrario, el disolvente se seca sobre un agente secante adecuado (como sulfato de sodio anhidro ), se filtra y luego se evapora a presión reducida para obtener el compuesto puro. Si la capa acuosa contiene el analito de interés, se ajusta al pH opuesto (por ejemplo, de básico a ácido). Los pasos 1 a 4 se repiten con esta fracción utilizando una solución acuosa de pH opuesto (por ejemplo, NaOH a HCl). Este procedimiento circular se realiza ya que normalmente es mucho más fácil eliminar el disolvente orgánico mediante evaporación rotatoria que el disolvente acuoso. [11]
Usos comunes en la síntesis química
La extracción ácido-base se utiliza con frecuencia como el primer paso en un procedimiento de elaboración después de una síntesis química [2] para eliminar materiales de partida ácidos y básicos o impurezas. [3] La extracción ácido-base suele ser un precursor de técnicas de purificación más complicadas, como la recristalización , si el producto sintetizado aún no es completamente puro. [12]
La síntesis orgánica a menudo utiliza extracciones ácido-base durante los procedimientos de elaboración. Por ejemplo, considere una esterificación de Fischer : la condensación de un ácido carboxílico con un alcohol para formar un éster . La mezcla posterior a la reacción a menudo consta de pequeñas cantidades de ácido y alcohol sobrantes, además del éster deseado. [13] La extracción ácido-base se puede utilizar para separar fácilmente los materiales de partida ácidos del éster. Al enjuagar la mezcla de producto crudo con una base débil (por ejemplo, bicarbonato de sodio ), el ácido carboxílico y el alcohol se lavarán con la capa acuosa, dejando el éster purificado en la capa orgánica. [14] La elección de la base utilizada para la extracción es fundamental, ya que una base fuerte (por ejemplo, hidróxido de sodio ) hidrolizará el éster.
Otro ejemplo común de extracción ácido-base ocurre después del acoplamiento de péptidos , donde el producto amida debe separarse del ácido carboxílico y la amina sobrantes . El ácido carboxílico se puede eliminar enjuagando la capa orgánica con una base débil (bicarbonato de sodio), mientras que la amina se puede eliminar enjuagando con un ácido débil ( ácido clorhídrico al 10% ). [15] Después de estas dos extracciones, la amida permanecerá en la capa orgánica y se habrá purificado significativamente.
Solución de problemas
Los siguientes problemas se observan comúnmente durante la extracción ácido-base y generalmente tienen soluciones simples
- En el embudo de separación sólo se observa una capa.
- Esto se debe al uso de un disolvente orgánico con una miscibilidad significativa con el agua (por ejemplo, acetonitrilo ). El disolvente orgánico utilizado debe ser insoluble en agua para observar la separación de fases y realizar una extracción ácido-base. [9]
- Se forman tres capas en el embudo de separación.
- A menudo esto es el resultado de una mezcla insuficiente, y una agitación ligera resolverá el problema. [9]
- No se observa el límite entre la capa orgánica y la capa acuosa .
- El hielo se puede utilizar para identificar el límite, ya que flotará entre las dos capas. [9]
- Se forma una emulsión y una capa queda suspendida en la otra en forma de pequeñas gotas.
- Esto se puede solucionar utilizando una varilla de vidrio para "empujar" suavemente las gotitas entre sí, lo que finalmente provoca la separación y hace que aparezcan las dos capas. También se puede utilizar una pequeña cantidad de solución de salmuera para romper la emulsión; este proceso se denomina "salificación". [16] Las emulsiones se pueden evitar mezclando las soluciones con suavidad en lugar de hacerlo con fuerza.
- Se desconocen las posiciones relativas de las capas acuosas/orgánicas.
- Se puede añadir una pequeña cantidad de agua al embudo de decantación. La capa en la que se depositen estas gotitas se denomina capa acuosa. [17]
Limitaciones
La extracción ácido-base es eficaz para separar compuestos con una gran diferencia de solubilidad entre su forma cargada y su forma no cargada. [4] Por lo tanto, este procedimiento no funcionará para:
- Zwitteriones con grupos funcionales ácidos y básicos en la misma molécula.
- Por ejemplo, la glicina es soluble en agua en la mayoría de los valores de pH [18] y, por lo tanto, es difícil de extraer en medios orgánicos.
- Compuestos lipofílicos .
- Los compuestos como las sales de tetrabutilamonio o los ácidos grasos no se disuelven fácilmente en la fase acuosa en su forma cargada. [19]
- Aminas básicas.
- Las aminas como el amoníaco , la metilamina o la trietanolamina son miscibles o significativamente solubles en agua a la mayoría de los pH y no se pueden extraer en medios orgánicos. [20]
- Ácidos inorgánicos hidrofílicos.
- Los ácidos como el ácido acético son indefinidamente miscibles en agua y tienen una solubilidad limitada en disolventes orgánicos. [21]
Alternativas
Las alternativas a la extracción ácido-base incluyen:
- Filtrar la mezcla a través de un tapón de gel de sílice o alúmina : si el producto es una sal cargada, permanecerá fuertemente adsorbida al gel de sílice o alúmina. [22]
- La cromatografía de intercambio iónico puede separar ácidos, bases o mezclas de ácidos y bases fuertes y débiles por sus diferentes afinidades con el medio de la columna a diferentes pH. [23]
- Utilizando cromatografía en columna para separar los compuestos neutros según sus valores de relación de frentes. [24]
- Electroforesis en gel , que separa biomoléculas grandes en función de su carga y tamaño. [25]
Véase también
Referencias
- ^ abcde «Extracción ácido-base». Chemistry LibreTexts . 2013-10-03 . Consultado el 2022-10-23 .
- ^ ab Xu, Bo; Hammond, Gerald B. (17 de octubre de 2014). "Elaboración rápida de reacciones químicas basada en una extracción con disolventes rígidos". Organic Letters . 16 (20): 5238–5241. doi :10.1021/ol501418t. ISSN 1523-7052. PMID 25296390.
- ^ abcd "Extracción en teoría y práctica (parte I)". www.chem.ucla.edu . Consultado el 11 de octubre de 2022 .
- ^ ab Assadieskandar, Amir; Rezende Miranda, Renata; Broyer, Rebecca M. (12 de mayo de 2020). "Seguimiento visual de extracciones ácido-base utilizando compuestos coloridos". Revista de educación química . 97 (5): 1402–1405. Código bibliográfico :2020JChEd..97.1402A. doi :10.1021/acs.jchemed.0c00196. ISSN 0021-9584. S2CID 219025790.
- ^ "7.5: Soluciones acuosas y solubilidad - Compuestos disueltos en agua". Chemistry LibreTexts . 2019-07-01 . Consultado el 2022-10-22 .
- ^ abcde Cooper, Raymond; Deakin, Jeffrey John (2016). Milagros botánicos: la química de las plantas que cambiaron el mundo . CRC Press. pág. 125. ISBN 9780367076214.
- ^ ab Falandysz, Jerzy; Chudzyński, Krzysztof; Kojta, Anna K.; Jarzyńska, Grażyna; Drewnowska, Małgorzata (1 de septiembre de 2012). "Comparación de dos métodos de extracción ácida para la determinación de minerales en suelos debajo del Bolete de alerce (Suillus grevillei) y con el objetivo de estimar el potencial de secuestro de minerales en cuerpos fructíferos". Revista de Ciencias Ambientales y Salud, Parte A. 47 ( 11): 1607–1613. doi :10.1080/10934529.2012.680781. ISSN 1093-4529. PMID 22702820. S2CID 24133083.
- ^ Kilway, Kathleen; Clevenger, Robert (2006). "Extracción" (PDF) . Universidad de Missouri - Kansas City .
- ^ abcdefg "Extracción en teoría y práctica (parte I)". www.chem.ucla.edu . Consultado el 11 de octubre de 2022 .
- ^ "Consejos y trucos de química médica » Portal de la mesa redonda farmacéutica de ACS GCI" . Consultado el 17 de octubre de 2022 .
- ^ "Índice de /mcdaniel/chem269/experiments/acidbase". people.chem.umass.edu . Consultado el 17 de octubre de 2022 .
- ^ Jasperse, Craig. "Extracciones líquido-líquido" (PDF) . Universidad Estatal de Minnesota .
- ^ "Extracción ácido-base". Chemistry LibreTexts . 2013-10-03 . Consultado el 2022-10-23 .
- ^ Kam, Caleb MT; Levonis, Stephan M.; Schweiker, Stephanie S. (14 de julio de 2020). "Una reacción de química orgánica visual: la síntesis del éster metílico del ácido 4-amino-3-nitrobenzoico mediante esterificación de Fischer". Revista de educación química . 97 (7): 1997–2000. Código Bibliográfico :2020JChEd..97.1997K. doi :10.1021/acs.jchemed.9b01168. ISSN 0021-9584. S2CID 225653198.
- ^ "Reactivos de acoplamiento" (PDF) . Universidad de París-Salay .
- ^ "Extracción en teoría y práctica (parte I)". www.chem.ucla.edu . Consultado el 11 de octubre de 2022 .
- ^ "4.4: ¿Qué capa es cuál?". Chemistry LibreTexts . 2017-10-21 . Consultado el 2022-10-23 .
- ^ Yang, Xia; Wang, Xiujuan; Ching, Chi Bun (1 de mayo de 2008). "Solubilidad de la forma α y la forma γ de la glicina en soluciones acuosas". Journal of Chemical & Engineering Data . 53 (5): 1133–1137. doi :10.1021/je7006988. ISSN 0021-9568.
- ^ "Lipofilia: una descripción general | Temas de ScienceDirect" www.sciencedirect.com . Consultado el 23 de octubre de 2022 .
- ^ PubChem. "Triethylamine". pubchem.ncbi.nlm.nih.gov . Consultado el 23 de octubre de 2022 .
- ^ PubChem. «Ácido acético». pubchem.ncbi.nlm.nih.gov . Consultado el 23 de octubre de 2022 .
- ^ "Procedimiento de síntesis orgánica". orgsyn.org . Consultado el 23 de octubre de 2022 .
- ^ Kunin, Robert; McGarvey, FX (1 de abril de 1962). "Cromatografía de intercambio iónico". Química analítica . 34 (5): 48R–50r. doi :10.1021/ac60185a005. ISSN 0003-2700.
- ^ "Cromatografía", ACS Reagent Chemicals , Washington, DC: American Chemical Society, enero de 2017, doi :10.1021/acsreagents.2007, ISBN 978-0-8412-3046-0, consultado el 23 de octubre de 2022
- ^ Boots, Sharon (15 de abril de 1989). "Electroforesis en gel de ADN". Química analítica . 61 (8): 551A–553A. doi :10.1021/ac00183a002. ISSN 0003-2700. PMID 2719273.
Enlaces externos
- Extracción ácido-base Archivado el 3 de marzo de 2016 en Wayback Machine.