Triquinosis
| Triquinosis | |
|---|---|
| Otros nombres | Triquinelosis, triquiniasis |
 | |
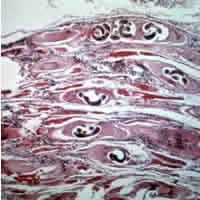
| Larvas de triquina en carne de oso prensada, parcialmente digerida con pepsina . Se observa la clásica forma espiral. | |
| Especialidad | Enfermedad infecciosa |
| Síntomas | Inicialmente : diarrea , dolor abdominal , vómitos [1] Más tarde : hinchazón de la cara, inflamación de la parte blanca de los ojos , fiebre , dolores musculares , erupción cutánea [1] |
| Complicaciones | Inflamación del músculo cardíaco , inflamación de los pulmones [1] |
| Causas | Trichinella por comer carne poco cocida [1] |
| Método de diagnóstico | Anticuerpos en la sangre , larvas en la biopsia de tejido [1] |
| Diagnóstico diferencial | Sarampión , dermatomiositis , gastroenteritis [2] |
| Prevención | Cocinar la carne por completo [3] |
| Medicamento | Albendazol , mebendazol [4] |
| Pronóstico | Bajo riesgo de muerte [5] |
| Frecuencia | ~10.000 casos al año [6] |
La triquinosis , también conocida como triquinelosis , es una enfermedad parasitaria causada por gusanos redondos del género Trichinella . [1] Durante la infección inicial, la invasión de los intestinos puede provocar diarrea , dolor abdominal y vómitos . [1] La migración de larvas al músculo, que ocurre aproximadamente una semana después de ser infectada, puede causar hinchazón de la cara, inflamación de la parte blanca de los ojos , fiebre , dolores musculares y sarpullido . [1] Una infección menor puede no presentar síntomas . [1] Las complicaciones pueden incluir inflamación del músculo cardíaco , afectación del sistema nervioso central e inflamación de los pulmones . [1]
La triquinosis se propaga principalmente cuando se come carne poco cocida que contiene quistes de Trichinella . [1] En América del Norte, la infección más frecuente es el oso, pero también puede producirse a partir de carne de cerdo, jabalí y perro. [7] Varias especies de Trichinella pueden causar enfermedades, siendo T. spiralis la más común. [1] Después de comer la carne infectada, las larvas se liberan de sus quistes en el estómago. [1] Luego invaden la pared del intestino delgado , donde se convierten en gusanos adultos. [1] Después de una semana, las hembras liberan nuevas larvas que migran a músculos controlados voluntariamente , donde forman quistes. [1] El diagnóstico generalmente se basa en los síntomas y se confirma al encontrar anticuerpos específicos en la sangre o larvas en una biopsia de tejido . [1]
La mejor manera de prevenir la triquinosis es cocinar completamente la carne. [3] Un termómetro para alimentos puede verificar que la temperatura dentro de la carne sea lo suficientemente alta. [3] La infección generalmente se trata con medicamentos antiparasitarios como albendazol o mebendazol . [4] El tratamiento rápido puede matar a los gusanos adultos y, por lo tanto, detener el empeoramiento de los síntomas. [4] Ambos medicamentos se consideran seguros, pero se han asociado con efectos secundarios como la supresión de la médula ósea . [4] Su uso durante el embarazo o en niños menores de 2 años está poco estudiado, pero parece ser seguro. [4] A veces también se requiere tratamiento con esteroides en casos graves. [4] Sin tratamiento, los síntomas generalmente se resuelven en tres meses. [5]
En todo el mundo, se producen alrededor de 10.000 infecciones al año. [6] Al menos 55 países, incluidos Estados Unidos, China, Argentina y Rusia, han tenido casos documentados recientemente. [5] Si bien la enfermedad se presenta en los trópicos, es menos común allí. [5] Las tasas de triquinosis en los Estados Unidos han disminuido de aproximadamente 400 casos por año en la década de 1940 a 20 o menos por año en la década de 2000. [6] [8] El riesgo de muerte por infección es bajo. [5]
Signos y síntomas
La gran mayoría de las infecciones por triquinosis presentan síntomas leves o nulos y no presentan complicaciones. [9] Las dos fases principales de la infección son la enteral (que afecta a los intestinos) y la parenteral (fuera de los intestinos). Los síntomas varían según la fase, la especie de Trichinella , la cantidad de larvas enquistadas ingeridas, la edad, el sexo y la inmunidad del huésped. [10]
Fase enteral
Una gran carga de gusanos adultos en los intestinos promueve síntomas como náuseas , acidez estomacal , dispepsia y diarrea de dos a siete días después de la infección, mientras que las cargas de gusanos pequeños generalmente son asintomáticas. La eosinofilia se presenta tempranamente y aumenta rápidamente. [11]
Fase parenteral
La gravedad de los síntomas causados por la migración de larvas desde los intestinos depende de la cantidad de larvas producidas. A medida que las larvas migran a través de los tejidos y los vasos, la respuesta inflamatoria del cuerpo produce edema , dolor muscular, fiebre y debilidad. Un signo clásico de triquinosis es el edema periorbitario , hinchazón alrededor de los ojos, que puede ser causado por vasculitis . La hemorragia en astilla en las uñas también es un síntoma común. [12]
En muy raras ocasiones, pueden causar suficiente daño como para producir déficits neurológicos graves (como ataxia o parálisis respiratoria ) debido a que los gusanos ingresan al sistema nervioso central (SNC), que se ve comprometido por la triquinosis en el 10-24% de los casos notificados de trombosis de los senos venosos cerebrales , una forma muy rara de accidente cerebrovascular (tres o cuatro casos por millón de incidencia anual en adultos). [13] La triquinosis puede ser fatal dependiendo de la gravedad de la infección; la muerte puede ocurrir entre 4 y 6 semanas después de la infección, [14] y generalmente es causada por miocarditis , encefalitis o neumonía . [15]
Causa

El agente clásico es T. spiralis (que se encuentra en todo el mundo en muchos animales carnívoros y omnívoros, tanto domésticos como silvestres ), [ cita requerida ] pero ahora también se reconocen siete especies principalmente silvestres de Trichinella :
Especies y características
- T. spiralis está más adaptada a los cerdos, es más patógena en los humanos y tiene una distribución cosmopolita. [ cita requerida ]
- T. britovi es la segunda especie más común que infecta a los humanos; se distribuye por toda Europa, Asia y el norte y oeste de África, generalmente en carnívoros salvajes, cocodrilos, aves, jabalíes y cerdos domésticos. [ cita requerida ]
- T. murrelli también infecta a los humanos, especialmente a través de la carne de oso negro; se distribuye entre carnívoros salvajes en América del Norte. [16]
- T. nativa , que tiene una alta resistencia a la congelación, se encuentra en las regiones árticas y subárticas; los huéspedes reservorios incluyen osos polares, zorros árticos, morsas y otros animales salvajes. [17]
- Se ha documentado que T. nelsoni , presente en depredadores y carroñeros del este de África, causa algunos casos humanos.
- T. papuae infecta tanto a mamíferos como a reptiles, incluidos cocodrilos, humanos y cerdos salvajes y domésticos; esta especie, que se encuentra en Papúa Nueva Guinea y Tailandia, tampoco está encapsulada. [18]
- T. pseudospiralis infecta aves y mamíferos, y se ha demostrado que produce infección en humanos; [19] es una especie no encapsulada.
- T. zimbabwensis puede infectar a mamíferos y posiblemente a humanos; esta especie no encapsulada fue detectada en cocodrilos en África. [1]
Taxonomía
- Reino: Animalia
- Filo: Nematoda
- Clase: Adenofórea
- Orden: Trichurida
- Familia: Trichinellidae
- Género: Trichinella
Ciclo vital

El ciclo de vida típico de T. spiralis involucra a humanos, cerdos y roedores. Un cerdo se infecta cuando come quistes infecciosos en carne cruda, a menudo carroña porcina o una rata ( ciclo selvático ). Un humano se infecta al consumir carne de cerdo infectada cruda o poco cocida (ciclo doméstico). En el estómago, los quistes de la carne poco cocida infectada son activados por la pepsina y el ácido clorhídrico , que ayudan a liberar las larvas de los quistes hacia el estómago . [10] Las larvas luego migran al intestino delgado y excavan en la mucosa intestinal , donde mudan cuatro veces antes de convertirse en adultas. [10]
Entre treinta y treinta y cuatro horas después de la ingestión original de los quistes, los adultos se aparean y en cinco días producen larvas. [10] Los gusanos adultos solo pueden reproducirse durante un tiempo limitado, porque el sistema inmunológico finalmente los expulsa del intestino delgado. [10] Las larvas luego usan su pieza bucal perforante, llamada "estilete", para atravesar la mucosa intestinal y entrar en los vasos linfáticos , y luego ingresar al torrente sanguíneo . [20]
Las larvas viajan por capilares a varios órganos, como la retina , el miocardio o los ganglios linfáticos ; sin embargo, solo las larvas que migran a las células del músculo esquelético sobreviven y se enquistan . [14] La célula huésped larvaria se convierte en una célula nodriza , en la que la larva quedará encapsulada, potencialmente durante la vida del huésped, a la espera de que este sea comido. El desarrollo de una red capilar alrededor de la célula nodriza completa la enquistación de la larva. La triquinosis no se transmite por el suelo, ya que el parásito no pone huevos, ni puede sobrevivir mucho tiempo fuera de un huésped. [5] [21]
Diagnóstico
El diagnóstico de triquinosis se confirma mediante una combinación de antecedentes de exposición, diagnóstico clínico y pruebas de laboratorio. [ cita requerida ]
Historial de exposición
Se puede realizar una investigación epidemiológica para determinar la exposición de un paciente a carne cruda infectada. A menudo, la infección surge de la preparación casera de carne contaminada, en cuyo caso se puede utilizar la microscopía de la carne para determinar la infección. La determinación de la exposición no tiene que ser directa a partir de un animal infectado confirmado en laboratorio. Los criterios de exposición indirecta incluyen el consumo de productos de un animal infectado confirmado en laboratorio o compartir una exposición común con un humano infectado confirmado en laboratorio. [14]
Diagnóstico clínico
La presentación clínica de los síntomas comunes de la triquinosis también puede sugerir una infección. Estos síntomas incluyen hinchazón ocular, hemorragia en astilla , gastroenteritis inespecífica y dolor muscular. [14] La definición de caso de triquinosis del Centro Europeo para el Control de Enfermedades establece: "al menos tres de los siguientes seis: fiebre , dolor y molestias musculares, síntomas gastrointestinales , edema facial , eosinofilia y hemorragias subconjuntivales, subungueales y retinianas ". [14]
Pruebas de laboratorio
Los análisis de sangre y la microscopía pueden ayudar al diagnóstico de la triquinosis. Los análisis de sangre incluyen un hemograma completo para detectar eosinofilia, actividad de la creatina fosfoquinasa y varios inmunoensayos como la prueba ELISA para detectar antígenos larvarios. [14]
Prevención
Legislación
Las leyes y normas para los productores de alimentos pueden mejorar la seguridad alimentaria para los consumidores, como las normas establecidas por la Comisión Europea para las inspecciones, el control de roedores y la mejora de la higiene. [14] Existe un protocolo similar en los Estados Unidos, en las directrices del USDA para las responsabilidades de las granjas y los mataderos en la inspección de la carne de cerdo. [22]
Educación y formación
La educación pública sobre los peligros de consumir carne cruda o poco cocida, especialmente de cerdo, puede reducir las tasas de infección. Los cazadores también son una población en riesgo debido a su contacto y consumo de animales salvajes, incluido el oso. Por ello, muchos estados, como Nueva York, exigen la realización de un curso sobre estas cuestiones antes de poder obtener una licencia de caza. [23]
Prueba de carne
Existen métodos de prueba tanto para cadáveres individuales como para el seguimiento de los rebaños. [24] El método de digestión artificial se utiliza generalmente para la prueba de cadáveres individuales, mientras que la prueba de anticuerpos específicos se utiliza generalmente para el seguimiento del rebaño. [24]
Preparación de alimentos
Las larvas pueden morir mediante el calentamiento o la irradiación de la carne cruda. La congelación normalmente sólo es eficaz para T. spiralis , ya que otras especies, como T. nativa , son resistentes a la congelación y pueden sobrevivir a la congelación a largo plazo. [14]
- Toda carne (incluida la de cerdo) se puede preparar de forma segura cocinándola a una temperatura interna de 165 °F (74 °C) o más durante 15 segundos o más. [ cita requerida ]
- Caza silvestre: La carne de caza silvestre debe cocinarse completamente (ver preparación de la carne más arriba). La congelación de la carne de caza silvestre no mata todas las larvas de los gusanos causantes de la triquinosis, porque las especies de gusanos que normalmente infestan la carne de caza silvestre pueden resistir la congelación. [ cita requerida ]
- Cerdo : congelar cortes de carne de cerdo de menos de 6 pulgadas de grosor durante 20 días a 5 °F (−15 °C) o tres días a −4 °F (−20 °C) mata las larvas de gusanos T. spiralis ; pero esto no matará otras especies de larvas de gusanos causantes de triquinosis, como T. nativa , si han infestado el suministro de alimentos para cerdos (lo cual es poco probable, debido a la geografía). [ cita requerida ]
La carne de cerdo se puede cocinar de forma segura a una temperatura ligeramente inferior, siempre que la temperatura interna de la carne sea al menos tan alta como la indicada en la tabla del USDA que aparece a continuación. [25] No obstante, es prudente permitir un margen de error para la variación de la temperatura interna dentro de un corte particular de cerdo, que puede tener huesos que afecten la uniformidad de la temperatura. Además, los termómetros de cocina tienen un margen de error de medición que debe tenerse en cuenta. La carne de cerdo se puede cocinar durante mucho más tiempo y a una temperatura interna uniforme más alta que la que se indica a continuación para que sea segura. [26]
| Temperatura interna | Temperatura interna | Tiempo mínimo |
|---|---|---|
| (° F ) | (° C ) | (minutos) |
| 120 | 49 | 1260 |
| 122 | 50.0 | 570 |
| 124 | 51.1 | 270 |
| 126 | 52.2 | 120 |
| 128 | 53.4 | 60 |
| 130 | 54.5 | 30 |
| 132 | 55.6 | 15 |
| 134 | 56,7 | 6 |
| 136 | 57.8 | 3 |
| 138 | 58,9 | 2 |
| 140 | 60.0 | 1 |
| 142 | 61.1 | 1 |
| 144 | 62.2 | Instante |
[25]
Los métodos inseguros y poco confiables para cocinar carne incluyen el uso de hornos microondas, el curado, el secado y el ahumado, ya que estos métodos son difíciles de estandarizar y controlar. [14]
Cría de cerdos
La incidencia de la infección se puede reducir mediante: [ cita requerida ]
- Mantener a los cerdos en corrales limpios, con pisos que se puedan lavar (como el concreto)
- No permitir que los cerdos coman cadáveres de otros animales, incluidas ratas, que pueden estar infectadas con Trichinella
- Cómo limpiar a fondo las picadoras de carne al preparar carnes picadas
- Control y destrucción de carne que contenga triquinas, por ejemplo, eliminación y eliminación adecuada de diafragmas porcinos antes de la venta pública de carne
Los Centros para el Control y la Prevención de Enfermedades de Estados Unidos hacen la siguiente recomendación: "Curar (salar), secar, ahumar o cocinar en microondas la carne no mata de manera consistente los gusanos infecciosos". [27] Sin embargo, en condiciones controladas de procesamiento comercial de alimentos, el USDA considera que algunos de estos métodos son efectivos. [28]
El Servicio de Inspección de Sanidad Animal y Vegetal (APHIS) del Departamento de Agricultura de los Estados Unidos (USDA) es responsable de las normas relativas a la importación de cerdos de países extranjeros. La sección Carne y productos cárnicos de origen extranjero, porcinos, cubre la carne de cerdo (cocida, curada y seca, y fresca). El APHIS desarrolló el Programa Nacional de Certificación de Triquinas; se trata de un programa voluntario "previo a la cosecha" para los productores de cerdos de los Estados Unidos "que proporcionará documentación de las prácticas de manejo de los cerdos" para reducir la incidencia de Trichinella en los cerdos. [29] Los CDC informan que el 0,013% de los cerdos de los Estados Unidos están infectados con Trichinella . [29]
Tratamiento
Como ocurre con la mayoría de las enfermedades, el tratamiento temprano es mejor y reduce el riesgo de desarrollar la enfermedad. Si las larvas se enquistan en las células del músculo esquelético, pueden seguir siendo infecciosas durante meses o años. [14]
Tratamiento primario
La administración temprana de antihelmínticos , como mebendazol o albendazol , disminuye la probabilidad de enquistamiento larvario, en particular si se administran dentro de los tres días posteriores a la infección. [12] Sin embargo, la mayoría de los casos se diagnostican después de este tiempo. [14] En humanos, se administra mebendazol (200–400 mg tres veces al día durante tres días) o albendazol (400 mg dos veces al día durante 8–14 días) para tratar la triquinosis. [30] Estos medicamentos evitan que las larvas recién nacidas se desarrollen, pero no deben administrarse a mujeres embarazadas ni a niños menores de dos años. [10]
Las referencias médicas de la década de 1940 no describían ningún tratamiento específico para la triquinosis en ese momento, pero se descubrió que la inyección intravenosa de sales de calcio era útil para controlar los síntomas relacionados con la toxemia grave de la infección. [31]
Tratamiento secundario
Después de la infección, se pueden utilizar esteroides , como la prednisona , para aliviar el dolor muscular asociado con la migración de las larvas. [ cita requerida ]
Investigación de vacunas
Los investigadores que intentan desarrollar una vacuna contra la Trichinella han intentado utilizar "extractos larvarios, antígeno excretor-secretor, ADN o proteína antigénica recombinante". [32] Actualmente, no hay ninguna vacuna comercializable disponible para la triquinosis, pero estudios experimentales con ratones han sugerido posibilidades.
- En un estudio, se utilizaron larvas de Trichinella calentadas en microondas para inmunizar ratones (por vía oral o intraperitoneal ), que posteriormente se infectaron. Según la dosis y la frecuencia de la inmunización, los resultados variaron desde una disminución del recuento de larvas hasta una protección completa contra la triquinosis. [33]
- Otro estudio [34] utilizó extractos y productos excretores-secretores de larvas de primera etapa para producir una vacuna oral. [35] Para evitar que los ácidos gástricos disolvieran los antígenos antes de llegar al intestino delgado, los científicos encapsularon los antígenos en microcápsulas. Esta vacuna aumentó significativamente los niveles de células CD4+ y aumentó la IgGq y la IgA séricas específicas del antígeno, lo que resultó en una reducción estadísticamente significativa en el número promedio de gusanos adultos en el intestino delgado de ratones. La importancia de este enfoque es que, si los glóbulos blancos en el intestino delgado han sido expuestos a antígenos de Trichinella (a través de la vacunación), cuando un individuo se infecta, el sistema inmunológico responderá para expulsar los gusanos del intestino delgado lo suficientemente rápido para evitar que los gusanos hembra liberen sus larvas. [ cita requerida ]
- Una vacuna de ADN probada en ratones “indujo una reducción de la carga de larvas musculares en ratones BALB/c del 29% en respuesta a la infección por T. spiralis ”. [32]
Epidemiología
_with_inadequate_labelling.tif/lossy-page1-440px-Parasite160031-fig1_Figatelli_(pork_sausages)_with_inadequate_labelling.tif.jpg)
Alrededor de 11 millones de humanos están infectados con Trichinella ; T. spiralis es la especie responsable de la mayoría de estas infecciones. [36] La infección alguna vez fue muy común, pero esta enfermedad ahora es rara en el mundo desarrollado , pero dos brotes conocidos ocurrieron en 2015. En el primer brote, alrededor de 40 personas se infectaron en Liguria, Italia, durante una celebración de Nochevieja. [37] [38] El segundo brote en Francia se asoció con salchichas de cerdo de Córcega , que se comieron crudas, afectando a 14 personas en total. [39] La incidencia de triquinosis en los EE. UU. Ha disminuido drásticamente en el último siglo de un promedio de 400 casos por año a mediados del siglo XX a un promedio anual de 20 casos por año (2008-10). [8] El número de casos ha disminuido debido a la legislación que prohíbe alimentar a los cerdos con basura de carne cruda, el aumento de la congelación comercial y doméstica de carne de cerdo y la conciencia pública del peligro de comer productos de cerdo crudos o poco cocidos. [40]
China reporta alrededor de 10.000 casos cada año, por lo que es el país con el mayor número de casos. [14] [ dudoso – discutir ] En China, entre 1964 y 1998, más de 20.000 personas se infectaron con triquinosis y más de 200 personas murieron. [32]
La triquinosis es común en los países en desarrollo donde la carne que se da a los cerdos es cruda o poco cocida, pero las infecciones también surgen en los países desarrollados de Europa donde la carne cruda o poco cocida de cerdo, jabalí y caballo puede consumirse como manjares. [14]
En el mundo en desarrollo , la mayoría de las infecciones están asociadas con carne de cerdo poco cocida. Por ejemplo, en Tailandia , se informan entre 200 y 600 casos al año en torno al Año Nuevo tailandés . Esto se debe principalmente a un manjar particular, el larb , que requiere carne de cerdo poco cocida como parte de la receta. [ cita requerida ]
En algunas partes de Europa del Este, según informa la Organización Mundial de la Salud , algunas piaras de cerdos tienen tasas de infección por triquinosis superiores al 50%, con un número correspondientemente elevado de infecciones humanas. [41]
Estados Unidos
Históricamente, se pensaba que los productos de cerdo presentaban el mayor riesgo de infectar a los humanos con T. spiralis . Sin embargo, una vigilancia de la triquinosis realizada entre 1997 y 2001 mostró un mayor porcentaje de casos causados por el consumo de animales salvajes (el ciclo de transmisión selvático). Se cree que esto se debe a la Ley Federal de Protección de la Salud Porcina (Ley Pública 96-468) que fue aprobada por el Congreso en 1980. Antes de esta ley, los cerdos eran alimentados con basura que potencialmente podría estar infectada por T. spiralis . Esta ley se puso en marcha para evitar que se diera a los cerdos alimentos contaminados con triquinela. Además, se establecieron otros requisitos, como el control de roedores, la limitación del contacto de los cerdos comerciales con la fauna silvestre, el mantenimiento de una buena higiene y la retirada inmediata de los cerdos muertos de los corrales. [42]
Entre 2002 y 2007, se notificaron a los CDC 11 casos de triquinosis en promedio por año en los Estados Unidos, y entre 2008 y 2010 hubo un promedio de 20 casos por año; [8] estos fueron en su mayoría el resultado del consumo de carne de caza poco cocida (transmisión selvática) o de cerdos criados en casa (transmisión doméstica). [ cita requerida ]
Grupos religiosos
Las leyes alimentarias kashrut y halal del judaísmo y el islam prohíben el consumo de carne de cerdo. En el siglo XIX, cuando se estableció por primera vez la asociación entre la triquinosis y la carne de cerdo poco cocida, se sugirió que esta asociación era la razón de la prohibición, lo que recuerda la opinión anterior del filósofo judío medieval Maimónides de que los alimentos prohibidos por la ley judía eran "insalubres". Esta teoría fue controvertida y finalmente cayó en desgracia. [43]
Resurgimiento
La desaparición del patógeno de los cerdos domésticos ha llevado a una relajación de la legislación y de los esfuerzos de control por parte de los sistemas de salud pública veterinaria. Últimamente se ha considerado a la triquinosis como una zoonosis reemergente , complementada por la mayor distribución de productos cárnicos, cambios políticos, un clima cambiante y una transmisión selvática cada vez mayor . [44]
Los grandes cambios sociopolíticos pueden generar condiciones que favorezcan el resurgimiento de las infecciones por Trichinella en los cerdos y, en consecuencia, en los seres humanos. Por ejemplo, "el derrocamiento de las estructuras sociales y políticas en la década de 1990" en Rumania provocó un aumento de la tasa de incidencia de la triquinosis. [45]
Historia
Ya en 1835 se sabía que la triquinosis era causada por un parásito, pero el mecanismo de infección no estaba claro en ese momento. Una década después, el científico estadounidense Joseph Leidy señaló que la carne poco cocida era el vector principal del parásito y dos décadas después, esta hipótesis fue plenamente aceptada por la comunidad científica. [46]
Parásito
Las circunstancias que rodearon la primera observación e identificación de T. spiralis son controvertidas, debido a la falta de registros. En 1835, James Paget , un estudiante de medicina de primer año, observó por primera vez la forma larvaria de T. spiralis , mientras presenciaba una autopsia en el Hospital St. Bartholomew de Londres. Paget se interesó especialmente en la presentación del músculo con motas blancas, descrito como un "diafragma arenoso". Aunque es muy probable que Paget sea la primera persona en haber notado y registrado estos hallazgos, el parásito fue nombrado y publicado en un informe por su profesor, Richard Owen , a quien ahora se le atribuye el descubrimiento de la forma larvaria de T. spiralis . [20] [47]
Ciclo vital
Una serie de experimentos realizados entre 1850 y 1870 por los investigadores alemanes Rudolf Virchow , Rudolf Leuckart y Friedrich Albert von Zenker , que implicaron alimentar a un perro con carne infectada y realizar la necropsia posterior, condujeron al descubrimiento del ciclo de vida de Trichinella . A través de estos experimentos, Virchow pudo describir el desarrollo y la infectividad de T. spiralis . [48]
Investigación
La Comisión Internacional sobre Triquinelosis (ICT) se formó en Budapest en 1958. Su misión es intercambiar información sobre la epidemiología, biología, fisiopatología, inmunología y aspectos clínicos de la triquinosis en humanos y animales. La prevención es un objetivo primordial. Desde la creación de la ICT, sus miembros (más de 110 de 46 países) se han reunido regularmente y han trabajado juntos durante reuniones celebradas cada cuatro años: la Conferencia Internacional sobre Triquinelosis . [ cita requerida ]
Véase también
Referencias
- ^ abcdefghijklmnopq «CDC – DPDx – Triquinelosis – índice». www.cdc.gov . Archivado desde el original el 4 de julio de 2015. Consultado el 19 de julio de 2015 .
- ^ Ferri FF (2010). "Capítulo T". Diagnóstico diferencial de Ferri: una guía práctica para el diagnóstico diferencial de síntomas, signos y trastornos clínicos (2.ª ed.). Filadelfia, PA: Elsevier/Mosby. ISBN 978-0323076999.
- ^ abc "CDC – Triquinelosis – Prevención y control". www.cdc.gov . Archivado desde el original el 24 de septiembre de 2015 . Consultado el 25 de julio de 2015 .
- ^ abcdef "CDC – DPDx – Triquinelosis – Información sobre el tratamiento" www.cdc.gov . Archivado desde el original el 22 de agosto de 2015 . Consultado el 25 de julio de 2015 .
- ^ abcdef Farrar J (2013). Enfermedades tropicales de Manson (23.ª ed.). Filadelfia: Saunders [Imprenta]. pp. 791–94. ISBN 978-0-7020-5101-2.
- ^ abc "Triquinelosis Fact Sheet – Division of Parasitic Diseases". Centro para el Control de Enfermedades, Gobierno de EE. UU. Agosto de 2012. Archivado desde el original el 22 de mayo de 2016. Consultado el 5 de junio de 2016. Durante el período 2008-2010 ,
se notificaron 20 casos al CDC por año en promedio.
- ^ Cook GC, Zumla A (2009). Enfermedades tropicales de Manson. Elsevier Health Sciences. pág. 325. ISBN 978-1416044703.
- ^ abc "Epidemiología y factores de riesgo de la triquinelosis". Archivado desde el original el 20 de diciembre de 2010. Consultado el 6 de marzo de 2020. Durante el período 2002-2007 ,
se notificaron 11 casos al CDC por año en promedio.
- ^ "11 síntomas de triquinosis, transmisión, tratamiento, ciclo de vida y cura". Archivado desde el original el 18 de diciembre de 2008. Consultado el 25 de diciembre de 2008 .
- ^ abcdef Capo, V., Despommier, DD (1996). "Aspectos clínicos de la infección por Trichinella spp." Clinical Microbiology Reviews . 9 (1): 47–54. doi :10.1128/cmr.9.1.47. PMC 172881 . PMID 8665476.
- ^ Bruschi F, Murrell KD (2002). "Nuevos aspectos de la triquinelosis humana: el impacto de las nuevas especies de Trichinella". Revista Médica de Postgrado . 78 (915): 15–22. doi :10.1136/pmj.78.915.15. PMC 1742236 . PMID 11796866.
- ^ de John D. y William A. Petri. Parasitología médica de Markell y Voge. Novena edición. Filadelfia: Saunders, 2006.
- ^ Evans RW, Patter BM (1982). "Triquinosis asociada con trombosis del seno sagital superior". Anales de neurología . 11 (2): 216–17. doi :10.1002/ana.410110225. PMID 7073258. S2CID 32598996.
- ^ abcdefghijklm Gottstein B, et al. (2009). "Epidemiología, diagnóstico, tratamiento y control de la triquinelosis". Clinical Microbiology Reviews . 22 (1): 127–45. doi :10.1128/cmr.00026-08. PMC 2620635 . PMID 19136437.
- ^ Pozio E, et al. (diciembre de 2002). "Trichinella zimbabwensis n.sp. (Nematoda), una nueva especie no encapsulada de cocodrilos (Crocodylus niloticus) en Zimbabwe que también infecta a mamíferos". Int J Parasitol . 32 (14): 1787–99. doi :10.1016/s0020-7519(02)00139-x. PMID 12464425.
- ^ Scandrett B, Konecsni K, Lalonde L, Boireau P, Vallée I (junio de 2018). "Detección de infecciones naturales por Trichinella murrelli y Trichinella spiralis en caballos mediante pruebas de seguridad alimentaria de rutina posteriores al sacrificio". Parasitología de alimentos y agua . 11 : 1–5. doi :10.1016/j.fawpar.2018.06.001. PMC 7033993 . PMID 32095599.
- ^ Gamble HR (1999). "Trichinella". Enciclopedia de microbiología de los alimentos . págs. 2181–2186. doi :10.1006/rwfm.1999.1595. ISBN . 978-0-12-227070-3.
- ^ "CDC – DPDx – Triquinelosis – índice". www.cdc.gov . Archivado desde el original el 4 de julio de 2015 . Consultado el 25 de julio de 2015 .
- ^ Jongwutiwes S, et al. (enero de 1998). "Primer brote de triquinelosis humana causada por Trichinella pseudospiralis". Clin Infect Dis . 26 (1): 111–15. doi : 10.1086/516278 . PMID 9455518.
- ^ ab Cook GC (2001). "Brote de triquinosis (triquiniasis) – contraído en Londres en 1879". Revista Médica de Postgrado . 77 (903): 62–63. doi :10.1136/pmj.77.903.62. PMC 1741881 . PMID 11123411.
- ^ Gottstein B, Pozio E, Nöckler K (enero de 2009). "Epidemiología, diagnóstico, tratamiento y control de la triquinelosis". Clinical Microbiology Reviews . 22 (1): 127–45, Tabla de contenidos. doi :10.1128/CMR.00026-08. PMC 2620635 . PMID 19136437.
- ^ Departamento de Agricultura de los Estados Unidos – Servicio de Inocuidad e Inspección de Alimentos. “Responsabilidades de los establecimientos NSS NRTE/RTE” (2006).
- ^ Departamento de Conservación Ambiental del Estado de Nueva York – Licencias de caza <www.dec.ny.gov/permits/6094.html>
- ^ ab Thimjos Ninios, Janne Lundén, Hannu Korkeala, Maria Fredriksson-Ahomaa, eds. (2014). Inspección y Control de Carnes. Wiley Blackwell. pag. 210.ISBN 9781118525869.
- ^ ab "Tabla de la sección 318.10 del Título 9 del USDA" (PDF) .
- ^ Hendrick B. "USDA revisa las temperaturas de cocción de la carne de cerdo". WebMD . Consultado el 6 de mayo de 2022 .
- ^ Además, de los informes de triquinosis en los Estados Unidos, todos han sido resultado de la producción en masa, particularmente en lugares grandes, como cafeterías y patios de comidas de centros comerciales. Centros para el Control y la Prevención de Enfermedades , División de Enfermedades Parasitarias (15 de julio de 2004). "Información sobre enfermedades parasitarias: triquinosis". Archivado desde el original el 28 de enero de 2007. Consultado el 28 de enero de 2007 .
- ^ Departamento de Agricultura de los Estados Unidos . «Código Electrónico de Reglamentos Federales; Título 9: Animales y productos animales; Parte 318 – Entrada a establecimientos oficiales; Reinspección y preparación de productos; § 318.10 Tratamiento prescrito de la carne de cerdo y productos que contienen carne de cerdo para destruir las triquinas». Archivado desde el original el 29 de septiembre de 2006. Consultado el 28 de enero de 2007 .
- ^ ab USDA Animal and Plant Health Inspection Service APHIS – Veterinary Services. Consultado el 11 de febrero de 2009, "Trichinae Herd Certification Pilot". Archivado desde el original el 14 de agosto de 2009. Consultado el 23 de agosto de 2009 .
- ^ "Monografía – Mebendazol". medscape.com . Consultado el 24 de febrero de 2009 .
- ^ "Aspectos clínicos y tratamiento de los parásitos intestinales más comunes en el hombre (TB-33)". Boletín técnico de la Administración de Veteranos 1946 y 1947. 10 : 1–14. 1948.
- ^ abc Gu Y., Li J., Zhu X., Yang J., Li Q., Liu Z., Yu S., Li Y. (2008). "Trichinella spiralis: caracterización de epítopos específicos expresados en fagos y su inmunidad protectora en ratones BALB/c". Parasitología experimental . 118 (1): 66–74. doi :10.1016/j.exppara.2007.06.014. PMID 17707815.
- ^ Ali S, El-Zawawy L, El-Said D, Gaafar M (2007). "Inmunización contra la triquinelosis utilizando larvas de Trichinella spiralis tratadas con microondas". Revista de la Sociedad Egipcia de Parasitología . 37 (1): 121–33. PMID 17580572.
- ^ Dea-Ayuela y otros (2006)
- ^ Dea-Ayuela MA, Iniguz SR, Fernandez FB (2006). "Vacunación de ratones contra infecciones intestinales por Trichinella spiralis mediante administración oral de antígenos microencapsulados en copolímeros de ácido metacrílico". Vaccine . 24 (15): 2772–80. doi :10.1016/j.vaccine.2006.01.006. PMID 16446017.
- ^ Dupouy-Camet J (diciembre de 2000). "Triquinelosis: una zoonosis mundial". Parasitología veterinaria . 93 (3–4): 191–200. doi :10.1016/S0304-4017(00)00341-1. PMID 11099837.
- ^ "Relazione dei nas - Genova, allarme carne cruda: decine di intossicati dopo Capodanno". Archivado desde el original el 18 de septiembre de 2016 . Consultado el 16 de septiembre de 2016 .
- ^ "Relación anual al PNI 2015 Triquina - Prevención y control". Archivado desde el original el 23 de septiembre de 2016, a través del Ministero della Salute www.salute.gov.it.
- ^ Ruetsch C, Delaunay P, Armengaud A, Peloux-Petiot F, Dupouy-Camet J, Vallée I, Polack B, Boireau P, Marty P (2016). "El etiquetado inadecuado de las salchichas de cerdo preparadas en Córcega provocó un brote de triquinelosis en Francia". Parásito . 23 : 27. doi : 10.1051/parasite/2016027. PMC 4912683 . PMID 27317463.

- ^ "Hoja informativa sobre la triquinelosis – División de enfermedades parasitarias". Centro para el Control de Enfermedades, Gobierno de los EE. UU. 2004. Archivado desde el original el 24 de febrero de 2008. Consultado el 25 de febrero de 2008 .
- ^ "EMedicine - Trichinosis: artículo de L Kristian Arnold, MD". Archivado desde el original el 28 de enero de 2006. Consultado el 27 de enero de 2006 .
- ^ Roy, Sharon, Adriana Lopez y Peter Schantz. "Trichinellosis Surveillance – United States, 1997–2001". Morbidity and Mortality Weekly Report: Surveillance Summaries (2003): 1–8. JSTOR. Centros para el Control y la Prevención de Enfermedades (CDC). Web. 1 de diciembre de 2014.
- ^ Harris M (1985). "4" . Es bueno comer: enigmas de la comida y la cultura . Nueva York: Simon and Schuster. págs. 67-70. ISBN 0-671-50366-9.
- ^ Murrell KD, Pozio E (2000). "Triquinelosis: la zoonosis que no desaparecerá en silencio". Revista Internacional de Parasitología . 30 (12–13): 1339–1349. doi :10.1016/s0020-7519(00)00132-6. PMID 11113259.
- ^ Blaga R, Durand B, Antoniu S, Gherman C, Cretu CM, Cozma V, Boireau P (2007). "Un aumento dramático en la incidencia de la triquinelosis humana en Rumania durante los últimos 25 años: impacto de los cambios políticos y los hábitos alimentarios regionales". The American Journal of Tropical Medicine and Hygiene . 76 (5): 983–986. doi :10.4269/ajtmh.2007.76.983. PMID 17488927.
- ^ "Academia de Ciencias Naturales - Joseph Leidy - Parasitología". www.ansp.org . Archivado desde el original el 8 de octubre de 2006 . Consultado el 13 de enero de 2022 .
- ^ Richard Owen (1835) "Descripción de un entozoo microscópico que infesta los músculos del cuerpo humano", Archivado el 26 de abril de 2016 en Wayback Machine . Transactions of the Zoological Society of London , 1 : 315–24. Paget se menciona en las páginas 315 y 320.
- ^ Blumer G. "Algunas observaciones sobre la historia temprana de la triquinosis (1822-1866)". Yale Journal of Biology and Medicine . 1 (6): 581–88.
- El texto de la versión original de este artículo fue tomado del recurso de dominio público en https://www.cdc.gov/ncidod/dpd/parasites/trichinosis/factsht_trichinosis.htm
- Centros para el Control y la Prevención de Enfermedades . Vigilancia de la triquinosis, Estados Unidos, 1987-1990, MMWR 1991;40:(SS-3)35-42.
- Moorhead A, Grunenwald PE, Dietz VJ, Schantz PM (1999). "Triquinelosis en los Estados Unidos, 1991-1996: en declive pero no ha desaparecido". Am J Trop Med Hyg . 60 (1): 66–69. doi :10.4269/ajtmh.1999.60.66. PMID 9988325. S2CID 23888211.
- Las regulaciones del USDA – Título 9 – Capítulo 3 – Parte 318 – incluyen “Tratamiento prescrito para carne de cerdo y productos que contienen carne de cerdo para destruir las triquinas”.
Enlaces externos
- Páginas web de la Comisión Internacional sobre Triquinelosis Archivado el 23 de agosto de 2007 en Wayback Machine.
- Departamento de Enfermedades Parasitarias de los CDC: Triquinosis
- Jokelainen P, Näreaho A, Hälli O, Heinonen M, Sukura A (junio de 2012). "Jabalíes de cría expuestos a Toxoplasma gondii y Trichinella spp". Veterinario. Parasitol . 187 (1–2): 323–27. doi :10.1016/j.vetpar.2011.12.026. PMID 22244535.

