Trasplante de intestino
| Trasplante de intestino | |
|---|---|
 Íleon enfermo resecado . La extirpación previa de secciones del intestino delgado para el tratamiento de enfermedades precursoras es la causa principal del síndrome del intestino corto (SIC), la principal causa de trasplante intestinal. | |
| Otros nombres | Trasplante de intestino delgado |
| CIE-9-CM | 46,97 |
El trasplante de intestino ( trasplante intestinal o trasplante de intestino delgado ) es el reemplazo quirúrgico del intestino delgado en casos crónicos y agudos de insuficiencia intestinal . Si bien la insuficiencia intestinal a menudo se puede tratar con terapias alternativas como la nutrición parenteral (NP), complicaciones como la enfermedad hepática asociada a la NP y el síndrome del intestino corto pueden hacer que el trasplante sea la única opción viable. El trasplante de intestino, uno de los tipos de trasplante de órganos más raros que se realizan, se está volviendo cada vez más frecuente como opción terapéutica debido a las mejoras en los regímenes inmunosupresores , la técnica quirúrgica, la NP y el manejo clínico de los pacientes pre y postrasplante. [ cita requerida ]
Historia
El trasplante de intestino se remonta a 1959, cuando un equipo de cirujanos de la Universidad de Minnesota dirigido por Richard C. Lillehei informó sobre un trasplante exitoso de intestino delgado en perros. Cinco años después, en 1964, Ralph Deterling en Boston intentó el primer trasplante intestinal humano, aunque sin éxito. Durante las siguientes dos décadas, los intentos de trasplante de intestino delgado en humanos se encontraron con un fracaso universal y los pacientes murieron por complicaciones técnicas, sepsis o rechazo del injerto . Sin embargo, el descubrimiento del inmunosupresor ciclosporina en 1972 desencadenó una revolución en el campo de la medicina de trasplantes. Debido a este descubrimiento, en 1988, E. Deltz realizó el primer trasplante intestinal exitoso en Alemania, seguido poco después por equipos en Francia y Canadá. El trasplante intestinal ya no era un procedimiento experimental, sino una terapia que salvaba vidas. En 1990, un fármaco inmunosupresor más nuevo, el tacrolimus , apareció en el mercado como una alternativa superior a la ciclosporina. En las dos décadas transcurridas desde entonces, los esfuerzos en materia de trasplante de intestino han mejorado enormemente tanto en número como en resultados. [1] [2]
Diagnósticos pretrasplante y síndrome del intestino corto
La insuficiencia del intestino delgado es potencialmente mortal debido a la incapacidad de absorber nutrientes , líquidos y electrolitos de los alimentos. Sin estas sustancias esenciales y la capacidad de mantener los equilibrios energéticos , no se puede mantener la homeostasis y el pronóstico será desalentador. Las causas de la insuficiencia intestinal pueden ser clínicamente complejas y pueden ser el resultado de una combinación de complicaciones nutricionales, infecciosas , traumáticas y metabólicas que afectan la anatomía y la fisiología ordinarias . [3] Muchas de las condiciones subyacentes que sirven como precursoras de la insuficiencia son de naturaleza genética o congénita. Por ejemplo, la inflamación grave , la ulceración , la obstrucción intestinal , la fistulación , la perforación u otras patologías de la enfermedad de Crohn pueden comprometer gravemente la función intestinal. [4] A pesar del peligro que estas condiciones pueden representar en sí mismas, pueden conducir a complicaciones aún más graves que requieran el reemplazo del intestino enfermo. La causa principal de un trasplante intestinal es la afección con el síndrome del intestino corto , a menudo una afección secundaria de alguna otra forma de enfermedad intestinal. [5] [6] El síndrome del intestino corto fue la causa del 73% de los trasplantes intestinales estadounidenses en 2008, seguido de problemas funcionales del intestino con el 15% y otras causas que representan el 12% de los casos. [7] El SBS natural es misericordiosamente raro, se estima que es de 3 por cada 100.000 nacimientos. [8] La extirpación quirúrgica es la causa más común, realizada como tratamiento para varias afecciones gastroenterológicas y congénitas como la enfermedad de Crohn, enterocolitis necrotizante , isquemia mesentérica , trastorno de la motilidad , onfalocele / gastrosquisis , tumores y vólvulo . [9]
Tratamientos alternativos

Independientemente de la afección subyacente, la pérdida de la función intestinal no necesariamente requiere un trasplante. Varias afecciones, como la enterocolitis necrosante o el vólvulo, pueden resolverse adecuadamente con otros tratamientos quirúrgicos y no quirúrgicos, especialmente si el SIC nunca se desarrolla. Una persona puede obtener nutrientes por vía intravenosa a través de la NP, evitando por completo el consumo de alimentos y su posterior digestión . La supervivencia a largo plazo con SIC y sin NP es posible con la nutrición enteral , pero esto es inadecuado para muchos pacientes, ya que depende de la capacidad del intestino restante para adaptarse y aumentar su capacidad de absorción. [3] Aunque es más complicado y costoso de realizar, cualquier persona puede recibir NP. Aunque la NP puede satisfacer todas las necesidades de energía, líquidos y nutrientes y puede realizarse en casa, la calidad de vida puede disminuir significativamente. En promedio, la NP tarda de 10 a 16 horas en administrarse, pero puede tardar hasta 24. Durante este período de tiempo, la vida diaria puede verse significativamente obstaculizada como consecuencia de la conexión a la bomba intravenosa . [5] [10] Durante largos períodos de tiempo, la PN puede provocar numerosos problemas de salud, incluida la deshidratación grave , infecciones relacionadas con el catéter y enfermedad hepática. [2] [11] La enfermedad hepática asociada a la PN afecta hasta el 50% de los pacientes en un plazo de 5 a 7 años, correlacionada con una tasa de mortalidad del 2 al 50%. [11]
Otro tratamiento alternativo al trasplante para pacientes con SBS es el alargamiento quirúrgico del intestino mediante enteroplastia transversa seriada (STEP) o la técnica más antigua de alargamiento y adaptación intestinal longitudinal (LILT). Aunque ambos procedimientos contribuyen a un aumento aproximado del 70% en la longitud, STEP parece algo más favorable en términos de menor mortalidad y progresión al trasplante. [12] Sin embargo, una recepción positiva de cualquiera de los procedimientos puede reducir el nivel de NP requerido, si no anular su uso requerido por completo. [8] [13]
Indicaciones
Existen cuatro indicaciones aprobadas por Medicare y Medicaid para el trasplante de intestino: pérdida de dos de las seis vías principales de acceso venoso , múltiples episodios de sepsis potencialmente mortal asociada al catéter , anomalías de líquidos y electrolitos ante la terapia médica máxima y enfermedad hepática asociada a NP. Los trasplantes también se pueden realizar si el crecimiento y el desarrollo de un paciente pediátrico no se producen, o en circunstancias extremas para pacientes con una calidad de vida excepcionalmente baja con NP. [14] [15] Se debe consultar a un equipo multidisciplinario formado por cirujanos de trasplantes , gastroenterólogos , dietistas , anestesiólogos , psiquiatras , representantes financieros y otros especialistas para evaluar el plan de tratamiento y garantizar que el trasplante sea la mejor opción para el paciente. También se deben realizar preparaciones psicológicas para el equipo de trasplantes y el paciente. La derivación temprana requiere confianza entre todas las partes involucradas en la operación para garantizar que una apresurada decisión no conduzca a un trasplante prematuro. [11] [16]
Otras contraindicaciones absolutas para recibir un trasplante intestinal incluyen la presencia de infecciones sistémicas y locales no tratadas, cáncer maligno, deterioro neurológico grave y enfermedad cardíaca y/o pulmonar grave . Estos criterios son similares a las pautas establecidas para trasplantes de otros tipos de órganos. [17] La infección por VIH es una contraindicación relativa para el trasplante de intestino; los pacientes terminales desesperados pueden aceptar un trasplante de un donante VIH positivo si están dispuestos a exponerse al VIH. [14]
Tipos de trasplantes
Existen tres tipos principales de trasplantes de intestino: un injerto intestinal aislado , un injerto combinado de intestino y hígado y un injerto multivisceral en el que también se pueden trasplantar otros órganos abdominales . En el injerto más básico y común, un injerto intestinal aislado, solo se trasplantan secciones del yeyuno y el íleon . [18] Estos se realizan en ausencia de insuficiencia hepática. En caso de disfunción hepática grave debido a NP, deficiencias enzimáticas u otros factores subyacentes, se puede trasplantar el hígado junto con el intestino. En un injerto multivisceral, se pueden incluir en el injerto el estómago , el duodeno , el páncreas y/o el colon . Los injertos multiviscerales se consideran cuando la afección subyacente compromete significativamente otras secciones del sistema digestivo, como tumores intraabdominales que aún no han hecho metástasis , trombosis venosa extensa o isquemia arterial del mesenterio y síndromes de motilidad. [11] [17]
Periodo preoperatorio
Los intestinos donados , como todos los órganos, deben ser compatibles con un receptor antes de la recuperación, para prepararlo y minimizar el tiempo que el órgano pasa fuera del cuerpo . [5] Los receptores potenciales se colocan en el Registro Internacional de Trasplante Intestinal (ITR), donde contribuyen a la creciente comprensión mundial del trasplante de intestino. Antes de que se pueda realizar un trasplante, primero se debe localizar un órgano. En los Estados Unidos, la compatibilidad de todos los órganos está coordinada por la Red Unida para la Intercambio de Órganos (UNOS). El donante intestinal estándar es el fallecido con un diagnóstico de muerte cerebral . [19] En términos de resultados del trasplante, los donantes con muerte cerebral son altamente preferibles a los donantes que han sufrido muerte cardiopulmonar . Si la respiración puede ser asistida por un respirador , los donantes con muerte cerebral pueden exhibir una función cardíaca , endocrina y excretora mantenible . Si se maneja adecuadamente, la continuación del flujo sanguíneo y el metabolismo corporal permite obtener órganos más saludables y tiempo adicional para preparar a los receptores para el trasplante. [20] Además, es posible la recuperación del íleon terminal de donantes vivos., [21] y se está desarrollando una técnica laparoscópica para extraer secciones limitadas del intestino delgado de donantes vivos. [22] Al determinar las posibles compatibilidades entre donante y receptor, las características importantes incluyen el tamaño del donante, la edad, la calidad del tejido y la compatibilidad ABO e histo . [11] [21] Si el intestino es demasiado grande, puede que no sea trasplantable en pacientes jóvenes o pequeños. Lo ideal es que los intestinos se seleccionen de donantes de menor peso que los receptores propuestos para garantizar el cierre simple de la herida abdominal. [23] Si un paciente es demasiado joven o demasiado viejo, puede que no sea lo suficientemente resistente para sobrevivir a la operación y al período de recuperación. [11] Si los órganos del donante y del receptor no cumplen los requisitos de compatibilidad, la amenaza de rechazo del órgano por parte del cuerpo es casi segura.
El rechazo de órganos es la desafortunada circunstancia de que el sistema inmunológico del huésped reconozca el órgano trasplantado como extraño. Esta es la complicación más notable que enfrentan los receptores de trasplantes. A través de los receptores de células T , los linfocitos T pueden distinguir entre lo propio y lo ajeno al reconocer los antígenos leucocitarios humanos (HLA) unidos a la proteína del complejo mayor de histocompatibilidad (MHC) ubicada en la superficie de las células del órgano . Una vez identificado como extraño, el sistema inmunológico procede a destruir el tejido trasplantado. La prueba de anticuerpos reactivos al panel (PRA) mide la proporción de la población a la que un receptor reaccionará a través de anticuerpos preexistentes a varios antígenos HLA ; en otras palabras, la probabilidad de que un paciente rechace de forma aguda su nuevo trasplante. Por lo tanto, es esencial que se analicen los estados de HLA y PRA y se demuestre una baja inmunorreactividad del paciente al injerto. [2] [21] [24] En algunos casos, un receptor puede sufrir la enfermedad de injerto contra huésped , en la que las células del órgano trasplantado atacan a las células del receptor. [25]
Para garantizar la histocompatibilidad adecuada, la calidad del tejido y la seguridad frente a infecciones, se deben recolectar y analizar análisis de sangre en el laboratorio. Además de la tipificación de HLA y PRA, se deben realizar hemograma completo (CSC), perfil de coagulación , panel metabólico completo y pruebas de determinación del grupo sanguíneo ABO tanto para el donante como para el receptor. [2] Los injertos ABO incompatibles a veces se pueden realizar en pacientes pediátricos muy jóvenes, ya que sus sistemas inmunológicos no se han desarrollado completamente y para quienes la mortalidad en lista de espera sigue siendo alta. [14] Además, se debe analizar el suero sanguíneo para detectar la presencia de virus , incluidos el VIH, la hepatitis B y C , el citomegalovirus (CMV) y los anticuerpos del virus de Epstein-Barr (VEB) para prevenir la infección. [24] Particularmente en el sistema inmunodeprimido necesario para el trasplante, estos virus pueden causar estragos en el cuerpo y volverse extremadamente peligrosos, incluso fatales. Incluso con niveles fisiológicos saludables, compatibilidades ABO y HLA y sin signos de infecciones bacterianas, virales y fúngicas , el trasplante de órganos no está exento de riesgos extraquirúrgicos. [2]
Lista de espera y resultados de donaciones
Un desafío importante que enfrenta la industria del trasplante intestinal es satisfacer la necesidad de intestinos trasplantables, particularmente en los Estados Unidos, donde se realizan la mayoría de los trasplantes intestinales. [9] Existe un estrecho intervalo de tiempo entre la obtención y el trasplante en el que cualquier órgano permanece viable, y se enfrentan desafíos logísticos para reunir el órgano y el receptor. Durante la obtención, los órganos que se están recuperando se enfrían y se perfunden con una solución de conservación. Esto ralentiza la actividad del órgano y aumenta el tiempo que permanecen viables para el trasplante. [2] Aunque el enfriamiento y la perfusión pueden extender la vida intestinal por varias horas, el fracaso sigue siendo inminente a menos que se trasplante. Esta duración entre el enfriamiento del órgano durante la obtención y la restauración de la temperatura fisiológica durante la implantación es el tiempo de isquemia fría. Debido a la sensibilidad del intestino a la lesión isquémica, muchos intestinos de donantes potenciales se pierden debido a los eventos posteriores a la muerte cerebral y el trauma. Además, se observa daño intestinal irreversible después de aproximadamente solo 5 horas de isquemia fría en forma de daño de la mucosa y translocación bacteriana fuera del tracto gastrointestinal . Por lo tanto, es esencial garantizar la supervivencia cardíaca y la proximidad del donante al receptor antes de la obtención para que los órganos no esperen demasiado tiempo fuera del cuerpo y sin flujo sanguíneo. [11] No solo hay una falta de intestinos trasplantables, sino también una deficiencia en el número de centros que poseen la capacidad para llevar a cabo el complicado procedimiento de trasplante. En 2005 [actualizar], solo había 61 centros médicos en el mundo capaces de realizar un trasplante intestinal. [9] Además, muchos niños pequeños, en particular los que pesan menos de 5 kg , no pueden encontrar un trasplante debido a la falta de donantes de tamaño compatible. [8]
A pesar de estos desafíos, obtener un intestino para trasplante es bastante probable en los Estados Unidos. En 2008, había 212 personas en la lista de espera de trasplante intestinal de EE. UU., 94% de las cuales eran ciudadanos estadounidenses. [7] Independientemente del tipo de trasplante, más de la mitad de los nuevos inscritos tienen 5 años de edad o menos. Los adultos componen la siguiente cohorte más grande, seguidos por los pacientes pediátricos de 6 años o más. En 2008, la composición étnica de la lista de espera de trasplante intestinal era 65% blanca , 18% negra , 16% hispana , 1% asiática y 0,5% de otra raza o mestiza , similar a la demografía de la población general estadounidense en ese momento, aparte de una cohorte asiática por debajo del promedio. Los tipos de sangre ABO también coincidieron con la población general, con 31% A, 14% B, 5% AB y 50% O. [7] En 2004, el período de espera promedio para recibir un trasplante fue de 220 días, [21] con una mediana de 142 días en 2008. [7] La tasa de adiciones a la lista de espera ha cambiado de un año a otro; las ganancias aumentaron hasta 2006 (con 317 agregados), pero luego disminuyeron en 2012 (a 124 agregados). [26] En 2007, solo el 9% de los pacientes en la lista de espera de EE. UU. murieron mientras esperaban un trasplante. [7] La mortalidad en la lista de espera alcanzó su punto máximo alrededor de 2002 y fue más alta para los pacientes de hígado-intestino (pediátricos). Las muertes entre todos los grupos pediátricos que esperan trasplantes de intestino-hígado han disminuido en los años previos a 2014, mientras que las muertes de intestino-hígado en adultos han disminuido de manera menos dramática. Es probable que la disminución en los últimos años se deba a una mejor atención de los bebés con insuficiencia intestinal y, posteriormente, a una disminución de las derivaciones para trasplantes. [26] Aunque se han logrado muchas mejoras en los Estados Unidos, los resultados en todas partes aún muestran mucho margen de mejora. En todo el mundo, el 25% de los pacientes pediátricos en lista de espera para un trasplante intestinal mueren antes de poder recibirlo. [8]
Protocolo de adquisiciones
Tras la compatibilidad del órgano, un equipo de cirujanos de trasplante abdominal puede realizar la complicada obtención del intestino delgado. Una vez que se ha seleccionado y aprobado un donante para la donación, se pueden iniciar varios tratamientos previos para destruir microorganismos y células inmunes . El intestino del donante debe descontaminarse con varios antibióticos , entre ellos neomicina , eritromicina , anfotericina B y cefalosporina . [18] También se los puede tratar con anticuerpos antilinfocitos ( globulina antitimocítica , alemtuzumab ), irradiación dirigida contra el exceso de tejido linfático mesentérico y se les puede irrigar el intestino . [17]
Una vez que se completa la preparación del donante, la obtención puede comenzar utilizando las mismas técnicas estándar para todas las adquisiciones de órganos abdominales. El equipo expone la cavidad abdominal e inserta dos cánulas para la infusión de la solución de preservación de órganos de la Universidad de Wisconsin en la aorta y la vena mesentérica inferior . A medida que los órganos abdominales se enfrían in situ , se diseca el tejido circundante para que puedan extraerse rápidamente. En el siguiente paso, se pinza la aorta , cortando el suministro de sangre a los órganos. Una vez que se corta el suministro de sangre y oxígeno a un órgano, la muerte del órgano se acercará rápidamente a menos que se tomen medidas para preservarlos hasta el trasplante. Por lo tanto, los órganos se drenan completamente de sangre , se enjuagan con una solución de preservación fría y se extraen del cuerpo. [2] [18] En un trasplante intestinal aislado, el colon se separará del intestino delgado. El ciego y el colon ascendente se desvascularizan, mientras se tiene cuidado de preservar la vasculatura principal en el íleon. El yeyuno se separará del duodeno, preservando la vasculatura del yeyuno, el íleon, el mesenterio y el páncreas. Si está sano, el páncreas a menudo se puede recuperar como una obtención aislada adicional. El aloinjerto intestinal, cuando está listo para ser extraído, se une mediante el pedículo mesentérico, donde los vasos convergen fuera del sistema intestinal. Este pedículo se cerrará con grapas y se puede separar del cuerpo a través de un corte transversal para crear un manguito vascular. Luego, se puede extraer el aloinjerto intestinal completo y envolverlo en una toalla quirúrgica . [18] Los protocolos para las adquisiciones combinadas de hígado y multiviscerales son mucho más complicados y meticulosos que el intestino aislado solo. [ cita requerida ]
Protocolo de trasplante
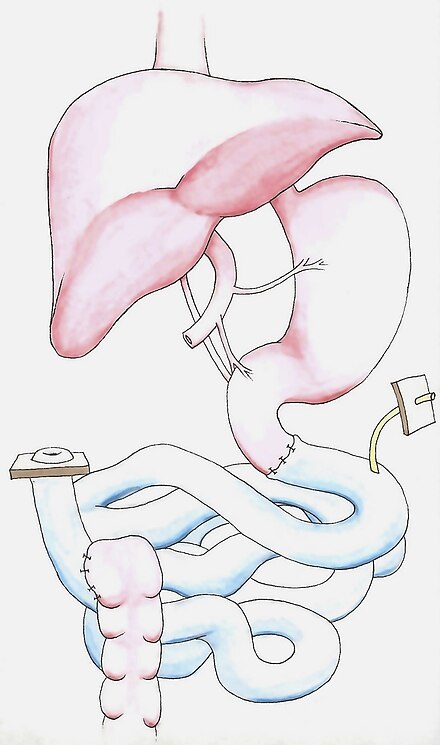
En primer lugar, se debe eliminar cualquier tejido cicatricial abdominal de cirugías anteriores. La aorta y la vena cava se disecan en preparación para la anastomosis vascular , seguida de la disección de los extremos proximal y distal del tracto digestivo. Luego se realiza la anastomosis para revascularizar el injerto. Los vasos arteriales se conectan a la aorta abdominal, debajo de los riñones . Sin embargo, el drenaje venoso, o la reinserción del órgano trasplantado al sistema venoso, se puede realizar de manera diferente dependiendo de la vasculatura intraabdominal única del receptor. El injerto generalmente se drena sistémicamente en la vena cava infrarrenal, [15] pero también se puede drenar portalmente en el portal hepático o la vena mesentérica superior . [17] Luego, el injerto se reperfunde con sangre y se detiene cualquier sangrado antes de que los extremos proximal y distal del intestino trasplantado se conecten al tracto digestivo original. Luego se crea una ileostomía en asa para proporcionar un acceso fácil para futuras observaciones endoscópicas y biopsias . Se puede colocar una sonda de alimentación por gastrostomía o yeyunostomía antes de cerrar la pared abdominal. [2]
Cuando se trasplanta un hígado junto con el intestino, primero se debe extraer el hígado del receptor . A continuación, se anastomosan la aorta, la cava y las venas porta del donante y del receptor. A continuación, se lava el injerto antes de retirar las pinzas de la cava . A continuación, se reconstruye el intestino como en un trasplante intestinal aislado, antes de conectarlo al conducto biliar que alimenta al nuevo hígado. [17] Los trasplantes multiviscerales son especialmente difíciles y susceptibles a complicaciones porque todos los órganos deben sobrevivir a una obtención, transporte y trasplante conjuntos. Estas tres medidas se adaptan a las necesidades individuales del receptor. [18] La preservación del bazo , el páncreas y el duodeno nativos durante un trasplante multivisceral puede reducir el riesgo de complicaciones adicionales relacionadas con estas estructuras. [11]
Período postoperatorio
Después del procedimiento, el paciente es monitoreado activamente en una unidad de cuidados intensivos (UCI). Se administran antibióticos de amplio espectro , se monitorea el sangrado y se miden los niveles de pH sérico y lactato para detectar evidencia de isquemia intestinal. El sistema inmunológico del paciente se modula fuertemente inmediatamente después de la operación. La fase inicial del tratamiento consiste en la administración de tacrolimus con corticosteroides para suprimir la activación de los linfocitos T. A continuación, se administran varios surtidos de antagonistas del receptor de interleucina-2 (IL-2) ( daclizumab , basiliximab ), agentes antiproliferativos ( azatioprina , micofenolato mofetilo ) y los medicamentos ciclofosfamida y sirolimus en cada paciente individual para suprimir aún más el sistema inmunológico. [11] La biodisponibilidad de estos medicamentos depende del área de superficie intestinal y del tiempo de tránsito y, por lo tanto, la longitud del aloinjerto determina el régimen de inmunosupresión. [2] La administración intravenosa de prostaglandina E1 se realiza ocasionalmente durante los primeros 5 a 10 días posteriores al trasplante para mejorar la circulación intestinal y una posible dispensación de efectos inmunosupresores. [2] [11] El intestino se descontamina selectivamente contra la flora de alto riesgo y se toman medidas preventivas contra el CMV y las infecciones fúngicas. [11]
Lo ideal es comenzar la nutrición enteral lo antes posible después del trasplante. Por lo tanto, se coloca rápidamente una sonda de alimentación que se conecta al estómago o al yeyuno para facilitar la rehabilitación. [11] Si se restablece la función gastrointestinal, se puede restablecer una dieta y avanzar con cautela según la tolerancia. La mayoría de los pacientes dejan de recibir nutrición enteral dentro de las 4 semanas posteriores al trasplante, y casi todos están libres de suplementos enterales adicionales al año. [14] La evidencia de la restauración de la función incluye la disminución de los retornos de la sonda de gastrostomía y el aumento del contenido de gas y entérico en la ileostomía. [2] La endoscopia de vigilancia de rutina y las biopsias a través de la ileostomía deben realizarse con una frecuencia decreciente durante varios meses para observar signos de rechazo, idealmente antes de que se presenten los síntomas clínicos. Si el paciente continúa teniendo un buen desempeño durante el primer año posterior al trasplante, generalmente se cerrará la ileostomía. Si se sospecha rechazo en el futuro, se realizarán endoscopias y se adaptará una terapia antirrechazo adecuada. El tiempo medio para el alta hospitalaria varía entre los procedimientos. Los tiempos medios para los trasplantes de intestino aislado, intestino-hígado y multiviscerales son 30, 60 y 40 días después de la operación respectivamente. [14] En los primeros meses, la capacidad de absorción de carbohidratos y aminoácidos debería normalizarse, seguida por la capacidad de absorción de grasas. Una vez que la nutrición enteral es capaz de satisfacer todas las necesidades nutricionales, se puede suspender la NP. [2] Casi todos los pacientes con un trasplante exitoso están libres de NP en el plazo de un año. [14]
Complicaciones biológicas
El trasplante intestinal es el tipo de trasplante menos realizado debido a una serie de obstáculos únicos. El más importante de ellos es la inmunosupresión profunda requerida debido a la capacidad del intestino para provocar respuestas inmunitarias fuertes. Debido a la exposición a una amplia gama de flora intestinal y material consumido por el cuerpo, el epitelio intestinal posee un sistema inmunológico innato altamente desarrollado y capacidades de presentación de antígenos . La inmunosupresión es el determinante principal del resultado en el trasplante de intestino delgado; el riesgo de rechazo del injerto aumenta con una inmunosupresión insuficiente y de infección local y sistémica con una inmunosupresión excesiva. [11] Por lo tanto, garantizar una dosis adecuada de inmunosupresor puede ser difícil, especialmente porque tanto la ciclosporina (14-36%) como el tacrolimus (8,5-22%) tienen biodisponibilidades generalmente bajas. [27] Un problema importante debido a la inmunosupresión en pacientes con trasplante intestinal es el trastorno linfoproliferativo postrasplante , en el que los linfocitos B proliferan excesivamente debido a la infección por EBV y dan lugar a lesiones similares a la mononucleosis infecciosa . [7] Los receptores de trasplante intestinal también corren el riesgo de sufrir insuficiencia renal crónica porque los inhibidores de la calcineurina son tóxicos para los riñones. Un receptor de trasplante debe permanecer con inmunosupresores durante el resto de su vida. [14]
Los trasplantes intestinales son altamente susceptibles a infecciones, incluso más que el receptor inmunodeprimido estándar de otros órganos debido a la gran composición y variedad de la flora intestinal. [11] Una compleja variedad de microorganismos habita en el tracto digestivo humano, con concentraciones de hasta 10 4 –10 7 UFC /ml en el yeyunoileo y 10 11 –10 12 UFC/ml en el colon. [28] Si bien la supresión del sistema inmunológico puede prevenir el ataque inmunológico al nuevo aloinjerto, también puede prevenir la capacidad del sistema inmunológico para mantener a raya ciertas poblaciones microbianas intestinales. A pesar de la descontaminación previa y posterior del trasplante, los receptores corren el riesgo de infección local y sistémica tanto por la flora natural como externa. El síntoma común de disfunción del injerto, ya sea debido a infección, rechazo o alguna otra afección, es la diarrea . [15]
Resultados e impacto del trasplante
Los resultados del trasplante intestinal han mejorado significativamente en los últimos años. A pesar de las leves incongruencias en los porcentajes de tasa de supervivencia entre los centros de América del Norte, Europa, Australia y otros lugares, los trasplantes intestinales en su mayoría se acercan a las tasas de supervivencia del trasplante de pulmón . [11] Al año, las tasas de supervivencia del injerto para el intestino aislado actualmente oscilan alrededor del 80%, y el 70% para el intestino-hígado y multivisceral. Durante el mismo período de tiempo, la supervivencia del paciente para pacientes de intestino aislado puede incluso superar el 90%, mientras que los trasplantes multiorgánicos más complicados no muestran ningún aumento en la supervivencia del paciente en comparación con los pacientes que sobreviven con el injerto intestinal solo. [14] La tasa de supervivencia a cinco años para pacientes y trasplantes varía del 50 al 80% (media general del 60%), dependiendo de la enfermedad subyacente y la morbilidad prequirúrgica . Los pacientes muy jóvenes (<1 año) y muy viejos (>60 años) que reciben un trasplante tienen tasas pronunciadas de mortalidad. [14] [15] Después de 4 años, la supervivencia pediátrica empeora significativamente en comparación con los adultos. [14]
Varios factores relacionados con el pronóstico superior del paciente y del injerto han demostrado ser estadísticamente significativos. Los pacientes que han sido admitidos para el trasplante directamente desde el hogar en lugar del hospital, los pacientes más jóvenes de más de un año de edad, los que reciben su primer trasplante, los que reciben trasplantes en centros de trasplantes experimentados y los que reciben terapias de inducción basadas en anticuerpos o sirolimus tienen mayores tasas de supervivencia. [9] [15] Además, se ha descubierto que la etiología subyacente , [29] la presencia de comorbilidad , la frecuencia de cirugías previas, el estado nutricional y el nivel de función hepática afectan la supervivencia del paciente y el injerto. [30] Se encontró que los pacientes con un diagnóstico previo al trasplante de vólvulo tenían un menor riesgo de mortalidad. [29] En 2008, el trasplante superviviente más largo registrado sobrevivió durante 18 años. [14] Entre 1999 y 2008, se realizaron 131 procedimientos de retrasplante en los Estados Unidos. [7]
La mejora de la calidad de vida después de un trasplante intestinal es significativa. De los pacientes vivos 6 meses después del trasplante, se considera que el 70% ha recuperado la función intestinal completa, el 15% tiene una función parcial y el 15% se ha quitado los injertos. [9] [14] Para aquellos con función completa, la autonomía nutricional enteral es alta. [7] La capacidad de reanudar las actividades regulares, como la capacidad de consumir alimentos y ejercer control sobre la función digestiva, es ciertamente un retorno bienvenido para los pacientes. La baja calidad de vida inducida por la insuficiencia intestinal a menudo se complementa con una discapacidad psicosocial significativa y una dependencia de narcóticos . Después del trasplante, se ha encontrado que generalmente disminuyen. [15] Según las encuestas que comparan a los pacientes que se han sometido a trasplantes y los que no, parece haber una mejora notable para los receptores de trasplantes en áreas como la ansiedad , la depresión, la apariencia , el estrés , la crianza de los hijos , la impulsividad , el optimismo , el cumplimiento médico y la calidad de las relaciones . [14] [15] [31]
Consideraciones financieras
Recibir un trasplante de órgano de cualquier tipo es una inversión financiera muy importante, pero un trasplante exitoso y que funcione bien puede ser muy rentable en comparación con terapias alternativas. Los costos totales para mantener la nutrición en el hogar pueden alcanzar más de $150,000 al año, aunque el costo real de la nutrición suele ser de solo $18 a $22 al día. [5] [14] Esto excluye el costo del apoyo domiciliario adicional, el equipo y el cuidado de las complicaciones relacionadas con la nutrición. El costo involucrado en someterse a un trasplante intestinal, incluida la hospitalización inicial para el trasplante, puede variar de $150,000 a $400,000, y las hospitalizaciones recurrentes son comunes hasta el segundo año. Dos a tres años después del trasplante, el costo financiero del trasplante alcanza la paridad con la nutrición y es más rentable a partir de entonces. [11] [14]
Referencias
- ^ Todo, Satoru; Tzakis, Andreas; Abu-Elmagd, Kareem; Reyes, Jorge; Starzl, Thomas E. (1994). "Estado actual del trasplante intestinal". Avances en cirugía . 27 : 295–316. PMC 2954648. PMID 8140977 .
- ^ abcdefghijkl Trasplante intestinal en eMedicine
- ^ ab Duran, Beyhan (2005). "Los efectos de la nutrición parenteral total a largo plazo sobre la inmunidad de la mucosa intestinal en niños con síndrome del intestino corto: una revisión sistemática". BMC Nursing . 4 (1): 2. doi : 10.1186/1472-6955-4-2 . PMC 549542 . PMID 15686591.
- ^ Enfermedad de Crohn en eMedicine
- ^ abcd Buchman, Alan L.; Scolapio, James; Fryer, Jon (2003). "Revisión técnica de la AGA sobre el síndrome del intestino corto y el trasplante intestinal". Gastroenterología . 124 (4): 1111–34. doi :10.1016/S0016-5085(03)70064-X. PMID 12671904.
- ^ Síndrome del intestino corto en eMedicine
- ^ abcdefgh Mazariegos, GV; Steffick, DE; Horslen, S.; Farmer, D.; Fryer, J.; Grant, D.; Langnas, A.; Magee, JC (2010). "Trasplante de intestino en los Estados Unidos, 1999-2008" (PDF) . American Journal of Transplantation . 10 (4 Pt 2): 1020–34. doi : 10.1111/j.1600-6143.2010.03044.x . hdl :2027.42/79108. PMID 20420650.
- ^ abcd Mears, Alice; Lakhoo, Kokila; Millar, Alastair JW (2010). "Síndrome del intestino corto" (PDF) . En Ameh, Emmanuel A.; Bickler, Stephen W.; Lakhoo, Kokila; Nwomeh, Benedict C.; Poenaru, Dan (eds.). Cirugía pediátrica: un texto completo para África. Global Help. págs. 424–8. ISBN 978-1-60189-091-7.
- ^ abcde Grant, David; Abu-Elmagd, Kareem; Reyes, Jorge; Tzakis, Andreas; Langnas, Alan; Fishbein, Thomas; Goulet, Olivier; Farmer, Douglas (2005). "Informe de 2003 del Registro de Trasplante de Intestino". Anales de Cirugía . 241 (4): 607–13. doi :10.1097/01.sla.0000157265.85388.a1. PMC 1357064 . PMID 15798462.
- ^ Koletzko, Berthold; Goulet, Olivier; Hunt, Joanne; Krohn, Kathrin; Shamir, Raanan (2005). "1. Directrices sobre nutrición parenteral pediátrica de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición Pediátricas (ESPGHAN) y la Sociedad Europea de Nutrición Clínica y Metabolismo (ESPEN), con el apoyo de la Sociedad Europea de Investigación Pediátrica (ESPR)". Revista de Gastroenterología y Nutrición Pediátricas . 41 (Supl. 2): S1–87. doi : 10.1097/01.mpg.0000181841.07090.f4 . PMID 16254497. S2CID 42811817.
- ^ abcdefghijklmnop Garg, Mayur; Jones, Robert M; Vaughan, Rhys B; Testro, Adam G (2011). "Trasplante intestinal: estado actual y direcciones futuras". Revista de Gastroenterología y Hepatología . 26 (8): 1221–8. doi : 10.1111/j.1440-1746.2011.06783.x . PMID 21595748.
- ^ Frongia, Giovanni; Kessler, Markus; Weih, Sandra; Nickkholgh, Arash; Mehrabi, Arianeb; Holland-Cunz, Stefan (2013). "Comparación de los procedimientos LILT y STEP en niños con síndrome del intestino corto: una revisión sistemática de la literatura". Revista de cirugía pediátrica . 48 (8): 1794–805. doi :10.1016/j.jpedsurg.2013.05.018. PMID 23932625.
- ^ Bianchi, A (1997). "Alargamiento y adaptación longitudinal del intestino: resultados en 20 niños". Revista de la Royal Society of Medicine . 90 (8): 429–32. doi :10.1177/014107689709000804. PMC 1296456 . PMID 9306995.
- ^ abcdefghijklmno Vianna, Rodrigo M.; Mangus, Richard S.; Tector, A. José (2008). "Estado actual del trasplante multivisceral y de intestino delgado". Avances en Cirugía . 42 : 129–50. doi :10.1016/j.yasu.2008.03.008. PMID 18953814.
- ^ abcdefg Fishbein, Thomas M. (2009). "Trasplante intestinal". New England Journal of Medicine . 361 (10): 998–1008. doi :10.1056/NEJMra0804605. PMID 19726774. S2CID 205115492.
- ^ Fishbein, Thomas M.; Matsumoto, Cal S. (2006). "Terapia de reemplazo intestinal: momento e indicaciones para la derivación de pacientes a un programa de rehabilitación y trasplante intestinal". Gastroenterología . 130 (2 Suppl 1): S147–51. doi : 10.1053/j.gastro.2005.12.004 . PMID 16473063.
- ^ abcde Troppmann, Christoph; Gruessne, Rainer WG (2001). "Trasplante de intestino". En Holzheimer, René G; Mannick, John A (eds.). Tratamiento quirúrgico: basado en evidencia y orientado a problemas . Múnich: Zuckschwerdt. ISBN 3-88603-714-2.
- ^ abcde Yersiz, Hasan; Renz, John F.; Hisatake, Garrett M.; Gordon, Sherylin; Saggi, Bob H.; Feduska, Nicholas J.; Busuttil, Ronald W.; Farmer, Douglas G. (2003). "Técnicas de obtención intestinal aislada y multivisceral". Trasplante de hígado . 9 (8): 881–6. doi : 10.1053/jlts.2003.50155 . PMID 12884206.
- ^ Gruessner, Rainer WG; Sharp, Harvey L. (1997). "Trasplante intestinal de un paciente vivo: primer informe de una técnica quirúrgica estandarizada". Trasplante . 64 (11): 1605–7. doi : 10.1097/00007890-199712150-00019 . PMID 9415566.
- ^ Lock, Margaret M. (2002). Dos veces muerta: trasplantes de órganos y la reinvención de la muerte . University of California Press. ISBN 978-0-520-22814-6.[ página necesaria ]
- ^ abc Testa, Giuliano; Panaro, Fabricio; Scena, Stefano; Holterman, Marcos; Abcariano, Herand; Benedetti, Enrico (2004). "Trasplante de intestino delgado relacionado con seres vivos". Anales de Cirugía . 240 (5): 779–84. doi :10.1097/01.sla.0000143266.59408.d7. PMC 1356482 . PMID 15492558.
- ^ Kim, WW; Gagner, M.; Fukuyama, S.; Hung, TI; Biertho, L.; Jacob, BP; Gentileschi, P. (2002). "Obtención laparoscópica de injerto de intestino delgado para trasplante de intestino delgado". Endoscopia quirúrgica . 16 (12): 1786–9. doi :10.1007/s00464-001-8249-9. PMID 12239647. S2CID 9202249.
- ^ Abu-Elmagd, Kareem; Fung, John; Bueno, Javier; Martin, Dolly; Madariaga, Juan R.; Mazariegos, George; Bond, Geoffrey; Molmenti, Ernesto; Corry, Robert J.; Starzl, Thomas E.; Reyes, Jorge (2000). "Logística y técnica para la obtención de injertos intestinales, pancreáticos y hepáticos del mismo donante". Anales de Cirugía . 232 (5): 680–7. doi :10.1097/00000658-200011000-00010. PMC 1421222 . PMID 11066140.
- ^ ab Tietz, Norbert W. (1995). Guía clínica de pruebas de laboratorio . WB Saunders. ISBN 978-0-7216-5035-7.[ página necesaria ]
- ^ Pascher, Andreas; Kohler, Sven; Neuhaus, Peter; Pratschke, Johann (2008). "Estado actual y perspectivas futuras del trasplante intestinal". Transplant International . 21 (5): 401–14. doi : 10.1111/j.1432-2277.2008.00637.x . PMID 18282247.
- ^ ab Khan, KM; Desai, CS; Mete, M.; Desale, S.; Girlanda, R.; Hawksworth, J.; Matsumoto, C.; Kaufman, S.; Fishbein, T. (2014). "Tendencias en desarrollo en la lista de espera para trasplantes intestinales". Revista estadounidense de trasplantes . 14 (12): 2830–7. doi : 10.1111/ajt.12919 . PMID 25395218. S2CID 12062834.
- ^ Hebert, M (1997). "Contribuciones del metabolismo hepático e intestinal y de la glicoproteína P a la administración oral de ciclosporina y tacrolimus". Advanced Drug Delivery Reviews . 27 (2–3): 201–214. doi :10.1016/S0169-409X(97)00043-4. PMID 10837558.
- ^ O'Hara, Ann M; Shanahan, Fergus (2006). "La flora intestinal como un órgano olvidado". EMBO Reports . 7 (7): 688–93. doi :10.1038/sj.embor.7400731. PMC 1500832 . PMID 16819463.
- ^ ab Lao, OB; Healey, PJ; Perkins, JD; Horslen, S.; Reyes, JD; Goldin, AB (2010). "Resultados en niños después del trasplante intestinal". Pediatría . 125 (3): e550–8. doi :10.1542/peds.2009-1713. PMC 2854035 . PMID 20142294.
- ^ Krawinkel, Michael B; Scholz, Dietmar; Busch, Andreas; Kohl, Martina; Wessel, Lucas M; Zimmer, Klaus-Peter (2012). "Insuficiencia intestinal crónica en niños". Deutsches Ärzteblatt Internacional . 109 (22–23): 409–15. doi :10.3238/arztebl.2012.0409. PMC 3389745 . PMID 22778793.
- ^ Rovera, Giuseppe M.; DiMartini, Andrea2; Schoen, Robert E.; Rakela, Jorge; Abu-Elmagd, Kareem; Graham, Toby O. (1998). "Calidad de vida de los pacientes tras el trasplante intestinal". Trasplante . 66 (9): 1141–5. doi : 10.1097/00007890-199811150-00005 . PMID 9825808.
{{cite journal}}: CS1 maint: nombres numéricos: lista de autores ( enlace )
Enlaces externos
- Trasplante de vida
- Colaboración con el equipo de trasplantes Archivado el 3 de junio de 2015 en Wayback Machine por UNOS
- Trasplante intestinal en eMedicine
- Trasplante intestinal para la enfermedad de Crohn, WebMD