Toxoplasma gondii
| Toxoplasma gondii | |
|---|---|
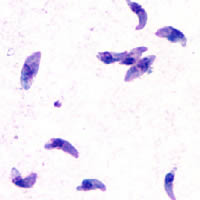 | |
| Taquizoítos de T. gondii teñidos con Giemsa , aumento de 1000× | |
| Clasificación científica | |
| Dominio: | Eucariota |
| Clado : | Diaforéticos |
| Clado : | RAE |
| Clado : | Alveolado |
| Filo: | Apicompleja |
| Clase: | Conoidasidas |
| Orden: | Eucoccidiorida |
| Familia: | Sarcocystidae |
| Subfamilia: | Toxoplasmatinae |
| Género: | Toxoplasma Nicolle y Manceaux , 1909 [2] |
| Especies: | T. gondii |
| Nombre binomial | |
| Toxoplasma gondii (Nicolle y Manceaux, 1908) [1] | |

Toxoplasma gondii ( /ˈtɒksəˌplæzməˈɡɒndii.aɪ,-iː/ ) es un protozoo parásito ( específicamente un apicomplejo ) que causa toxoplasmosis . [ 3 ] Encontrado en todo el mundo, T. gondii es capaz de infectar virtualmente a todoslos animales de sangre caliente, [4] : 1 pero los félidos son los únicos huéspedes definitivos conocidos en losque el parásito puede experimentar reproducción sexual . [ 5 ] [ 6 ]
En roedores , T. gondii altera el comportamiento de maneras que aumentan las posibilidades de que los roedores sean presa de los felinos. [7] [8] [9] El apoyo a esta "hipótesis de manipulación" proviene de estudios que muestran que las ratas infectadas con T. gondii tienen una menor aversión a la orina de gato, mientras que la infección en ratones reduce la ansiedad general , aumenta los comportamientos exploratorios y aumenta la pérdida de aversión a los depredadores en general. [7] [10] Debido a que los gatos son uno de los únicos huéspedes dentro de los cuales T. gondii puede reproducirse sexualmente, se piensa que tales manipulaciones del comportamiento son adaptaciones evolutivas que aumentan el éxito reproductivo del parásito, ya que los roedores que no evitan las habitaciones de los gatos tendrán más probabilidades de convertirse en presas de gatos. [7] Los mecanismos primarios de los cambios de comportamiento inducidos por T. gondii en roedores ocurren a través de la remodelación epigenética en las neuronas que gobiernan los comportamientos relevantes (por ejemplo, la hipometilación de los genes relacionados con la vasopresina arginina en la amígdala medial , que disminuyen en gran medida la aversión a los depredadores). [11] [12]
En los seres humanos, en particular en los bebés y en aquellos con inmunidad debilitada , la infección por T. gondii es generalmente asintomática, pero puede provocar un caso grave de toxoplasmosis . [13] [4] T. gondii puede causar inicialmente síntomas leves similares a los de la gripe en las primeras semanas posteriores a la exposición, pero por lo demás, los adultos humanos sanos son asintomáticos. [14] [13] [4] Este estado asintomático de infección se conoce como infección latente y se ha asociado con numerosas alteraciones sutiles del comportamiento, psiquiátricas y de personalidad en los seres humanos. [14] [15] [16] Los cambios de comportamiento observados entre los seres humanos infectados y no infectados incluyen una menor aversión a la orina de gato (pero con trayectorias divergentes según el género) y un mayor riesgo de esquizofrenia . [17] La evidencia preliminar ha sugerido que la infección por T. gondii puede inducir algunas de las mismas alteraciones en el cerebro humano que las observadas en los roedores. [18] [19] [9] [20] [21] [22] Muchas de estas asociaciones han sido intensamente debatidas y estudios más recientes han descubierto que son débiles, concluyendo: [23]
En general, hubo poca evidencia de que T. gondii estuviera relacionado con un mayor riesgo de trastorno psiquiátrico, mal control de los impulsos, aberraciones de personalidad o deterioro neurocognitivo.
Sin embargo, existe evidencia de que T. gondii puede causar ideación suicida y suicidio en humanos. [24]
T. gondii es uno de los parásitos más comunes en los países desarrollados; [25] [26] Los estudios serológicos estiman que hasta el 50% de la población mundial ha estado expuesta y puede estar infectada crónicamente con T. gondii ; aunque las tasas de infección difieren significativamente de un país a otro. [14] [27] Las estimaciones han demostrado que la seroprevalencia de IgG más alta se encuentra en Etiopía , con un 64,2%, en 2018. [28]
Estructura

T. gondii contiene orgánulos llamados roptrias y micronemas , así como otros orgánulos.
Ciclo vital


El ciclo de vida de T. gondii puede resumirse ampliamente en dos componentes: un componente sexual que ocurre solo dentro de los gatos (felinos, salvajes o domésticos), y un componente asexual que puede ocurrir dentro de prácticamente todos los animales de sangre caliente, incluidos humanos, gatos y pájaros. [29] : 2 Debido a que T. gondii puede reproducirse sexualmente solo dentro de los gatos, los gatos son, por lo tanto, el huésped definitivo de T. gondii . Todos los demás huéspedes, en los que solo puede ocurrir la reproducción asexual, son huéspedes intermediarios .
Reproducción sexual en el huésped definitivo felino
Cuando un felino se infecta con T. gondii (por ejemplo, al consumir un ratón infectado que porta los quistes tisulares del parásito), el parásito sobrevive al paso por el estómago y acaba infectando las células epiteliales del intestino delgado del gato. [29] : 39 Dentro de estas células intestinales, los parásitos experimentan desarrollo sexual y reproducción, produciendo millones de quistes de paredes gruesas que contienen cigotos , conocidos como ooquistes. Los felinos son el único huésped definitivo porque carecen de la expresión de la enzima delta-6-desaturasa (D6D) en su intestino. Esta enzima convierte el ácido linoleico ; la ausencia de expresión permite la acumulación sistémica de ácido linoleico. Hallazgos recientes demostraron que este exceso de ácido linoleico es esencial para la reproducción sexual de T. gondii . [6]

Desprendimiento de ooquistes felinos
Las células epiteliales infectadas finalmente se rompen y liberan ooquistes en el lumen intestinal , donde se eliminan en las heces del gato. [4] : 22 Los ooquistes pueden luego propagarse al suelo, agua, alimentos o cualquier cosa potencialmente contaminada con las heces. Altamente resistentes, los ooquistes pueden sobrevivir y seguir siendo infecciosos durante muchos meses en climas fríos y secos. [30]
La ingestión de ooquistes por parte de humanos u otros animales de sangre caliente es una de las vías de infección más comunes. [31] Los humanos pueden estar expuestos a los ooquistes, por ejemplo, al consumir verduras sin lavar o agua contaminada, o al manipular las heces (cama) de un gato infectado. [29] : 2 [32] Aunque los gatos también pueden infectarse al ingerir ooquistes, son mucho menos sensibles a la infección por ooquistes que los huéspedes intermediarios. [33] [4] : 107
Infección inicial del huésped intermediario
Los huéspedes intermediarios encontrados incluyen cerdos, pollos, cabras, ovejas [29] : 2 y Macropus rufus por Moré et al. 2010. [34] : 162 El ganado vacuno y los caballos son resistentes y se cree que son incapaces de una infección significativa. [29] : 11 Se considera que T. gondii tiene tres etapas de infección: la etapa de taquizoíto de división rápida, la etapa de bradizoíto de división lenta dentro de los quistes tisulares y la etapa ambiental del ooquiste. [35] Los taquizoítos también se conocen como "merozoítos taquizoicos" y los bradizoítos como "merozoítos bradizoicos". [36] Cuando un ooquiste o un quiste tisular es ingerido por un ser humano u otro animal de sangre caliente, la pared resistente del quiste se disuelve por enzimas proteolíticas en el estómago y el intestino delgado, liberando esporozoítos del interior del ooquiste. [31] [35] Los parásitos primero invaden las células dentro y alrededor del epitelio intestinal, y dentro de estas células, los parásitos se diferencian en taquizoítos, la etapa celular móvil y de rápida multiplicación de T. gondii . [29] : 39 Los quistes tisulares en tejidos como el cerebro y el tejido muscular, se forman aproximadamente de 7 a 10 días después de la infección inicial. [35] Aunque se ha observado una infección grave de M. rufus , se desconoce si esto es común. [34]
Reproducción asexual en el huésped intermediario
Dentro de las células huésped, los taquizoítos se replican dentro de vacuolas especializadas (llamadas vacuolas parasitóforas ) creadas a partir de la membrana de la célula huésped durante la invasión a la célula. [29] : 23–39 Los taquizoítos se multiplican dentro de esta vacuola hasta que la célula huésped muere y se rompe, liberando y diseminando los taquizoítos a través del torrente sanguíneo a todos los órganos y tejidos del cuerpo, incluido el cerebro . [29] : 39–40
Crecimiento en cultivo de tejidos
El parásito puede cultivarse fácilmente en monocapas de células de mamíferos mantenidas in vitro en cultivos de tejidos . Invade y se multiplica fácilmente en una amplia variedad de líneas celulares de fibroblastos y monocitos . En cultivos infectados, el parásito se multiplica rápidamente y miles de taquizoítos se desprenden de las células infectadas y entran en las células adyacentes, destruyendo la monocapa a su debido tiempo. Luego se pueden infectar nuevas monocapas utilizando una gota de este líquido de cultivo infectado y el parásito se puede mantener indefinidamente sin necesidad de animales.
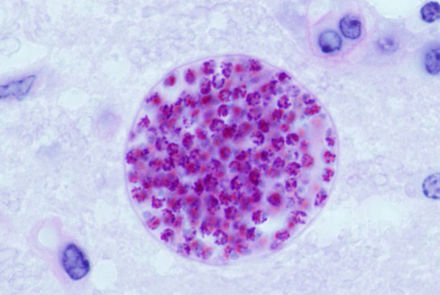
Formación de quistes tisulares.
Tras el periodo inicial de infección caracterizado por la proliferación de taquizoítos en todo el cuerpo, la presión del sistema inmunitario del huésped hace que los taquizoítos de T. gondii se conviertan en bradizoítos, la fase celular semidormida y de división lenta del parásito. [37] Dentro de las células huésped, los grupos de estos bradizoítos se conocen como quistes tisulares. La pared del quiste está formada por la membrana de la vacuola parasitófora. [29] : 343 Aunque los quistes tisulares que contienen bradizoítos pueden formarse en prácticamente cualquier órgano, los quistes tisulares se forman y persisten predominantemente en el cerebro, los ojos y el músculo estriado (incluido el corazón). [29] : 343 Sin embargo, los tropismos tisulares específicos pueden variar entre especies de huéspedes intermediarios; en los cerdos, la mayoría de los quistes tisulares se encuentran en el tejido muscular, mientras que en los ratones, la mayoría de los quistes se encuentran en el cerebro. [29] : 41
Los quistes suelen tener un tamaño que oscila entre cinco y 50 μm de diámetro, [38] (siendo 50 μm aproximadamente dos tercios del ancho del cabello humano promedio). [39]
El consumo de quistes tisulares en la carne es uno de los principales medios de infección por T. gondii , tanto para los seres humanos como para los animales de sangre caliente que comen carne. [29] : 3 Los seres humanos consumen quistes tisulares cuando comen carne cruda o poco cocida (en particular, cerdo y cordero). [40] El consumo de quistes tisulares también es el principal medio por el cual los gatos se infectan. [4] : 46
Una exhibición en el Museo de Historia Natural de San Diego afirma que la escorrentía urbana con heces de gato transporta Toxoplasma gondii al océano, lo que puede matar a las nutrias marinas. [41]
Infección crónica
Los quistes tisulares pueden mantenerse en el tejido del huésped durante toda la vida del animal. [29] : 580 Sin embargo, la presencia perpetua de quistes parece deberse a un proceso periódico de ruptura y reenquistamiento de quistes, en lugar de una vida perpetua de quistes o bradizoítos individuales. [29] : 580 En un momento dado en un huésped crónicamente infectado, un porcentaje muy pequeño de quistes se rompen, [29] : 45 aunque la causa exacta de esta ruptura de quiste tisular, a partir de 2010, aún no se conoce. [4] : 47
En teoría, T. gondii puede transmitirse entre huéspedes intermediarios de forma indefinida a través de un ciclo de consumo de quistes tisulares en la carne. Sin embargo, el ciclo de vida del parásito comienza y se completa solo cuando el parásito pasa a un huésped felino, el único huésped en el que el parásito puede volver a experimentar el desarrollo sexual y la reproducción. [31]
Estructura de la población en estado salvaje
En 2006, los investigadores revisaron la evidencia de que T. gondii tiene una estructura poblacional inusual dominada por tres linajes clonales llamados Tipos I, II y III que se encuentran en América del Norte y Europa, a pesar de la ocurrencia de una fase sexual en su ciclo de vida. Estimaron que existió un ancestro común hace unos 10.000 años. [42] Los autores de un estudio posterior y más amplio sobre 196 aislamientos de diversas fuentes, incluyendo T. gondii en el águila calva, el lobo gris, el zorro ártico y la nutria marina, también encontraron que las cepas de T. gondii que infectan la fauna silvestre de América del Norte tienen una diversidad genética limitada con la aparición de solo unos pocos tipos clonales principales. Encontraron que el 85% de las cepas en América del Norte eran de uno de los tres genotipos generalizados II, III y Tipo 12. Por lo tanto, T. gondii ha conservado la capacidad de tener sexo en América del Norte durante muchas generaciones, produciendo poblaciones en gran parte clonales, y los apareamientos han generado poca diversidad genética. [43]
Etapas celulares
Durante los diferentes períodos de su ciclo de vida, los parásitos individuales se transforman en varias etapas celulares, cada una de las cuales se caracteriza por una morfología , bioquímica y comportamiento celular distintos. Estas etapas incluyen los taquizoítos, los merozoítos, los bradizoítos (que se encuentran en los quistes tisulares) y los esporozoítos (que se encuentran en los ooquistes).
Algunas etapas son móviles y algunas proteínas quinasas dependientes del calcio (Las TgCDPK están involucradas en la motilidad de este parásito. [44] [45] Gaji et al. 2015 encontraronTgCDPK3 es necesario para iniciar la acción de la motilidad porque fosforila la miosina A de T. gondii ( TgMYOA ). [44] [45] TgCDPK3 es el ortólogo funcional de CDPK1 en este parásito. [45]
Taquizoitos

Los taquizoítos móviles y de rápida multiplicación son responsables de expandir la población del parásito en el huésped. [46] [29] : 19 Cuando un huésped consume un quiste tisular (que contiene bradizoítos) o un ooquiste (que contiene esporozoítos), los bradizoítos o esporozoítos se convierten en taquizoítos al infectar el epitelio intestinal del huésped. [29] : 359 Durante el período agudo inicial de la infección, los taquizoítos se propagan por todo el cuerpo a través del torrente sanguíneo. [29] : 39–40 Durante las últimas etapas latentes (crónicas) de la infección, los taquizoítos se convierten en bradizoítos para formar quistes tisulares.
Merozoitos

Al igual que los taquizoítos, los merozoítos se dividen rápidamente y son responsables de expandir la población del parásito dentro del intestino del gato antes de la reproducción sexual. [29] Cuando un huésped definitivo felino consume un quiste tisular (que contiene bradizoítos), los bradizoítos se convierten en merozoítos dentro de las células epiteliales intestinales. Después de un breve período de rápido crecimiento de la población en el epitelio intestinal, los merozoítos se convierten en las etapas sexuales no infecciosas del parásito para experimentar la reproducción sexual, lo que finalmente da como resultado ooquistes que contienen cigotos. [29] : 306
El estudio de las fases sexuales del ciclo de vida de T. gondii sigue siendo un desafío y la determinación de los desencadenantes precisos y los mecanismos moleculares que rigen este programa de desarrollo sigue siendo un área de investigación en curso. Los principales desafíos asociados con la capacidad de cultivar etapas presexuales y sexuales de T. gondii in vitro han limitado nuestra comprensión de este programa de desarrollo y cómo es desencadenado por el parásito en respuesta a la infección del gato. Múltiples estudios [47] , [48] revelaron diferencias distintivas en los transcriptomas de las etapas asexuales y sexuales de T. gondii . Además, las disparidades metabólicas dentro del huésped felino se han identificado como factores clave que influyen en la transición a las etapas sexuales. [49] Sin embargo, la vinculación de los patrones de expresión genética con las transiciones de etapa y el descifrado de los desencadenantes genéticos que impulsan el cambio del desarrollo asexual al sexual siguen sin resolverse.
Los recientes avances importantes en el campo han arrojado nueva luz sobre los mecanismos reguladores que gobiernan el desarrollo sexual en T. gondii . Farhat y colegas [50] demostraron que los modificadores de cromatina MORC y HDAC3 desempeñan papeles críticos en el silenciamiento de genes específicos del desarrollo sexual. En parásitos sin MORC, se observó una amplia activación de la expresión de genes sexuales. En un estudio posterior, se sugirió que los parásitos sin MORC han interrumpido el silenciamiento de genes subteloméricos. La desorganización en los telómeros puede haber llevado a la desregulación del desarrollo sexual.
Además, el descubrimiento de factores de transcripción específicos esenciales para el compromiso sexual ha proporcionado información valiosa sobre la intrincada red reguladora que orquesta la especificidad de la etapa en T. gondii . Se han identificado múltiples factores de transcripción de parásitos como supresores críticos del desarrollo presexual, [51] lo que permite el estudio de las etapas presexuales y abre nuevas vías para usar la genética para impulsar el ciclo sexual completo in vitro . Específicamente, el agotamiento de AP2XI-2 y AP2XII-1 en T. gondii induce la expresión génica específica del merozoito, lo que aumenta la posibilidad de cultivar el desarrollo sexual de T. gondii en entornos de laboratorio.
Aún persisten preguntas cruciales sobre los determinantes genéticos que determinan si los parásitos se convierten en macrogametos o microgametos. El desarrollo de nuevos enfoques moleculares y genómicos, como la transcriptómica y la proteómica de células individuales , debería ser útil para quienes trabajan en este campo para desentrañar las complejidades moleculares de este proceso.
Bradizoitos
Los bradizoítos son la fase de división lenta del parásito que forma los quistes tisulares. Cuando un huésped no infectado consume un quiste tisular, los bradizoítos liberados del quiste infectan las células epiteliales intestinales antes de convertirse en la fase proliferativa de taquizoíto. [29] : 359 Después del período inicial de proliferación en todo el cuerpo del huésped, los taquizoítos se convierten nuevamente en bradizoítos, que se reproducen dentro de las células del huésped para formar quistes tisulares en el nuevo huésped.
Esporozoitos
Los esporozoitos son la fase del parásito que reside dentro de los ooquistes. Cuando un ser humano u otro huésped de sangre caliente consume un ooquiste, se liberan esporozoitos que infectan las células epiteliales antes de convertirse en la fase proliferativa de taquizoíto. [29] : 359
Respuesta inmune
Inicialmente, una infección por T. gondii estimula la producción de IL-2 e IFN-γ por el sistema inmunológico innato. [37] La producción continua de IFN-γ es necesaria para el control de la infección aguda y crónica por T. gondii . [37] Estas dos citocinas provocan una respuesta inmunitaria mediada por células T CD4+ y CD8+. [37] Por lo tanto, las células T desempeñan un papel central en la inmunidad contra la infección por Toxoplasma . Las células T reconocen los antígenos de Toxoplasma que les presentan las moléculas del Complejo Mayor de Histocompatibilidad (CMH) del propio cuerpo. La secuencia genética específica de una molécula de MHC dada difiere dramáticamente entre individuos, por lo que estas moléculas están involucradas en el rechazo de trasplantes. Los individuos que portan ciertas secuencias genéticas de moléculas de MHC tienen muchas más probabilidades de estar infectados con Toxoplasma . Un estudio de más de 1600 personas encontró que la infección por Toxoplasma era especialmente común entre las personas que expresaban ciertos alelos MHC (HLA-B*08:01, HLA-C*04:01, HLA-DRB 03:01, HLA-DQA*05:01 y HLA-DQB*02:01). [52]
La IL-12 se produce durante la infección por T. gondii para activar las células asesinas naturales (NK) . [37] El triptófano es un aminoácido esencial para T. gondii, que extrae de las células huésped. El IFN-γ induce la activación de la indol-amina-2,3-dioxigenasa (IDO) y la triptófano-2,3-dioxigenasa (TDO), dos enzimas responsables de la degradación del triptófano. [53] La presión inmunitaria finalmente lleva al parásito a formar quistes que normalmente se depositan en los músculos y en el cerebro de los huéspedes. [37]
Respuesta inmune y alteraciones del comportamiento
La activación de IDO y TDO mediada por IFN-γ es un mecanismo evolutivo que sirve para matar de hambre al parásito, pero puede resultar en el agotamiento del triptófano en el cerebro del huésped. IDO y TDO degradan el triptófano a N-formilquinurenina . La administración de L-quinurenina es capaz de inducir un comportamiento similar a la depresión en ratones. [53] Se ha demostrado que la infección por T. gondii aumenta los niveles de ácido quinurénico (KYNA) en los cerebros de ratones infectados y en el cerebro de personas esquizofrénicas. [53] Los niveles bajos de triptófano y serotonina en el cerebro ya se asociaban con la depresión. [54]
Factores de riesgo de infección humana
Se han identificado los siguientes factores de riesgo para la infección por T. gondii en humanos y animales de sangre caliente:
- al consumir carne cruda o poco cocida que contenga quistes de tejido de T. gondii . [32] [55] [56] [57] [58] La amenaza más común para los ciudadanos de los Estados Unidos es comer carne de cerdo cruda o poco cocida. [59]
- al ingerir agua, tierra, verduras o cualquier cosa contaminada con ooquistes desprendidos en las heces de un animal infectado. [55] La materia fecal de gato es particularmente peligrosa: un solo quiste consumido por un gato puede dar lugar a miles de ooquistes. Por eso, los médicos recomiendan que las personas embarazadas o enfermas no limpien la caja de arena del gato en casa. [59] Estos ooquistes son resistentes a las duras condiciones ambientales y pueden sobrevivir más de un año en el suelo contaminado. [35] [60]
- de una transfusión de sangre o un trasplante de órgano [61]
- por transmisión transplacentaria de la madre al feto, en particular cuando se contrae T. gondii durante el embarazo [55]
- por beber leche de cabra no pasteurizada [56]
- de aguas residuales crudas y tratadas y mariscos bivalvos contaminados por aguas residuales tratadas [62] [63] [64] [65]
Un argumento común en el debate sobre si es ético tener un gato involucra la cuestión de la transmisión de T. gondii a los humanos. [66] Aunque "vivir en un hogar con un gato que usaba una caja de arena estaba fuertemente asociado con la infección", [32] y que vivir con varios gatitos o cualquier gato menor de un año tiene cierta importancia, [56] varios otros estudios afirman haber demostrado que vivir en un hogar con un gato no es un factor de riesgo significativo para la infección por T. gondii . [57] [67]
Los vectores específicos de transmisión también pueden diferir según la ubicación geográfica. "Se cree que el agua de mar en California está contaminada por ooquistes de T. gondii que se originan en las heces de gato, sobreviven o evitan el tratamiento de aguas residuales y viajan a la costa a través de los sistemas fluviales. Se ha identificado T. gondii en un mejillón de California mediante reacción en cadena de la polimerasa y secuenciación de ADN. En vista de la posible presencia de T. gondii , las mujeres embarazadas y las personas inmunodeprimidas deben ser conscientes de este riesgo potencial asociado con el consumo de ostras, mejillones y almejas crudas". [56]
En animales de sangre caliente, como ratas pardas , ovejas y perros, también se ha demostrado que T. gondii se transmite sexualmente. [68] [69] [70] Aunque T. gondii puede infectar, transmitirse y reproducirse asexualmente dentro de los humanos y prácticamente todos los demás animales de sangre caliente, el parásito puede reproducirse sexualmente solo dentro de los intestinos de los miembros de la familia de los gatos (félidos) . [31] Por lo tanto, los félidos son los huéspedes definitivos de T. gondii ; todos los demás huéspedes (como los humanos u otros mamíferos) son huéspedes intermediarios .
Prevención de infecciones
Se recomiendan las siguientes precauciones para prevenir o reducir en gran medida las probabilidades de infectarse con T. gondii . Esta información ha sido adaptada de los sitios web de los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos [71] y de la Clínica Mayo [72] .
De la comida
Las prácticas básicas de seguridad en la manipulación de alimentos pueden prevenir o reducir las posibilidades de infectarse con T. gondii , como lavar frutas y verduras sin lavar y evitar carne, aves y mariscos crudos o poco cocidos. Otras prácticas inseguras, como beber leche no pasteurizada o agua no tratada, pueden aumentar las probabilidades de infección. [71] Como T. gondii se transmite comúnmente a través de la ingestión de quistes microscópicos en los tejidos de animales infectados, la carne que no está preparada para destruirlos presenta un riesgo de infección. Congelar la carne durante varios días a temperaturas bajo cero (0 °F o −18 °C) antes de cocinarla puede descomponer todos los quistes, ya que rara vez sobreviven a estas temperaturas. [4] : 45 Durante la cocción, los cortes enteros de carne roja deben cocinarse a una temperatura interna de al menos 145 °F (63 °C). La carne a medio cocinar generalmente se cocina entre 130 y 140 °F (55 y 60 °C), [73] por lo que se recomienda cocinar la carne al menos a medio . Después de la cocción, se debe dejar reposar durante 3 minutos antes de consumir. Sin embargo, la carne molida se debe cocinar a una temperatura interna de al menos 160 °F (71 °C) sin período de reposo. Todas las aves de corral se deben cocinar a una temperatura interna de al menos 165 °F (74 °C). Después de la cocción, se debe dejar reposar durante 3 minutos antes de consumir.
Del medio ambiente
This section needs additional citations for verification. (February 2023) |
Los ooquistes en las heces de gato tardan al menos un día en esporular (volverse infecciosos después de ser eliminados), por lo que desechar la arena para gatos a diario reduce en gran medida la posibilidad de que se desarrollen ooquistes infecciosos. Como estos pueden propagarse y sobrevivir en el medio ambiente durante meses, las personas deben usar guantes cuando trabajen en el jardín o con tierra, y deben lavarse las manos inmediatamente después de desechar la arena para gatos. Estas precauciones se aplican a los areneros o areneros para jugar al aire libre, que deben cubrirse cuando no se utilicen. Las heces de gato nunca deben tirarse por el inodoro.
Las mujeres embarazadas tienen mayor riesgo de transmitir el parásito a su hijo no nacido y las personas inmunodeprimidas de contraer una infección persistente. Por este motivo, no deben cambiar ni manipular las cajas de arena de los gatos. Lo ideal es que los gatos se mantengan en el interior y se les dé solo alimentos que tengan un riesgo bajo o nulo de portar ooquistes, como comida comercial para gatos o comida de mesa bien cocida.
Vacunación
No existe ninguna vacuna humana aprobada contra Toxoplasma gondii . [74] [75] Se están realizando investigaciones sobre vacunas humanas. [74] [76]
Para las ovejas , una vacuna viva aprobada vendida como Toxovax (de MSD Animal Health ) proporciona protección de por vida. [74] [77] [78]
Actualmente no existe una vacuna comercialmente disponible para prevenir la infección por T. gondii en gatos. Sin embargo, se están realizando investigaciones sobre vacunas felinas contra la toxoplasmosis y varias candidatas han mostrado resultados positivos en ensayos clínicos. [74] [79]
Tratamiento
En los seres humanos, la toxoplasmosis activa se puede tratar con una combinación de fármacos como pirimetamina y sulfadiazina , más ácido folínico . Los pacientes inmunodeprimidos pueden necesitar un tratamiento continuo hasta que se restablezca su sistema inmunológico. [80]
Efectos ambientales
En muchas partes del mundo, donde hay grandes poblaciones de gatos salvajes, existe un mayor riesgo para la fauna silvestre nativa debido al aumento de la infección por Toxoplasma gondii . Se ha descubierto que las concentraciones séricas de T. gondii en la población silvestre aumentaron donde hay grandes cantidades de poblaciones de gatos. Esto crea un entorno peligroso para los organismos que no han evolucionado en cohabitación con los felinos y sus parásitos contribuyentes. [81]
Impacto sobre las especies marinas
Visones y nutrias
La toxoplasmosis es uno de los factores que contribuyen a la mortalidad en las nutrias marinas del sur , especialmente en áreas donde hay una gran escorrentía urbana. [82] En sus hábitats naturales, las nutrias marinas controlan las poblaciones de erizos de mar y, por lo tanto, controlan indirectamente los bosques de algas marinas. Al permitir el crecimiento de las algas marinas, se protegen otras poblaciones marinas y se reducen las emisiones de CO2 debido a la capacidad de las algas para absorber el carbono atmosférico. [ 83] Un examen de 105 nutrias que se encontraban en la playa reveló que el 38,1% tenía infecciones parasitarias y el 28% de dichas infecciones habían resultado en muertes por meningoencefalitis protozoaria. [82] Se encontró que Toxoplasma gondii era la causa principal en el 16,2% de estas muertes, mientras que el 6,7% de las muertes se debieron a un parásito protozoario estrechamente relacionado conocido como Sarcocystis neurona . [82]
Los visones, al ser semiacuáticos, también son susceptibles a la infección y a ser positivos a los anticuerpos contra T. gondii . [84] Los visones pueden seguir una dieta similar a la de las nutrias y se alimentan de crustáceos, peces e invertebrados, por lo que la ruta de transmisión sigue un patrón similar al de las nutrias. Debido a la capacidad del visón de atravesar la tierra con mayor frecuencia, y a que a menudo se lo considera una especie invasora en sí mismo, los visones son una amenaza mayor en el transporte de T. gondii a otras especies de mamíferos, en lugar de las nutrias, que tienen un alcance más restrictivo. [84]
Pingüinos de patas negras
Aunque poco estudiadas, las poblaciones de pingüinos, especialmente aquellas que comparten un ambiente con la población humana, están en riesgo debido a infecciones parasitarias, principalmente Toxoplasmosis gondii . Las principales subespecies de pingüinos que se han encontrado infectadas por T. gondii incluyen pingüinos de Magallanes y de Galápagos salvajes, así como pingüinos azules y africanos en cautiverio. [85] En un estudio, se encontró que 57 (43,2%) de 132 muestras de suero de pingüinos de Magallanes tenían T. gondii . Se sabe que la isla donde se encuentra el pingüino, Isla Magdalena, no tiene poblaciones de gatos, pero sí una población humana muy frecuente, lo que indica la posibilidad de transmisión. [85]
Histopatología
El examen de pingüinos de patas negras con toxoplasmosis revela hepatomegalia, esplenomegalia, hemorragia craneal y riñones necróticos. [86] El tejido alveolar y hepático presenta un alto número de células inmunes como macrófagos que contienen taquizoítos de T. gondii . [86] Las características histopatológicas en otros animales afectados con toxoplasmosis tenían taquizoítos en estructuras oculares como la retina que conducen a ceguera. [86]
Transmisión de agua
La transmisión de ooquistes es desconocida, aunque existen numerosos casos documentados de infección en especies marinas. Los investigadores han descubierto que los ovocitos de T. gondii pueden sobrevivir en agua de mar durante al menos seis meses, sin que la cantidad de concentración de sal afecte a su ciclo de vida. No se han realizado estudios sobre la capacidad del ciclo de vida de los ooquistes de T. gondii en ambientes de agua dulce, aunque las infecciones siguen estando presentes. Una posible hipótesis de transmisión es a través de especies de amebas, en particular Acanthamoeba spp., una especie que se encuentra en todos los ambientes acuáticos (agua dulce, salobre y salada). Normalmente, las amebas funcionan como un filtro natural, fagocitando los nutrientes y las bacterias que se encuentran en el agua. Sin embargo, algunos patógenos han aprovechado esto para su beneficio y han evolucionado para poder evitar su descomposición y, por lo tanto, sobrevivir encapsulados en la ameba; esto incluye a Holosporaceae, Pseudomonaceae, Burkholderiacceae, entre otras. [87] En general, esto ayuda al patógeno en el transporte, pero también lo protege de medicamentos y esterilizadores que, de lo contrario, causarían la muerte en el patógeno. [88] Los estudios han demostrado que los ooquistes de T. gondii pueden vivir dentro de las amebas después de haber sido engullidos durante al menos 14 días sin una eliminación significativa del parásito. [89] La capacidad del microorganismo para sobrevivir in vitro depende del propio microorganismo, pero hay algunos mecanismos generales presentes. Se ha descubierto que los ooquistes de T. gondii resisten un pH ácido y, por lo tanto, están protegidos por la acidificación que se encuentra en las vacuolas endocíticas y los lisosomas. [89] La fagocitosis aumenta aún más con la membrana superficial rica en carbohidratos ubicada en las amebas. [90] El patógeno puede liberarse por lisis de las amebas o por exocitosis, pero esto está poco estudiado [91]
Impacto sobre las aves silvestres
Casi todas las especies de aves que han sido analizadas para Toxoplasma gondii han resultado positivas. Las únicas especies de aves que no han presentado síntomas clínicos de toxoplasmosis serían los patos salvajes, y solo se ha encontrado un informe sobre patos domésticos en 1962. [92] Las especies con resistencia a T. gondii incluyen pavos domésticos, [93] búhos, halcones de cola roja y gorriones, dependiendo de la cepa de T. gondii . [94] T. gondii es considerablemente más grave en palomas, particularmente palomas coronadas, palomas ornamentales y palomas originarias de Australia y Nueva Zelanda. El inicio típico es rápido y generalmente resulta en la muerte. Los que sobreviven a menudo tienen condiciones crónicas de encefalitis y neuritis. [94] De manera similar, se observa que los canarios son tan graves como las palomas, pero los síntomas clínicos son más anormales en comparación con otras especies. La mayor parte de la infección afecta al ojo, causando ceguera, lesiones coroideas, conjuntivitis, atrofia del ojo, blefaritis y coriorretinitis [94]. La mayoría de las veces, la infección conduce a la muerte.
Esfuerzos ambientales actuales
La urbanización y el calentamiento global son extremadamente influyentes en la transmisión de T. gondii . [95] La temperatura y la humedad son factores enormes en la etapa de esporulación: la baja humedad siempre es fatal para los ooquistes, y también son vulnerables a temperaturas extremas. [95] La lluvia también es un factor importante para la supervivencia de los patógenos transmitidos por el agua. Debido a que el aumento de las precipitaciones aumenta directamente el caudal de los ríos, también aumenta la cantidad de flujo en las zonas costeras. Esto puede propagar patógenos transmitidos por el agua en amplias áreas.
No existe una vacuna eficaz contra T. gondii y se están realizando investigaciones sobre una vacuna viva. Alimentar a los gatos con comida disponible comercialmente, en lugar de carne cruda y poco cocida, evita que los felinos se conviertan en huéspedes de ooquistes, ya que la prevalencia es mayor en áreas donde se alimenta con carne cruda. [96] Los investigadores también sugieren que los dueños restrinjan a los gatos a vivir en interiores y a ser castrados o esterilizados para disminuir las poblaciones de gatos callejeros y reducir las interacciones con huéspedes intermediarios. Se sugiere que la materia fecal de las cajas de arena se recoja diariamente, se coloque en una bolsa sellable y se deseche en la basura en lugar de tirarla al inodoro, de modo que se limite la contaminación del agua. [97]
Los estudios han demostrado que los humedales con una alta densidad de vegetación disminuyen la concentración de ooquistes en el agua a través de dos posibles mecanismos. En primer lugar, la vegetación disminuye las velocidades del flujo, lo que permite una mayor sedimentación debido al aumento del tiempo de transporte. [97] En segundo lugar, la vegetación puede eliminar los ooquistes mediante su capacidad para filtrar mecánicamente el agua, así como mediante el proceso de adhesión (es decir, la fijación a las biopelículas). Se ha descubierto que las áreas de erosión y destrucción de humedales costeros albergan mayores concentraciones de ooquistes de T. gondii , que luego fluyen hacia aguas costeras abiertas. Se ha demostrado que los tratamientos físicos y químicos actuales que se utilizan normalmente en las instalaciones de tratamiento de agua son ineficaces contra T. gondii . Las investigaciones han demostrado que la desinfección con UV-C del agua que contiene ooquistes da como resultado la inactivación y posible esterilización. [98]
Genoma
Se han secuenciado los genomas de más de 60 cepas de T. gondii . La mayoría tienen un tamaño de 60 a 80 Mb y constan de 11 a 14 cromosomas . [99] [100] Las cepas principales codifican entre 7800 y 10 000 proteínas , de las cuales unas 5200 se conservan en RH, GT1, ME49 y VEG. [99] Se ha establecido una base de datos, ToxoDB, para documentar la información genómica sobre Toxoplasma . [101] [102] [103]
Historia
En 1908, mientras trabajaban en el Instituto Pasteur de Túnez , Charles Nicolle y Louis Manceaux descubrieron un organismo protozoario en los tejidos de un roedor parecido al hámster conocido como gundi , Ctenodactylus gundi . [31] Aunque Nicolle y Manceaux creyeron inicialmente que el organismo era un miembro del género Leishmania que describieron como "Leishmania gondii" , pronto se dieron cuenta de que habían descubierto un organismo completamente nuevo; lo rebautizaron como Toxoplasma gondii . El nuevo nombre del género Toxoplasma es una referencia a su morfología: Toxo , del griego τόξον ( toxon , 'arco, arco'), y πλάσμα ( plasma , 'forma, forma') y el huésped en el que fue descubierto, el gundi (gondii). [104] El mismo año en que Nicolle y Mancaeux descubrieron T. gondii , Alfonso Splendore identificó el mismo organismo en un conejo en Brasil . Sin embargo, no le dio un nombre. [31] En 1914, el tropicalista italiano Aldo Castellani "fue el primero en sospechar que la toxoplasmosis podía afectar a los humanos". [105]
La primera identificación concluyente de T. gondii en humanos fue en una niña que nació a término por cesárea el 23 de mayo de 1938 en el Babies' Hospital de la ciudad de Nueva York . [31] La niña comenzó a tener convulsiones a los tres días de edad y los médicos identificaron lesiones en las máculas de ambos ojos. Cuando murió al mes de edad, se realizó una autopsia . Se encontró que las lesiones descubiertas en su cerebro y tejido ocular tenían T. gondii tanto libre como intracelular . [31] El tejido infectado de la niña se homogeneizó y se inoculó intracerebralmente en conejos y ratones; luego desarrollaron encefalitis . Más tarde, se confirmó la transmisión congénita en muchas otras especies, particularmente ovejas y roedores infectados.
La posibilidad de transmisión de T. gondii a través del consumo de carne poco cocida fue propuesta por primera vez por D. Weinman y AH Chandler en 1954. [31] En 1960, se demostró que la pared del quiste relevante se disolvía en las enzimas proteolíticas que se encuentran en el estómago, liberando bradizoítos infecciosos en el estómago (que pasan al intestino). La hipótesis de transmisión a través del consumo de carne poco cocida se puso a prueba en un orfanato en París en 1965; la incidencia de T. gondii aumentó del 10% al 50% después de un año de agregar dos porciones de carne de res o de caballo poco cocida a las dietas diarias de muchos huérfanos, y al 100% entre los alimentados con chuletas de cordero poco cocidas. [31]
Un estudio realizado en Mumbai en 1959 determinó que la prevalencia entre los vegetarianos estrictos era similar a la de los no vegetarianos, lo que planteó la posibilidad de una tercera vía de infección importante, además de la transmisión congénita y a través de la carne mal cocida. [31]
En 1970, se encontraron ooquistes en heces de gatos. Se demostró la vía fecal-oral de infección a través de ooquistes. [31] En los años 1970 y 1980, se analizaron las heces de una amplia gama de especies animales infectadas para ver si contenían ooquistes: al menos 17 especies de félidos eliminan ooquistes, pero no se ha demostrado que ningún animal no félido permita la reproducción sexual de T. gondii (lo que conduce a la eliminación de ooquistes). [31]
En 1984, Elmer R. Pfefferkorn publicó su descubrimiento de que el tratamiento de fibroblastos humanos con interferón gamma recombinante humano bloquea el crecimiento de T. gondii . [106]
Diferencias de comportamiento de los huéspedes infectados
Existen muchos casos en los que se han descrito cambios de comportamiento en roedores infectados por T. gondii . Los cambios observados fueron una reducción de su aversión innata a los gatos, lo que facilitó que los gatos cazaran a los roedores. En un experimento realizado por Berdoy y sus colegas, las ratas infectadas mostraron preferencia por la zona con olor a gato frente a la zona con olor a conejo, lo que facilitó que el parásito diera su paso final en su huésped felino definitivo. [7] Este es un ejemplo del concepto de fenotipo extendido , es decir, la idea de que el comportamiento del animal infectado cambia para maximizar la supervivencia de los genes que aumentan la depredación del huésped roedor intermediario. [107]
- Las diferencias en el comportamiento dependiente del sexo observadas en los huéspedes infectados en comparación con los individuos no infectados pueden atribuirse a diferencias en la testosterona. Los machos infectados tenían niveles más altos de testosterona, mientras que las hembras infectadas tenían niveles significativamente más bajos, en comparación con sus equivalentes no infectados. [108]
- En los estudios realizados con el cuestionario de 16 factores de personalidad de Cattell , se observó que los hombres infectados tenían una puntuación más baja en el factor G (fuerza del superyó/conciencia de las reglas) y más alta en el factor L (vigilancia), mientras que en las mujeres infectadas se observó el patrón opuesto. [109] Estos hombres tenían más probabilidades de ignorar las reglas y eran más oportunistas, desconfiados y celosos. Por otro lado, las mujeres eran más afectuosas, extrovertidas, concienzudas y moralistas. [109]
- Las investigaciones publicadas también han indicado que la infección por T. gondii podría promover cambios en las creencias y valores políticos de una persona. Quienes están infectados con el parásito tienden a mostrar un mayor grado de pensamiento de “nosotros contra ellos”. [110] [111] [112]
- Los ratones infectados con T. gondii tienen un peor rendimiento motor que los ratones no infectados. [113] [114] Por lo tanto, se realizó una prueba de reacción simple computarizada tanto a adultos infectados como a no infectados. Se encontró que los adultos infectados se desempeñaron mucho peor y perdieron su concentración más rápidamente que el grupo de control . Pero, el efecto de la infección solo explica menos del 10% de la variabilidad en el rendimiento [109] (es decir, podría haber otros factores de confusión).
- También se ha observado una correlación entre la seroprevalencia de T. gondii en humanos y un mayor riesgo de sufrir accidentes de tráfico. Los sujetos infectados tienen un riesgo 2,65 veces mayor de sufrir un accidente de tráfico. [115] Un estudio turco confirmó que esto es cierto entre los conductores. [116]
- Este parásito se ha asociado con muchos trastornos neurológicos como la esquizofrenia . En un metanálisis de 23 estudios que cumplieron los criterios de inclusión, la seroprevalencia de anticuerpos contra T. gondii en personas con esquizofrenia es significativamente mayor que en las poblaciones de control (OR=2,73, P<0,000001). [117]
- Un resumen de estudios de 2009 encontró que quienes intentaron suicidarse tenían muchos más anticuerpos indicativos (IgG) que los pacientes internados en centros de salud mental sin un intento de suicidio. [118] También se demostró que la infección estaba asociada con el suicidio en mujeres mayores de 60 años. (P < 0,005) [119]
- Las investigaciones sobre la relación entre la infección por T. gondii y el comportamiento empresarial mostraron que los estudiantes que dieron positivo en la prueba de exposición a T. gondii tenían 1,4 veces más probabilidades de especializarse en negocios y 1,7 veces más probabilidades de especializarse en "gestión y emprendimiento". Entre 197 participantes de eventos de emprendimiento, la exposición a T. gondii se correlacionó con una probabilidad 1,8 veces mayor de haber iniciado su propio negocio. [120]
- Otro estudio representativo de la población con 7440 personas en los Estados Unidos encontró que la infección por Toxoplasma era 2,4 veces más común en personas que tenían antecedentes de síntomas maníacos y depresivos (trastorno bipolar tipo 1) en comparación con la población general. [121]
Como se mencionó anteriormente, estos resultados de mayores proporciones de personas seropositivas para el parásito en casos de estos trastornos neurológicos no necesariamente indican una relación causal entre la infección y el trastorno. También es importante mencionar que en 2016 se realizó un estudio de cohorte de nacimiento representativo de la población para probar la hipótesis de que la toxoplasmosis está relacionada con el deterioro en el cerebro y el comportamiento medido por una variedad de fenotipos que incluyen trastornos neuropsiquiátricos, control deficiente de los impulsos, déficit de personalidad y neurocognitivos. Los resultados de este estudio no respaldaron los resultados de los estudios mencionados anteriormente, más que marginalmente. Ninguno de los valores P mostró significancia para ninguna medida de resultado. Por lo tanto, según este estudio, la presencia de anticuerpos contra T. gondii no está correlacionada con una mayor susceptibilidad a ninguno de los fenotipos de comportamiento (excepto posiblemente con una mayor tasa de intentos de suicidio fallidos). Este equipo no observó ninguna asociación significativa entre la seropositividad a T. gondii y la esquizofrenia . El equipo señala que los resultados nulos podrían ser un falso negativo debido al bajo poder estadístico debido al pequeño tamaño de la muestra, pero considera que su configuración debería evitar algunas posibilidades de error en los aproximadamente 40 estudios que sí mostraron una correlación positiva. Concluyeron que se deberían realizar más estudios. [122]
El mecanismo detrás de los cambios de comportamiento se atribuye parcialmente al aumento del metabolismo de la dopamina, [123] que puede ser neutralizado por medicamentos antagonistas de la dopamina. [124] T. gondii tiene dos genes que codifican una fenilalanina bifuncional y una tirosina hidroxilasa , dos pasos importantes y limitantes de la velocidad de la biosíntesis de la dopamina. Uno de los genes se expresa de forma constitutiva, mientras que el otro solo se produce durante el desarrollo del quiste. [125] [126] Además de la producción adicional de dopamina, la infección por T. gondii también produce cambios epigenéticos duraderos en los animales que aumentan la expresión de vasopresina , una causa probable de alteraciones que persisten después de la desaparición de la infección. [127]
En 2022, un estudio publicado en Communications Biology sobre una población bien documentada de lobos estudiados a lo largo de sus vidas sugirió que T. gondii también puede tener un efecto significativo en su comportamiento. [128] Sugirió que la infección con este parásito envalentonó a los lobos infectados a un comportamiento que determinó roles de liderazgo e influyó en el comportamiento de toma de riesgos, tal vez incluso motivando el establecimiento de nuevas manadas independientes que establecerían y liderarían en patrones de comportamiento diferentes a los de las manadas en las que nacieron. El estudio determinó que, a veces, un lobo infectado se convertiría en el único macho reproductor de una manada, lo que provocaría un efecto significativo en otra especie por parte de T. gondii .
Posible uso médico
En julio de 2024, un estudio publicado en Nature Microbiology mostró que T. gondii puede ser diseñado para administrar la proteína MECP2 , un objetivo terapéutico del síndrome de Rett , al cerebro de ratones infectados. [129] [130]
Véase también
Referencias
- ^ Nicolle, C.; Manceaux, L. (1908). "Sur una infección à corps de Leishman (ou organismos voisins) du Gondi". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences (en francés). 147 (2): 763–66.
- ^ Nicolle, C.; Manceaux, L. (1909). "Sur un Protozoaire nouveau du Gondi". Comptes Rendus Hebdomadaires des Séances de l'Académie des Sciences (en francés). 148 (1): 369–72.
- ^ Dardé, ML; Ajzenberg, D.; Smith, J. (2011). "Estructura poblacional y epidemiología de Toxoplasma gondii". En Weiss, LM; Kim, K. (eds.). Toxoplasma Gondii: El Apicomplejo Modelo. Perspectivas y Métodos . Ámsterdam, Boston, Heidelberg, Londres, Nueva York: Elsevier . págs. 49–80. doi :10.1016/B978-012369542-0/50005-2. ISBN 9780123695420.
- ^ abcdefgh Dubey, JP (2010). "Biología general". Toxoplasmosis en animales y humanos (2.ª ed.). Boca Raton / Londres / Nueva York: Taylor and Francis Group. págs. 1–20. ISBN 9781420092370. Recuperado el 1 de febrero de 2019 .
- ^ "CDC - Toxoplasmosis - Biología". 17 de marzo de 2015. Consultado el 14 de junio de 2015 .
- ^ ab Knoll, Laura J.; Dubey, JP; Wilson, Sarah K.; Genova, Bruno Martorelli Di (1 de julio de 2019). "La actividad de la delta-6-desaturasa intestinal determina el rango de hospedadores para la reproducción sexual de Toxoplasma". bioRxiv . 17 (8): 688580. doi : 10.1101/688580 . PMC 6701743 . PMID 31430281.
- ^ abcd Berdoy, M.; Webster, JP; Macdonald, DW (agosto de 2000). "Atracción fatal en ratas infectadas con Toxoplasma gondii". Actas de la Royal Society of London B: Biological Sciences . 267 (1452): 1591–94. doi :10.1098/rspb.2000.1182. PMC 1690701 . PMID 11007336.
- ^ Webster, JP (mayo de 2007). "El efecto del Toxoplasma gondii en el comportamiento animal: jugar al gato y al ratón". Boletín de esquizofrenia . 33 (3): 752–756. doi :10.1093/schbul/sbl073. PMC 2526137 . PMID 17218613.
- ^ ab Webster, JP; Kaushik, M.; Bristow, GC; McConkey, GA (enero de 2013). "La infección por Toxoplasma gondii, desde la depredación hasta la esquizofrenia: ¿puede el comportamiento animal ayudarnos a entender el comportamiento humano?". The Journal of Experimental Biology . 216 (Pt 1): 99–112. doi :10.1242/jeb.074716. PMC 3515034 . PMID 23225872.
- ^ Boillat, M.; Hammoudi, PM; Dogga, SK; Pagès, S.; Goubran, M.; Rodríguez, I.; Soldati-Favre, D. (2020). "Manipulación aespecífica del miedo a los depredadores de ratones asociada a la neuroinflamación por Toxoplasma gondii". Cell Reports . 30 (2). págs. 320–334.e6. doi : 10.1016/j.celrep.2019.12.019 . PMC 6963786 . PMID 31940479.
- ^ Hari Dass, SA; Vyas, A. (diciembre de 2014). " La infección por Toxoplasma gondii reduce la aversión a los depredadores en ratas a través de la modulación epigenética en la amígdala medial del huésped". Ecología molecular . 23 (24): 6114–22. Bibcode :2014MolEc..23.6114H. doi :10.1111/mec.12888. PMID 25142402. S2CID 45290208.
- ^ Flegr, J.; Markoš, A. (diciembre de 2014). "Obra maestra de ingeniería epigenética: cómo Toxoplasma gondii reprograma el cerebro del huésped para cambiar el miedo por atracción sexual". Ecología molecular . 23 (24): 5934–5936. Bibcode :2014MolEc..23.5934F. doi : 10.1111/mec.13006 . PMID 25532868. S2CID 17253786.
- ^ ab "Parásitos de los CDC: enfermedad por toxoplasmosis (infección por Toxoplasma)" . Consultado el 12 de marzo de 2013 .
- ^ abc Flegr, J.; Prandota, J.; Sovičková, M.; Israili, ZH (marzo de 2014). "Toxoplasmosis: una amenaza global. Correlación de la toxoplasmosis latente con la carga de enfermedad específica en un conjunto de 88 países". PLOS ONE . 9 (3): e90203. Bibcode :2014PLoSO...990203F. doi : 10.1371/journal.pone.0090203 . PMC 3963851 . PMID 24662942.
La toxoplasmosis se está convirtiendo en un peligro para la salud mundial, ya que infecta entre el 30 y el 50 % de la población humana mundial. Clínicamente, la presencia del parásito durante toda la vida en los tejidos de la mayoría de los individuos infectados suele considerarse asintomática. Sin embargo, varios estudios muestran que esta "infección asintomática" también puede conducir al desarrollo de otras patologías humanas. ... La seroprevalencia de la toxoplasmosis se correlacionó con diversas cargas de enfermedad. Las asociaciones estadísticas no necesariamente significan causalidad. Sin embargo, el principio de precaución sugiere que el posible papel de la toxoplasmosis como factor desencadenante responsable del desarrollo de varias entidades clínicas merece mucha más atención y apoyo financiero tanto en la práctica médica diaria como en la investigación clínica futura.
- ^ Cocinero, tuberculosis; Brenner, Luisiana; Clonador, CR; Langenberg, P.; Igbide, A.; Giegling, yo; Hartmann, AM; Konte, B.; Friedl, M.; Brundin, L.; Groer, MW; Puede, A.; Rujescu, D.; Postolache, TT (enero de 2015). "Infección "latente" por Toxoplasma gondii: asociación con la agresión y la impulsividad como rasgos en adultos sanos". Journal of Psychiatric Research . 60 : 87–94. doi :10.1016/j.jpsychires.2014.09.019. PMID 25306262.
- ^ Flegr, J. (enero de 2013). "Influencia de la infección latente por Toxoplasma en la personalidad, fisiología y morfología humanas: pros y contras del modelo humano-Toxoplasma en el estudio de la hipótesis de manipulación". The Journal of Experimental Biology . 216 (Pt 1): 127–33. doi : 10.1242/jeb.073635 . PMID 23225875.
- ^ Burgdorf, KS; Trabjerg, BB; Pedersen, MG; Nissen, J.; Banasik, K.; Pedersen, OB; et al. (2019). "Estudio a gran escala de Toxoplasma y Cytomegalovirus muestra una asociación entre infección y trastornos psiquiátricos graves". Cerebro, comportamiento e inmunidad . 79 : 152–158. doi : 10.1016/j.bbi.2019.01.026 . PMID 30685531.
- ^ Parlog, A.; Schlüter, D.; Dunay, IR (marzo de 2015). "Alteraciones neuronales inducidas por Toxoplasma gondii". Inmunología de parásitos . 37 (3): 159–70. doi :10.1111/pim.12157. hdl :10033/346575. PMID 25376390. S2CID 17132378.
- ^ Blanchard, N.; Dunay, IR; Schlüter, D. (marzo de 2015). "Persistencia de Toxoplasma gondii en el sistema nervioso central: un equilibrio afinado entre el parásito, el cerebro y el sistema inmunológico". Inmunología de parásitos . 37 (3): 150–58. doi : 10.1111/pim.12173 . hdl :10033/346515. PMID 25573476. S2CID 1711188.
- ^ Pearce, BD; Kruszon-Moran, D.; Jones, JL (2012). "La relación entre la infección por Toxoplasma gondii y los trastornos del estado de ánimo en la Tercera Encuesta Nacional de Salud y Nutrición". Psiquiatría biológica . 72 (4): 290–95. doi :10.1016/j.biopsych.2012.01.003. PMC 4750371 . PMID 22325983.
- ^ de Barros, JL; Barbosa, IG; Salem, H.; Rocha, NP; Kummer, A.; Okusaga, OO; Soares, JC; Teixeira; AL (febrero de 2017). "¿Existe alguna asociación entre la infección por Toxoplasma gondii y el trastorno bipolar? Una revisión sistemática y un metanálisis". Journal of Affective Disorders . 209 : 59–65. doi :10.1016/j.jad.2016.11.016. PMID 27889597.
- ^ Flegr, J.; Lenochová, P.; Hodný, Z.; Vondrová, M (noviembre de 2011). "Fenómeno de atracción fatal en humanos: el atractivo del olor a gato aumentó en los hombres infectados con toxoplasma, pero disminuyó en las mujeres infectadas". PLOS Neglected Tropical Diseases . 5 (11): e1389. doi : 10.1371/journal.pntd.0001389 . PMC 3210761 . PMID 22087345.
- ^ Sugden, Karen; Moffitt, Terrie E.; Pinto, Lauriane; Poulton, Richie; Williams, Benjamin S.; Caspi, Avshalom (17 de febrero de 2016). "¿Está relacionada la infección por Toxoplasma gondii con alteraciones cerebrales y conductuales en humanos? Evidencia de una cohorte de nacimientos representativa de la población". PLOS ONE . 11 (2): e0148435. Bibcode :2016PLoSO..1148435S. doi : 10.1371/journal.pone.0148435 . PMC 4757034 . PMID 26886853.
- ^ "Rompecabezas evolutivo de Toxoplasma gondii con ideación suicida e intentos de suicidio: una revisión sistemática y un metanálisis actualizados". 9 de abril de 2020. Consultado el 20 de septiembre de 2024 .
- ^ "Parásito felino vinculado a enfermedad mental y esquizofrenia". CBS. 5 de junio de 2015. Consultado el 23 de septiembre de 2015 .
- ^ "CDC – Acerca de los parásitos" . Consultado el 12 de marzo de 2013 .
- ^ Pappas, G.; Roussos, N.; Falagas, ME (octubre de 2009). "Instantáneas de toxoplasmosis: estado global de la seroprevalencia de Toxoplasma gondii e implicaciones para el embarazo y la toxoplasmosis congénita". Revista Internacional de Parasitología . 39 (12): 1385–94. doi :10.1016/j.ijpara.2009.04.003. PMID 19433092.
- ^ Bigna, Jean Joel; Tochie, Joel Noutakdie; Tounouga, Dahlia Noelle; Bekolo, Anne Olive; Ymele, Nadia S.; Youda, Emilie Lettitia; Sime, Paule Sandra; Nansseu, Jobert Richie (21 de julio de 2020). "Seroprevalencia mundial, regional y nacional de Toxoplasma gondii en mujeres embarazadas: una revisión sistemática, modelado y metanálisis". Scientific Reports . 10 (1): 12102. Bibcode :2020NatSR..1012102B. doi :10.1038/s41598-020-69078-9. ISSN 2045-2322. PMC 7374101 . PMID 32694844.
- ^ abcdefghijklmnopqrstu v Weiss LM, Kim K (2011). Toxoplasma gondii: el apicomplejo modelo: perspectivas y métodos (2.ª ed.). Academic Press. ISBN 9780080475011. Recuperado el 12 de marzo de 2013 .
- ^ Dubey, JP; Ferreira, LR; Martins, J.; Jones, JL (octubre de 2011). "Esporulación y supervivencia de ooquistes de Toxoplasma gondii en diferentes tipos de arena comercial para gatos". The Journal of Parasitology . 97 (5): 751–54. doi :10.1645/GE-2774.1. PMID 21539466. S2CID 41292680.
- ^ abcdefghijklm Dubey, JP (julio de 2009). "Historia del descubrimiento del ciclo de vida de Toxoplasma gondii ". Revista Internacional de Parasitología . 39 (8): 877–82. doi :10.1016/j.ijpara.2009.01.005. PMID 19630138.
- ^ abc Kapperud, G.; Jenum, Pensilvania; Stray-Pedersen, B.; Melby, KK; Eskild, A.; Eng, J. (agosto de 1996). "Factores de riesgo de infección por Toxoplasma gondii durante el embarazo. Resultados de un estudio prospectivo de casos y controles en Noruega". Revista Estadounidense de Epidemiología . 144 (4): 405–12. doi : 10.1093/oxfordjournals.aje.a008942 . PMID 8712198.
- ^ Dubey, JP (julio de 1998). "Avances en el ciclo de vida de Toxoplasma gondii". Revista Internacional de Parasitología . 28 (7): 1019–24. doi :10.1016/S0020-7519(98)00023-X. PMID 9724872.
- ^ ab Moré, Gastón; Venturini, María Cecilia; Pardini, Lais; Unzaga, Juan Manuel (8 de noviembre de 2017). Protozoos parásitos de animales de granja y mascotas . Cham, Suiza : Springer . ISBN 9783319701318.
- ^ abcd Robert-Gangneux, F.; Dardé, ML (abril de 2012). "Epidemiología y estrategias de diagnóstico de la toxoplasmosis". Clinical Microbiology Reviews . 25 (2): 264–96. doi :10.1128/CMR.05013-11. PMC 3346298 . PMID 22491772.
- ^ Markus, MB (1987). "Términos para los merozoitos coccidios". Anales de Medicina Tropical y Parasitología . 81 (4): 463. doi :10.1080/00034983.1987.11812147. PMID 3446034.
- ^ abcdef Miller, CM; Boulter, NR; Ikin, RJ; Smith, NC (enero de 2009). "La inmunobiología de la respuesta innata a Toxoplasma gondii ". Revista Internacional de Parasitología . 39 (1): 23–39. doi :10.1016/j.ijpara.2008.08.002. PMID 18775432.
- ^ "Toxoplasmosis de los CDC: hallazgos microscópicos". Archivado desde el original el 6 de noviembre de 2013. Consultado el 13 de marzo de 2013 .
- ^ Robbins, Clarence R. (2012). Comportamiento químico y físico del cabello humano. Springer. pág. 585. ISBN 9783642256103. Recuperado el 12 de marzo de 2013 .
- ^ Jones, JL; Dubey, JP (septiembre de 2012). "Toxoplasmosis transmitida por alimentos". Clinical Infectious Diseases . 55 (6): 845–51. doi : 10.1093/cid/cis508 . PMID 22618566.
- ^ "El parásito que se desprende de las heces de los gatos mata a las nutrias marinas – California Sea Grant" (PDF) . www-csgc.ucsd.edu . Archivado desde el original (PDF) el 1 de julio de 2010 . Consultado el 14 de marzo de 2018 .
- ^ Khan, A.; Böhme, U.; Kelly, KA; Adlem, E.; Brooks, K.; Simmonds, M.; Mungall, K.; Quail, MA; Arrowsmith, C.; Chillingworth, T.; Churcher, C.; Harris, D.; Collins, M.; Fosker, N.; Fraser, A.; Hance, Z.; Jagels, K.; Moule, S.; Murphy, L.; O'Neil, S.; Rajandream, MA; Saunders, D.; Seeger, K.; Whitehead, S.; Mayr, T.; Xuan, X.; Watanabe, J.; Suzuki, Y.; Wakaguri, H.; Sugano, S.; Sugimoto, C.; Paulsen, I.; Mackey, AJ; Roos, DS; Hall, N.; Berriman, M.; Barrell, B.; Sibley, LD; Ajioka, JW (2006). "Herencia común del cromosoma Ia asociada con la expansión clonal de Toxoplasma gondii". Genome Research . 16 (9): 1119–1125. doi :10.1101/gr.5318106. PMC 1557770 . PMID 16902086.
- ^ Dubey, JP; Velmurugan, GV; Rajendran, C.; Yabsley, MJ; Thomas, Nueva Jersey; Beckmen, KB; Sinnett, D.; Ruid, D.; Hart, J.; Feria, Pensilvania; McFee, NOSOTROS; Shearn-Bochsler, V.; Kwok, OC; Ferreira, LR; Choudhary, S.; Faria, EB; Zhou, H.; Félix, TA; Su, C. (2011). "La caracterización genética de Toxoplasma gondii en la vida silvestre de América del Norte reveló una prevalencia alta y generalizada del cuarto tipo clonal". Revista Internacional de Parasitología . 41 (11): 1139-1147. doi :10.1016/j.ijpara.2011.06.005. PMID 21802422. S2CID 16654819.
- ^ ab Frénal, Karine; Dubremetz, Jean-François; Lebrun, Maryse; Soldati-Favre, Dominique (4 de septiembre de 2017). "La motilidad deslizante potencia la invasión y la salida en Apicomplexa". Nature Reviews Microbiology . 15 (11). Nature Portfolio : 645–660. doi :10.1038/nrmicro.2017.86. ISSN 1740-1526. PMID 28867819. S2CID 23129560.
- ^ abc Brochet, Mathieu; Billker, Oliver (12 de febrero de 2016). "Señalización de calcio en parásitos de la malaria". Microbiología molecular . 100 (3). Wiley : 397–408. doi : 10.1111/mmi.13324 . ISSN 0950-382X. PMID 26748879. S2CID 28504228.
- ^ ab Rigoulet, J.; Hennache, A.; Lagourette, P.; George, C.; Longeart, L.; Le Net, JL; Dubey, JP (2014). "Toxoplasmosis en una tórtola (Geopelia humeralis) del zoológico de Clères, Francia". Parasite . 21 : 62. doi :10.1051/parasite/2014062. PMC 4236686 . PMID 25407506.

- ^ Hehl, Adrian B.; Basso, Walter U.; Lippuner, Christoph; Ramakrishnan, Chandra; Okoniewski, Michal; Walker, Robert A.; Grigg, Michael E.; Smith, Nicholas C.; Deplazes, Peter (13 de febrero de 2015). "La expansión asexual de los merozoitos de Toxoplasma gondii es distinta de la de los taquizoitos e implica la expresión de familias de genes no superpuestos para unirse, invadir y replicarse dentro de los enterocitos felinos". BMC Genomics . 16 (1): 66. doi : 10.1186/s12864-015-1225-x . PMC 4340605 . PMID 25757795.
- ^ Behnke, Michael S.; Zhang, Tiange P.; Dubey, Jitender P.; Sibley, L. David (8 de mayo de 2014). "El análisis de la expresión génica del merozoito de Toxoplasma gondii en comparación con el ciclo de vida revela un estado de expresión único durante el desarrollo entérico". BMC Genomics . 15 (1): 350. doi : 10.1186/1471-2164-15-350 . PMC 4035076 . PMID 24885521.
- ^ Genova, Bruno Martorelli Di; Wilson, Sarah K.; Dubey, JP; Knoll, Laura J. (20 de agosto de 2019). "La actividad de la delta-6-desaturasa intestinal determina el rango de hospedadores para la reproducción sexual de Toxoplasma". PLOS Biology . 17 (8): e3000364. doi : 10.1371/journal.pbio.3000364 . PMC 6701743 .
- ^ Farhat, Dayana C.; Swale, Christopher; Dard, Céline; Cannella, Dominique; Ortet, Philippe; Barakat, Mohamed; Sindikubwabo, Fabien; Belmudes, Lúcido; De Bock, Pieter-Jan; Couté, Yohann; Bougdour, Alejandro; Hakimi, Mohamed-Ali (abril de 2020). "Un interruptor transcripcional impulsado por MORC controla las trayectorias de desarrollo y el compromiso sexual de Toxoplasma". Microbiología de la naturaleza . 5 (4): 570–583. doi :10.1038/s41564-020-0674-4. PMC 7104380 . PMID 32094587.
- ^ Antunes, Ana Vera; Shahinas, Martina; Swale, Christopher; Farhat, Dayana C.; Ramakrishnan, Chandra; Bruley, Christophe; Cannella, Dominique; Robert, María G.; Corrao, Charlotte; Couté, Yohann; Hehl, Adrián B.; Bougdour, Alejandro; Coppens, Isabelle; Hakimi, Mohamed-Ali (11 de enero de 2024). "Producción in vitro de etapas presexuales de Toxoplasma restringidas a gatos". Naturaleza . 625 (7994): 366–376. doi :10.1038/s41586-023-06821-y. PMC 10781626 . PMID 38093015.
- ^ Parks, S.; Avramopoulos, D.; Mulle, J.; McGrath, J.; Wang, R.; Goes, FS; Conneely, K.; Ruczinski, I.; Yolken, R.; Pulver, AE (mayo de 2018). "La tipificación de HLA utilizando datos de todo el genoma revela tipos de susceptibilidad a infecciones en una muestra enriquecida con enfermedades psiquiátricas". Cerebro, comportamiento e inmunidad . 70 : 203–213. doi :10.1016/j.bbi.2018.03.001. PMID 29574260. S2CID 4482168.
- ^ abc Henriquez, SA; Brett, R.; Alexander, J.; Pratt, J.; Roberts, CW (2009). "Enfermedad neuropsiquiátrica e infección por Toxoplasma gondii". Neuroinmunomodulación . 16 (2): 122–133. doi :10.1159/000180267. PMID 19212132. S2CID 7382051.
- ^ Konsman, JP; Parnet, P.; Dantzer, R. (marzo de 2002). "Comportamiento de enfermedad inducido por citocinas: mecanismos e implicaciones". Tendencias en neurociencias . 25 (3): 154–59. doi :10.1016/s0166-2236(00)02088-9. PMID 11852148. S2CID 29779184.
- ^ abc Tenter, AM; Heckeroth, AR; Weiss, LM (noviembre de 2000). "Toxoplasma gondii: de los animales a los humanos". Revista Internacional de Parasitología . 30 (12–13): 1217–58. doi :10.1016/S0020-7519(00)00124-7. PMC 3109627 . PMID 11113252.
- ^ abcd Jones, JL; Dargelas, V.; Roberts, J.; Press, C.; Remington, JS; Montoya, JG (septiembre de 2009). "Factores de riesgo de infección por Toxoplasma gondii en los Estados Unidos". Enfermedades infecciosas clínicas . 49 (6): 878–84. doi : 10.1086/605433 . PMID 19663709.
- ^ ab Cook, AJ; Gilbert, RE; Buffolano, W.; Zufferey, J.; Petersen, E.; Jenum, PA; Foulon, W.; Semprini, AE; Dunn, DT (julio de 2000). "Fuentes de infección por toxoplasma en mujeres embarazadas: estudio multicéntrico europeo de casos y controles. Red Europea de Investigación sobre Toxoplasmosis Congénita". BMJ . 321 (7254): 142–47. doi :10.1136/bmj.321.7254.142. PMC 27431 . PMID 10894691.
- ^ Sakikawa, M.; Noda, S.; Hanaoka, M.; Nakayama, H.; Hojo, S.; Kakinoki, S.; Nakata, M.; Yasuda, T.; Ikenoue, T.; Kojima, T. (marzo de 2012). "Prevalencia de anticuerpos anti-Toxoplasma, tasa de infección primaria y factores de riesgo en un estudio de toxoplasmosis en 4.466 mujeres embarazadas en Japón". Inmunología clínica y de vacunas . 19 (3): 365–67. doi :10.1128/CVI.05486-11. PMC 3294603 . PMID 22205659.
- ^ ab Dubey, JP; Hill, DE; Jones, JL; Hightower, AW; Kirkland, E.; Roberts, JM; Marcet, PL; Lehmann, T.; Vianna, MC; Miska, K.; Sreekumar, C.; Kwok, OC; Shen, SK; Gamble, HR (octubre de 2005). "Prevalencia de Toxoplasma gondii viable en carne de res, pollo y cerdo de carnicerías minoristas en los Estados Unidos: evaluación de riesgos para los consumidores". The Journal of Parasitology . 91 (5): 1082–93. doi :10.1645/ge-683.1. PMID 16419752. S2CID 26649961.
- ^ Mai, K.; Sharman, PA; Walker, RA; Katrib, M.; De Souza, D.; McConville, MJ; Wallach, MG; Belli, SI; Ferguson, DJ; Smith, NC (marzo de 2009). "Formación y composición de la pared de ooquistes en parásitos coccidios". Memorias del Instituto Oswaldo Cruz . 104 (2): 281–89. doi : 10.1590/S0074-02762009000200022 . hdl : 1807/57649 . PMID 19430654.
- ^ Siegel, SE; Lunde, MN; Gelderman, AH; Halterman, RH; Brown, JA; Levine, AS; Graw, RG (abril de 1971). "Transmisión de toxoplasmosis por transfusión de leucocitos". Sangre . 37 (4): 388–94. doi : 10.1182/blood.V37.4.388.388 . PMID 4927414.
- ^ Gallas-Lindemann, C.; Sotiriadou, I.; Mahmoodi, señor; Karanis, P. (febrero de 2013). "Detección de oocistos de Toxoplasma gondii en diferentes recursos hídricos mediante amplificación isotérmica mediada por bucle (LAMP)". Acta Trópica . 125 (2): 231–36. doi :10.1016/j.actatropica.2012.10.007. PMID 23088835.
- ^ Alvarado-Esquivel, C.; Liesenfeld, O.; Márquez-Conde, JA; Estrada-Martínez, S.; Dubey, JP (octubre de 2010). "Seroepidemiología de la infección por Toxoplasma gondii en trabajadores expuestos ocupacionalmente a agua, aguas residuales y suelo en Durango, México". The Journal of Parasitology . 96 (5): 847–50. doi :10.1645/GE-2453.1. PMID 20950091. S2CID 23241017.
- ^ Esmerini, PO; Gennari, SM; Pena, HF (mayo de 2010). "Análisis de mariscos bivalvos marinos del mercado de pescado de la ciudad de Santos, estado de São Paulo, Brasil, para Toxoplasma gondii". Parasitología Veterinaria . 170 (1–2): 8–13. doi : 10.1016/j.vetpar.2010.01.036 . PMID 20197214.
- ^ Dattoli, VC; Veiga, RV; Cunha, SS; Pontes-de-Carvalho, L.; Barreto, ML; Alcantara-Neves, NM (diciembre de 2011). "La ingestión de ooquistes como vía de transmisión importante de Toxoplasma gondii en niños urbanos brasileños". La Revista de Parasitología . 97 (6): 1080–84. doi :10.1645/GE-2836.1. PMC 7612830 . PMID 21740247. S2CID 7170467.
- ^ Gross, Rachel (20 de septiembre de 2016). «El coste moral de los gatos». Revista Smithsonian . Instituto Smithsoniano . Consultado el 23 de octubre de 2020 .
- ^ Bobić, B.; Jevremović, I.; Marinković, J.; Sibalić, D.; Djurković-Djaković, O. (septiembre de 1998). "Factores de riesgo de infección por Toxoplasma en una población femenina en edad reproductiva en el área de Belgrado, Yugoslavia". Revista Europea de Epidemiología . 14 (6): 605–10. doi :10.1023/A:1007461225944. PMID 9794128. S2CID 9423818.
- ^ Dass, SA; Vasudevan, A.; Dutta, D.; Soh, LJ; Sapolsky, RM; Vyas, A. (2011). "El parásito protozoario Toxoplasma gondii manipula la elección de pareja en ratas al mejorar el atractivo de los machos". PLOS ONE . 6 (11): e27229. Bibcode :2011PLoSO...627229D. doi : 10.1371/journal.pone.0027229 . PMC 3206931 . PMID 22073295.
- ^ Arantes, TP; Lopes, WD; Ferreira, RM; Pieroni, JS; Pinto, VM; Sakamoto, California; Costa, AJ (octubre de 2009). " Toxoplasma gondii : evidencia de la transmisión por semen en perros". Parasitología Experimental . 123 (2): 190–94. doi :10.1016/j.exppara.2009.07.003. PMID 19622353.
- ^ J., Gutierrez; O'Donovan, J.; Williams, E.; Proctor, A.; Brady, C.; Marques, PX; Worrall, S.; Nally, JE; McElroy, M.; Bassett, H.; Sammin, D.; Buxton, D.; Maley, S.; Markey, BK (agosto de 2010). "Detección y cuantificación de Toxoplasma gondii en tejidos fetales y maternos ovinos de ovejas preñadas infectadas experimentalmente mediante PCR en tiempo real". Parasitología veterinaria . 172 (1–2): 8–15. doi :10.1016/j.vetpar.2010.04.035. PMID 20510517.
- ^ ab "CDC: Parásitos – Toxoplasmosis (infección por Toxoplasma) – Prevención y control" . Consultado el 13 de marzo de 2013 .
- ^ "Mayo Clinic – Toxoplasmosis – Prevention" (Clínica Mayo – Toxoplasmosis – Prevención) . Consultado el 13 de marzo de 2013 .
- ^ Green, Aliza (2005). Guía de campo de la carne . Filadelfia, Pensilvania: Quirk Books. pp. 294–95. ISBN 9781594740176.
- ^ abcd Zhang Y, Li D, Lu S, Zheng B (octubre de 2022). "Vacunas contra la toxoplasmosis: ¿qué tenemos y adónde ir?". npj Vaccines . 7 (1): 131. doi :10.1038/s41541-022-00563-0. PMC 9618413 . PMID 36310233.
- ^ Verma, R.; Khanna, P. (febrero de 2013). "Desarrollo de la vacuna contra Toxoplasma gondii: un desafío global". Vacunas e inmunoterapias humanas . 9 (2): 291–93. doi :10.4161/hv.22474. PMC 3859749 . PMID 23111123.
- ^ "Resultado breve de TOXPOX: vacuna contra la toxoplasmosis". CORDIS, Comisión Europea. 14 de enero de 2015. Archivado desde el original el 22 de diciembre de 2015 . Consultado el 11 de diciembre de 2015 .
- ^ "TOXOVAX®". MSD Salud Animal. Archivado desde el original el 22 de enero de 2016. Consultado el 10 de noviembre de 2015 .
- ^ Hasan T, Nishikawa Y (2022). "Avances en el desarrollo de vacunas y la respuesta inmune contra la toxoplasmosis en ovejas y cabras". Frontiers in Veterinary Science . 9 : 951584. doi : 10.3389/fvets.2022.951584 . PMC 9453163 . PMID 36090161.
- ^ Bonačić Marinović AA, Opsteegh M, Deng H, Suijkerbuijk AW, van Gils PF, van der Giessen J (diciembre de 2019). "Perspectivas del control de la toxoplasmosis mediante la vacunación de gatos". Epidemias . 30 : 100380. doi : 10.1016/j.epidem.2019.100380 . PMID 31926434.
- ^ "CDC - Toxoplasmosis - Tratamiento". Centros para el Control y la Prevención de Enfermedades de Estados Unidos. 28 de febrero de 2019. Consultado el 13 de julio de 2021 .
- ^ Hollings, T.; Jones, M.; Mooney, N.; McCallum, H. (2013). "Ecología de enfermedades de la vida silvestre en paisajes cambiantes: liberación de mesopredadores y toxoplasmosis". Revista internacional de parasitología: parásitos y vida silvestre . 2 : 110–118. doi :10.1016/j.ijppaw.2013.02.002. PMC 3862529 . PMID 24533323.
- ^ abc Conrad, PA; Miller, MA; Kreuder, C.; James, ER; Mazet, J.; Dabritz, H.; Jessup, DA; Gulland, Frances; Grigg, ME (octubre de 2005). "Transmisión de Toxoplasma : pistas del estudio de las nutrias marinas como centinelas del flujo de Toxoplasma gondii hacia el entorno marino". Revista Internacional de Parasitología . 35 (11–12): 1155–1168. doi :10.1016/j.ijpara.2005.07.002. PMID 16157341.
- ^ "Nutria marina". Defensores de la vida silvestre . 2020.
- ^ ab Ahlers, Adam A.; Mitchell, Mark A.; Dubey, Jitender P.; Schooley, Robert L.; Heske, Edward J. (1 de abril de 2015). "Factores de riesgo de exposición a Toxoplasma gondii en mamíferos semiacuáticos en un ecosistema de agua dulce". Enfermedades de la fauna silvestre . 51 (2): 488–492. doi :10.7589/2014-03-071. PMID 25574808.
- ^ ab Acosta, ICL; Souza-Filho, AF; Muñoz-Leal, S.; Soares, HS; Heinemann, MB; Moreno, L.; González-Acuña, D.; Gennari, SM (abril de 2019). "Evaluación de anticuerpos contra Toxoplasma gondii y Leptospira spp. en pingüinos de Magallanes ( Speniscus magellanicus ) en Isla Magdalena, Chile". Parasitología veterinaria: estudios e informes regionales . 16 : 1–4. doi :10.1016/j.vprsr.2019.100282. PMID 31027597. S2CID 91996679.
- ^ abc Ploeg, M.; Ultee, T.; Kik, M. (2011). "Toxoplasmosis diseminada en pingüinos de patas negras ( Spheniscus demersus )". Enfermedades aviares . 55 (4): 701–703. doi :10.1637/9700-030411-Case.1. PMID 22312996. S2CID 31105636.
- ^ Greub, Gilbert; Raoult, Didier (abril de 2004). "Microorganismos resistentes a las amebas de vida libre". Clinical Microbiology Reviews . 17 (2): 413–433. doi :10.1128/CMR.17.2.413-433.2004. PMC 387402 . PMID 15084508.
- ^ Cirillo, Jeffrey D.; Falkow, Stanley; Tompkins, Lucy S.; Bermundez, Luiz E. (septiembre de 1997). "La interacción de Mycobacterium avium con amebas ambientales aumenta la virulencia". Infección e inmunidad . 65 (9): 3759–3767. doi : 10.1128/iai.65.9.3759-3767.1997 . PMC 175536 . PMID 9284149.
- ^ ab Winiecka-Krusnell, Jadwiga; Dellacasa-Lindberg, Isabel; Dubey, JP; Barragan, Antonio (febrero de 2009). " Toxoplasma gondii : captación y supervivencia de ooquistes en amebas de vida libre". Parasitología experimental . 121 (2): 124–131. doi :10.1016/j.exppara.2008.09.022. PMID 18992742.
- ^ Elloway, EAG; Armstrong, RA; Bird, RA; Kelly, SL; Smith, SN (1 de diciembre de 2004). "Análisis de la exposición de Acanthamoeba polyphaga a carbohidratos de superficie mediante la unión de lectina FITC y evaluación de fluorescencia". Journal of Applied Microbiology . 97 (6): 1319–1325. doi :10.1111/j.1365-2672.2004.02430.x. PMID 15546423. S2CID 23877072.
- ^ Paquet, Valérie E.; Charette, Steve J. (8 de febrero de 2016). "Bacterias resistentes a las amebas encontradas en cuerpos multilamelares secretados por Dictyostelium discoideum: las amebas sociales también pueden empaquetar bacterias". FEMS Microbiology Ecology . 92 (3): fiw025. doi : 10.1093/femsec/fiw025 . hdl : 20.500.11794/313 . PMID 26862140.
- ^ Boehringer, Emilio Geronimo; Fornari, Oscar Elias; Boehringer, Irene K. (noviembre de 1962). "El primer caso de T. gondii en patos domésticos en Argentina". Enfermedades aviares . 6 (4): 391–396. doi :10.2307/1587913. JSTOR 1587913.
- ^ Drobeck, Hans Peter; Manwell, Reginald D.; Bernstein, Emil; Dillon, Raymond D. (noviembre de 1953). "Estudios adicionales sobre la toxoplasmosis en aves". American Journal of Epidemiology . 59 (3): 329–339. doi :10.1016/S0304-4017(02)00034-1. PMID 12031816.
- ^ abc Dubey, JP (junio de 2002). "Una revisión de la toxoplasmosis en aves silvestres". Parasitología veterinaria . 106 (2): 121–153. doi :10.1016/S0304-4017(02)00034-1. PMID 12031816.
- ^ ab Yan, Chao; Liang, Li-Jun; Zheng, Kui-Yang; Zhu, Xing-Quan (10 de marzo de 2016). "Impacto de los factores ambientales en la aparición, transmisión y distribución de Toxoplasma gondii". Parasites & Vectors . 9 : 137. doi : 10.1186/s13071-016-1432-6 . PMC 4785633 . PMID 26965989.
- ^ Elmore, Stacey A.; Jones, Jeffrey L.; Conrad, Patricia A.; Patton, Sharon; Lindsay, David S.; Dubey, JP (abril de 2010). "Toxoplasma gondii: epidemiología, aspectos clínicos felinos y prevención". Tendencias en parasitología . 26 (4): 190–196. doi :10.1016/j.pt.2010.01.009. PMID 20202907.
- ^ ab Shapiro, Karen; Bahia-Oliveira, Lillian; Dixon, Brent; Dumètre, Aurélien; de Wit, Luiz A.; VanWormer, Elizabeth; Villena, Isabelle (abril de 2019). "Transmisión ambiental de Toxoplasma gondii: ooquistes en agua, suelo y alimentos". Parasitología de los alimentos y el agua . 12 : e00049. doi : 10.1016/j.fawpar.2019.e00049 . PMC 7033973 . PMID 32095620.
- ^ Dumètre, Aurélien; Le Brás, Caroline; Baffet, Maxime; Meneceur, Pascale; Dubey, JP; Derouin, Francisco; Duguet, Jean-Pierre; Joveux, Michel; Moulin, Laurent (mayo de 2008). "Efectos de los tratamientos con ozono y radiación ultravioleta sobre la infectividad de los ooquistes de Toxoplasma gondii ". Parasitología Veterinaria . 153 (3–4): 209–213. doi :10.1016/j.vetpar.2008.02.004. PMID 18355965.
- ^ ab Lau, YL; Lee, WC; Gudimella, R.; Zhang, G.; Ching, XT; Razali, R.; Aziz, F.; Anwar, A.; Fong, MY (29 de junio de 2016). "Descifrando el borrador del genoma de la cepa RH de Toxoplasma gondii". PLOS ONE . 11 (6): e0157901. Bibcode :2016PLoSO..1157901L. doi : 10.1371/journal.pone.0157901 . PMC 4927122 . PMID 27355363.
- ^ Bontell, IL; Hall, N.; Ashelford, KE; Dubey, JP; Boyle, JP; Lindh, J.; Smith, JE (20 de mayo de 2009). "La secuenciación del genoma completo de una cepa recombinante natural de Toxoplasma gondii revela la clasificación cromosómica y las variantes alélicas locales". Genome Biology . 10 (5): R53. doi : 10.1186/gb-2009-10-5-r53 . PMC 2718519 . PMID 19457243.
- ^ Kissinger, JC; Gajria, B.; Li, L.; Paulsen, IT; Roos, DS (enero de 2003). "ToxoDB: acceso al genoma de Toxoplasma gondii". Nucleic Acids Research . 31 (1): 234–36. doi :10.1093/nar/gkg072. PMC 165519 . PMID 12519989.
- ^ Gajria, B.; Bahl, A.; Brestelli, J.; Dommer, J.; Fischer, S.; Gao, X.; Heiges, M.; Yodice, J.; Kissinger, JC; Mackey, AJ; Pinney, DF; Roos, DS; Stoeckert, CJ; Wang, H.; Brunk, BP (enero de 2008). "ToxoDB: un recurso de base de datos integrado de Toxoplasma gondii". Investigación de ácidos nucleicos . 36 (Problema de la base de datos): D553–56. doi : 10.1093/nar/gkm981. PMC 2238934 . PMID 18003657.
- ^ "ToxoDB: The Toxoplasma Genomics Resource" (ToxoDB: el recurso genómico del toxoplasma). toxodb.org . Consultado el 1 de marzo de 2018 .
- ^ Flegr, Jaroslav; Prandota, Joseph; Sovičková, Michaela; Israili, Zafar H. (24 de marzo de 2014). "Toxoplasmosis: una amenaza global. Correlación de la toxoplasmosis latente con la carga de enfermedad específica en un conjunto de 88 países". PLOS ONE . 9 (3): e90203. Bibcode :2014PLoSO...990203F. doi : 10.1371/journal.pone.0090203 . ISSN 1932-6203. PMC 3963851 . PMID 24662942.
- ^ Norman, Jeremy M., ed. (1991). Bibliografía médica de Morton: una lista anotada de textos que ilustran la historia de la medicina (5.ª ed.). Aldershot: Garrison and Morton / Scolar Press. pág. 860 (§ 5535.1).
- ^ Pfefferkorn, ER (1984). "El interferón gamma bloquea el crecimiento de Toxoplasma gondii en fibroblastos humanos al inducir a las células huésped a degradar el triptófano". Actas de la Academia Nacional de Ciencias . 81 (3): 908–912. Bibcode :1984PNAS...81..908P. doi : 10.1073/pnas.81.3.908 . PMC 344948 . PMID 6422465.
- ^ McConkey, GA; Martin, HL; Bristow, GC; Webster, JP (enero de 2013). "Infección y comportamiento de Toxoplasma gondii: ¿ubicación, ubicación, ubicación?". The Journal of Experimental Biology . 216 (Pt 1): 113–19. doi :10.1242/jeb.074153. PMC 3515035 . PMID 23225873.
- ^ Flegr, J.; Lindová, J.; Kodym, P. (abril de 2008). "Diferencias en la concentración de testosterona en humanos asociadas a la toxoplasmosis dependientes del sexo". Parasitología . 135 (4): 427–31. doi :10.1017/S0031182007004064. PMID 18205984. S2CID 18829116.
- ^ abc Flegr, J. (mayo de 2007). "Efectos del toxoplasma en el comportamiento humano". Boletín de esquizofrenia . 33 (3): 757–60. doi :10.1093/schbul/sbl074. PMC 2526142. PMID 17218612 .
- ^ Kopecky, R.; Příplatová, L.; Boschetti, S.; Talmont-Kaminski, K.; Flegr, J. (2022). "El pequeño príncipe maquiavélico: efectos de la toxoplasmosis latente en las creencias y valores políticos". Psicología evolutiva . 20 (3): 1–13. doi : 10.1177/14747049221112657 . PMC 10303488 . PMID 35903902.
- ^ Ellwood, Beth (5 de octubre de 2022). «Una enfermedad parasitaria común llamada toxoplasmosis podría alterar las creencias políticas de una persona». PsyPost . Consultado el 30 de noviembre de 2022 .
- ^ Singh, Ananya (10 de octubre de 2022). "Un parásito común podría estar alterando las creencias políticas de las personas, sugiere un estudio". The Swaddle . Consultado el 30 de noviembre de 2022 .
- ^ Hrdá, S.; Votýpka, J.; Kodym, P.; Flegr, J. (agosto de 2000). "Naturaleza transitoria de los cambios de comportamiento inducidos por Toxoplasma gondii en ratones". The Journal of Parasitology . 86 (4): 657–63. doi :10.1645/0022-3395(2000)086[0657:TNOTGI]2.0.CO;2. PMID 10958436. S2CID 2004169.
- ^ Hutchison, WM; Aitken, PP; Wells, BW (octubre de 1980). "Infecciones crónicas por Toxoplasma y rendimiento motor en el ratón". Anales de Medicina Tropical y Parasitología . 74 (5): 507–10. doi :10.1080/00034983.1980.11687376. PMID 7469564.
- ^ Flegr, J.; Havlícek, J.; Kodym, P.; Malý, M.; Smahel, Z. (julio de 2002). "Aumento del riesgo de accidentes de tráfico en sujetos con toxoplasmosis latente: un estudio retrospectivo de casos y controles". BMC Infectious Diseases . 2 : 11. doi : 10.1186/1471-2334-2-11 . PMC 117239 . PMID 12095427.
- ^ Kocazeybek, B.; Oner, YA; Turksoy, R.; Babur, C.; Cakan, H.; Sahip, N.; Unal, A.; Ozaslan, A.; Kilic, S.; Saribas, S.; Aslan, M.; Taylan, A.; Koc, S.; Dirican, A.; Uner, HB; Oz, V.; Ertekin, C.; Kucukbasmaci, O.; Torun, MM (mayo de 2009). "Una mayor prevalencia de toxoplasmosis en víctimas de accidentes de tráfico sugiere un mayor riesgo de accidente de tráfico en los habitantes de Estambul y sus suburbios infectados por Toxoplasma". Forensic Science International . 187 (1–3): 103–08. doi :10.1016/j.forsciint.2009.03.007. PMID 19356869.
- ^ Torrey, EF; Bartko, JJ; Lun, ZR; Yolken, RH (mayo de 2007). "Anticuerpos contra Toxoplasma gondii en pacientes con esquizofrenia: un metaanálisis". Boletín de esquizofrenia . 33 (3): 729–36. doi :10.1093/schbul/sbl050. PMC 2526143 . PMID 17085743.
- ^ Arling, TA; Yema, RH; Lapidus, M.; Langenberg, P.; Dickerson, FB; Zimmerman, SA; Balis, T.; Cabassa, JA; Scrandis, DA; Tonelli, LH; Postolache, TT (diciembre de 2009). "Títulos de anticuerpos contra Toxoplasma gondii e antecedentes de intentos de suicidio en pacientes con trastornos del estado de ánimo recurrentes". La revista de enfermedades nerviosas y mentales . 197 (12): 905–08. doi :10.1097/nmd.0b013e3181c29a23. PMID 20010026. S2CID 33395780.
- ^ Ling, VJ; Lester, D.; Mortensen, PB; Langenberg, PW; Postolache, TT (julio de 2011). "Seropositividad a Toxoplasma gondii y tasas de suicidio en mujeres". The Journal of Nervous and Mental Disease . 199 (7): 440–44. doi :10.1097/nmd.0b013e318221416e. PMC 3128543 . PMID 21716055.
- ^ Johnson, SK; Fitza, MA; Lerner, DA; Calhoun, DM; Beldon, MA; Chan, ET; Johnson, PT (2018). "Negocios riesgosos: vinculación de la infección por Toxoplasma gondii y comportamientos emprendedores en individuos y países". Actas de la Royal Society B: Biological Sciences . 285 (1883): 20180822. doi :10.1098/rspb.2018.0822. PMC 6083268 . PMID 30051870.
- ^ Pearce, BD; Kruszon-Moran, D.; Jones, JL (2012). "La relación entre la infección por Toxoplasma gondii y los trastornos del estado de ánimo en la Tercera Encuesta Nacional de Salud y Nutrición". Psiquiatría biológica . 72 (4): 290–95. doi :10.1016/j.biopsych.2012.01.003. PMC 4750371 . PMID 22325983.
- ^ Sugden, K.; Moffitt, TE; Pinto, L.; Poulton, R.; Williams, BS; Caspi, A. (2016). "¿Está relacionada la infección por Toxoplasma gondii con alteraciones cerebrales y conductuales en humanos? Evidencia de una cohorte de nacimientos representativa de la población". PLOS ONE . 11 (2): e0148435. Bibcode :2016PLoSO..1148435S. doi : 10.1371/journal.pone.0148435 . PMC 4757034 . PMID 26886853.
- ^ Prandovszky, E.; Gaskell, E.; Martin, H.; Dubey, JP; Webster, JP; McConkey, GA (2011). "El parásito neurotrópico Toxoplasma gondii aumenta el metabolismo de la dopamina". PLOS ONE . 6 (9): e23866. Bibcode :2011PLoSO...623866P. doi : 10.1371/journal.pone.0023866 . PMC 3177840 . PMID 21957440.
- ^ Webster, JP; Lamberton, PH; Donnelly, CA; Torrey, EF (22 de abril de 2006). "¿Parásitos como agentes causantes de trastornos afectivos humanos? El impacto de la medicación antipsicótica, estabilizadora del estado de ánimo y antiparasitaria en la capacidad de Toxoplasma gondii de alterar el comportamiento del huésped". Actas. Ciencias biológicas . 273 (1589): 1023–30. doi :10.1098/rspb.2005.3413. PMC 1560245. PMID 16627289 .
- ^ Gaskell, EA; Smith, JE; Pinney, JW; Westhead, DR; McConkey, GA (2009). "Una hidroxilasa de aminoácidos de doble actividad única en Toxoplasma gondii". PLOS ONE . 4 (3): e4801. Bibcode :2009PLoSO...4.4801G. doi : 10.1371/journal.pone.0004801 . PMC 2653193 . PMID 19277211.
- ^ Sangrador, Amaia; Mitchell, Alex (6 de noviembre de 2014). «Protein focus: Don't blame the cat – the toxoplasmosis effect» (Enfoque proteico: no culpemos al gato: el efecto de la toxoplasmosis). Blog de la base de datos InterPro . Archivado desde el original el 22 de septiembre de 2016. Consultado el 27 de mayo de 2019 .
- ^ Hari Dass, SA; Vyas, A. (diciembre de 2014). "La infección por Toxoplasma gondii reduce la aversión a los depredadores en ratas a través de la modulación epigenética en la amígdala medial del huésped". Ecología molecular . 23 (24): 6114–22. Bibcode :2014MolEc..23.6114H. doi :10.1111/mec.12888. PMID 25142402. S2CID 45290208.
- ^ Meyer, Connor J.; Cassidy, Kira A.; Stahler, Erin E.; Brandell, Ellen E.; Anton, Colby B.; Stahler, Daniel R.; Smith, Douglas W. (24 de noviembre de 2022). "La infección parasitaria aumenta la asunción de riesgos en un carnívoro social, huésped intermediario". Communications Biology . 5 (1): 1180. doi :10.1038/s42003-022-04122-0. ISSN 2399-3642. PMC 9691632 . PMID 36424436.
- ^ Bracha, Shahar; et al. (29 de julio de 2024). "Ingeniería de los sistemas de secreción de Toxoplasma gondii para la administración intracelular de múltiples proteínas terapéuticas grandes a las neuronas". Nature Microbiology . 9 : 2051–2072. doi :10.1038/s41564-024-01750-6. PMC 11306108 .
- ^ Sullivan, Bill (7 de agosto de 2024). «Un parásito común podría algún día suministrar medicamentos al cerebro: cómo los científicos están convirtiendo al Toxoplasma gondii de enemigo en amigo». The Conversation . Archivado desde el original el 11 de agosto de 2024. Consultado el 11 de agosto de 2024 .
Enlaces externos
- ToxoDB: el recurso del genoma de Toxoplasma gondii en el Centro de recursos bioinformáticos VEuPathDB
- Parásitos - Toxoplasmosis (infección por Toxoplasma) por los Centros para el Control y la Prevención de Enfermedades
- Eliminación de Toxoplasmosis y el Instituto y Centro de Investigación de Toxoplasmosis de la Universidad de Chicago
- Anti-Toxo: un blog de noticias sobre toxoplasma y una lista de laboratorios de investigación por Bill Sullivan de la Facultad de Medicina de la Universidad de Indiana


