Micotoxina T-2
Este artículo necesita citas adicionales para su verificación . ( octubre de 2008 ) |
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC 3-metilbutanoato de (2α,3α,4β,8α)-4,15-bis(acetiloxi)-3-hidroxi-12,13-epoxitricotec-9-en-8-ilo | |
| Otros nombres Toxina T-2 Fusariotoxina T 2 Insariotoxina Micotoxina T 2 | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| EBICh |
|
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.040.255 |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| C24H34O9 | |
| Masa molar | 466,527 g·mol −1 |
| Insoluble | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La micotoxina T-2 es una micotoxina tricoteceno . Es un subproducto natural del hongo Fusarium spp. que es tóxico para los seres humanos y otros animales. La afección clínica que provoca es una aleukia tóxica alimentaria y una serie de síntomas relacionados con órganos tan diversos como la piel, las vías respiratorias y el estómago. La ingestión puede provenir del consumo de cereales integrales mohosos . La T-2 puede absorberse a través de la piel humana. [2] Aunque no se esperan efectos sistémicos significativos después del contacto dérmico en entornos agrícolas o residenciales normales, no se pueden excluir los efectos cutáneos locales. Por lo tanto, el contacto cutáneo con T-2 debe ser limitado.
Historia
La aleucia tóxica alimentaria (ATA), una enfermedad causada por tricotecenos como la micotoxina T-2, mató a miles de ciudadanos de la URSS en el distrito de Oremburgo en la década de 1940. Se informó que la tasa de mortalidad fue del 10% de toda la población de esa zona. Durante la década de 1970 se propuso que el consumo de alimentos contaminados era la causa de este envenenamiento masivo. Debido a la Segunda Guerra Mundial, la cosecha de cereales se retrasó y los alimentos escasearon en Rusia. Esto dio lugar al consumo de cereales contaminados con hongos Fusarium , que producen la micotoxina T-2. [3]
En 1981, el Secretario de Estado de los Estados Unidos, Alexander Haig , y su sucesor, George P. Shultz, acusaron a la Unión Soviética de utilizar la micotoxina T-2 como arma química conocida como « lluvia amarilla » en Laos (1975-1981), Kampuchea (1979-1981) y Afganistán (1979-1981), donde supuestamente causó miles de víctimas. [4] Aunque varios expertos estadounidenses en armas químicas afirman haber identificado muestras de «lluvia amarilla» de Laos como tricotecenos, otros expertos creen que esta exposición se debió a la micotoxina T-2 natural presente en alimentos contaminados. [5] Otra teoría alternativa fue desarrollada por el biólogo de Harvard Matthew Meselson , quien propuso que la «lluvia amarilla» encontrada en el sudeste asiático se originó a partir de los excrementos de las abejas de la selva. [6] El primer indicio de esta teoría provino del hallazgo de altos niveles de polen en las muestras recogidas, lo que le dio a la sustancia su color amarillo. También se descubrió que las abejas de la jungla en esta zona vuelan colectivamente en grandes cantidades, a altitudes demasiado altas para ser vistas fácilmente, produciendo lluvias de heces que podrían haber sido confundidas con aerosoles de aeronaves. [7] Pruebas posteriores determinaron que el líquido aceitoso era, de hecho, las heces llenas de polen de las abejas de la jungla. [6] Un caso similar en China salió a la luz, y en este caso la causa del fenómeno también había sido el excremento de las abejas. [8] A pesar de este análisis concluyente, Estados Unidos no ha retirado sus acusaciones y declara que el problema no se ha resuelto por completo.
También se cree que la micotoxina T-2 es una causa del síndrome de la Guerra del Golfo . Las tropas estadounidenses sufrieron síntomas similares a la micotoxicosis después de que un misil iraquí detonara en un campamento militar estadounidense en Arabia Saudita durante la Operación Tormenta del Desierto en la Guerra del Golfo Pérsico, en 1991. Se ha demostrado que Irak investigó las micotoxinas tricoteceno, entre otras sustancias, y por lo tanto era capaz de poseerlas y emplearlas en la guerra química . Sin embargo, gran parte de la información clave de estos incidentes sigue siendo clasificada, lo que deja estos asuntos aún sin resolver. [9]
Propiedades químicas
Este compuesto tiene un sistema de anillo sesquiterpenoide tetracíclico 12,13-epoxitricoteno, que lo relaciona con los tricotecenos. [10] Estos compuestos son generalmente muy estables y no se degradan durante el almacenamiento/molienda y cocción/procesamiento de alimentos. Tampoco se degradan a altas temperaturas. Este compuesto tiene un anillo epóxido y varios grupos acetilo e hidroxilo en sus cadenas laterales. Estas características son las principales responsables de la actividad biológica del compuesto y lo hacen altamente tóxico. La micotoxina T-2 es capaz de inhibir la síntesis de ADN y ARN in vivo e in vitro [11] y puede inducir apoptosis . [12] Sin embargo, in vivo el compuesto se metaboliza rápidamente a micotoxina HT-2 (un metabolito principal ). [13]
Mecanismo de acción
La toxicidad de la toxina T-2 se debe a su anillo 12,13-epoxi. [14] Los epóxidos son en general compuestos tóxicos; estos reaccionan con nucleófilos y luego experimentan reacciones enzimáticas adicionales . La reactividad de los epóxidos puede conducir a reacciones con compuestos endógenos y constituyentes celulares como bases de ADN y proteínas. [15] Estas reacciones podrían ser la razón de las acciones y efectos observados de la micotoxina T-2. El compuesto tóxico influye en el metabolismo de los fosfolípidos de membrana , conduce a un aumento de las peroxidasas lipídicas del hígado y tiene un efecto inhibidor sobre la síntesis de ADN y ARN. Además, puede unirse a una parte integral de la subunidad ribosómica 60s, la peptidiltransferasa , inhibiendo así la síntesis de proteínas . Se cree que estos efectos son la explicación de la apoptosis inducida por la toxina T-2 (muerte celular) en diferentes tejidos como el sistema inmunológico , el tejido gastrointestinal y también el tejido fetal. En lo que respecta a la apoptosis, se ha observado que el nivel del factor proapoptótico Bas (proteína X asociada a Bcl-2) aumentó y el nivel de Bcl-xl, un factor antiapoptótico, disminuyó en los condocitos humanos ( células del cartílago ). Cuando se expusieron a la micotoxina T-2, también aumentaron los niveles de Fas, un antígeno de superficie celular relacionado con la apoptosis, y p53, una proteína que regula el ciclo celular.
Síntesis
La micotoxina T-2 es producida naturalmente por hongos Fusarium de los cuales las especies más importantes son: F. sporotrichioides , F. langsethiae , F. acuminatum y F. poae . Estos hongos se encuentran en granos como la cebada , el trigo y la avena . La producción de este compuesto para fines comerciales y de investigación se logra generalmente cultivando alguna cepa de hongos productores de micotoxina T-2 en placas de agar . En estas placas de agar, los hongos tienen un aspecto pulverulento y pueden producir cantidades sustanciales de micotoxina T-2. Para el aislamiento del compuesto se utiliza comúnmente la cromatografía líquida de alta presión (HPLC). [16]
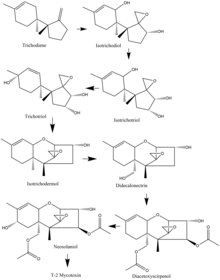
En las especies de Fusarium , la biosíntesis de la micotoxina T-2 a menudo comienza con tricodieno, y muchas de las especies comparten una ruta común de oxidaciones y ciclizaciones . Como ejemplo, en la especie F. sporotrichioides , los pasos de oxidación importantes que ocurren comienzan con tricodieno y van al isotricodiol. A partir de allí, el undécimo átomo de carbono se oxida para formar isotricotriol. Luego se oxida el noveno carbono y se forma tricotriol, que luego se cicla para formar isotricodermol. Después de eso, el decimoquinto carbono se oxida para formar didecalonectrina, que conduce a la oxidación del cuarto carbono y se forma diacetoxiscirpenol. El penúltimo paso es la oxidación del octavo carbono para formar neosolaniol, que luego sufre una ligera modificación para crear la toxina T-2. [17]
Toxicidad
Propiedades de ADME
Absorción y exposición
Los seres humanos y los animales generalmente están expuestos a las micotoxinas T-2 a través de los alimentos. Ciertos granos pueden contener la toxina, lo que la convierte en una amenaza para la salud humana y una carga económica. [18] A diferencia de la mayoría de las toxinas biológicas, la micotoxina T-2 puede absorberse a través de la piel intacta. El compuesto puede administrarse a través de alimentos, agua, gotitas, aerosoles y humo de varios sistemas de dispersión. Esto la convierte en un arma biológica potencial , sin embargo , se requieren grandes cantidades del compuesto para una dosis letal . La micotoxina T-2 tiene una DL50 de aproximadamente 1 miligramo por kilogramo de peso corporal.
La EFSA estima que la exposición media a T-2 en la UE se sitúa entre 12 y 43 ng/kg de peso corporal/día. [19] Este rango está por debajo de la TDI de 100 ng/kg de peso corporal para la suma de toxinas HT-2 y T-2 que utiliza la EFSA.
Distribución
La micotoxina T-2 se distribuye uniformemente por todo el cuerpo sin preferencia por un órgano o sitio específico. En roedores, los niveles de concentración plasmática alcanzan su punto máximo aproximadamente treinta minutos después de la exposición, y en un estudio, se observó que la vida media de la toxina T-2 era inferior a veinte minutos. En otro estudio con cerdos, se observó que la distribución después de cuatro horas de inyección intravenosa era del 15 al 24 % en el tracto gastrointestinal y del 4,7 al 5,2 % en varios otros tejidos. [20]
Metabolismo
Una vez absorbida y distribuida a varios tejidos, la micotoxina T-2 pasa por varias reacciones metabólicas antes de ser excretada. Los estudios in vivo mostraron que las reacciones más frecuentes son la hidrólisis de ésteres y la hidroxilación del grupo isovalerilo. También se producen oxidación profunda y conjugación de glucurónido . Ht-2 es el metabolito principal. Para la hidroxilación, se sugiere que está involucrado el complejo enzimático citocromo p450. Es más probable que el triol T-2 y el tetraol T-2 se formen a través de las esterasas de acetilcolinesterasas . Algunas de las reacciones metabólicas de la micotoxina las realiza la microflora del intestino. Los metabolitos formados en estas reacciones dependen de la especie y del pH. Sin embargo, las escisiones de ésteres las realiza el propio mamífero y no la microflora. En los glóbulos rojos, la micotoxina T-2 se metaboliza a neosolaniol y, en los glóbulos blancos , a HT-2 a través de la hidrólisis catalizada por carboxilesterasas.
Excreción
Después de la absorción, distribución y metabolismo, la micotoxina T-2 se excreta con bastante rapidez, donde el 80-90% de ella se excreta dentro de las 48 horas. [20] Los principales métodos de excreción parecen ser la orina y las heces, [21] donde la excreción a través de la bilis contribuye en gran medida a la vía de excreción de las heces. [14] También hay muy poca micotoxina T-2 original en las excreciones, lo que significa que la mayor parte del compuesto inicial se metaboliza de antemano. [21]
Efectos tóxicos
La T-2 es altamente tóxica cuando se inhala. Los síntomas de toxicidad aguda incluyen vómitos, diarrea, irritación de la piel, picazón, sarpullido, ampollas, sangrado y disnea . [ cita requerida ] Si el individuo está expuesto a la T-2 durante un período prolongado, se desarrolla aleucia tóxica alimentaria (ATA).
Al principio, el paciente siente una sensación de ardor en la boca, la garganta y el estómago. Después de unos días, la persona padecerá una gastroenteritis aguda que durará de 3 a 9 días. En el plazo de 9 semanas, la médula ósea se degenerará lentamente. También comienza a sangrar la piel y disminuye el número total de leucocitos . Pueden aparecer problemas en el sistema nervioso.
Al final pueden aparecer los siguientes síntomas: fiebre alta, hemorragia petequial , necrosis de músculos y piel, infecciones bacterianas del tejido necrótico, ganglios linfáticos agrandados . Existe la posibilidad de asfixia por edema laríngeo y estenosis de la glotis . La falta de oxígeno es entonces la causa de la muerte. De lo contrario, el paciente morirá de neumonía bronquial y hemorragia pulmonar. [22]
Efectos sobre los animales
La micotoxina T-2 también es tóxica para los animales. El compuesto es conocido por tener efectos letales y subletales en animales de granja. A menudo se encuentra en granos de cereales contaminados que se les dan a estos animales. [23] La mayoría de los efectos tóxicos se comparten entre humanos y animales. Después de exponer embriones de pez cebra a una concentración de 20 μmol/L o mayor, las tasas de malformación y mortalidad aumentaron. Las malformaciones incluyeron deformidades de la cola, defectos cardiovasculares y cambios en el comportamiento en las primeras etapas de la vida. Esto es el resultado de un aumento en la cantidad de epóxidos, que causa apoptosis celular. [24] Otros estudios han demostrado que la toxina T-2 causa peroxidación lipídica en ratas después de alimentárselas. Como efecto de la toxina T-2, se observaron niveles elevados de especies reactivas de oxígeno (ROS) en varias especies de mamíferos. Sin embargo, a pesar de los efectos nocivos generales causados por la toxina, en un estudio realizado en diferentes modelos de cultivo de células hepáticas derivadas de pollo, no se encontraron alteraciones en el estado redox de las células. [25]
El compuesto también parece reducir la fertilidad de las ovejas y las novillas. Las investigaciones han demostrado que una dosis alta de T-2 retrasa la ovulación debido a un retraso en la maduración de los folículos . Esto posiblemente retrasa la luteinización posterior , lo que hace imposible que las hembras conciban.
La T-2 también tiene un efecto sobre la fertilidad de los toros. En 1998 se descubrió que el heno mohoso influía en la calidad del semen de los toros. El análisis del heno mohoso mostró la presencia de T-2. El compuesto disminuyó la motilidad de los espermatozoides y los niveles de testosterona y aumentó la frecuencia de anomalías morfológicas en los espermatozoides.
El hígado es otro objetivo de la micotoxina. Es uno de los primeros órganos por donde pasa el compuesto después de la ingestión. Aquí provoca una reducción de la expresión de las proteínas CYP1A en conejos, cerdos y ratas. La actividad de CYP3A también disminuye en los cerdos. Estas enzimas ayudan a metabolizar los fármacos que pasan a través del hígado. La disminución de la actividad podría provocar un aumento de fármacos no metabolizados en el plasma. Esto puede tener un efecto peligroso sobre la salud de un animal. [26]
Todos los efectos mencionados se producen cuando se ingiere T-2 en dosis altas. Los animales son capaces de metabolizar el compuesto con enzimas de la familia CYP3A, al igual que los humanos.
Tratos
Actualmente, no existe una terapia específica para las intoxicaciones por micotoxina T-2. [21] La exposición a la micotoxina suele ir seguida de un tratamiento estandarizado para compuestos tóxicos con el fin de reducir el efecto de la toxina. Esto incluye el uso de carbón activado , que tiene una alta capacidad de unión de 0,48 mg de micotoxina T-2 a 1 mg de carbón. [21] Para el contacto dérmico, se utiliza agua y jabón para reducir los efectos dérmicos. [21] Como una especie de profilaxis , se cree que los antioxidantes tienen propiedades que pueden proporcionar beneficios. [20]
Solicitud
En la actualidad, no existen aplicaciones, aparte de la guerra, para las micotoxinas T-2; sin embargo, existen algunos usos terapéuticos plausibles. Debido a sus propiedades, las investigaciones muestran posibles usos para las micotoxinas como promotores del crecimiento, antibióticos , antivirales , antileucémicos y antipalúdicos . [ 20]
Véase también
Referencias
- ^ "Toxina T-2: datos esenciales". CBWInfo.com . Archivado desde el original el 12 de octubre de 2008.
- ^ Boonen J, Malysheva SV, Taevernier L, Diana Di Mavungu J, De Saeger S, De Spiegeleer B (noviembre de 2012). "Penetración de micotoxinas modelo seleccionadas en la piel humana". Toxicology . 301 (1–3): 21–32. Bibcode :2012Toxgy.301...21B. doi :10.1016/j.tox.2012.06.012. PMID 22749975.
- ^ Pitt JI (julio de 1989). Semple RL, Frio AS, Hicks PA, Lozare JW (eds.). Introducción a las micotoxinas . Prevención y control de micotoxinas en cereales alimentarios. Actas de asistencia para el curso de capacitación. Bangkok.
- ^ Shultz GP (1982). Chemical warfare in Southeast Asia and Afghanistan: an update (Informe). Departamento de Estado de los Estados Unidos, Oficina de Asuntos Públicos, Oficina de Comunicación Pública, División Editorial.
- ^ Caldwell RD (1983). "¿Lluvia amarilla o toxinas naturales?". Nature . 301 (5902): 651. Bibcode :1983Natur.301Q.651C. doi : 10.1038/301651a0 . S2CID 4263047.
- ^ ab "Cae lluvia amarilla". New York Times . 3 de septiembre de 1987. Archivado desde el original el 9 de noviembre de 2012 . Consultado el 20 de enero de 2022 .
La lluvia amarilla es el excremento de las abejas de la jungla. Es amarilla por los granos de polen digeridos y llueve desde enjambres de abejas demasiado altos para ser vistos. Su teoría resulta ser completamente correcta. Los propios estudios del Gobierno, aún inéditos, prueban que la fuente son las abejas, no las bombas.
- ^ Meselson MS, Robinson JP (junio de 2008). "El asunto de la lluvia amarilla: lecciones de una acusación desacreditada". En Clunan AL, Lavoy PR, Martin SB (eds.). Terrorismo, guerra o enfermedad? Desentrañando el uso de armas biológicas . Stanford: Stanford University Press. págs. 72–96. Archivado desde el original el 27 de julio de 2014. Consultado el 3 de septiembre de 2015 .
- ^ Zhang Z (1977). "Un estudio del origen y análisis del polen de la" lluvia amarilla "en el norte de Jiangsu". Kexue Tongbao . 22 : 409–12.
- ^ Zilinskas RA (agosto de 1997). "Las armas biológicas de Irak. ¿El pasado como futuro?". JAMA . 278 (5): 418–424. doi :10.1001/jama.1997.03550050080037. PMID 9244334.
- ^ CBRNE - Micotoxinas T-2 en eMedicine
- ^ Marin S, Ramos AJ, Cano-Sancho G, Sanchis V (octubre de 2013). "Micotoxinas: incidencia, toxicología y evaluación de la exposición". Toxicología alimentaria y química . 60 : 218–237. doi :10.1016/j.fct.2013.07.047. PMID 23907020.
- ^ Torp M, Langseth W (1999). "Producción de toxina T-2 por un Fusarium parecido a Fusarium poae". Mycopathologia . 147 (2): 89–96. doi :10.1023/A:1007060108935. PMID 10967967. S2CID 13540977.
- ^ Wu QH, Wang X, Yang W, Nüssler AK, Xiong LY, Kuča K, et al. (julio de 2014). "Citotoxicidad mediada por estrés oxidativo y metabolismo de la toxina T-2 y el deoxinivalenol en animales y humanos: una actualización". Archivos de toxicología . 88 (7): 1309–1326. Bibcode :2014ArTox..88.1309W. doi :10.1007/s00204-014-1280-0. PMID 24894432. S2CID 14146122.
- ^ ab Li Y, Wang Z, Beier RC, Shen J, De Smet D, De Saeger S, Zhang S (abril de 2011). "Toxina T-2, una micotoxina tricoteceno: revisión de toxicidad, metabolismo y métodos analíticos". Revista de química agrícola y alimentaria . 59 (8): 3441–3453. Bibcode :2011JAFC...59.3441L. doi :10.1021/jf200767q. PMID 21417259.
- ^ Timbrell JA (28 de enero de 2013). Principios de toxicología bioquímica (4.ª ed.). Boca Raton: CRC Press. doi :10.3109/9781420007084. ISBN 978-0-429-12493-8.
- ^ "Toxina T-2 de fusarium sp., polvo, ≥98% (HPLC)". Sigma-Aldridge .
- ^ Desjardins AE, Hohn TM, McCormick SP (septiembre de 1993). "Biosíntesis de tricoteceno en especies de Fusarium: química, genética y significado". Microbiological Reviews . 57 (3): 595–604. doi :10.1128/MMBR.57.3.595-604.1993. PMC 372927 . PMID 8246841.
- ^ Wan Q, Wu G, He Q, Tang H, Wang Y (marzo de 2015). "La toxicidad de la exposición aguda a la toxina T-2 evaluada mediante la técnica de metabonómica". Molecular BioSystems . 11 (3): 882–891. doi :10.1039/C4MB00622D. PMID 25588579.
- ^ Escrivá L, Font G, Manyes L (abril de 2015). "Estudios de toxicidad in vivo de micotoxinas de fusarium en la última década: una revisión". Food and Chemical Toxicology . 78 : 185–206. doi :10.1016/j.fct.2015.02.005. PMID 25680507.
- ^ abcd Adhikari M, Negi B, Kaushik N, Adhikari A, Al-Khedhairy AA, Kaushik NK, Choi EH (mayo de 2017). "Micotoxina T-2: efectos toxicológicos y estrategias de descontaminación". Oncotarget . 8 (20): 33933–33952. doi :10.18632/oncotarget.15422. PMC 5464924 . PMID 28430618.
- ^ abcde Wannemacher RW, Weiner SL (1997). "Capítulo 34: Micotoxinas tricotecénicas". Aspectos médicos de la guerra química y biológica . Oficina de Imprenta del Gobierno de los Estados Unidos. págs. 655–676. ISBN 9789997320919.
- ^ Semple RL, Frio AS, Hicks PA, Lozare JV (1989). Prevención y control de micotoxinas en cereales alimentarios. Red regional de cooperación entre países sobre tecnología de precosecha y control de calidad de cereales alimentarios (REGNET) del PNUD/FAO y Programa de poscosecha de cereales de la ASEAN (informe). Tailandia.
- ^ Cortinovis C, Pizzo F, Spicer LJ, Caloni F (octubre de 2013). "Micotoxinas de Fusarium: efectos sobre la función reproductiva en animales domésticos: una revisión". Theriogenology . 80 (6): 557–564. doi :10.1016/j.theriogenology.2013.06.018. PMID 23916251.
- ^ Yuan G, Wang Y, Yuan X, Zhang T, Zhao J, Huang L, Peng S (abril de 2014). "La toxina T-2 induce toxicidad del desarrollo y apoptosis en embriones de pez cebra". Revista de Ciencias Ambientales . 26 (4): 917–925. Bibcode :2014JEnvS..26..917Y. doi :10.1016/S1001-0742(13)60510-0. PMID 25079423.
- ^ Mackei M, Orbán K, Molnár A, Pál L, Dublecz K, Husvéth F, et al. (enero de 2020). "Efectos celulares de la toxina T-2 en modelos de cultivo de células hepáticas primarias de pollos". Toxins . 12 (1): 46. doi : 10.3390/toxins12010046 . PMC 7020465 . PMID 31941063.
- ^ Goossens J, De Bock L, Osselaere A, Verbrugghe E, Devreese M, Boussery K, et al. (julio de 2013). "La micotoxina T-2 inhibe la actividad hepática del citocromo P4503A en cerdos". Food and Chemical Toxicology . 57 : 54–56. doi :10.1016/j.fct.2013.03.009. PMID 23524315.
Lectura adicional
- "Micotoxina (T-2)". Manejo médico de víctimas biológicas: manual . Instituto de Investigación Médica de Enfermedades Infecciosas del Ejército de los Estados Unidos (USAMRIID). 1998. págs. 107-111.
- Bamburg JR, Riggs NV, Strong FM (1968). "La estructura de las toxinas de dos cepas de Fusarium tricinctum". Tetrahedron . 24 (8): 3329–3336. doi :10.1016/S0040-4020(01)92631-6. PMID 5648271.
- Bamburg JR, Strong FM (1971). "12,13-Epoxytrichothecenes". En Kadis S, Ciegler A, Ajl SJ (eds.). Toxinas microbianas . Vol. VII. Nueva York, NY: Academic Press. págs. 207–292.
Enlaces externos
- Sitio del síndrome de la Guerra del Golfo en el ejército de EE. UU.
- Exportaciones de micotoxina T-2 a Irak Archivado el 4 de febrero de 2005 en Wayback Machine.
- La polémica de la 'lluvia amarilla'
- Resumen del informe de Meselson



