Tiourea
 | |
 | |
| Nombres | |
|---|---|
| Nombre IUPAC preferido Tiourea [1] | |
| Otros nombres Tiocarbamida | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| 605327 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| Tarjeta informativa de la ECHA | 100.000.494 |
| 1604 | |
| BARRIL | |
Identificador de centro de PubChem |
|
| Número RTECS |
|
| UNIVERSIDAD | |
| Número de la ONU | 2811 |
Panel de control CompTox ( EPA ) |
|
| |
| |
| Propiedades | |
| S( NH2 ) 2 | |
| Masa molar | 76,12 g·mol −1 |
| Apariencia | sólido blanco |
| Densidad | 1,405 g/ml |
| Punto de fusión | 182 °C (360 °F; 455 K) |
| 142 g/L (25 °C) | |
| −4,24 × 10 −5 cm3 / mol | |
| Peligros | |
| Etiquetado SGA : | |
   | |
| Advertencia | |
| H302 , H351 , H361 , H411 | |
| P201 , P202 , P264 , P270 , P273 , P281 , P301+P312 , P308+P313 , P330 , P391 , P405 , P501 | |
| NFPA 704 (rombo cortafuegos) | |
| Compuestos relacionados | |
Compuestos relacionados | Urea Selenourea |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
La tiourea ( / ˌ θ aɪ . oʊ j ʊəˈr iː . ə , - ˈ jʊər i -/ ) [2] [3] [4] es un compuesto organosulfurado con la fórmula SC(NH 2 ) 2 y la estructura H 2 N−C(=S)−NH 2 . Es estructuralmente similar a la urea ( H 2 N−C(=O)−NH 2 ), excepto que el átomo de oxígeno es reemplazado por un átomo de azufre (como lo implica el prefijo tio- ); sin embargo, las propiedades de la urea y la tiourea difieren significativamente. La tiourea es un reactivo en síntesis orgánica . Las tioureas son una amplia clase de compuestos con la estructura general R 2 N−C(=S)−NR 2 .
Estructura y unión
La tiourea es una molécula plana. La distancia de enlace C=S es de 1,71 Å. Las distancias CN promedian 1,33 Å. [5] El debilitamiento del enlace CS por el enlace pi CN está indicado por el enlace C=S corto en la tiobenzofenona , que es de 1,63 Å.
La tiourea se presenta en dos formas tautoméricas , de las cuales la forma tiona predomina en soluciones acuosas. La constante de equilibrio se ha calculado como K eq es1,04 × 10 −3 . [6] La forma tiol , que también se conoce como isotiourea, se puede encontrar en compuestos sustituidos como las sales de isotiouronio .
Producción
La producción anual mundial de tiourea es de alrededor de 10.000 toneladas. Alrededor del 40% se produce en Alemania, otro 40% en China y el 20% en Japón. La tiourea se puede producir a partir de tiocianato de amonio , pero lo más común es que se fabrique mediante la reacción de sulfuro de hidrógeno con cianamida de calcio en presencia de dióxido de carbono . [7]
- CaCN2 +3H2S → Ca (SH ) 2+ ( NH2 ) 2CS
- 2 CaCN2 + Ca(SH) 2 + 6 H2O → 2 (NH2 ) 2 CS + 3 Ca(OH) 2
- Ca(OH) 2 + CO 2 → CaCO 3 + H 2 O
Aplicaciones
Precursor de tiox
La tiourea en sí tiene pocas aplicaciones. Se consume principalmente como precursor del dióxido de tiourea , que es un agente reductor común en el procesamiento textil. [7]
Fertilizantes
Recientemente se ha investigado la tiourea por sus múltiples propiedades deseables como fertilizante , especialmente en condiciones de estrés ambiental. [8] Se puede aplicar en diversas capacidades, como pretratamiento de semillas (para cebar), pulverización foliar o suplementación del medio.
Otros usos
Otros usos industriales de la tiourea incluyen la producción de resinas retardantes de llama y aceleradores de vulcanización . La tiourea es un componente básico de los derivados de pirimidina . Por lo tanto, las tioureas se condensan con compuestos de β-dicarbonilo. [9] El grupo amino de la tiourea se condensa inicialmente con un carbonilo, seguido de ciclización y tautomerización. La desulfuración libera la pirimidina. Los productos farmacéuticos ácido tiobarbitúrico y sulfatiazol se preparan utilizando tiourea. [7] El 4-amino-3-hidrazino-5-mercapto-1,2,4-triazol se prepara mediante la reacción de tiourea e hidrazina .
La tiourea se utiliza como agente auxiliar en papel diazo, papel para fotocopias sensible a la luz y casi todos los demás tipos de papel para copia.
También se utiliza para tonificar impresiones fotográficas en gelatina de plata (ver Tonalización sepia ).
La tiourea se utiliza en los procesos de galvanoplastia brillante y semibrillante de Clifton-Phillips y Beaver. [10] También se utiliza en una solución con cloruro de estaño (II) como solución de estañado químico para placas de circuito impreso de cobre .
Las tioureas se utilizan (generalmente como catalizadores donantes de enlaces de hidrógeno ) en un tema de investigación llamado organocatálisis de tiourea . [11] A menudo se descubre que las tioureas son donantes de enlaces de hidrógeno más fuertes ( es decir, más ácidas) que las ureas . [12] [13]
Reacciones
El material tiene la propiedad inusual de transformarse en tiocianato de amonio al calentarse por encima de130 °C . Al enfriarse, la sal de amonio se convierte nuevamente en tiourea. [ cita requerida ]
Reductor
La tiourea reduce los peróxidos a los dioles correspondientes . [14] El intermedio de la reacción es un endoperóxido inestable .

La tiourea también se utiliza en el tratamiento reductor de la ozonólisis para dar compuestos carbonílicos . [15] El sulfuro de dimetilo también es un reactivo eficaz para esta reacción, pero es muy volátil (punto de ebullición 37 °C ) y tiene un olor desagradable, mientras que la tiourea es inodora y convenientemente no volátil (lo que refleja su polaridad).

Fuente de sulfuro
La tiourea se emplea como fuente de sulfuro, por ejemplo para convertir haluros de alquilo en tioles. La reacción aprovecha la alta nucleofilia del centro de azufre y la fácil hidrólisis de la sal intermedia de isotiouronio :
- CS(NH2 ) 2 + RX → RSC( NH2 )+2X −
- CRS( NH2 )+2X − + 2 NaOH → RSNa + OC(NH 2 ) 2 + NaX + H 2 O
- RSNa + HCl → RSH + NaCl
En este ejemplo, el etano-1,2-ditiol se prepara a partir de 1,2-dibromoetano : [16]
- C2H4Br2 + 2SC ( NH2 ) 2 → [ C2H4 ( SC ( NH2 ) 2 ) 2 ] Br2
- [ C2H4 (SC(NH2 ) 2 ) 2 ] Br2 + 2 KOH → C2H4 ( SH) 2 + 2 OC(NH2 ) 2 + 2 KBr
Al igual que otras tioamidas , la tiourea puede servir como fuente de sulfuro al reaccionar con iones metálicos. Por ejemplo, el sulfuro de mercurio se forma cuando las sales de mercurio en solución acuosa se tratan con tiourea:
- Hg2 + + SC(NH2 ) 2 + H2O → HgS+OC(NH2 ) 2 + 2H +
Estas reacciones de sulfuración, que se han aplicado a la síntesis de muchos sulfuros metálicos, requieren agua y, normalmente, algo de calentamiento. [17] [18]
Precursor de los heterociclos
Las tioureas son los componentes básicos de los derivados de pirimidina . Por lo tanto, las tioureas se condensan con compuestos de β-dicarbonilo. [19] El grupo amino de la tiourea se condensa inicialmente con un carbonilo, seguido de ciclización y tautomerización. La desulfuración libera la pirimidina.
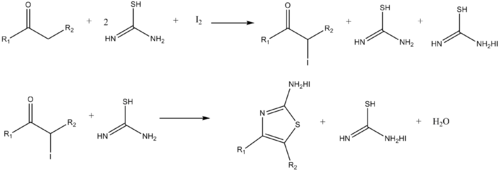
De manera similar, los aminotiazoles pueden sintetizarse mediante la reacción de α-halo cetonas y tiourea. [20]
Los productos farmacéuticos ácido tiobarbitúrico y sulfatiazol se preparan utilizando tiourea. [7] El 4-amino-3-hidrazino-5-mercapto-1,2,4-triazol se prepara mediante la reacción de tiourea e hidrazina .
Pulido de plata
Según la etiqueta de los productos de consumo TarnX [21] y Silver Dip [22] , los productos líquidos de limpieza de plata contienen tiourea junto con una advertencia de que la tiourea es una sustancia química incluida en la lista de carcinógenos de California . [23] Se puede crear un lixiviante para la lixiviación de oro y plata oxidando selectivamente la tiourea, evitando los pasos de uso de cianuro y fundición. [24]
Reacción de Kurnakov
La tiourea es un reactivo esencial en la prueba de Kurnakov que se utiliza para diferenciar los isómeros cis y trans de ciertos complejos de platino cuadrados y planos . La reacción fue descubierta en 1893 por el químico ruso Nikolai Kurnakov y todavía se realiza como un ensayo para compuestos de este tipo. [25]
Seguridad
La LD 50 para la tiourea es125 mg/kg para ratas (por vía oral). [26]
Se ha informado de un efecto bociógeno (agrandamiento de la glándula tiroides) por exposición crónica, lo que refleja la capacidad de la tiourea para interferir con la absorción de yoduro. [7]
Un derivado cíclico de la tiourea llamado tiamazol se utiliza para tratar la tiroides hiperactiva.
Véase también
Referencias
- ^ Favre, Henri A.; Powell, Warren H. (2014). Nomenclatura de la química orgánica: recomendaciones de la IUPAC y nombres preferidos 2013 (Libro azul). Cambridge: Royal Society of Chemistry . pp. 98, 864. doi :10.1039/9781849733069. ISBN . 9780854041824.OCLC 1077224056 .
- ^ "tiourea". Diccionario de inglés Lexico UK . Oxford University Press . Archivado desde el original el 22 de marzo de 2020.
- ^ "tiourea". Diccionario Merriam-Webster.com . Merriam-Webster . Consultado el 21 de enero de 2016 .
- ^ "tiourea". Dictionary.com Unabridged (en línea). nd
- ^ D. Mullen; E. Hellner (1978). "Un refinamiento simple de las distribuciones de densidad de electrones de enlace. IX. Distribución de densidad de electrones de enlace en tiourea, CS(NH 2 ) 2 , a 123 K". Acta Crystallogr . B34 (9): 2789–2794. Código Bibliográfico :1978AcCrB..34.2789M. doi :10.1107/S0567740878009243.
- ^ Allegretti, PE; Castro, EA; Furlong, JJP (marzo de 2000). "Equilibrio tautomérico de amidas y compuestos relacionados: evidencias teóricas y espectrales". Journal of Molecular Structure: THEOCHEM . 499 (1–3): 121–126. doi :10.1016/S0166-1280(99)00294-8.
- ^ abcde Mertschenk, Bernd; Beck, Ferdinand; Bauer, Wolfgang (2002). "Tiourea y derivados de la tiourea". Ullmann's Encyclopedia of Industrial Chemistry . Wiley-VCH. doi :10.1002/14356007.a26_803. ISBN 3527306730.
- ^ Wahid, Abdul (1 de agosto de 2017). "Tiourea: una molécula con inmenso significado biológico para las plantas" (PDF) . Revista internacional de agricultura y biología . 19 (4): 911–920. doi : 10.17957/ijab/15.0464 . ISSN 1560-8530. Archivado (PDF) desde el original el 15 de febrero de 2020 . Consultado el 9 de diciembre de 2020 .
- ^ Foster, HM; Snyder, HR (1955). "4-Metil-6-hidroxipirimidina". Síntesis orgánicas . 35 : 80. doi :10.15227/orgsyn.035.0080.
- ^ "81st Universal Metal Finishing Guidebook". Edición de guía y directorio de acabado de metales . Revista Metal Finishing: 285. Otoño de 2013. ISSN 0026-0576. Archivado desde el original el 17 de noviembre de 2017. Consultado el 11 de octubre de 2016 .
- ^ R. Schreiner, Peter (2003). "Organocatálisis sin metales a través de interacciones explícitas de enlaces de hidrógeno". Chem. Soc. Rev. 32 ( 5): 289–296. doi :10.1039/b107298f. PMID 14518182.
- ^ Jakab, Gergely; Tancon, Carlo; Zhang, Zhiguo; Lippert, Katharina M.; Schreiner, Peter R. (2012). "Acidez de equilibrio de organocatalizadores de (tio)urea en DMSO". Cartas orgánicas . 14 (7): 1724–1727. doi :10.1021/ol300307c. PMID 22435999.
- ^ Nieuwland, Celine; Fonseca Guerra, Célia (2022). "Cómo el tamaño del átomo de calcógeno determina la capacidad de donación de enlaces de hidrógeno de las carboxamidas, tioamidas y selenoamidas". Química: una revista europea . 28 (31): e202200755. doi :10.1002/chem.202200755. PMC 9324920 . PMID 35322485.
- ^ Kaneko, C.; Sugimoro, A.; Tanaka, S. (1974). "Una síntesis sencilla en un solo paso de cis-2-ciclopenteno y cis-2-ciclohexeno-1,4-dioles a partir de los ciclodienos correspondientes". Síntesis . 1974 (12): 876–877. doi :10.1055/s-1974-23462. S2CID 93207044. Archivado desde el original el 2021-06-12 . Consultado el 2022-06-18 .
- ^ Gupta, D., Soman, G. y Dev, S. (1982). "Tiourea, un reactivo conveniente para la escisión reductora de productos de ozonólisis de olefinas". Tetrahedron . 38 (20): 3013–3018. doi :10.1016/0040-4020(82)80187-7.
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Speziale, AJ (1963). "Etanoditiol". Síntesis orgánicas; Volúmenes recopilados , vol. 4, pág. 401.
- ^ Liang, Y.; et, al. (2016). "Un precursor eficiente para sintetizar varias nanoestructuras de FeS2 mediante un método de síntesis hidrotermal simple". CrystEngComm . 18 (33): 6262–6271. doi :10.1039/c6ce01203e.
- ^ Bao, N.; et al. (2007). "Síntesis sencilla de termólisis de complejos de Cd-tiourea de nanocristales de CdS controlados por fase para la producción fotocatalítica de hidrógeno bajo luz visible". The Journal of Physical Chemistry C . 111 (47): 17527–17534. doi :10.1021/jp076566s.
- ^ Foster, HM y Snyder, HR (1963). "4-Metil-6-hidroxipirimidina". Síntesis orgánicas
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ); Volúmenes recopilados , vol. 4, pág. 638. - ^ Dodson, RM y King, LC (1945). "La reacción de cetonas con halógenos y tiourea". J. Am. Chem. Soc. 67 (12): 2242–2243. doi :10.1021/ja01228a059. PMID 21005695.
- ^ "Quitamanchas Tarn-X PRO" (PDF) . The Betty Mills Company, Inc. Archivado (PDF) del original el 2021-06-06 . Consultado el 2021-06-06 .
- ^ "Hagerty Silver Dip". JL Smith & Co. Archivado desde el original el 2021-06-06 . Consultado el 2021-06-06 .
- ^ Valores acelerados de potencia cancerígena y niveles reglamentarios propuestos para determinados carcinógenos de la Proposición 65 (PDF) (Informe). Abril de 1992. Archivado (PDF) desde el original el 21 de enero de 2022. Consultado el 18 de junio de 2022 .
- ^ Esposito, Anthony (13 de julio de 2007). "Peñoles y la UAM inauguran planta piloto de lixiviación de Au-Ag con tiourea en México". Business News Americas. Archivado desde el original el 17 de febrero de 2009.
- ^ Kauffman, George B. (enero de 1983). «Nikolaĭ Semenovich Kurnakov, la reacción (1893) y el hombre (1860-1941): una visión retrospectiva de noventa años». Poliedro . 2 (9): 855–863. doi :10.1016/S0277-5387(00)81400-X. ISSN 0277-5387. Archivado desde el original el 28 de marzo de 2021 . Consultado el 9 de diciembre de 2020 .
- ^ "La tiourea y sus propiedades". 11 de septiembre de 1986. Archivado desde el original el 27 de mayo de 2010. Consultado el 6 de enero de 2012 .
Lectura adicional
- Patai, Saul (1977). La química de los grupos funcionales con doble enlace . Nueva York, NY: John Wiley & Sons. pp. 1355–1496. ISBN 9780471924937.OCLC 643207498 .
Enlaces externos
- Evaluación de tiourea por parte del INCHEM
- Ficha internacional de seguridad química 0680