Proteína de erizo sónico
| Silencio | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | SHH , HHG1, HLP3, HPE3, MCOPCB5, SMMCI, TPT, TPTPS, Sonic Hedgehog, Sonic Hedgehog, ShhNC, molécula de señalización de Sonic Hedgehog | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 600725; MGI : 98297; HomoloGene : 30961; Tarjetas genéticas : SHH; OMA :SHH - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
La proteína Sonic Hedgehog ( SHH ) está codificada por el gen SHH . [5] La proteína recibe su nombre del personaje del videojuego Sonic the Hedgehog .
Esta molécula de señalización es clave en la regulación de la morfogénesis embrionaria en todos los animales. SHH controla la organogénesis y la organización del sistema nervioso central, las extremidades, los dedos y muchas otras partes del cuerpo. Sonic hedgehog es un morfógeno que modela el embrión en desarrollo utilizando un gradiente de concentración caracterizado por el modelo de la bandera francesa . [6] Este modelo tiene una distribución no uniforme de moléculas SHH que gobierna diferentes destinos celulares según la concentración. Las mutaciones en este gen pueden causar holoprosencefalia , un fallo en la división de los hemisferios cerebrales, [7] como se demostró en un experimento con ratones knock-out SHH en el que la línea media del prosencéfalo no se desarrolló y en su lugar solo resultó una única vesícula telencefálica fusionada. [8]
Sonic hedgehog todavía desempeña un papel en la diferenciación, proliferación y mantenimiento de los tejidos adultos. La activación anormal de la señalización SHH en los tejidos adultos se ha relacionado con varios tipos de cáncer, incluidos el cáncer de mama , de piel , de cerebro , de hígado , de vesícula biliar y muchos más. [9]
Descubrimiento y denominación
El gen hedgehog ( hh ) fue identificado por primera vez en la mosca de la fruta Drosophila melanogaster en las clásicas pantallas de Heidelberg de Christiane Nüsslein-Volhard y Eric Wieschaus , publicadas en 1980. [10] Estas pantallas , que llevaron a los investigadores a ganar un Premio Nobel en 1995 junto con el genetista del desarrollo Edward B. Lewis , identificaron genes que controlan el patrón de segmentación de los embriones de Drosophila . El fenotipo mutante de pérdida de función hh hace que los embriones estén cubiertos de dentículos, es decir, pequeñas proyecciones puntiagudas que se asemejan a las púas de un erizo . Las investigaciones destinadas a encontrar un equivalente de hedgehog en vertebrados por Philip Ingham , Andrew P. McMahon y Clifford Tabin revelaron tres genes homólogos . [11] [12] [13] [14]
Dos de estos genes, el erizo del desierto y el erizo indio , recibieron el nombre de especies de erizos, mientras que el erizo sónico recibió el nombre del personaje del videojuego Sonic the Hedgehog . [15] [16] El gen fue nombrado por Robert Riddle, un investigador postdoctoral en el Laboratorio Tabin , después de que su esposa Betsy Wilder llegara a casa con una revista que contenía un anuncio del primer juego de la serie, Sonic the Hedgehog (1991). [17] [18] [19] En el pez cebra , dos de los tres genes hh de vertebrados están duplicados: SHH a [20] y SHH b [21] (anteriormente descrito como tiggywinkle hedgehog , llamado así por la Sra. Tiggy-Winkle , un personaje de los libros para niños de Beatrix Potter ) e ihha e ihhb [22] (anteriormente descrito como echidna hedgehog , llamado así por el oso hormiguero espinoso y no por el personaje Knuckles the Echidna en la franquicia Sonic ).
Función
De los homólogos hh , se ha descubierto que SHH tiene los papeles más críticos en el desarrollo, actuando como un morfógeno involucrado en la formación de patrones en muchos sistemas, incluyendo la pituitaria anterior , [23] el palio del cerebro, [24] la médula espinal , [25] los pulmones , [26] los dientes [27] y el tálamo por la zona limitans intrathalamica . [28] [29] En los vertebrados, el desarrollo de las extremidades y los dígitos depende de la secreción de sonic hedgehog por la zona de actividad polarizante , ubicada en el lado posterior de la yema de la extremidad embrionaria . [13] Las mutaciones en el gen humano sonic hedgehog SHH causan holoprosencefalia tipo 3 HPE3, como resultado de la pérdida de la línea media ventral . La vía de transcripción del erizo sónico también se ha vinculado a la formación de tipos específicos de tumores cancerosos, incluido el tumor cerebeloso embrionario [30] y el meduloblastoma [31] , así como a la progresión de los tumores de cáncer de próstata . [32] Para que SHH se exprese en las extremidades del embrión en desarrollo, un morfógeno llamado factores de crecimiento de fibroblastos debe secretarse desde la cresta ectodérmica apical . [33]
También se ha demostrado que Sonic hedgehog actúa como una señal de guía axonal . Se ha demostrado que SHH atrae axones comisurales en la línea media ventral de la médula espinal en desarrollo. [34] Específicamente, SHH atrae axones de células ganglionares de la retina (RGC) en concentraciones bajas y los repele en concentraciones más altas. [35] Se ha demostrado que la ausencia (no expresión) de SHH controla el crecimiento de las extremidades traseras nacientes en cetáceos [36] ( ballenas y delfines ).
El gen SHH es un miembro de la familia de genes hedgehog con cinco variaciones de alteraciones de la secuencia de ADN o variantes de empalme. [37] SHH se encuentra en el cromosoma siete e inicia la producción de la proteína Sonic Hedgehog. [37] Esta proteína envía señales de corto y largo alcance a los tejidos embrionarios para regular el desarrollo. [38] Si el gen SHH está mutado o ausente, la proteína Sonic Hedgehog no puede hacer su trabajo correctamente. Sonic hedgehog contribuye al crecimiento celular, la especificación y formación celular, la estructuración y organización del plan corporal. [39] Esta proteína funciona como una molécula de señalización morfogénica vital y juega un papel importante en la formación de muchas estructuras diferentes en embriones en desarrollo. [39] El gen SHH afecta a varios sistemas de órganos importantes, como el sistema nervioso, el sistema cardiovascular, el sistema respiratorio y el sistema musculoesquelético. [37] [38] Las mutaciones en el gen SHH pueden causar malformaciones de los componentes de estos sistemas, lo que puede resultar en problemas importantes en el embrión en desarrollo. El cerebro y los ojos, por ejemplo, pueden verse significativamente afectados por mutaciones en este gen y causar trastornos como la microftalmia y la holoprosencefalia . [39] La microftalmia es una afección que afecta a los ojos, lo que da como resultado tejidos pequeños y subdesarrollados en uno o ambos ojos. [39] Esto puede conducir a problemas que van desde un coloboma hasta un solo ojo pequeño o la ausencia total de ojos. [38] La holoprosencefalia es una afección causada más comúnmente por una mutación del gen SHH que causa una separación o giro inadecuado del cerebro izquierdo y derecho [40] y dismorfia facial. [38] [39] Muchos sistemas y estructuras dependen en gran medida de la expresión adecuada del gen SHH y la posterior proteína Sonic Hedgehog, lo que le valió la distinción de ser un gen esencial para el desarrollo.
Patrones del sistema nervioso central
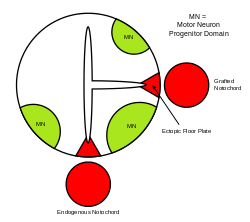
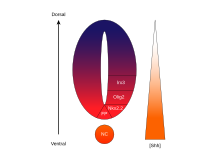
La molécula de señalización Sonic Hedgehog (SHH) asume varias funciones en la formación de patrones del sistema nervioso central (SNC) durante el desarrollo de los vertebrados . Una de las funciones más caracterizadas de SHH es su papel en la inducción de la placa del suelo y diversos tipos de células ventrales dentro del tubo neural . [41] La notocorda , una estructura derivada del mesodermo axial , produce SHH, que viaja extracelularmente a la región ventral del tubo neural y da instrucciones a esas células para que formen la placa del suelo. [42] Otra visión de la inducción de la placa del suelo plantea la hipótesis de que algunas células precursoras ubicadas en la notocorda se insertan en la placa neural antes de su formación, dando lugar posteriormente a la placa del suelo. [43]
El tubo neural en sí es la base inicial del sistema nervioso central de los vertebrados , y la placa del suelo es una estructura especializada, ubicada en el punto medio ventral del tubo neural. La evidencia que respalda a la notocorda como centro de señalización proviene de estudios en los que se implanta una segunda notocorda cerca de un tubo neural in vivo, lo que conduce a la formación de una placa del suelo ectópica dentro del tubo neural. [44]
Sonic hedgehog es la proteína secretada que media las actividades de señalización de la notocorda y la placa del suelo. [45] Los estudios que implican la expresión ectópica de SHH in vitro [46] e in vivo [47] dan como resultado la inducción de la placa del suelo y la diferenciación de la neurona motora y las interneuronas ventrales . Por otro lado, los ratones mutantes para SHH carecen de características de la médula espinal ventral. [48] El bloqueo in vitro de la señalización de SHH utilizando anticuerpos contra él muestra fenotipos similares. [47] SHH ejerce sus efectos de manera dependiente de la concentración, [49] de modo que una alta concentración de SHH da como resultado una inhibición local de la proliferación celular . [50] Esta inhibición hace que la placa del suelo se vuelva delgada en comparación con las regiones laterales del tubo neural . Una concentración más baja de SHH da como resultado la proliferación celular y la inducción de varios tipos de células neurales ventrales. [47] Una vez que se establece la placa del suelo , las células que residen en esta región posteriormente expresarán SHH por sí mismas, [50] generando un gradiente de concentración dentro del tubo neural.
Aunque no hay evidencia directa de un gradiente de SHH , hay evidencia indirecta a través de la visualización de la expresión del gen Patched ( Ptc ) , que codifica el dominio de unión del ligando del receptor SHH [51] en todo el tubo neural ventral. [52] Los estudios in vitro muestran que los cambios incrementales de dos y tres veces en la concentración de SHH dan lugar a neuronas motoras y diferentes subtipos interneuronales como los que se encuentran en la médula espinal ventral. [53] Estos cambios incrementales in vitro corresponden a la distancia de los dominios desde el tejido de señalización (notocorda y placa del suelo) que posteriormente se diferencia en diferentes subtipos neuronales como ocurre in vitro . [54] Se sugiere que la señalización graduada de SHH está mediada por la familia de proteínas Gli , que son homólogos vertebrados del factor de transcripción que contiene el dedo de zinc Cubitus interruptus ( Ci ) de Drosophila . Ci es un mediador crucial de la señalización hedgehog ( Hh ) en Drosophila . [55] En los vertebrados, hay tres proteínas Gli diferentes, a saber, Gli1 , Gli2 y Gli3 , que se expresan en el tubo neural. [56] Los ratones mutantes para Gli1 muestran un desarrollo normal de la médula espinal, lo que sugiere que es prescindible para mediar la actividad de SHH. [57] Sin embargo, los ratones mutantes Gli2 muestran anomalías en la médula espinal ventral, con graves defectos en la placa del suelo y en las interneuronas más ventrales (V3). [58] Gli3 antagoniza la función de SHH de una manera dependiente de la dosis , promoviendo subtipos neuronales dorsales. Los fenotipos mutantes de SHH se pueden rescatar en un mutante doble SHH/Gli3 . [59] Las proteínas Gli tienen un dominio de activación C-terminal y un dominio represivo N-terminal. [56] [60]
Se ha sugerido que la SHH promueve la función de activación de Gli2 e inhibe la actividad represiva de Gli3. La SHH también parece promover la función de activación de Gli3, pero esta actividad no es lo suficientemente fuerte. [59] La concentración gradual de SHH da lugar a una actividad gradual de Gli 2 y Gli3, que promueven los subtipos neuronales ventrales y dorsales en la médula espinal ventral. La evidencia de los mutantes Gli3 y SHH/Gli3 muestra que la SHH regula principalmente la restricción espacial de los dominios progenitores en lugar de ser inductiva, ya que los mutantes SHH/Gli3 muestran una mezcla de tipos de células. [59] [61]
La SHH también induce otras proteínas con las que interactúa, y estas interacciones pueden influir en la sensibilidad de una célula hacia la SHH. La proteína que interactúa con Hedgehog ( HHIP ) es inducida por la SHH, que a su vez atenúa su actividad de señalización. [62] La vitronectina es otra proteína que es inducida por la SHH; actúa como un cofactor obligado para la señalización de la SHH en el tubo neural. [63]
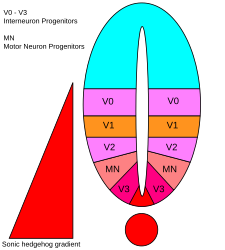
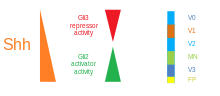
Existen cinco dominios progenitores distintos en el tubo neural ventral: interneuronas V3 , neuronas motoras (MN), interneuronas V2 , V1 y V0 (en orden ventral a dorsal). [53] Estos diferentes dominios progenitores se establecen por "comunicación" entre diferentes clases de factores de transcripción homeobox . (Véase Nervio trigémino ). Estos factores de transcripción responden a la concentración del gradiente de SHH. Dependiendo de la naturaleza de su interacción con SHH, se clasifican en dos grupos (clase I y clase II) y están compuestos por miembros de las familias Pax , Nkx , Dbx e Irx . [50] Las proteínas de clase I se reprimen en diferentes umbrales de SHH que delimitan los límites ventrales de los dominios progenitores , mientras que las proteínas de clase II se activan en diferentes umbrales de SHH que delimitan el límite dorsal de los dominios. Las interacciones selectivas de represión cruzada entre las proteínas de clase I y clase II dan lugar a cinco subtipos neuronales ventrales cardinales. [64]
Es importante señalar que SHH no es la única molécula de señalización que ejerce un efecto sobre el tubo neural en desarrollo. Muchas otras moléculas, vías y mecanismos están activos (p. ej., RA , FGF , BMP ), y son posibles interacciones complejas entre SHH y otras moléculas. Se sugiere que las BMP desempeñan un papel fundamental en la determinación de la sensibilidad de la célula neural a la señalización de SHH. La evidencia que respalda esto proviene de estudios que utilizan inhibidores de BMP que ventralizan el destino de la célula de la placa neural para una concentración dada de SHH. [65] Por otro lado, la mutación en antagonistas de BMP (p. ej., noggin ) produce defectos graves en las características más ventrales de la médula espinal, seguido de la expresión ectópica de BMP en el tubo neural ventral. [66] Las interacciones de SHH con Fgf y RA aún no se han estudiado en detalle molecular.
Actividad morfogenética
La actividad de SHH, que depende de la concentración y del tiempo y determina el destino celular en el tubo neural ventral, lo convierte en un excelente ejemplo de morfógeno . En los vertebrados, la señalización de SHH en la porción ventral del tubo neural es la más notablemente responsable de la inducción de las células de la placa del piso y las neuronas motoras . [67] SHH emana de la notocorda y la placa del piso ventral del tubo neural en desarrollo para crear un gradiente de concentración que abarca el eje dorsoventral y es antagonizado por un gradiente inverso de Wnt , que especifica la médula espinal dorsal. [68] [69] Se encuentran concentraciones más altas del ligando SHH en los aspectos más ventrales del tubo neural y la notocorda, mientras que se encuentran concentraciones más bajas en las regiones más dorsales del tubo neural. [68] El gradiente de concentración de SHH se ha visualizado en el tubo neural de ratones diseñados para expresar una proteína de fusión SHH::GFP para mostrar esta distribución graduada de SHH durante el tiempo de formación del patrón del tubo neural ventral. [70]
Se cree que el gradiente de SHH funciona para provocar múltiples destinos celulares diferentes mediante un mecanismo dependiente de la concentración y el tiempo que induce una variedad de factores de transcripción en las células progenitoras ventrales . [68] [70] Cada uno de los dominios progenitores ventrales expresa una combinación altamente individualizada de factores de transcripción (Nkx2.2, Olig2, Nkx6.1, Nkx6.2, Dbx1, Dbx2, Irx3, Pax6 y Pax7) que está regulada por el gradiente de SHH. Estos factores de transcripción se inducen secuencialmente a lo largo del gradiente de concentración de SHH con respecto a la cantidad y el tiempo de exposición al ligando SHH. [68] A medida que cada población de células progenitoras responde a los diferentes niveles de proteína SHH, comienzan a expresar una combinación única de factores de transcripción que conduce a la diferenciación del destino celular neuronal. Esta expresión génica diferencial inducida por SHH crea límites nítidos entre los dominios discretos de expresión de factores de transcripción, que en última instancia modelan el tubo neural ventral. [68]
El aspecto espacial y temporal de la inducción progresiva de genes y destinos celulares en el tubo neural ventral se ilustra mediante los dominios de expresión de dos de los factores de transcripción mejor caracterizados, Olig2 y Nkx2.2. [68] Temprano en el desarrollo, las células en la línea media ventral solo han sido expuestas a una baja concentración de SHH por un tiempo relativamente corto y expresan el factor de transcripción Olig2. [68] La expresión de Olig2 se expande rápidamente en una dirección dorsal concomitantemente con la extensión dorsal continua del gradiente de SHH a lo largo del tiempo. [68] Sin embargo, a medida que el frente morfogenético del ligando SHH se mueve y comienza a crecer más concentrado, las células que están expuestas a niveles más altos del ligando responden apagando Olig2 y activando Nkx2.2, [68] creando un límite nítido entre las células que expresan el factor de transcripción Nkx2.2 ventral a las células que expresan Olig2. De esta manera, se piensa que cada uno de los dominios de las seis poblaciones de células progenitoras se modela sucesivamente a lo largo del tubo neural por el gradiente de concentración de SHH. [68] La inhibición mutua entre pares de factores de transcripción expresados en dominios vecinos contribuye al desarrollo de límites definidos; sin embargo, en algunos casos, se ha encontrado una relación inhibitoria incluso entre pares de factores de transcripción de dominios más distantes. En particular, se informa que NKX2-2 expresado en el dominio V3 inhibe a IRX3 expresado en V2 y dominios más dorsales, aunque V3 y V2 están separados por un dominio adicional denominado MN. [71]
La expresión de SHH en la zona ectodérmica frontonasal (ZEF), que es un centro de señalización responsable del desarrollo pautado de la mandíbula superior, regula el desarrollo craneofacial mediante la mediación de la familia miR-199 en la ZEF. Específicamente, las señales dependientes de SHH del cerebro regulan los genes de la familia miR-199, con regulaciones negativas de los genes miR-199 que aumentan la expresión de SHH y dan como resultado caras más anchas, mientras que las regulaciones positivas de los genes miR-199 disminuyen la expresión de SHH, lo que da como resultado caras más estrechas. [72]
Desarrollo de los dientes
La SHH desempeña un papel importante en la organogénesis y, lo que es más importante, en el desarrollo craneofacial. Dado que la SHH es una molécula de señalización, funciona principalmente por difusión a lo largo de un gradiente de concentración, afectando a las células de diferentes maneras. En el desarrollo temprano de los dientes, la SHH se libera desde el nudo del esmalte primario (un centro de señalización) para proporcionar información posicional en un patrón de señalización tanto lateral como plano en el desarrollo de los dientes y la regulación del crecimiento de la cúspide dentaria. [73] La SHH en particular es necesaria para el crecimiento de las asas cervicales epiteliales, donde los epitelios externo e interno se unen y forman un reservorio para las células madre dentales. Después de que los nudos del esmalte primarios se apoptósean, se forman los nudos del esmalte secundarios. Los nudos del esmalte secundarios secretan SHH en combinación con otras moléculas de señalización para engrosar el ectodermo oral y comenzar a modelar las formas complejas de la corona de un diente durante la diferenciación y la mineralización. [74] En un modelo de gen knock out, la ausencia de SHH es indicativa de holoprosencefalia . Sin embargo, la SHH activa moléculas posteriores de Gli2 y Gli3. Los embriones mutantes de Gli2 y Gli3 presentan un desarrollo anormal de los incisivos, que se detienen en el desarrollo temprano de los dientes, así como de los molares pequeños. [75]
Desarrollo pulmonar
Aunque la SHH se asocia más comúnmente con el desarrollo del cerebro y los dedos de las extremidades, también es importante en el desarrollo pulmonar. [76] [77] [78] [79] Los estudios que utilizan qPCR y knockouts han demostrado que la SHH contribuye al desarrollo pulmonar embrionario. La ramificación pulmonar de los mamíferos ocurre en el epitelio de los bronquios y pulmones en desarrollo. [80] [81] La SHH se expresa en todo el endodermo del intestino anterior (la más interna de las tres capas germinales) en el epitelio distal, donde se están desarrollando los pulmones embrionarios. [78] [81] Esto sugiere que la SHH es parcialmente responsable de la ramificación de los pulmones. Se ha visto más evidencia del papel de la SHH en la ramificación pulmonar con qPCR. La expresión de SHH ocurre en los pulmones en desarrollo alrededor del día embrionario 11 y se expresa fuertemente en los brotes de los pulmones fetales, pero baja en los bronquios en desarrollo. [78] [81] Los ratones deficientes en SHH pueden desarrollar una fístula traqueoesofágica (conexión anormal del esófago y la tráquea). [82] [78] Además, un modelo de ratón doblemente knock out (SHH-/-) exhibió un desarrollo pulmonar deficiente. Los pulmones del doble knock out de SHH no experimentaron lobulación ni ramificación (es decir, los pulmones anormales solo desarrollaron una ramificación, en comparación con un fenotipo extensamente ramificado del tipo salvaje). [78]
Función regenerativa potencial
El erizo sónico puede desempeñar un papel en la regeneración de las células pilosas de los mamíferos . Al modular la actividad de la proteína del retinoblastoma en la cóclea de la rata, el erizo sónico permite que las células pilosas maduras que normalmente no pueden volver a un estado proliferativo se dividan y se diferencien. Las proteínas del retinoblastoma suprimen el crecimiento celular al impedir que las células vuelvan al ciclo celular , lo que impide la proliferación. La inhibición de la actividad de Rb parece permitir que las células se dividan. Por lo tanto, el erizo sónico, identificado como un importante regulador de Rb, también puede resultar una característica importante en la regeneración de las células pilosas después de un daño. [83]
La SHH es importante para regular la adipogénesis dérmica por parte de las células amplificadoras del tránsito del folículo piloso (HF-TAC). En concreto, la SHH induce la angiogénesis dérmica al actuar directamente sobre los precursores de los adipocitos y promover su proliferación a través de la expresión del gen del receptor activado por el proliferador de peroxisomas γ (Pparg). [84]
Tratamiento
La SHH sufre una serie de pasos de procesamiento antes de ser secretada de la célula. La SHH recién sintetizada pesa 45 kDa y se denomina preproproteína. Como proteína secretada, contiene una secuencia de señal corta en su extremo N, que es reconocida por la partícula de reconocimiento de señal durante la translocación al retículo endoplasmático (RE), el primer paso en la secreción de proteínas . Una vez que se completa la translocación, la secuencia de señal es eliminada por la peptidasa de señal en el RE. Allí, la SHH sufre un autoprocesamiento para generar un dominio de señalización N-terminal de 20 kDa (SHH-N) y un dominio C-terminal de 25 kDa sin una función de señalización conocida. [85] La escisión es catalizada por una proteasa dentro del dominio C-terminal. Durante la reacción, se agrega una molécula de colesterol al extremo C de la SHH-N. [86] [87] Por lo tanto, el dominio C-terminal actúa como una inteína y una transferasa de colesterol. Otra fracción hidrofóbica , un palmitato , se añade a la amina alfa de la cisteína N-terminal de SHH-N. Esta modificación es necesaria para una señalización eficiente, lo que da como resultado un aumento de 30 veces en la potencia sobre la forma no palmitilada y es llevada a cabo por un miembro de la familia de O-aciltransferasas unidas a la membrana, la proteína-cisteína N-palmitoiltransferasa HHAT . [88]
Robotnikinin
Se ha encontrado un inhibidor potencial de la vía de señalización de Hedgehog y se lo ha denominado "Robotnikinin", en honor al némesis de Sonic the Hedgehog y principal antagonista de la serie de juegos Sonic the Hedgehog, el Dr. Ivo "Eggman" Robotnik . [89]
Antigua controversia en torno al nombre
El gen se ha relacionado con una enfermedad conocida como holoprosencefalia , que puede provocar graves defectos en el cerebro, el cráneo y la cara, lo que ha provocado que algunos médicos y científicos critiquen el nombre por considerarlo demasiado frívolo. Se ha observado que la mención de una mutación en un gen de Sonic Hedgehog podría no ser bien recibida en una discusión sobre un trastorno grave con un paciente o su familia. [17] [90] [91] Esta controversia se ha calmado en gran medida y ahora el nombre se considera generalmente como una reliquia humorística de la época anterior al surgimiento de la secuenciación completa del genoma rápida y barata y la nomenclatura estandarizada. [92] El problema de la "inapropiación" de los nombres de genes como " Madres contra decapentapléjicos ", " Lunatic fringe " y "Sonic Hedgehog" se evita en gran medida mediante el uso de abreviaturas estandarizadas cuando se habla con los pacientes y sus familias. [93]
Galería
 |  |  |
Véase también
- Pikachurin , una proteína de la retina que lleva el nombre de Pikachu
- Zbtb7 , un oncogén que originalmente se llamó " Pokémon "
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000164690 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000002633 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia de PubMed sobre ratón". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ Marigo V, Roberts DJ, Lee SM, Tsukurov O, Levi T, Gastier JM, Epstein DJ, Gilbert DJ, Copeland NG, Seidman CE (julio de 1995). "Clonación, expresión y localización cromosómica de SHH e IHH: dos homólogos humanos del gen de polaridad de segmento hedgehog de Drosophila". Genómica . 28 (1): 44–51. doi :10.1006/geno.1995.1104. PMID 7590746.
- ^ Jaeger J, Martinez-Arias A (marzo de 2009). "Obtención de la medida de la información posicional". PLOS Biology . 7 (3): e81. doi : 10.1371/journal.pbio.1000081 . PMC 2661971 . PMID 19338391.
- ^ Nanni L, Ming JE, Bocian M, Steinhaus K, Bianchi DW, Die-Smulders C, Giannotti A, Imaizumi K, Jones KL, Campo MD, Martin RA, Meinecke P, Pierpont ME, Robin NH, Young ID, Roessler E, Muenke M (diciembre de 1999). "El espectro mutacional del gen Sonic Hedgehog en la holoprosencefalia: las mutaciones de SHH causan una proporción significativa de holoprosencefalia autosómica dominante". Genética molecular humana . 8 (13): 2479–2488. doi : 10.1093/hmg/8.13.2479 . PMID 10556296.
- ^ Blaess S, Szabó N, Haddad-Tóvolli R, Zhou X, Álvarez-Bolado G (6 de enero de 2015). "Señalización de Sonic hedgehog en el desarrollo del hipotálamo del ratón". Fronteras en Neuroanatomía . 8 : 156. doi : 10.3389/fnana.2014.00156 . PMC 4285088 . PMID 25610374.
- ^ Jeng KS, Chang CF, Lin SS (enero de 2020). "Señalización de Sonic Hedgehog en organogénesis, tumores y microambientes tumorales". Revista internacional de ciencias moleculares . 21 (3): 758. doi : 10.3390/ijms21030758 . PMC 7037908 . PMID 31979397.
- ^ Nüsslein-Volhard C, Wieschaus E (octubre de 1980). "Mutaciones que afectan el número de segmentos y la polaridad en Drosophila". Nature . 287 (5785): 795–801. Bibcode :1980Natur.287..795N. doi :10.1038/287795a0. PMID 6776413. S2CID 4337658.
- ^ Krauss S, Concordet JP, Ingham PW (diciembre de 1993). "Un homólogo funcionalmente conservado del gen de polaridad del segmento hh de Drosophila se expresa en tejidos con actividad polarizante en embriones de pez cebra". Cell . 75 (7): 1431–1444. doi :10.1016/0092-8674(93)90628-4. PMID 8269519. S2CID 46266627.
- ^ Echelard Y, Epstein DJ, St-Jacques B, Shen L, Mohler J, McMahon JA, McMahon AP (diciembre de 1993). "Sonic hedgehog, un miembro de una familia de moléculas de señalización putativas, está implicado en la regulación de la polaridad del SNC". Cell . 75 (7): 1417–1430. doi :10.1016/0092-8674(93)90627-3. PMID 7916661. S2CID 6732599.
- ^ ab Riddle RD, Johnson RL, Laufer E, Tabin C (diciembre de 1993). "Sonic hedgehog media la actividad polarizadora de la ZPA". Cell . 75 (7): 1401–1416. doi :10.1016/0092-8674(93)90626-2. PMID 8269518. S2CID 4973500.
- ^ Angier N (11 de enero de 1994). "Biólogos encuentran genes clave que dan forma a los patrones de los embriones". The New York Times . Archivado desde el original el 17 de agosto de 2017. Consultado el 18 de febrero de 2017 .
- ^ Anwood R (6 de septiembre de 2007). Los emús no pueden caminar hacia atrás. Ebury Press. págs. 113-114. ISBN 978-0-09-192151-4Archivado desde el original el 7 de mayo de 2017. Consultado el 6 de octubre de 2016 .
- ^ Simonite T (15 de diciembre de 2005). "Pokémon bloquea el nombre del gen". Nature . 438 (897): 897. Bibcode :2005Natur.438..897S. doi : 10.1038/438897a . PMID 16355177. S2CID 37632823.
- ^ ab "Un gen llamado Sonic". The New York Times . 11 de enero de 1994. Archivado desde el original el 28 de febrero de 2018 . Consultado el 18 de febrero de 2017 .
- ^ Keen A, Tabin C (12 de abril de 2004). "Cliff Tabin: Super Sonic An Interview". The Weekly Murmur. Archivado desde el original el 10 de noviembre de 2005. Consultado el 24 de abril de 2014 .
- ^ Riddle R. Ingenious: El gen cíclope. BBC.co.uk. Entrevista realizada por Kat Arney. BBC Radio.
- ^ "Zebrafish SHHa". Universidad de Oregon. Archivado desde el original el 25 de junio de 2009.
- ^ "Zebrafish SHHb". Universidad de Oregon. Archivado desde el original el 26 de junio de 2009.
- ^ Currie PD, Ingham PW (agosto de 1996). "Inducción de un tipo específico de célula muscular por una proteína similar a la del erizo en el pez cebra". Nature . 382 (6590): 452–455. Bibcode :1996Natur.382..452C. doi :10.1038/382452a0. PMID 8684485. S2CID 4271898.
- ^ Herzog W, Zeng X, Lele Z, Sonntag C, Ting JW, Chang CY, Hammerschmidt M (febrero de 2003). "Formación de la adenohipófisis en el pez cebra y su dependencia de Sonic Hedgehog". Biología del desarrollo . 254 (1): 36–49. doi : 10.1016/S0012-1606(02)00124-0 . PMID 12606280.
- ^ Rash BG, Grove EA (octubre de 2007). "Modelado del telencéfalo dorsal: ¿un papel para Sonic Hedgehog?". The Journal of Neuroscience . 27 (43): 11595–11603. doi :10.1523/JNEUROSCI.3204-07.2007. PMC 6673221 . PMID 17959802.
- ^ Lewis KE, Eisen JS (septiembre de 2001). "La señalización Hedgehog es necesaria para la inducción de neuronas motoras primarias en el pez cebra". Desarrollo . 128 (18): 3485–3495. doi :10.1242/dev.128.18.3485. PMID 11566854.
- ^ Wolpert L (2015). Principios del desarrollo (5.ª ed.). Oxford University Press. pág. 500.
- ^ Dassule HR, Lewis P, Bei M, Maas R, McMahon AP (noviembre de 2000). "El erizo sónico regula el crecimiento y la morfogénesis del diente". Desarrollo . 127 (22): 4775–4785. doi :10.1242/dev.127.22.4775. PMID 11044393.
- ^ Scholpp S, Wolf O, Brand M, Lumsden A (marzo de 2006). "La señalización del erizo desde la zona limitans intrathalamica organiza la formación de patrones en el diencéfalo del pez cebra". Desarrollo . 133 (5): 855–864. doi : 10.1242/dev.02248 . PMID 16452095. S2CID 27550686.
- ^ Rash BG, Grove EA (noviembre de 2011). "Shh y Gli3 regulan la formación de la unión telencefálica-diencefálica y suprimen una fuente de señalización similar al istmo en el prosencéfalo". Biología del desarrollo . 359 (2): 242–250. doi :10.1016/j.ydbio.2011.08.026. PMC 3213684 . PMID 21925158.
- ^ Taylor MD, Northcott PA, Korshunov A, Remke M, Cho YJ, Clifford SC, Eberhart CG, Parsons DW, Rutkowski S, Gajjar A, Ellison DW, Lichter P, Gilbertson RJ, Pomeroy SL, Kool M, Pfister SM (abril de 2012). "Subgrupos moleculares del meduloblastoma: el consenso actual". Acta Neuropathologica . 123 (4): 465–472. doi :10.1007/s00401-011-0922-z. PMC 3306779 . PMID 22134537.
- ^ DeSouza RM, Jones BR, Lowis SP, Kurian KM (22 de julio de 2014). "Meduloblastoma pediátrico: actualización sobre la clasificación molecular que impulsa las terapias dirigidas". Frontiers in Oncology . 4 : 176. doi : 10.3389/fonc.2014.00176 . PMC 4105823 . PMID 25101241.
- ^ Lubik AA, Nouri M, Truong S, Ghaffari M, Adomat HH, Corey E, Cox ME, Li N, Guns ES, Yenki P, Pham S, Buttyan R (enero de 2017). "La señalización paracrina sónica hedgehog contribuye significativamente a la esteroidogénesis adquirida en el microambiente del tumor de próstata". Revista internacional del cáncer . 140 (2): 358–369. doi : 10.1002/ijc.30450 . PMID 27672740. S2CID 2354209.
- ^ Riddle RD, Tabin C (febrero de 1999). "Cómo se desarrollan las extremidades". Scientific American . 280 (2): 74–79. Bibcode :1999SciAm.280b..74R. doi :10.1038/scientificamerican0299-74. PMID 9924814.
- ^ Charron F, Stein E, Jeong J, McMahon AP, Tessier-Lavigne M (abril de 2003). "El morfógeno Sonic Hedgehog es un quimioatrayente axonal que colabora con la netrina-1 en la guía axonal de la línea media". Cell . 113 (1): 11–23. doi : 10.1016/S0092-8674(03)00199-5 . PMID 12679031. S2CID 13909497.
- ^ Kolpak A, Zhang J, Bao ZZ (marzo de 2005). "El erizo sónico tiene un efecto dual en el crecimiento de los axones ganglionares de la retina dependiendo de su concentración". The Journal of Neuroscience . 25 (13): 3432–3441. doi :10.1523/JNEUROSCI.4938-04.2005. PMC 1564194 . PMID 15800198.
- ^ Thewissen JG, Cohn MJ, Stevens LS, Bajpai S, Heyning J, Horton WE (mayo de 2006). "Base de desarrollo para la pérdida de extremidades traseras en delfines y origen del plan corporal de los cetáceos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 103 (22): 8414–8418. Bibcode :2006PNAS..103.8414T. doi : 10.1073/pnas.0602920103 . PMC 1482506 . PMID 16717186.
- ^ abc "ENSG00000164690". GRCh38 . Versión 99 de Ensembl. Archivado desde el original el 1 de noviembre de 2020 . Consultado el 9 de abril de 2020 .
- ^ abcd «UniprotKB - Q15465 (SHH_HUMAN)». UniProt . Consorcio UniProt. Archivado desde el original el 31 de mayo de 2020 . Consultado el 9 de abril de 2020 .
- ^ abcde «gen SHH». Genetics Home Reference . Biblioteca Nacional de Medicina de EE. UU. Archivado desde el original el 2 de abril de 2020. Consultado el 9 de abril de 2020 .
- ^ de Lussanet MH, Osse JW (2012). "Una torsión axial ancestral explica la protuberancia anterior contralateral y el quiasma óptico en vertebrados". Animal Biology . 62 (2): 193–216. arXiv : 1003.1872 . doi :10.1163/157075611X617102. S2CID 7399128.
- ^ Litingtung Y, Chiang C (octubre de 2000). "Control de la actividad y señalización de Shh en el tubo neural". Dinámica del desarrollo . 219 (2): 143–154. doi :10.1002/1097-0177(2000)9999:9999<::AID-DVDY1050>3.0.CO;2-Q. PMID 11002335. S2CID 221646338.
- ^ Placzek M (agosto de 1995). "El papel de la notocorda y la placa del suelo en las interacciones inductivas". Current Opinion in Genetics & Development . 5 (4): 499–506. doi :10.1016/0959-437X(95)90055-L. PMID 7580143.
- ^ Teillet MA, Lapointe F, Le Douarin NM (septiembre de 1998). "Revisión de las relaciones entre la notocorda y la placa del suelo en el desarrollo de los vertebrados". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 95 (20): 11733–11738. Bibcode :1998PNAS...9511733T. doi : 10.1073/pnas.95.20.11733 . PMC 21709 . PMID 9751734.
- ^ van Straaten HW, Hekking JW, Thors F, Wiertz-Hoessels EL, Drukker J (octubre de 1985). "Inducción de una placa de suelo adicional en el tubo neural". Acta Morphologica Neerlando-Scandinavica . 23 (2): 91–97. PMID 3834777.
- ^ Patten I, Placzek M (noviembre de 2000). "El papel de Sonic hedgehog en la formación de patrones del tubo neural". Ciencias de la vida celular y molecular . 57 (12): 1695–1708. doi :10.1007/PL00000652. PMC 11146859 . PMID 11130176. S2CID 20950575.
- ^ Martí E, Bumcrot DA, Takada R, McMahon AP (mayo de 1995). "Requisito de la forma 19K de Sonic hedgehog para la inducción de distintos tipos de células ventrales en explantos del sistema nervioso central". Nature . 375 (6529): 322–325. Bibcode :1995Natur.375..322M. doi :10.1038/375322a0. PMID 7753196. S2CID 4362006.
- ^ abc Ericson J, Morton S, Kawakami A, Roelink H, Jessell TM (noviembre de 1996). "Dos períodos críticos de señalización de Sonic Hedgehog necesarios para la especificación de la identidad de la neurona motora". Cell . 87 (4): 661–673. doi : 10.1016/S0092-8674(00)81386-0 . PMID 8929535. S2CID 11578260.
- ^ Chiang C, Litingtung Y, Lee E, Young KE, Corden JL, Westphal H, Beachy PA (octubre de 1996). "Ciclopía y patrón axial defectuoso en ratones que carecen de la función del gen Sonic hedgehog". Nature . 383 (6599): 407–413. Bibcode :1996Natur.383..407C. doi :10.1038/383407a0. PMID 8837770. S2CID 4339131.
- ^ Placzek M, Tessier-Lavigne M, Yamada T, Jessell T, Dodd J (noviembre de 1990). "Control mesodérmico de la identidad de las células neuronales: inducción de la placa del suelo por la notocorda". Science . 250 (4983): 985–988. Bibcode :1990Sci...250..985P. doi :10.1126/science.2237443. PMID 2237443.
- ^ abc Wilson L, Maden M (junio de 2005). "Los mecanismos de la formación de patrones dorsoventrales en el tubo neural de los vertebrados". Biología del desarrollo . 282 (1): 1–13. doi : 10.1016/j.ydbio.2005.02.027 . PMID 15936325.
- ^ Stone DM, Hynes M, Armanini M, Swanson TA, Gu Q, Johnson RL, Scott MP, Pennica D, Goddard A, Phillips H, Noll M, Hooper JE, de Sauvage F, Rosenthal A (noviembre de 1996). "El gen supresor de tumores patched codifica un receptor candidato para Sonic hedgehog". Nature . 384 (6605): 129–134. Bibcode :1996Natur.384..129S. doi :10.1038/384129a0. PMID 8906787. S2CID 4342540.
- ^ Marigo V, Tabin CJ (septiembre de 1996). "Regulación de patched por Sonic Hedgehog en el tubo neural en desarrollo". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 93 (18): 9346–9351. Bibcode :1996PNAS...93.9346M. doi : 10.1073/pnas.93.18.9346 . PMC 38430 . PMID 8790332.
- ^ ab Ericson J, Briscoe J, Rashbass P, van Heyningen V, Jessell TM (1997). "Señalización sónica gradual de hedgehog y especificación del destino celular en el tubo neural ventral". Simposios de Cold Spring Harbor sobre biología cuantitativa . 62 : 451–466. doi :10.1101/SQB.1997.062.01.053. PMID 9598380.
- ^ Ericson J, Rashbass P, Schedl A, Brenner-Morton S, Kawakami A, van Heyningen V, Jessell TM, Briscoe J (julio de 1997). "Pax6 controla la identidad de las células progenitoras y el destino neuronal en respuesta a la señalización Shh graduada". Cell . 90 (1): 169–180. doi : 10.1016/S0092-8674(00)80323-2 . PMID 9230312. S2CID 17054686.
- ^ Lum L, Beachy PA (junio de 2004). "La red de respuesta Hedgehog: sensores, conmutadores y enrutadores". Science . 304 (5678): 1755–1759. Bibcode :2004Sci...304.1755L. CiteSeerX 10.1.1.476.3902 . doi :10.1126/science.1098020. PMID 15205520. S2CID 13949436.
- ^ ab Ruiz i Altaba A (junio de 1998). "Función combinatoria del gen Gli en la placa del suelo y en las inducciones neuronales por Sonic hedgehog". Desarrollo . 125 (12): 2203–2212. doi :10.1242/dev.125.12.2203. PMID 9584120.
- ^ Park HL, Bai C, Platt KA, Matise MP, Beeghly A, Hui CC, Nakashima M, Joyner AL (abril de 2000). "Los mutantes de Gli1 de ratón son viables pero tienen defectos en la señalización SHH en combinación con una mutación de Gli2". Desarrollo . 127 (8): 1593–1605. doi :10.1242/dev.127.8.1593. PMID 10725236.
- ^ Matise MP, Epstein DJ, Park HL, Platt KA, Joyner AL (agosto de 1998). "Gli2 es necesaria para la inducción de la placa del suelo y las células adyacentes, pero no para la mayoría de las neuronas ventrales en el sistema nervioso central del ratón". Desarrollo . 125 (15): 2759–2770. doi :10.1242/dev.125.15.2759. PMID 9655799.
- ^ abc Litingtung Y, Chiang C (octubre de 2000). "La especificación de los tipos de neuronas ventrales está mediada por una interacción antagónica entre Shh y Gli3". Nature Neuroscience . 3 (10): 979–985. doi :10.1038/79916. PMID 11017169. S2CID 10102370.
- ^ Sasaki H, Nishizaki Y, Hui C, Nakafuku M, Kondoh H (septiembre de 1999). "Regulación de las actividades de Gli2 y Gli3 por un dominio de represión amino-terminal: implicación de Gli2 y Gli3 como mediadores primarios de la señalización de Shh". Desarrollo . 126 (17): 3915–3924. doi :10.1242/dev.126.17.3915. PMID 10433919.
- ^ Persson M, Stamataki D, te Welscher P, Andersson E, Böse J, Rüther U, Ericson J, Briscoe J (noviembre de 2002). "El patrón dorsoventral de la médula espinal requiere la actividad del represor transcripcional Gli3". Genes & Development . 16 (22): 2865–2878. doi :10.1101/gad.243402. PMC 187477 . PMID 12435629.
- ^ Chuang PT, McMahon AP (febrero de 1999). "Señalización de vertebrados Hedgehog modulada por la inducción de una proteína de unión a Hedgehog". Nature . 397 (6720): 617–621. Bibcode :1999Natur.397..617C. doi :10.1038/17611. PMID 10050855. S2CID 204991314.
- ^ Pons S, Martí E (enero de 2000). "Sonic hedgehog se sinergiza con la proteína de matriz extracelular vitronectina para inducir la diferenciación de neuronas motoras espinales". Desarrollo . 127 (2): 333–342. doi :10.1242/dev.127.2.333. PMID 10603350.
- ^ Briscoe J, Pierani A, Jessell TM, Ericson J (mayo de 2000). "Un código de proteína de homeodominio especifica la identidad de la célula progenitora y el destino neuronal en el tubo neural ventral". Cell . 101 (4): 435–445. doi : 10.1016/S0092-8674(00)80853-3 . PMID 10830170. S2CID 17295764.
- ^ Liem KF, Jessell TM, Briscoe J (noviembre de 2000). "Regulación de la actividad de modelado neuronal de Sonic Hedgehog por inhibidores de BMP secretados expresados por notocorda y somitas". Desarrollo . 127 (22): 4855–4866. doi :10.1242/dev.127.22.4855. PMID 11044400.
- ^ McMahon JA, Takada S, Zimmerman LB, Fan CM, Harland RM, McMahon AP (mayo de 1998). "El antagonismo de la señalización de BMP mediado por Noggin es necesario para el crecimiento y la formación de patrones del tubo neural y el somita". Genes & Development . 12 (10): 1438–1452. doi :10.1101/gad.12.10.1438. PMC 316831 . PMID 9585504.
- ^ Roelink H, Porter JA, Chiang C, Tanabe Y, Chang DT, Beachy PA, Jessell TM (mayo de 1995). "Inducción de la placa del suelo y de la neurona motora por diferentes concentraciones del producto de escisión amino-terminal de la autoproteólisis de Sonic Hedgehog". Cell . 81 (3): 445–455. doi : 10.1016/0092-8674(95)90397-6 . PMID 7736596. S2CID 18937753.
- ^ abcdefghij Ribes V, Briscoe J (agosto de 2009). "Establecimiento e interpretación de la señalización graduada de Sonic Hedgehog durante la formación de patrones del tubo neural en vertebrados: el papel de la retroalimentación negativa". Cold Spring Harbor Perspectives in Biology . 1 (2): a002014. doi :10.1101/cshperspect.a002014. PMC 2742090 . PMID 20066087.
- ^ Muroyama Y, Fujihara M, Ikeya M, Kondoh H, Takada S (marzo de 2002). "La señalización de Wnt desempeña un papel esencial en la especificación neuronal de la médula espinal dorsal". Genes & Development . 16 (5): 548–553. doi :10.1101/gad.937102. PMC 155351 . PMID 11877374.
- ^ ab Chamberlain CE, Jeong J, Guo C, Allen BL, McMahon AP (marzo de 2008). "La Shh derivada de la notocorda se concentra en estrecha asociación con el cuerpo basal ubicado apicalmente en las células diana neuronales y forma un gradiente dinámico durante la formación de patrones neuronales". Desarrollo . 135 (6): 1097–1106. doi : 10.1242/dev.013086 . PMID 18272593. S2CID 17431502.
- ^ Lovrics A, Gao Y, Juhász B, Bock I, Byrne HM, Dinnyés A, Kovács KA (noviembre de 2014). "El modelado booleano revela nuevas conexiones reguladoras entre los factores de transcripción que orquestan el desarrollo de la médula espinal ventral". PLOS ONE . 9 (11): e111430. Bibcode :2014PLoSO...9k1430L. doi : 10.1371/journal.pone.0111430 . PMC 4232242 . PMID 25398016.
- ^ Richbourg HA, Hu DP, Xu Y, Barczak AJ, Marcucio RS (septiembre de 2020). "La familia miR-199 contribuye a la regulación de la expresión de Sonic Hedgehog durante el desarrollo craneofacial". Dinámica del desarrollo . 249 (9): 1062–1076. doi :10.1002/dvdy.191. PMC 7484444 . PMID 32391617.
- ^ Nanci A (2012). Histología oral de Ten Cate: desarrollo, estructura y función (8.ª ed.). St. Louis, Mo.: Elsevier. ISBN 978-0-323-07846-7.
- ^ Thesleff I (mayo de 2003). "Señalización epitelial-mesenquimal que regula la morfogénesis dental". Journal of Cell Science . 116 (Pt 9): 1647–1648. doi : 10.1242/jcs.00410 . PMID 12665545. S2CID 45648812.
- ^ Hardcastle Z, Mo R, Hui CC, Sharpe PT (agosto de 1998). "La vía de señalización Shh en el desarrollo dentario: defectos en mutantes Gli2 y Gli3". Desarrollo . 125 (15): 2803–2811. doi :10.1242/dev.125.15.2803. PMID 9655803.
- ^ Wolpert L (2015). Principios del desarrollo (5.ª ed.). Oxford University Press. pág. 500. ISBN 978-0-19-967814-3.
- ^ Bellusci S, Furuta Y, Rush MG, Henderson R, Winnier G, Hogan BL (enero de 1997). "Participación de Sonic hedgehog (Shh) en el crecimiento y la morfogénesis de los pulmones embrionarios de ratón". Desarrollo . 124 (1): 53–63. doi :10.1242/dev.124.1.53. PMID 9006067.
- ^ abcde Pepicelli CV, Lewis PM, McMahon AP (septiembre de 1998). "Sonic hedgehog regula la morfogénesis de ramificación en el pulmón de los mamíferos". Current Biology . 8 (19): 1083–1086. Bibcode :1998CBio....8.1083P. doi : 10.1016/S0960-9822(98)70446-4 . PMID 9768363. S2CID 12711144.
- ^ White AC, Xu J, Yin Y, Smith C, Schmid G, Ornitz DM (abril de 2006). "La señalización de FGF9 y SHH coordina el crecimiento y desarrollo pulmonar a través de la regulación de dominios mesenquimales distintos". Desarrollo . 133 (8): 1507–1517. doi : 10.1242/dev.02313 . PMID 16540513. S2CID 23839558.
- ^ Miura T (2008). "Modelado de la morfogénesis de la ramificación pulmonar". Temas actuales en biología del desarrollo . 81 : 291–310. doi :10.1016/S0070-2153(07)81010-6. ISBN 9780123742537. Número de identificación personal 18023732.
- ^ abc Kugler MC, Joyner AL, Loomis CA, Munger JS (enero de 2015). "Señalización de Sonic hedgehog en el pulmón. Del desarrollo a la enfermedad". American Journal of Respiratory Cell and Molecular Biology . 52 (1): 1–13. doi :10.1165/rcmb.2014-0132TR. PMC 4370254 . PMID 25068457.
- ^ Cardoso WV, Lü J (mayo de 2006). "Regulación de la morfogénesis pulmonar temprana: preguntas, hechos y controversias". Desarrollo . 133 (9): 1611–1624. doi : 10.1242/dev.02310 . PMID 16613830. S2CID 18195361.
- ^ Lu N, Chen Y, Wang Z, Chen G, Lin Q, Chen ZY, Li H (enero de 2013). "Sonic hedgehog inicia la regeneración de las células ciliadas cocleares mediante la regulación negativa de la proteína del retinoblastoma". Comunicaciones de investigación bioquímica y biofísica . 430 (2): 700–705. doi :10.1016/j.bbrc.2012.11.088. PMC 3579567. PMID 23211596 .
- ^ Zhang B, Tsai PC, Gonzalez-Celeiro M, Chung O, Boumard B, Perdigoto CN, Ezhkova E, Hsu YC (octubre de 2016). "Las células amplificadoras de tránsito de los folículos pilosos gobiernan la producción simultánea de adipocitos dérmicos a través de Sonic Hedgehog". Genes & Development . 30 (20): 2325–2338. doi :10.1101/gad.285429.116. PMC 5110998 . PMID 27807033.
- ^ Bumcrot DA, Takada R, McMahon AP (abril de 1995). "El procesamiento proteolítico produce dos formas secretadas de Sonic Hedgehog". Biología molecular y celular . 15 (4): 2294–2303. doi :10.1128/MCB.15.4.2294. PMC 230457 . PMID 7891723.
- ^ Ingham PW, Nakano Y, Seger C (junio de 2011). "Mecanismos y funciones de la señalización Hedgehog en los metazoos". Nature Reviews. Genetics . 12 (6): 393–406. doi :10.1038/nrg2984. PMID 21502959. S2CID 33769324.
- ^ Porter JA, Young KE, Beachy PA (octubre de 1996). "Modificación del colesterol de las proteínas de señalización hedgehog en el desarrollo animal". Science . 274 (5285): 255–259. Bibcode :1996Sci...274..255P. doi :10.1126/science.274.5285.255. PMID 8824192. S2CID 11125394.
- ^ Pepinsky RB, Zeng C, Wen D, Rayhorn P, Baker DP, Williams KP, Bixler SA, Ambrose CM, Garber EA, Miatkowski K, Taylor FR, Wang EA, Galdes A (mayo de 1998). "Identificación de una forma modificada con ácido palmítico del erizo sónico humano". The Journal of Biological Chemistry . 273 (22): 14037–14045. doi : 10.1074/jbc.273.22.14037 . PMID 9593755. S2CID 22783982.
- ^ Stanton BZ, Peng LF, Maloof N, Nakai K, Wang X, Duffner JL, Taveras KM, Hyman JM, Lee SW, Koehler AN, Chen JK, Fox JL, Mandinova A, Schreiber SL (marzo de 2009). "Una pequeña molécula que se une a Hedgehog y bloquea su señalización en células humanas". Nature Chemical Biology . 5 (3): 154–156. doi :10.1038/nchembio.142. PMC 2770933 . PMID 19151731.
- ^ Maclean K (enero de 2006). "El humor de los nombres de genes que se pierden en la traducción para los pacientes". Nature . 439 (7074): 266. Bibcode :2006Natur.439..266M. doi : 10.1038/439266d . PMID 16421543. S2CID 19861153.
- ^ Cohen MM (julio de 2006). "Problemas en la denominación de genes". American Journal of Medical Genetics. Parte A. 140 ( 13): 1483–1484. doi :10.1002/ajmg.a.31264. PMID 16718675. S2CID 221388561.
- ^ White M (26 de septiembre de 2014). "Sonic Hedgehog, DICER y el problema de nombrar genes". psmag.com . Pacific Standard. Archivado desde el original el 12 de noviembre de 2020 . Consultado el 24 de diciembre de 2020 .
- ^ Hopkin M (6 de noviembre de 2006). "Troublesome gene names get the boot" (Los nombres de genes problemáticos son eliminados). Nature : news061106–2. doi : 10.1038/news061106-2 . S2CID : 86514270. Archivado desde el original el 31 de diciembre de 2020. Consultado el 24 de diciembre de 2020 .
Lectura adicional
- Dorus S, Anderson JR, Vallender EJ, Gilbert SL, Zhang L, Chemnick LG, Ryder OA, Li W, Lahn BT (julio de 2006). "Sonic Hedgehog, un gen clave del desarrollo, experimentó una evolución molecular intensificada en primates". Human Molecular Genetics . 15 (13): 2031–2037. doi : 10.1093/hmg/ddl123 . PMID 16687440.
- Gilbert SF (2000). Biología del desarrollo (6.ª ed.). Sunderland, Mass.: Sinauer Associates. ISBN 978-0-87893-243-6.
- Kim J, Kim P, Hui CC (mayo de 2001). "La asociación VACTERL: lecciones de la vía Sonic hedgehog". Clinical Genetics . 59 (5): 306–315. doi :10.1034/j.1399-0004.2001.590503.x. PMID 11359461. S2CID 34304310.
- Morton JP, Lewis BC (julio de 2007). "Señalización Shh y cáncer de páncreas: ¿implicaciones para la terapia?". Cell Cycle . 6 (13): 1553–1557. doi : 10.4161/cc.6.13.4467 . PMID 17611415. S2CID 4670615.
- Mullor JL, Sánchez P, Ruiz i Altaba A (diciembre de 2002). "Vías y consecuencias: señalización Hedgehog en enfermedades humanas". Trends in Cell Biology . 12 (12): 562–569. doi :10.1016/S0962-8924(02)02405-4. PMID 12495844.
- Nanni L, Ming JE, Du Y, Hall RK, Aldred M, Bankier A, Muenke M (julio de 2001). "La mutación SHH está asociada con el incisivo central maxilar medio solitario: un estudio de 13 pacientes y revisión de la literatura". American Journal of Medical Genetics . 102 (1): 1–10. doi :10.1002/1096-8628(20010722)102:1<1::AID-AJMG1336>3.0.CO;2-U. PMID 11471164.
- Williams JA (diciembre de 2005). "Erizo y lesión de la médula espinal". Opinión de expertos sobre objetivos terapéuticos . 9 (6): 1137–1145. doi :10.1517/14728222.9.6.1137. PMID 16300466. S2CID 5548531.
Enlaces externos
- Un artículo introductorio sobre SHH en Davidson College
- Redescubriendo la biología: Unidad 7 Genética del desarrollo .. Transcripciones de entrevistas a expertos Entrevista con John Incardona PhD .. Explicación del descubrimiento y denominación del gen Sonic Hedgehog
- 'Sonic Hedgehog' sonaba gracioso al principio... New York Times 12 de noviembre de 2006...
- Entrada de GeneReviews/NCBI/NIH/UW sobre la descripción general de la anoftalmia/microftalmia
- SHH – Sonic Hedgehog Biblioteca Nacional de Medicina de EE. UU.
- Resumen de toda la información estructural disponible en el PDB para UniProt : Q15465 (proteína humana Sonic hedgehog) en PDBe-KB .
- Resumen de toda la información estructural disponible en el PDB para UniProt : Q62226 (proteína hedgehog de ratón Sonic) en PDBe-KB .