Implante mamario
| Implante mamario | |
|---|---|
Un implante mamario es una prótesis que se utiliza para cambiar el tamaño, la forma y el contorno de los senos de una persona . En la cirugía plástica reconstructiva , los implantes mamarios se pueden colocar para restaurar un seno de aspecto natural después de una mastectomía , para corregir defectos congénitos y deformidades de la pared torácica o, desde el punto de vista estético, para agrandar el aspecto de los senos mediante una cirugía de aumento de senos .
Las complicaciones de los implantes pueden incluir dolor en los senos , erupciones, cambios en la piel, infección, ruptura, cambios cosméticos en los senos como asimetría y dureza, y una acumulación de líquido alrededor del seno. [1]
Una complicación poco frecuente asociada con los implantes con superficies texturizadas y los implantes cubiertos con espuma de poliuretano es un tipo de linfoma (cáncer del sistema inmunológico) conocido como linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL). [2]
Existen cuatro tipos generales de implantes mamarios, definidos por su material de relleno: solución salina, gel de silicona, relleno estructurado y compuesto. El implante salino tiene una cubierta de elastómero de silicona rellena con solución salina estéril durante la cirugía; el implante de silicona tiene una cubierta de elastómero de silicona rellena previamente con gel de silicona viscoso ; los implantes estructurados utilizan cubiertas de elastómero de silicona anidadas y dos lúmenes llenos de solución salina; y los implantes de composición alternativa presentan rellenos diversos, como hidrogel, aceite de soja o hilo de polipropileno . [ cita requerida ]
En la práctica quirúrgica, para la reconstrucción de una mama, el dispositivo expansor de tejido es una prótesis mamaria temporal que se utiliza para formar y establecer un bolsillo para el implante mamario permanente futuro. Para la corrección de defectos y deformidades mamarias masculinas, el implante pectoral es la prótesis mamaria que se utiliza para la reconstrucción y la reparación estética de la pared torácica de un hombre (ver: ginecomastia y mastopexia ). [ cita requerida ]
Usos

Un procedimiento de mamoplastia para la colocación de dispositivos de implantes mamarios tiene tres propósitos:
- reconstrucción primaria: el reemplazo de tejidos mamarios dañados por traumatismo ( contundente , penetrante , explosión ), enfermedad ( cáncer de mama ) y desarrollo anatómico fallido ( deformidad tuberosa de la mama ).
- revisión y reconstrucción: revisar (corregir) el resultado de una cirugía de reconstrucción mamaria previa.
- aumento primario: aumentar estéticamente el tamaño, la forma y la sensación de los senos.
El tiempo de quirófano en la reconstrucción mamaria postmastectomía y en la cirugía de aumento mamario está determinado por el procedimiento empleado, el tipo de incisiones, el implante mamario (tipo y materiales) y la ubicación pectoral del bolsillo del implante.
Investigaciones recientes han indicado que las mamografías no deben realizarse con mayor frecuencia que la utilizada en los procedimientos normales en pacientes que se someten a cirugía de mama, incluidos implantes mamarios, aumento, mastopexia y reducción mamaria. [3]
Psicología
La paciente de aumento de senos generalmente es una mujer joven cuyo perfil de personalidad indica malestar psicológico sobre su apariencia personal y su autoimagen corporal , y antecedentes de haber soportado críticas (burlas) sobre la estética de su persona. [4] Los estudios Body Image Concerns of Breast Augmentation Patients (2003) [ cita completa requerida ] y Body Dysmorphic Disorder and Cosmetic Surgery (2006) [ cita completa requerida ] informaron que la mujer que se sometió a una cirugía de aumento de senos también se había sometido a psicoterapia , sufría baja autoestima , presentaba frecuentes episodios de depresión psicológica , había intentado suicidarse y tenía dismorfia corporal , un tipo de enfermedad mental.
Las encuestas a pacientes postoperatorias sobre salud mental y calidad de vida informaron una mejoría en la salud física, apariencia física, vida social, confianza en sí mismas, autoestima y funcionamiento sexual satisfactorio . Además, las mujeres informaron satisfacción a largo plazo con los resultados de sus implantes mamarios; algunas a pesar de tener complicaciones médicas que requirieron revisión quirúrgica, ya sea correctiva o estética. Asimismo, en Dinamarca, el 8% de las pacientes de aumento mamario tenían antecedentes preoperatorios de hospitalización psiquiátrica. [5] [6] [7] [8] [9] [10] [11] [12] [13] [14]
En 2008, el estudio longitudinal Excess Mortality from Suicide and other External Causes of Death Among Women with Cosmetic Breast Implants (2007) (Exceso de mortalidad por suicidio y otras causas externas de muerte entre mujeres con implantes mamarios cosméticos) informó que las mujeres que se habían colocado implantes mamarios tenían casi tres veces más probabilidades de suicidarse que las mujeres que no se habían colocado implantes mamarios. En comparación con la tasa estándar de suicidios de las mujeres de la población general, la tasa de suicidios de las mujeres con aumento de pecho se mantuvo constante hasta 10 años después de la implantación, pero aumentó a 4,5 veces más a los 11 años, y así se mantuvo hasta los 19 años, cuando aumentó a 6 veces más a los 20 años después de la implantación. Además, además del riesgo de suicidio, las mujeres con implantes mamarios también se enfrentaban a un riesgo de muerte triplicado por alcoholismo y abuso de medicamentos recetados y recreativos. [15] [16] Aunque siete estudios han relacionado estadísticamente el aumento de senos de una mujer con una mayor tasa de suicidio, la investigación indica que la cirugía de aumento de senos no aumenta la tasa de mortalidad; y que, en primera instancia, es la mujer con inclinación psicopatológica la que tiene más probabilidades de someterse a un procedimiento de aumento de senos. [17] [18] [19] [20] [21] [22]
El estudio Effect of Breast Augmentation Mammoplasty on Self-Esteem and Sexuality: A Quantitative Analysis (2007), informó que las mujeres atribuyeron su mejor autoimagen , autoestima y aumento del funcionamiento sexual satisfactorio a haberse sometido a un aumento de senos; la cohorte, de 21 a 57 años, promedió aumentos de autoestima posoperatorios que oscilaron entre 20,7 y 24,9 puntos en la escala de autoestima de Rosenberg de 30 puntos , datos que respaldaron el aumento del 78,6 por ciento en la libido de la mujer , en relación con su nivel de libido preoperatorio. [23] Por lo tanto, antes de aceptar cualquier cirugía, el cirujano plástico evalúa y considera la salud mental de la mujer para determinar si los implantes mamarios pueden afectar positivamente su autoestima y funcionamiento sexual .
Complicaciones
La colocación quirúrgica plástica de dispositivos de implantes mamarios, ya sea para reconstrucción mamaria o con fines estéticos , presenta los mismos riesgos de salud comunes a la cirugía , como reacción adversa a la anestesia , hematoma (hemorragia postoperatoria), hematoma tardío (hemorragia postoperatoria después de 6 meses o más), [24] seroma (acumulación de líquido), ruptura del sitio de la incisión (infección de la herida). Las complicaciones específicas del aumento mamario incluyen dolor mamario, sensibilidad alterada, función de lactancia impedida, arrugas visibles, asimetría, adelgazamiento del tejido mamario y sinmastia , la "formación de pan" del busto que interrumpe el plano natural entre los senos. Los tratamientos específicos para las complicaciones de los implantes mamarios permanentes ( contractura capsular y ruptura capsular) son el monitoreo periódico con resonancia magnética y los exámenes físicos. Además, las complicaciones y reoperaciones relacionadas con la cirugía de implantación y con los expansores de tejido (marcadores de posición de los implantes durante la cirugía) pueden causar cicatrices desfavorables en aproximadamente el 6-7 por ciento de las pacientes. [25] [26] [27] Estadísticamente , el 20 por ciento de las mujeres que se sometieron a un implante cosmético y el 50 por ciento de las mujeres que se sometieron a un implante de reconstrucción mamaria, requirieron su explantación (extirpación quirúrgica) a los 10 años. [28]
Seguridad
En la década de 1990, varios informes revisaron los pocos estudios que evaluaban el aumento del riesgo de enfermedades sistémicas y autoinmunes entre las mujeres con implantes mamarios. La conclusión en ese momento fue que no había evidencia que estableciera una conexión causal entre la implantación de implantes mamarios de silicona y ninguno de los dos tipos de enfermedad. [29] [30] Sin embargo, el informe del Instituto de Medicina señaló que estos estudios anteriores incluyeron muy pocas mujeres para evaluar de manera concluyente el impacto en estas enfermedades raras. [29] Además, muchos de los estudios incluyeron mujeres que tuvieron implantes mamarios durante solo unos meses, lo que sería demasiado pronto para desarrollar una enfermedad autoinmune diagnosticada. En los últimos años, grandes estudios epidemiológicos han informado aumentos clínica y estadísticamente significativos en algunas de estas enfermedades. Un estudio de Watad y colegas que se publicó en 2018 comparó y examinó los registros médicos de más de 24.000 mujeres con implantes mamarios con más de 98.000 "controles emparejados" que no tenían implantes mamarios pero compartían rasgos demográficos muy similares. [31] El estudio encontró un aumento general estadísticamente significativo del 22% en los trastornos autoinmunes o reumáticos diagnosticados. Los mayores aumentos en los diagnósticos para mujeres con implantes mamarios fueron para el síndrome de Sjögren , la esclerosis múltiple (EM) y la sarcoidosis, cada uno de los cuales fue entre un 58% y un 98% más alto en mujeres con implantes mamarios. Ese análisis se basó en mujeres israelíes con implantes mamarios confirmados por registros médicos, y los análisis de enfermedades se basaron en diagnósticos realizados después de que las mujeres se colocaron implantes mamarios que se incluyeron en los registros médicos durante hasta 20 años de seguimiento. [31]
En 2019, Coroneos y sus colegas del MD Anderson Medical Center publicaron un estudio publicado sobre mujeres estadounidenses con resultados similares. [32] Los datos se basaron en dos estudios con un total combinado de casi 100 000 mujeres con implantes mamarios, pero muchas abandonaron el estudio a los pocos años de su cirugía de implantes mamarios. Sin embargo, de las mujeres que participaron en el estudio durante al menos dos años, los investigadores informaron un aumento del 800 % en el síndrome de Sjögren, del 700 % en la esclerodermia y de casi el 600 % en la artritis reumatoide entre las mujeres con implantes mamarios en comparación con la población general de mujeres de la misma edad y demografía.
Una investigación reciente sobre mujeres que informaron síntomas autoinmunes y de otros sistemas pero que no fueron diagnosticadas con una enfermedad autoinmune evaluó si los síntomas de las mujeres cambiaron después de que se les extrajeron los implantes. Un estudio de 2020 sobre la efectividad de la cirugía de explante en mujeres con enfermedad por implantes mamarios encontró que casi la totalidad de las 750 mujeres que se sometieron a una cirugía de explante informaron una mejora significativa en su salud dentro del mes posterior a la cirugía. Los investigadores se centraron en los siguientes síntomas: pérdida de cabello, pérdida de memoria, ojos secos y/o visión borrosa, entumecimiento u hormigueo en las extremidades, fatiga crónica, dolor en las articulaciones, erupciones cutáneas, dolor en los senos, intolerancia alimentaria, síntomas similares a los de la gripe y dificultad para respirar. Los mismos autores también publicaron un estudio sobre el impacto de la extracción de implantes mamarios en las dificultades respiratorias y encontraron una mejora estadísticamente significativa en medidas objetivas bien establecidas de la función pulmonar después de la cirugía de explante. [33]
| Año | País | Grupo de Revisión Sistémica | Conclusiones |
|---|---|---|---|
| 1991–93 | Reino Unido | Grupo Asesor de Expertos Independientes (GAIE) | No hubo evidencia de un mayor riesgo de enfermedad del tejido conectivo en pacientes que se habían sometido a la colocación de implantes mamarios de gel de silicona, y no hubo motivos para cambiar la práctica o la política sobre implantes mamarios en el Reino Unido. |
| 1996 | Estados Unidos | Instituto de Medicina de Estados Unidos (IOM) [34] | "No hubo evidencia suficiente de una asociación entre los implantes mamarios rellenos de gel de silicona o solución salina y una enfermedad definida del tejido conectivo". |
| 1996 | Francia | Agence Nationale pour le Developpement de l'Evaluación Médica (ANDEM) [Agencia Nacional para el Desarrollo y la Evaluación Médica] [35] | Original francés: "Nous n'avons pas observé de connectivité ni d'autre pathologie auto-inmune susceptible d'être directement ou indirectement induite par la présence d'un implant mammaire en particulier en gel de silicona...." No observamos enfermedades del tejido conectivo que estuvieran asociadas directa o indirectamente a la presencia de un implante mamario, en particular uno de gel de silicona...." |
| 1997 | Australia | Comité de evaluación de dispositivos terapéuticos (TDEC) | La "literatura actual de alta calidad sugiere que no existe asociación entre los implantes mamarios y síndromes similares a enfermedades del tejido conectivo (enfermedades atípicas del tejido conectivo)". [36] |
| 1998 | Alemania | Instituto Federal de Medicamentos y Productos Sanitarios | Se informó que "los implantes mamarios de silicona no causan enfermedades autoinmunes ni enfermedades reumáticas y no tienen efectos desventajosos sobre el embarazo, la capacidad de amamantar o la salud de los niños amamantados. No hay evidencia científica de la existencia de alergia a la silicona, envenenamiento por silicona, enfermedades atípicas relacionadas con la silicona o una nueva enfermedad relacionada con la silicona". [37] |
| 2000 | Estados Unidos | Revisión ordenada por un tribunal federal [38] | "No hay evidencia de una asociación entre... los implantes mamarios rellenos de gel de silicona específicamente, y cualquiera de los CTD individuales, todos los CTD definidos combinados u otras condiciones autoinmunes o reumáticas". |
| 2000 | unión Europea | Comité Europeo de Garantía de Calidad y Productos Sanitarios en Cirugía Plástica (EQUAM) | "Estudios médicos adicionales no han demostrado ninguna asociación entre los implantes mamarios rellenos de gel de silicona y las enfermedades autoinmunes o del tejido conectivo tradicionales, el cáncer ni ninguna otra enfermedad maligna... EQUAM sigue creyendo que no hay evidencia científica de que exista alergia a la silicona, intoxicación por silicona, enfermedad atípica o una 'nueva enfermedad de la silicona'". [39] |
| 2001 | Reino Unido | Grupo de Revisión Independiente del Reino Unido (UK-IRG) | "No hay evidencia de una asociación con una respuesta inmune anormal o enfermedades o síndromes típicos o atípicos del tejido conectivo". [40] |
| 2001 | Estados Unidos | Revisión del Panel Nacional de Ciencias designado por el Tribunal [41] | El panel evaluó enfermedades del tejido conectivo (ETC) establecidas e indiferenciadas y concluyó que no había evidencia causal entre los implantes mamarios y estas ETC. |
| 2003 | España | Evaluación de opciones científicas y tecnológicas (STOA) | El informe de STOA al Comité de Peticiones del Parlamento Europeo informó que la evidencia científica actual no demuestra ninguna evidencia causal sólida que vincule los implantes mamarios de silicona con enfermedades graves, por ejemplo, cáncer de mama o enfermedades del tejido conectivo. [42] |
| 2009 | unión Europea | Panel del Comité Internacional de Garantía de Calidad, Tecnologías y Dispositivos Médicos en Cirugía Plástica (IQUAM) | La declaración de consenso de la conferencia Transatlantic Innovations (abril de 2009) indicó que estudios médicos adicionales no demostraron ninguna asociación entre los implantes mamarios rellenos de gel de silicona y el carcinoma o cualquier trastorno metabólico, inmunológico o alérgico. [43] |
Rotura del implante

Debido a que un implante mamario es un dispositivo médico de Clase III con una vida útil limitada, los principales factores que determinan la tasa de ruptura son su antigüedad y diseño; no obstante, un dispositivo de implante mamario puede conservar su integridad mecánica durante décadas en el cuerpo de una mujer. [44] Cuando un implante mamario de solución salina se rompe, pierde y se vacía, se desinfla rápidamente y, por lo tanto, se puede explantar fácilmente (retirar quirúrgicamente). En algunos casos, la ruptura del implante de solución salina puede provocar una infección debido a bacterias o moho que habían estado dentro del implante, aunque esto es poco común. [45] El informe de seguimiento, Natrelle Saline-filled Breast Implants: a Prospective 10-year Study (2009) indicó tasas de ruptura-deflación del 3-5 por ciento a los 3 años posteriores a la implantación, y tasas de ruptura-deflación del 7-10 por ciento a los 10 años posteriores a la implantación. [46] En un estudio de sus 4761 pacientes de mamoplastia de aumento, Eisenberg informó que el sobrellenado de los implantes mamarios con solución salina en un 10-13% redujo significativamente la tasa de ruptura-deflación al 1,83% a los 8 años después de la implantación. [47]

Cuando un implante mamario de silicona se rompe, por lo general no se desinfla, pero el gel de relleno se filtra y puede migrar al bolsillo del implante; por lo tanto, una ruptura intracapsular (fuga dentro de la cápsula) puede convertirse en una ruptura extracapsular (fuga fuera de la cápsula), y cada caso se resuelve mediante explantación. Aunque el gel de relleno de silicona filtrado puede migrar desde los tejidos del pecho a otras partes del cuerpo de la mujer, la mayoría de las complicaciones clínicas se limitan a las áreas de los senos y las axilas, y generalmente se manifiestan como granulomas (nódulos inflamatorios) y linfadenopatía axilar ( ganglios linfáticos agrandados en el área de las axilas). [48] [49] [50]
Los mecanismos sospechosos de rotura del implante mamario son:
- Daños durante la implantación
- Daños durante (otros) procedimientos quirúrgicos
- Degradación química de la cubierta del implante mamario
- Traumatismo ( traumatismo cerrado , traumatismo penetrante , traumatismo por explosión )
- Presión mecánica del examen mamográfico de mama tradicional [51]
La ruptura de implantes de silicona se puede evaluar mediante imágenes por resonancia magnética; a partir de los datos de resonancia magnética a largo plazo para implantes mamarios de un solo lumen, la literatura europea sobre implantes mamarios de gel de silicona de segunda generación (diseño de la década de 1970) informó tasas de ruptura silenciosa del dispositivo del 8 al 15 por ciento a los 10 años posteriores a la implantación (15 al 30 % de los pacientes). [52] [53] [54] [55]
El estudio Safety and Effectiveness of Mentor's MemoryGel Implants at 6 Years (2009), que fue un estudio de rama de los ensayos clínicos centrales de la FDA de EE. UU. para pacientes de cirugía de aumento mamario primario , informó tasas bajas de ruptura del dispositivo del 1,1 por ciento a los 6 años posteriores a la implantación. [56] La primera serie de evaluaciones de MRI de los implantes mamarios de silicona con gel de relleno espeso informó una tasa de ruptura del dispositivo del 1 por ciento, o menos, a la edad media del dispositivo de 6 años. [57] Estadísticamente, el examen manual (palpación) de la mujer es inadecuado para evaluar con precisión si un implante mamario se ha roto. El estudio, The Diagnosis of Silicone Breast implant Rupture: Clinical Findings Compared with Findings at Magnetic Resonance Imaging (2005), informó que, en pacientes asintomáticas, solo el 30 por ciento de los implantes mamarios rotos son palpados y detectados con precisión por un cirujano plástico experimentado, mientras que los exámenes de MRI detectaron con precisión el 86 por ciento de las roturas de implantes mamarios. [58] Por lo tanto, la FDA de EE. UU. recomendó exámenes de MRI programados, como exámenes de detección de rotura silenciosa, comenzando en el tercer año posterior a la implantación, y luego cada dos años, a partir de entonces. [25] Sin embargo, más allá de EE. UU., los establecimientos médicos de otras naciones no han respaldado la detección rutinaria de MRI y, en su lugar, propusieron que dicho examen radiológico se reserve para dos propósitos: (i) para la mujer con sospecha de rotura de implante mamario; y (ii) para la confirmación de estudios mamográficos y ultrasónicos que indiquen la presencia de un implante mamario roto. [59]
Además, en The Effect of Study design Biases on the Diagnostic Accuracy of Magnetic Resonance Imaging for Detecting Silicone Breast Implant Ruptures: a Meta-analysis (2011) se informó que las imágenes por resonancia magnética de detección de roturas de implantes mamarios realizadas a mujeres asintomáticas podrían sobrestimar la incidencia de rotura de implantes mamarios. [60] En ese sentido, la Administración de Alimentos y Medicamentos de los Estados Unidos destacó que "los implantes mamarios no son dispositivos para toda la vida. Cuanto más tiempo lleve una mujer implantes mamarios rellenos de gel de silicona, más probabilidades tendrá de sufrir complicaciones". [61]
Contractura capsular
La respuesta inmune del cuerpo humano a un objeto extraño instalado quirúrgicamente (implante mamario, marcapasos cardíaco , prótesis ortopédica ) es encapsularlo con cápsulas de tejido cicatricial de fibras de colágeno estrechamente tejidas , con el fin de mantener la integridad del cuerpo aislando el objeto extraño y así tolerar su presencia. La contractura capsular , que debe distinguirse del tejido capsular normal, ocurre cuando la cápsula de fibra de colágeno se engrosa y comprime el implante mamario; es una complicación dolorosa que puede distorsionar el implante mamario, la mama o ambos. La contractura capsular se diagnostica a través de un examen visual y físico de acuerdo con el nivel de gravedad creciente según la escala de grados de Baker: Grado I de Baker, Grado II de Baker, Grado III de Baker y Grado IV de Baker.

La causa de la contractura capsular es desconocida, pero los factores de incidencia comunes incluyen contaminación bacteriana, ruptura de la cubierta del dispositivo, fuga de relleno y hematoma . Los procedimientos de implantación quirúrgica que han reducido la incidencia de contractura capsular incluyen la colocación submuscular, el uso de implantes mamarios con una superficie texturizada (recubiertos de poliuretano); [62] [63] [64] manipulación preoperatoria limitada de los implantes, contacto limitado con la piel del pecho del bolsillo del implante antes de la colocación del implante mamario e irrigación del sitio receptor con soluciones triplemente antibióticas. [65] [66]
La corrección de la contractura capsular puede requerir una capsulotomía abierta (liberación quirúrgica) de la cápsula de fibra de colágeno, o la extracción y posible reemplazo del implante mamario. Además, en el tratamiento de la contractura capsular, la capsulotomía cerrada (ruptura mediante manipulación externa) alguna vez fue una maniobra común para tratar las cápsulas duras, pero ahora es una técnica desaconsejada, porque puede romper el implante mamario. Los tratamientos no quirúrgicos para las cápsulas de fibra de colágeno incluyen masajes, terapia ultrasónica externa, inhibidores de la vía de los leucotrienos como zafirlukast (Accolate) o montelukast (Singulair) y terapia de campo electromagnético pulsado (PEMFT). [67] [68] [69] [70]
Cirugías de reparación y revisión
Cuando la paciente no está satisfecha con el resultado de la mamoplastia de aumento; o cuando ocurren complicaciones técnicas o médicas; o debido a la vida útil limitada de los implantes mamarios, es probable que necesite reemplazar los implantes mamarios. Las indicaciones comunes de cirugía de revisión incluyen complicaciones médicas mayores y menores, contractura capsular , ruptura de la cubierta y desinflado del dispositivo. [51] Las tasas de incidencia de revisión fueron mayores para las pacientes de reconstrucción mamaria, debido a los cambios posteriores a la mastectomía en los tejidos blandos y en la envoltura cutánea de la mama, y en los bordes anatómicos de la mama, especialmente en mujeres que recibieron radioterapia externa adyuvante . [51] Además, además de la reconstrucción mamaria, las pacientes con cáncer de mama generalmente se someten a una cirugía de revisión del complejo areola-pezón (NAC) y procedimientos de simetría en la mama opuesta, para crear un busto de apariencia, tamaño, forma y sensación naturales. La combinación cuidadosa del tipo y tamaño de los implantes mamarios con las características de los tejidos blandos pectorales de la paciente reduce la incidencia de la cirugía de revisión. Gracias a la combinación adecuada de tejidos, la selección del implante y la técnica de implantación adecuada, la tasa de reoperación fue del 3 por ciento a los 7 años, en comparación con la tasa de reoperación del 20 por ciento a los 3 años, según lo informado por la Administración de Alimentos y Medicamentos de los EE. UU. [71] [72]
Enfermedad sistémica

En la década de 1990, los ministerios de salud nacionales de los países enumerados revisaron los estudios pertinentes para encontrar vínculos causales entre los implantes mamarios de gel de silicona y las enfermedades autoinmunes sistémicas y diagnosticadas y el cáncer de mama. [73] [38] [74] Un estudio realizado por investigadores del Instituto Nacional de Salud de EE. UU. informó un aumento de cuatro tipos de cáncer entre las mujeres con implantes mamarios en comparación con otras pacientes de cirugía plástica de la misma edad y rasgos demográficos y hábitos de salud similares. [17] Este aumento del cáncer se atenuó pero no desapareció cuando los investigadores siguieron a las mujeres durante 5 años más, con un aumento del 43% en el cáncer cerebral y un aumento del 63% en el cáncer respiratorio en comparación con otras pacientes de cirugía plástica. [75] Un estudio de Watad et al. evaluó los registros médicos de más de 24.000 mujeres con implantes mamarios en comparación con más de 98.000 mujeres con los mismos rasgos demográficos que no tenían implantes mamarios. Los investigadores encontraron un aumento estadísticamente significativo del 22 por ciento en varias enfermedades diagnosticadas, aumentando a más del 60% para el síndrome de Sjögren , la esclerosis múltiple y la sarcoidosis [31]. Después de investigar este tema, en 2021 la FDA de EE. UU. revisó sus "advertencias de recuadro negro" sobre los implantes mamarios para reconocer la asociación entre los implantes mamarios y los síntomas autoinmunes, reumatológicos y neurológicos sistémicos para indicar: "Los pacientes que reciben implantes mamarios han informado una variedad de síntomas sistémicos, como dolor en las articulaciones, dolores musculares, confusión, fatiga crónica, enfermedades autoinmunes y otros. El riesgo individual del paciente de desarrollar estos síntomas no ha sido bien establecido. Algunos pacientes informan una resolución completa de los síntomas cuando se retiran los implantes sin reemplazo". [76]
Un estudio de 2021 realizado por médicos de la Clínica Cleveland investigó el resultado de la extracción de implantes mamarios en mujeres con implantes mamarios que habían informado dificultad para respirar u opresión en el pecho; este es uno de los síntomas asociados con la enfermedad de los implantes mamarios . [33] El estudio examinó a pacientes con implantes mamarios que informaron problemas para respirar, comparando sus puntuaciones en 6 pruebas de función pulmonar antes y después de que se les retiraran los implantes y las cápsulas cicatriciales. Los investigadores informaron que el 74% de las pacientes informaron mejoras significativas en al menos 3 de las pruebas de función pulmonar. En los autoinformes, todas las participantes del estudio informaron que su respiración mejoró después de la cirugía de implantes.
Toxicidad del platino
El platino es un catalizador que se utiliza en la fabricación de carcasas de polímeros para implantes de silicona y otros dispositivos de silicona que se utilizan en medicina. La literatura indica que pequeñas cantidades de platino se filtran de estos implantes y están presentes en el tejido circundante. La FDA revisó los estudios disponibles en la literatura médica sobre platino e implantes mamarios en 2002 y concluyó que había poca evidencia que sugiriera toxicidad del platino en pacientes con implantes. [77] La FDA revisó este estudio y la literatura adicional varios años después, reafirmando las conclusiones anteriores de que los catalizadores de platino utilizados en implantes probablemente no estén ionizados y, por lo tanto, no representarían un riesgo para las mujeres. [78]
Linfoma anaplásico de células grandes
La FDA ha identificado que los implantes mamarios pueden estar asociados con una forma rara de cáncer llamada linfoma anaplásico de células grandes (ALCL), que algunos expertos creen que se asocia con la inflamación bacteriana crónica. [79] Se han observado fenómenos de ALCL similares con otros tipos de implantes médicos, incluidos los puertos de acceso vascular, los implantes ortopédicos de cadera y los implantes de mandíbula (ATM). La asociación causal entre los implantes mamarios y el ALCL se estableció de manera concluyente en diciembre de 2013, cuando los investigadores del MD Anderson Cancer Center publicaron un estudio de 60 mujeres con implantes mamarios a las que se les diagnosticó ALCL en la mama. En 2015, los cirujanos plásticos publicaron un artículo que revisaba 37 artículos en la literatura sobre 79 pacientes y recopilaron otros 94 casos no informados, lo que dio como resultado 173 mujeres con implantes mamarios que habían desarrollado ALCL en la mama. Llegaron a la conclusión de que "el linfoma anaplásico asociado a implantes mamarios es una manifestación novedosa de linfoma de sitio y material específico que se origina en una ubicación de cicatriz específica, presenta una amplia gama de características diversas y sugiere una causa multifactorial". Afirmaron que "no hubo preferencia por el relleno de solución salina o silicona ni por indicaciones cosméticas o reconstructivas". Cuando se conocía el historial de implantes, la paciente había recibido al menos un dispositivo de superficie texturizada. En 2016, la Organización Mundial de la Salud (OMS) reconoció oficialmente el linfoma anaplásico asociado a implantes mamarios. [80]
Hasta abril de 2022, la FDA ha recibido 1130 informes de dispositivos médicos (MDR) globales de BIA-ALCL, incluidas 59 muertes. [81] Dado que se pensaba que el ALCL se diagnosticaba solo en 1 mujer de medio millón, 60 mujeres era una cifra mucho mayor de lo esperado. Los investigadores señalaron que el BIA-ALCL podría ser mortal. [82] Si las mujeres con implantes presentan hinchazón tardía o acumulación de líquido, se sugieren estudios citológicos y una prueba del marcador CD30 . La Sociedad Estadounidense de Cirugía Plástica (ASPS) afirma que "el CD30 es la principal prueba diagnóstica que se debe realizar en el líquido del seroma, ya que la patología de rutina o la tinción H&E con frecuencia pueden pasar por alto el diagnóstico". [83] El diagnóstico y el tratamiento del ALCL asociado a implantes mamarios ahora siguen las pautas estandarizadas establecidas por la Red Nacional Integral del Cáncer. [84]
En la actualidad, se desconoce el riesgo de por vida de BIA-ALCL en los EE. UU., pero las estimaciones oscilan entre una de cada 70 000 y una de cada 500 000 mujeres con implantes mamarios, según el MD Anderson Cancer Center . [85] Los países con registros de implantes mamarios tienen los mejores datos sobre los riesgos de BIA-ALCL. Por ejemplo, a octubre de 2020, la Administración de Productos Terapéuticos de Australia y Nueva Zelanda informó un "riesgo de 1:3345 con Allergan Biocell y un riesgo de 1:86 029 con Mentor Siltex". [83] En los EE. UU., las estimaciones del riesgo de BIA-ALCL en implantes texturizados varían de 1,79 por 1000 (1 mujer con BIA-ALCL por cada 559 implantes) a 2,82 por 1000 (1 mujer por cada 355 implantes) [2]. En abril de 2022, la FDA informó 1130 informes de dispositivos médicos (MDR) de BIA-ALCL. De esos MDR, 59 de las mujeres murieron. La FDA afirma que 798 de los 1130 MDR de BIA-ALCL involucraron implantes mamarios texturizados, 37 MDR involucraron implantes de superficie lisa y 295 MDR no especificaron si los implantes eran texturizados o lisos. [81] En algunos casos, las mujeres que desarrollaron BIA-ALCL después de implantes mamarios lisos tenían expansores texturizados antes de sus implantes. La mayoría de las pacientes tenían BIA-ALCL que afectaba solo una mama y solo 8 pacientes fueron diagnosticadas con BIA-ALCL bilateral. El síntoma informado más común de BIA-ALCL según la FDA fue el seroma, seguido de hinchazón y dolor en las mamas, contractura capsular y masa o bulto periimplantario. Además, el 84 por ciento de los implantes informados fueron fabricados por Allergan, el mayor fabricante de implantes mamarios en ese momento. [81]
Un estudio realizado en el centro oncológico Memorial Sloan Kettering de mujeres que se sometieron a mastectomías profilácticas indicó que 1 de cada 355 mujeres fue diagnosticada posteriormente con LACG-IA. [86] Casi todas esas mujeres tenían implantes y expansores Biocell de Allergan. Estos informes sugieren firmemente que el LACG-IA se desarrolla principalmente en pacientes con implantes o expansores texturizados. En todos los casos, sin embargo, muchos investigadores sospechan que el LACG-IA es una complicación poco reconocida, mal diagnosticada y poco informada de los implantes mamarios.
La ASPS y la Fundación de Cirugía Plástica (PSF) se han asociado con la FDA para estudiar esta afección y, al hacerlo, crearon el Registro de pacientes y resultados para implantes mamarios y etiología y epidemiología del linfoma anaplásico de células grandes (PROFILE). La FDA de los Estados Unidos alienta enfáticamente a todos los médicos a que informen los casos a PROFILE en un esfuerzo por comprender mejor el papel de los implantes mamarios en el linfoma anaplásico de células grandes y el tratamiento de esta enfermedad. [87]
Otros linfomas y carcinomas de células escamosas
En septiembre de 2022, la FDA anunció nueva información sobre otros tipos de cánceres relacionados con los implantes mamarios, basándose en informes de dispositivos médicos (MDR) de casos de pacientes con carcinoma de células escamosas o varios linfomas encontrados en el tejido cicatricial alrededor de los implantes mamarios. La agencia informó 10 MDR sobre carcinoma de células escamosas encontrado en el tejido cicatricial de la cápsula y 12 MDR sobre varios linfomas también en el tejido cicatricial alrededor de los implantes mamarios. Estos nuevos casos no se superponen con los casos de BIA-ALCL. Se han encontrado SCC y otros linfomas en implantes de superficie lisa y texturizados, así como en implantes rellenos de gel de silicona y solución salina. Los pacientes que informaron síntomas especificaron hinchazón, dolor, bultos y cambios en la piel. A partir de 2022, no se conoce ni la tasa de incidencia ni la prevalencia. [88]
Procedimientos quirúrgicos
Tipos de incisión
La colocación de implantes mamarios se realiza mediante cinco tipos de incisiones quirúrgicas:
- Inframamaria: incisión realizada en el pliegue inframamario (pliegue natural debajo del seno), que brinda un acceso máximo para una disección precisa de los tejidos y la colocación de los implantes mamarios. Es la técnica quirúrgica preferida para la colocación de implantes de gel de silicona, porque expone mejor la interfaz entre el tejido mamario y el músculo pectoral ; sin embargo, la implantación de IMF puede producir cicatrices quirúrgicas más gruesas y ligeramente más visibles .
- Periareolar: una incisión en el borde de la periferia de la areola , que proporciona un abordaje óptimo cuando se requieren ajustes en la posición de la IMF, o cuando se incluye una mastopexia (levantamiento de senos) en el procedimiento de mamoplastia primaria . En la colocación periareolar, la incisión se realiza alrededor de la mitad medial (mitad inferior) de la circunferencia de la areola. Los implantes de gel de silicona pueden ser difíciles de colocar a través de una incisión periareolar, debido a la corta longitud de cinco centímetros (~ 5,0 cm) de la incisión de acceso requerida. Estéticamente, debido a que las cicatrices están en el borde de la areola (periferia), generalmente son menos visibles que las cicatrices de la incisión de la IMF de las mujeres con areolas de pigmento claro; en comparación con las cicatrices de la incisión cutánea, los epitelios modificados de las areolas son menos propensos a las cicatrices hipertróficas (elevadas).
- Transaxilar: incisión realizada en la axila , desde donde se realiza la disección en dirección medial para colocar los implantes, ya sea de manera roma o con un endoscopio (microcámara de video iluminada), sin producir cicatrices visibles en la mama propiamente dicha; sin embargo, es más probable que produzca una asimetría inferior en la posición del implante y el dispositivo. Por lo tanto, la revisión quirúrgica de los implantes mamarios colocados de manera transaxilar generalmente requiere una incisión de la membrana fibrótica interna o una incisión periareolar.
- Transumbilical: un aumento mamario transumbilical ( TUBA ) es una técnica de colocación de implantes menos común en la que la incisión se realiza en el ombligo y la disección se realiza en dirección superior, hacia el busto. El abordaje TUBA permite colocar los implantes mamarios sin producir cicatrices visibles en el seno propiamente dicho, pero hace que la disección y la colocación del dispositivo sean más difíciles técnicamente. Un procedimiento TUBA se realiza de forma roma (sin la asistencia visual del endoscopio) y no es apropiado para colocar implantes de gel de silicona (precargados), debido al gran potencial de dañar la cubierta de elastómero de silicona del implante mamario durante su inserción manual a través de la incisión corta (~2,0 cm) en el ombligo, y porque los implantes de gel de silicona precargados son incompresibles y no se pueden insertar a través de una incisión tan pequeña. [89]
- Transabdominal: al igual que en el procedimiento TUBA, en el aumento de senos mediante transabdominoplastia (TABA), los implantes mamarios se tunelizan superiormente desde la incisión abdominal hacia bolsillos de implantes disecados de forma roma, mientras que la paciente se somete simultáneamente a una abdominoplastia . [90]
Colocación de bolsillos para implantes
Los cinco abordajes quirúrgicos para colocar un implante mamario en el bolsillo del implante a menudo se describen en relación anatómica con el músculo pectoral mayor .
- Subglandular: el implante mamario se coloca en el espacio retromamario , entre el tejido mamario (la glándula mamaria) y el músculo pectoral mayor (el músculo principal del tórax), que es el que más se aproxima al plano del tejido mamario normal y ofrece los resultados más estéticos. Sin embargo, en mujeres con tejido blando pectoral delgado, la posición subglandular es más propensa a mostrar las ondulaciones y arrugas del implante subyacente. Además, la tasa de incidencia de contractura capsular es ligeramente mayor con la implantación subglandular.
- Subfascial: el implante mamario se coloca debajo de la fascia del músculo pectoral mayor; la posición subfascial es una variante de la posición subglandular del implante mamario. [91] Las ventajas técnicas de la técnica de implante subfascial son motivo de debate; los cirujanos defensores informan que la capa de tejido fascial proporciona una mayor cobertura del implante y mantiene mejor su posición. [92]
- Subpectoral (plano dual): el implante mamario se coloca debajo del músculo pectoral mayor, después de que el cirujano libera las inserciones musculares inferiores, con o sin disección parcial del plano subglandular. Como resultado, el polo superior del implante está parcialmente debajo del músculo pectoral mayor, mientras que el polo inferior del implante está en el plano subglandular. Esta técnica de implantación logra una cobertura máxima del polo superior del implante, al tiempo que permite la expansión del polo inferior del implante; sin embargo, la "deformidad por animación", el movimiento de los implantes en el plano subpectoral puede ser excesivo para algunos pacientes. [93]
- Submuscular: el implante mamario se coloca debajo del músculo pectoral mayor, sin liberar el origen inferior del músculo propiamente dicho. La cobertura muscular total del implante se puede lograr liberando los músculos laterales de la pared torácica (ya sea el músculo serrato o el músculo pectoral menor , o ambos) y suturándolos al músculo pectoral mayor. En la cirugía de reconstrucción mamaria , el abordaje de implantación submuscular logra una cobertura máxima de los implantes mamarios. Esta técnica rara vez se utiliza en cirugía estética debido al alto riesgo de deformidades por animación.
- Prepectoral o subcutánea: en una reconstrucción mamaria posterior a una mastectomía con conservación de piel o de piel y pezón , el implante se coloca por encima del músculo pectoral mayor sin disecarlo, de manera que el implante rellene directamente el volumen de la glándula mamaria extirpada. Para evitar el problema de la contractura capsular, el implante suele estar cubierto frontal o completamente con una malla de biomaterial , ya sea biológico o sintético.
Recuperación postoperatoria
Las cicatrices quirúrgicas de una mamoplastia de aumento de senos se desarrollan aproximadamente a las 6 semanas después de la operación y desaparecen en unos meses. Dependiendo de las actividades físicas de la vida diaria que se requieran de la mujer, la paciente de aumento de senos generalmente reanuda su vida normal a la semana después de la operación. Además, las mujeres cuyos implantes mamarios se colocaron debajo de los músculos del pecho (colocación submuscular) generalmente tienen una convalecencia más larga y ligeramente más dolorosa, debido a la curación de las incisiones en los músculos del pecho. Por lo general, no hace ejercicio ni realiza actividades físicas extenuantes durante aproximadamente 6 semanas. Durante la recuperación postoperatoria inicial, se anima a la mujer a ejercitar regularmente (flexionar y mover) el brazo para aliviar el dolor y el malestar; Si es necesario, los catéteres con medicación analgésica permanente pueden aliviar el dolor [94] [95] Además, la recuperación de las pacientes ha mejorado significativamente gracias a las técnicas refinadas de implantación de dispositivos mamarios (submusculares, subglandulares), que permiten que el 95 por ciento de las mujeres reanuden su vida normal a las 24 horas posteriores al procedimiento, sin vendajes, drenajes de líquidos, bombas para el dolor, catéteres, sujetadores de apoyo médico o analgésicos narcóticos . [96] [97] [98] [99]
Tipos


Hoy en día, existen tres tipos de implantes mamarios que se utilizan comúnmente para procedimientos de mamoplastia , reconstrucción mamaria y aumento mamario: [100]
- implante salino relleno con solución salina estéril .
- Implante de silicona relleno de gel de silicona viscoso .
- Implantes estructurados que utilizan cubiertas de elastómero de silicona anidadas y dos lúmenes llenos de solución salina.
Un cuarto tipo de implante, los implantes compuestos (o de compuestos alternativos), se han dejado de fabricar en gran medida. Estos tipos incluían rellenos como aceite de soja y polipropileno. Otros materiales que se han dejado de fabricar son el cartílago de buey, la lana de terileno, el caucho molido, el caucho silástico y las prótesis de teflón y silicona. [101]
Implantes salinos
El implante mamario de solución salina, relleno con solución salina (agua salada de concentración biológica 0,90% p/v de NaCl , ca. 300 mOsm /L), fue fabricado por primera vez por la empresa Laboratoires Arion, en Francia, y se introdujo para su uso como dispositivo médico protésico en 1964. Los modelos contemporáneos de implantes mamarios de solución salina se fabrican con carcasas vulcanizadas a temperatura ambiente (RTV) más gruesas hechas de un elastómero de silicona . El estudio In vitro Deflation of Pre-filled Saline Breast Implants (2006) informó que las tasas de deflación (fuga de relleno) del implante mamario de solución salina precargado lo convirtieron en una prótesis de segunda opción para la cirugía correctiva de mama. [102] Sin embargo, en la década de 1990, el implante mamario de solución salina fue el dispositivo protésico más común utilizado para la cirugía de aumento mamario en los Estados Unidos, debido a la restricción de la FDA estadounidense contra la implantación de implantes mamarios rellenos de silicona fuera de los estudios clínicos. Los implantes mamarios de solución salina han gozado de poca popularidad en el resto del mundo, y poseen una participación de mercado insignificante.
El objetivo técnico de la tecnología de implantes salinos era una técnica quirúrgica físicamente menos invasiva para colocar un dispositivo de implante mamario vacío a través de una incisión quirúrgica más pequeña. [103] En la práctica quirúrgica, después de haber colocado los implantes mamarios vacíos en los bolsillos de los implantes, el cirujano plástico llenó cada dispositivo con solución salina y, debido a que las incisiones de inserción requeridas son cortas y pequeñas, las cicatrices de incisión resultantes serán más pequeñas y más cortas que las cicatrices quirúrgicas habituales de las incisiones largas requeridas para insertar implantes de gel de silicona precargados.
En comparación con los resultados obtenidos con un implante mamario de gel de silicona, el implante de solución salina puede producir resultados aceptables, como un aumento del tamaño de los senos, un contorno hemisférico más suave y una textura realista; sin embargo, es más probable que cause problemas estéticos, como ondulaciones y arrugas en la piel que envuelve los senos, un estiramiento acelerado del polo inferior del seno y problemas técnicos, como que la presencia del implante sea perceptible a la vista y al tacto. La aparición de tales problemas estéticos es más probable en el caso de la mujer con muy poco tejido mamario y en el caso de la mujer que requiere una reconstrucción mamaria después de una mastectomía ; por lo tanto, el implante de gel de silicona es el dispositivo protésico técnicamente superior para el aumento mamario y la reconstrucción mamaria. En el caso de la mujer con mucho tejido mamario, para quien la colocación submuscular es el enfoque quirúrgico recomendado, los implantes mamarios de solución salina pueden producir un resultado estético muy similar al que ofrecen los implantes mamarios de silicona. [104] [105] Los estudios de resultados y exámenes de ultrasonido han revelado que los implantes mamarios de solución salina y de silicona se ven y se sienten similares. [106]
Implantes de gel de silicona
Como tecnología de dispositivo médico , existen cinco generaciones de implantes mamarios de silicona, cada una definida por técnicas comunes de fabricación de modelos. [ cita requerida ]
La prótesis mamaria moderna fue inventada en 1961 por los cirujanos plásticos estadounidenses Thomas Cronin y Frank Gerow, y fabricada por la Corporación Dow Corning ; posteriormente, en 1962 se realizó la primera mamoplastia de aumento.
Primera generación
El implante Cronin-Gerow, modelo de prótesis 1963, era una bolsa de caucho de silicona, con forma de lágrima, que se rellenaba con gel de silicona viscoso. Para reducir la rotación del implante mamario colocado sobre la pared torácica, la prótesis modelo 1963 se fijaba a la bolsa del implante con un parche de fijación, hecho de material Dacron ( tereftalato de polietileno ), que se fijaba a la parte posterior de la cubierta del implante mamario. [107]
Segunda generación
En la década de 1970, los fabricantes presentaron la segunda generación de prótesis sobre implantes mamarios que incorporaban novedades funcionales y mejoras estéticas en la tecnología:
- Los primeros avances tecnológicos fueron una carcasa de menor espesor y un gel de relleno de silicona de baja cohesión, que mejoró la funcionalidad y la verosimilitud (tamaño, apariencia y textura) del implante mamario de gel de silicona. Sin embargo, en la práctica clínica, los implantes mamarios de segunda generación demostraron ser frágiles y se produjeron más casos de rotura de la carcasa y de fuga de relleno ("sangrado de gel de silicona") a través de la carcasa intacta del dispositivo. Las consiguientes tasas de incidencia aumentadas de complicaciones médicas (por ejemplo, contractura capsular ) precipitaron demandas colectivas por productos defectuosos por parte del gobierno de los EE. UU. contra Dow Corning Corporation y otros fabricantes de prótesis mamarias.
- El segundo desarrollo tecnológico fue un recubrimiento de espuma de poliuretano para la cubierta del implante mamario; el recubrimiento redujo la incidencia de contractura capsular , al causar una reacción inflamatoria que impidió la formación de una cápsula de tejido fibroso de colágeno alrededor del implante mamario. Sin embargo, a pesar de esa medida profiláctica, el uso médico de los implantes mamarios recubiertos de poliuretano se interrumpió brevemente, debido al riesgo potencial para la salud que plantea la 2,4-toluendiamina (TDA), un subproducto cancerígeno de la descomposición química del recubrimiento de espuma de poliuretano del implante mamario que se ha demostrado que causa cáncer de hígado y de piel en estudios con modelos animales. [108]
- Tras examinar los datos médicos, la Administración de Alimentos y Medicamentos de Estados Unidos concluyó que el cáncer de mama inducido por TDA representaba un riesgo infinitesimal para la salud de las mujeres con implantes mamarios y no justificaba la obligación legal de que los médicos explicaran el asunto a sus pacientes. De hecho, los implantes mamarios recubiertos de poliuretano siguen utilizándose en la práctica de la cirugía plástica en Europa y Sudamérica, y ningún fabricante ha solicitado la aprobación de la FDA para la venta médica de dichos implantes mamarios en Estados Unidos [109].
- El tercer desarrollo tecnológico fue el implante mamario de doble lumen, una prótesis de doble cavidad compuesta por un implante mamario de silicona contenido dentro de un implante mamario de solución salina. El doble objetivo técnico era: (i) los beneficios cosméticos del gel de silicona (el lumen interno) encerrado en solución salina (el lumen externo); (ii) un dispositivo de implante mamario cuyo volumen se puede ajustar postoperatoriamente. Sin embargo, el diseño más complejo del implante mamario de doble lumen sufrió una tasa de falla del dispositivo mayor que la de los implantes mamarios de un solo lumen. Las versiones contemporáneas de los dispositivos de implante mamario de segunda generación (presentados en 1984) son los modelos de implante mamario "Becker Expandable", que se utilizan principalmente para la reconstrucción mamaria .
Tercera y cuarta generaciones
En la década de 1980, los modelos de la tercera y cuarta generación de dispositivos de implantes mamarios fueron avances secuenciales en la tecnología de fabricación, como las carcasas recubiertas de elastómero que reducían el sangrado de gel (fuga de relleno) y un gel de relleno más espeso (mayor cohesión). Sociológicamente , los fabricantes de prótesis mamarias diseñaron y fabricaron modelos anatómicos (pechos naturales) y modelos con formas (redondos, cónicos) que correspondían de manera realista con los tipos de mama y cuerpo de las mujeres. Los modelos cónicos de implantes mamarios tienen una superficie con textura uniforme, lo que reduce la rotación de la prótesis dentro del bolsillo del implante; los modelos redondos de implantes mamarios están disponibles en tipos de superficie lisa y superficie texturizada.
Quinta generación
Desde mediados de los años 1990, la quinta generación de implantes mamarios de gel de silicona está hecha de un gel de silicona de alta resistencia y altamente cohesivo que elimina en gran medida las ocurrencias de fuga de relleno ("sangrado de gel de silicona") y de la migración del relleno de silicona desde el bolsillo del implante a otras partes del cuerpo de la mujer. Estos implantes se conocen comúnmente como "implantes mamarios de osito de goma" por su consistencia firme y flexible, que es similar a la de los caramelos de goma. Los estudios Experience with Anatomical Soft Cohesive Silicone gel Prosthesis in Cosmetic and Reconstructive Breast Implant Surgery (2004) y Cohesive Silicone gel Breast Implants in Aesthetic and Reconstructive Breast Surgery (2005) informaron tasas de incidencia bajas de contractura capsular y de ruptura de la cubierta del dispositivo; y mayores tasas de seguridad médica mejorada y eficacia técnica que las de los dispositivos de implantes mamarios de primera generación. [110] [111] [112]
Amamantamiento
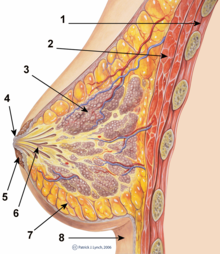
La presencia de implantes mamarios actualmente no representa ninguna contraindicación para la lactancia materna, y la FDA de los Estados Unidos no reconoce ninguna evidencia que sustente que la práctica pueda presentar problemas de salud para un bebé amamantado .
Las mujeres con implantes mamarios pueden tener dificultades funcionales para amamantar; los procedimientos de mamoplastia que incluyen incisiones periareolares son especialmente propensos a causar dificultades para amamantar. La cirugía también puede dañar los conductos galactóforos y los nervios en el área del pezón y la areola. [113] [114] [115]
Las dificultades para la lactancia materna funcional surgen si el cirujano corta los conductos galactóforos o los nervios principales que inervan la mama, o si las glándulas mamarias se dañaron de alguna otra manera. El daño a los conductos galactóforos y a los nervios es más común si las incisiones cortan tejido cerca del pezón. Las glándulas mamarias tienen más probabilidades de verse afectadas por implantes subglandulares (debajo de la glándula) y por implantes mamarios de gran tamaño, que pellizcan los conductos galactóforos e impiden el flujo de leche. Los implantes mamarios de tamaño pequeño y los implantes submusculares causan menos problemas de función mamaria; sin embargo, es imposible predecir si una mujer que se somete a un aumento mamario podrá amamantar con éxito, ya que algunas mujeres pueden amamantar después de incisiones periareolares y colocación subglandular y otras no pueden hacerlo después del aumento mediante incisiones submusculares y otros tipos de incisiones quirúrgicas. [115]
Mamografía

La presencia de implantes mamarios radiológicamente opacos (ya sean de solución salina o de silicona) puede interferir con la sensibilidad radiográfica de la mamografía , es decir, la imagen puede no mostrar ningún tumor presente. En este caso, se requiere una mamografía con vista de Eklund para determinar la presencia o ausencia de un tumor canceroso, en la que el implante mamario se desplaza manualmente contra la pared torácica y se tira de la mama hacia adelante, de modo que la mamografía pueda visualizar un mayor volumen de los tejidos internos; no obstante, aproximadamente un tercio del tejido mamario permanece visualizado de manera inadecuada, lo que resulta en una mayor incidencia de mamografías con resultados falsos negativos. [116] [117]
Los estudios de cáncer de mama Cancer in the Augmented Breast: Diagnosis and Prognosis (1993) y Breast Cancer after Augmentation Mammoplasty (2001) de mujeres con prótesis de implantes mamarios no informaron diferencias significativas en el estadio de la enfermedad en el momento del diagnóstico de cáncer; los pronósticos son similares en ambos grupos de mujeres, y las pacientes con prótesis de implantes mamarios tienen un menor riesgo de recurrencia posterior del cáncer o muerte. [118] [119] Por el contrario, el uso de implantes para la reconstrucción mamaria después de una mastectomía por cáncer de mama parece no tener ningún efecto negativo sobre la incidencia de muerte relacionada con el cáncer. [120] El hecho de que a las pacientes con implantes mamarios se les diagnostique con mayor frecuencia tumores palpables (pero no de mayor tamaño) indica que los tumores de igual tamaño podrían palparse más fácilmente en las pacientes con prótesis de implantes mamarios, lo que podría compensar las imágenes de mamografía deterioradas. [121] La fácil palpabilidad del tumor o tumores de cáncer de mama es consecuencia del adelgazamiento del tejido mamario por compresión, de manera innata en mamas más pequeñas a priori (porque tienen menores volúmenes de tejido), y que el implante sirve como una base radiopaca contra la cual se puede diferenciar un tumor canceroso. [122]

El implante mamario no tiene ninguna relación clínica con la cirugía de conservación de mama mediante lumpectomía para mujeres que desarrollaron cáncer de mama después del procedimiento de implantación, ni tampoco interfiere con los tratamientos de radiación de haz externo (XRT); además, la incidencia posterior al tratamiento de fibrosis del tejido mamario es común y, por lo tanto, una mayor tasa consecuente de contractura capsular . [123] Hay evidencia tentativa de que las mujeres que se han sometido a un aumento de mama tienen un peor pronóstico de cáncer de mama. [124] El uso de implantes para la reconstrucción mamaria después de una mastectomía por cáncer de mama parece no tener un efecto negativo sobre la muerte relacionada con el cáncer. [120] [125]
Se han notificado múltiples casos de otros efectos adversos de la mamografía en mujeres con implantes mamarios; la mayoría de estos casos se deben a rupturas causadas por la presión ejercida sobre el implante mamario. [126] La compresión también puede provocar dolor o exacerbar el dolor ya existente en los senos. [126]
Historia

Siglo XIX
Desde finales del siglo XIX, los implantes mamarios se han utilizado para aumentar quirúrgicamente el tamaño (volumen), modificar la forma (contorno) y mejorar la sensación (tacto) de los senos de una mujer. En 1895, el cirujano Vincenz Czerny realizó la primera colocación de implantes mamarios cuando utilizó tejido adiposo autólogo de la paciente, extraído de un lipoma lumbar benigno , para reparar la asimetría del seno del que había extirpado un tumor. [127] En 1889, el cirujano Robert Gersuny experimentó con inyecciones de parafina , con resultados desastrosos derivados de la ruptura de la parafina en cuerpos más pequeños después del procedimiento. [128]
Siglo XX
Desde la primera mitad del siglo XX, los médicos utilizaron otras sustancias como relleno de implantes mamarios: marfil , bolas de vidrio, caucho molido, cartílago de buey , lana de terileno , gutapercha , Dicora, chips de polietileno , Ivalon ( alcohol polivinílico - esponja de polímero de formaldehído), una bolsa de polietileno con Ivalon, esponja de espuma de poliéter (Etheron), cinta de polietileno (Polystan) tiras enrolladas en una bola, poliéster (esponja de espuma de poliuretano), caucho Silastic y prótesis de teflón-silicona. [129]
A mediados del siglo XX, Morton I. Berson, en 1945, y Jacques Maliniac, en 1950, realizaron cada uno aumentos de mama basados en colgajos rotando el tejido de la pared torácica de la paciente hacia el seno para aumentar su volumen. Además, a lo largo de las décadas de 1950 y 1960, los cirujanos plásticos utilizaron rellenos sintéticos, incluidas inyecciones de silicona recibidas por unas 50.000 mujeres, a partir de las cuales se desarrollaron granulomas de silicona y endurecimiento de la mama que requirieron tratamiento mediante mastectomía . [130] En 1961, los cirujanos plásticos estadounidenses Thomas Cronin y Frank Gerow, y la Corporación Dow Corning , desarrollaron la primera prótesis mamaria de silicona, rellena de gel de silicona; Con el tiempo, la primera mamoplastia de aumento se realizó en 1962 utilizando el implante Cronin-Gerow, modelo de prótesis 1963. En 1964, la empresa francesa Laboratoires Arion desarrolló y fabricó el implante mamario salino, relleno con solución salina , y luego introducido para su uso como dispositivo médico en 1964. [102]
Aprobación de la FDA
En 1988, veintiséis años después de la introducción en 1962 de los implantes mamarios rellenos de gel de silicona, la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) investigó los fallos de los implantes mamarios y las complicaciones posteriores, reclasificó los dispositivos de implantes mamarios como dispositivos médicos de Clase III y exigió a los fabricantes los datos documentales que corroboraran la seguridad y eficacia de sus dispositivos de implantes mamarios. [131] En 1992, la FDA puso en moratoria los implantes mamarios de gel de silicona en los Estados Unidos, porque había "información inadecuada para demostrar que los implantes mamarios eran seguros y eficaces". No obstante, el acceso médico a los dispositivos de implantes mamarios de gel de silicona continuó para estudios clínicos de reconstrucción mamaria postmastectomía , la corrección de deformidades congénitas y el reemplazo de implantes de gel de silicona rotos. La FDA exigió a los fabricantes los datos de los ensayos clínicos y les permitió proporcionar implantes mamarios a las pacientes de aumento mamario para los estudios estadísticos requeridos por la Administración de Alimentos y Medicamentos de los Estados Unidos. [131] A mediados de 1992, la FDA aprobó un protocolo de estudio complementario para implantes rellenos de gel de silicona para pacientes de reconstrucción mamaria y para pacientes de cirugía de revisión. También en 1992, Dow Corning Corporation , un fabricante de productos de silicona e implantes mamarios, anunció la interrupción de cinco siliconas de grado de implante , pero continuaría produciendo otros 45 materiales de silicona de grado médico; tres años después, en 1995, Dow Corning Corporation se declaró en quiebra cuando enfrentó grandes demandas colectivas que reclamaban una variedad de enfermedades. [131]
- En 1997, el Departamento de Salud y Servicios Humanos de los Estados Unidos (HHS) designó al Instituto de Medicina (IOM) de la Academia Nacional de Ciencias de los Estados Unidos (NAS) para investigar los riesgos potenciales de complicaciones operatorias y postoperatorias de la colocación de implantes mamarios de silicona. La revisión del IOM sobre la seguridad y eficacia de los implantes mamarios rellenos de gel de silicona, informó que la "evidencia sugiere que las enfermedades o afecciones, como enfermedades del tejido conectivo , cáncer , enfermedades neurológicas u otras quejas o afecciones sistémicas no son más comunes en mujeres con implantes mamarios que en mujeres sin implantes"; estudios posteriores y una revisión sistemática no encontraron un vínculo causal entre los implantes mamarios de silicona y la enfermedad. [131]

- En 1998, la FDA de los EE. UU. aprobó protocolos de estudios complementarios para implantes rellenos de gel de silicona únicamente para pacientes de reconstrucción mamaria y para pacientes de cirugía de revisión; y también aprobó el estudio de Exención de Dispositivo en Investigación (IDE) de Dow Corning Corporation para implantes mamarios de gel de silicona para un número limitado de pacientes de aumento, reconstrucción y cirugía de revisión mamaria. [131]
- En 1999, el Instituto de Medicina publicó el estudio Seguridad de los implantes mamarios de silicona (1999) que no informó evidencia de que los dispositivos de implantes mamarios rellenos de solución salina o de gel de silicona causaran problemas de salud sistémicos; que su uso no planteaba nuevos riesgos para la salud o la seguridad; y que las complicaciones locales son "el principal problema de seguridad con los implantes mamarios de silicona", al distinguir entre complicaciones médicas rutinarias y locales y problemas de salud sistémicos". [131] [132] [133]
- En el año 2000, la FDA aprobó las solicitudes de aprobación previa a la comercialización de implantes mamarios de solución salina que contenían los datos sobre el tipo y la frecuencia de las complicaciones médicas locales experimentadas por las pacientes de cirugía mamaria. [134] "A pesar de las complicaciones experimentadas por algunas mujeres, la mayoría de las mujeres que todavía participaban en los estudios de Inamed Corporation y Mentor Corporation , después de tres años, informaron estar satisfechas con sus implantes". [131] Las aprobaciones previas a la comercialización se otorgaron para el aumento de senos, para mujeres de al menos 18 años de edad y para mujeres que requerían reconstrucción mamaria. [135] [136]
- En 2006, la Administración de Alimentos y Medicamentos de los Estados Unidos levantó las restricciones que impedían el uso de implantes mamarios de gel de silicona para la reconstrucción mamaria y la mamoplastia de aumento en el caso de la Corporación Inamed y la Corporación Mentor. Sin embargo, la aprobación estaba condicionada a la aceptación de la supervisión de la FDA, la finalización de estudios de 10 años de duración en mujeres que ya tenían implantes mamarios y la finalización de un segundo estudio de 10 años de duración sobre la seguridad de los implantes mamarios en otras 40.000 mujeres. [137] La FDA advirtió al público que los implantes mamarios conllevan riesgos médicos y recomendó que las mujeres que se sometieran a un aumento mamario se sometieran periódicamente a exámenes de resonancia magnética para detectar signos de rotura de la cubierta o de fuga del relleno, o de ambas afecciones; y ordenó que se proporcionaran a las pacientes de cirugía mamaria folletos informativos detallados que explicaran los riesgos médicos del uso de implantes mamarios de gel de silicona. [131]
- En marzo de 2019, la FDA organizó una reunión pública de su Panel Asesor de Dispositivos de Cirugía Plástica y General para discutir cuestiones de seguridad de los implantes mamarios de silicona y solución salina, incluyendo el BIA-ALCL y la enfermedad por implantes mamarios. [138] Uno de los temas principales de esa reunión pública fue la evidencia de que los implantes mamarios texturizados BIOCELL de Allergan eran el tipo de implantes mamarios con más probabilidades de causar BIA-ALCL. Después de la reunión del comité, la FDA solicitó a Allergan que retirara del mercado sus implantes mamarios texturizados BIOCELL y expansores de tejido, y en julio de 2019 Allergan retiró del mercado esos implantes y expansores texturizados BIOCELL. Posteriormente, Allergan anunció que se comunicaría con todos los clientes que habían comprado sus productos para asegurarse de que estuvieran al tanto del retiro del mercado. [139]
La Administración de Alimentos y Medicamentos de los Estados Unidos estableció los rangos de edad para las mujeres que buscan implantes mamarios; para la reconstrucción mamaria, los implantes rellenos de gel de silicona y los implantes rellenos de solución salina fueron aprobados para mujeres de todas las edades; para el aumento mamario, los implantes salinos fueron aprobados para mujeres de 18 años de edad y mayores; los implantes de silicona fueron aprobados para mujeres de 22 años de edad y mayores. [140] Debido a que cada dispositivo de implante mamario implica diferentes riesgos médicos, la edad mínima de la paciente para implantes mamarios salinos es diferente de la edad mínima de la paciente para implantes mamarios de silicona, debido a los riesgos de fuga de relleno y ruptura silenciosa de la cubierta; por lo tanto, los exámenes periódicos de detección de MRI son la terapia de seguimiento postoperatoria recomendada para la paciente. [140] En otros países, en Europa y Oceanía, las políticas de implantes mamarios de los ministerios de salud nacionales no respaldan la detección periódica de MRI de pacientes asintomáticas, pero sugieren que la palpación adecuada, con o sin una detección ultrasónica , es una terapia postoperatoria suficiente para la mayoría de las pacientes.
Véase también
Referencias
- ^ "Riesgos y complicaciones de los implantes mamarios". FDA . 21 de octubre de 2019 . Consultado el 30 de octubre de 2019 .
- ^ Loch-Wilkinson, Anna; Beath, Kenneth J; Magnusson, Mark R; Cooter, Rodney; Shaw, Karen; French, James; Vickery, Karen; Prince, H Miles; Deva, Anand K (13 de julio de 2020). "Linfoma anaplásico de células grandes asociado a implantes mamarios en Australia: un estudio longitudinal de los factores de riesgo relacionados con los implantes". Revista de cirugía estética . 40 (8): 838–846. doi :10.1093/asj/sjz333. ISSN 1090-820X.
- ^ Sociedad Estadounidense de Cirujanos Plásticos (24 de abril de 2014), "Cinco cosas que los médicos y los pacientes deberían cuestionar", Choosing Wisely : una iniciativa de la Fundación ABIM , Sociedad Estadounidense de Cirujanos Plásticos, archivado desde el original el 19 de julio de 2014 , consultado el 25 de julio de 2014
- ^ Brinton LA, Brown SL, Colton T, Burich MC, Lubin J (2000). "Características de una población de mujeres con implantes mamarios en comparación con mujeres que buscan otros tipos de cirugía plástica". Cirugía Plástica y Reconstructiva . 105 (3): 919–927. doi :10.1097/00006534-200003000-00014. PMID 10724251. S2CID 32599107.
- ^ Jacobsen PH, Hölmich LR, McLaughlin JK, Johansen C, Olsen JH, Kjøller K, Friis S (2004). "Mortalidad y suicidio entre mujeres danesas con implantes mamarios cosméticos". Arch. Intern. Med . 164 (22): 2450–5. doi :10.1001/archinte.164.22.2450. PMID 15596635.
- ^ Young VL, Nemecek JR, Nemecek DA (1994). "La eficacia del aumento de senos: aumento del tamaño de los senos, satisfacción del paciente y efectos psicológicos". Cirugía plástica y reconstructiva . 94 (diciembre): 958–969. doi :10.1097/00006534-199412000-00009. PMID 7972484. S2CID 753343.
- ^ Crerand CE, Franklin ME, Sarwer DB (2006). "Trastorno dismórfico corporal y cirugía estética". Cirugía plástica y reconstructiva . 118 (julio): 167e–180e. doi :10.1097/01.prs.0000242500.28431.24. PMID 17102719. S2CID 8925060.
- ^ Sarwer DB, LaRossa D, Bartlett SP, Low DW, Bucky LP, Whitaker LA (2003). "Preocupaciones sobre la imagen corporal de las pacientes de aumento de senos". Cirugía plástica y reconstructiva . 112 (julio): 83–90. doi :10.1097/01.PRS.0000066005.07796.51. PMID 12832880. S2CID 45574374.
- ^ Chahraoui K, Danino A, Frachebois C, Clerc AS, Malka G (2006). "Cirugía estética y calidad de vida antes y cuatro meses después de la operación". Revista de efectos a largo plazo de los implantes médicos . 51 (3): 207–210. doi :10.1016/j.anplas.2005.07.010. PMID 16181718.
- ^ Cash TF, Duel LA, Perkins LL (2002). "Resultados psicosociales de las mujeres tras el aumento de pecho con implantes de gel de silicona: un estudio prospectivo de 2 años". Cirugía Plástica y Reconstructiva . 109 (mayo): 2112–2121. doi :10.1097/00006534-200205000-00049. PMID 11994621.
- ^ Figueroa-Haas CL (2007). "Efecto de la mamoplastia de aumento de senos en la autoestima y la sexualidad: un análisis cuantitativo". Enfermería en cirugía plástica . 27 (marzo): 16–36. doi :10.1097/01.PSN.0000264159.30505.c9. PMID 17356451. S2CID 23169107.
- ^ "Información importante para mujeres sobre el aumento de senos con implantes de gel de silicona Inamed" (PDF) . Administración de Alimentos y Medicamentos . 2006. Archivado desde el original (PDF) el 2007-01-03.
- ^ Dolan, Eric W. (6 de octubre de 2023). «Los implantes mamarios tienen un impacto positivo en la sexualidad femenina, según una nueva investigación». PsyPost . Consultado el 9 de octubre de 2023 .
- ^ Handel N, Cordray T, Gutierrez J, Jensen JA (2006). "Un estudio a largo plazo de los resultados, las complicaciones y la satisfacción de las pacientes con implantes mamarios". Cirugía Plástica y Reconstructiva . 117 (marzo): 757–767. doi :10.1097/01.prs.0000201457.00772.1d. PMID 16525261. S2CID 15228702.
- ^ "Estudio vincula los implantes mamarios con el suicidio". Reuters . 8 de agosto de 2007. Archivado desde el original el 21 de diciembre de 2008.
- ^ Manning A (6 de agosto de 2007). "Los implantes mamarios están relacionados con tasas de suicidio más altas". USA Today . Archivado desde el original el 18 de marzo de 2011. Consultado el 26 de abril de 2010 .
- ^ ab Brinton LA, Lubin JH, Burich MC, Colton T, Brown SL, Hoover RN (2001). "Riesgo de cáncer en sitios distintos de la mama después de una mamoplastia de aumento". Ann Epidemiol . 11 (4): 248–256. doi :10.1016/s1047-2797(00)00223-4. PMID 11306343.
- ^ Koot VC, Peeters PH, Granath F, Grobbee DE, Nyren O (2003). "Mortalidad total y por causa específica entre mujeres suecas con implantes mamarios cosméticos: estudio prospectivo". BMJ . 326 (7388): 527–8. doi :10.1136/bmj.326.7388.527. PMC 150462 . PMID 12623911.
- ^ Pukkala E, Kulmala I, Hovi SL, Hemminki E, Keskimäki I, Pakkanen M, Lipworth L, Boice JD, McLaughlin JK (2003). "Causas de muerte entre mujeres finlandesas con implantes mamarios cosméticos, 1971-2001". Ann Plast Cirugía . 51 (4): 339–42, discusión 343–4. doi :10.1097/01.sap.0000080407.97677.A5. PMID 14520056. S2CID 34929987.
- ^ Villeneuve PJ, Holowaty EJ, Brisson J, Xie L, Ugnat AM, Latulippe L, Mao Y (2006). "Mortalidad entre mujeres canadienses con implantes mamarios cosméticos". Am. J. Epidemiol . 164 (4): 334–41. doi :10.1093/aje/kwj214. PMID 16777929.
- ^ Brinton LA, Lubin JH, Murray MC, Colton T, Hoover RN (2006). "Tasas de mortalidad entre pacientes de mamoplastia de aumento: una actualización". Epidemiología . 17 (2): 162–9. doi : 10.1097/01.ede.0000197056.84629.19 . PMID 16477256. S2CID 22285852.
- ^ Estadísticas nacionales de procedimientos de cirugía plástica, 2006. Arlington Heights, Illinois, Sociedad Estadounidense de Cirujanos Plásticos, 2007
- ^ "La cirugía plástica mejora la autoestima". Psych Central.com . Archivado desde el original el 19 de junio de 2010.
- ^ Grippaudo FR, Renzi L, Costantino B, Longo B, Santanelli F (2013). "Hematoma unilateral tardío después de reconstrucción mamaria con implantes: informe de caso y revisión de la literatura". Revista de cirugía estética . 33 (6): 830–834. doi : 10.1177/1090820X13496249 . PMID 23864111.
- ^ ab "Información importante para mujeres sobre el aumento de senos con implantes mamarios rellenos de silicona INAMED" (PDF) . Administración de Alimentos y Medicamentos . 2006-11-03. Archivado desde el original (PDF) el 2007-01-03 . Consultado el 2007-05-04 .
- ^ "Información importante para pacientes de aumento mamario sobre los implantes mamarios de gel de silicona MemoryGel de Mentor" (PDF) . 2006-11-03. Archivado desde el original (PDF) el 16 de octubre de 2014 . Consultado el 11 de octubre de 2014 .
- ^ "Cirugía de implantes mamarios con solución salina: cómo tomar una decisión informada (Mentor Corporation)". Manual del consumidor de implantes mamarios de la FDA - 2004. 13 de enero de 2004. Archivado desde el original el 26 de noviembre de 2006. Consultado el 4 de mayo de 2007 .
- ^ "COMUNICADO DE PRENSA DE LA FDA". Administración de Alimentos y Medicamentos . Archivado desde el original el 2011-11-03 . Consultado el 2011-11-09 .
- ^ ab Diamond BA; Hulka BS; Kerkvliet NI; Tugwell P. "Implantes mamarios de silicona en relación con enfermedades del tejido conectivo y disfunción inmunológica: Informe de un panel científico nacional al Honorable Sam C. Pointer Jr., juez coordinador del litigio multidistrital federal sobre implantes mamarios". 1998.
- ^ Janowsky, EC; Kupper, LL; Hulka, BS (16 de marzo de 2000). "Metaanálisis de la relación entre los implantes mamarios de silicona y el riesgo de enfermedades del tejido conectivo". The New England Journal of Medicine . 342 (11): 781–790. doi : 10.1056/NEJM200003163421105 . ISSN 0028-4793. PMID 10717013.
- ^ abc Watad, A.; Rosenberg, V.; Tiosano, S.; Cohen Tervaert, JW; Yavne, Y.; Shoenfeld, Y.; Shalev, V.; Chodick, G.; Amital, H. (2018). "Implantes mamarios de silicona y riesgo de trastornos autoinmunes/reumáticos: un análisis del mundo real". Int J Epidemiol . 47 (6): 1846–1854. doi : 10.1093/ije/dyy217 . PMID 30329056.
- ^ Coroneos, Christopher J.; Selber, Jesse C.; Offodile, Anaeze C.; Butler, Charles E.; Clemens, Mark W. (enero de 2019). "Estudios posteriores a la aprobación de implantes mamarios por parte de la FDA de EE. UU.: resultados a largo plazo en 99 993 pacientes". Anales de cirugía . 269 (1): 30–36. doi :10.1097/SLA.0000000000002990. ISSN 1528-1140. PMID 30222598. S2CID 52284936.
- ^ ab Wee, Corinne E (junio de 2021). "El efecto objetivo de la extracción de implantes mamarios y la capsulectomía en la función pulmonar". Cirugía Plástica y Reconstructiva - Global Open . 9 (6): e3636. doi : 10.1097/GOX.0000000000003636 . S2CID 235801794.
- ^ Brinton LA, Malone KE, Coates RJ, Schoenberg JB, Swanson CA, Daling JR, Stanford JL (1996). "Agrandamiento y reducción de los senos: resultados de un estudio de casos y controles de cáncer de mama". Cirugía Plástica y Reconstructiva . 97 (2): 269–275. doi :10.1097/00006534-199602000-00001. PMID 8559808. S2CID 29456173.
- ^ Benadiba L (2004). "Histoire des prótesis mamarias" (en francés). Archivado desde el original el 29 de enero de 2015 . Consultado el 12 de octubre de 2015 .
- ^ Folleto informativo sobre implantes mamarios (PDF) (4.ª ed.). Canberra: Commonwealth of Australia. 2001. ISBN 0642735794Archivado desde el original (PDF) el 1 de enero de 2007. Consultado el 29 de diciembre de 2006 .
- ^ "Sociedad Alemana de Senología, Declaración de consenso sobre la seguridad de los implantes mamarios de silicona". 24 de septiembre de 1998.
- ^ ab Janowsky EC, Kupper LL, Hulka BS (2000). "Metaanálisis de la relación entre los implantes mamarios de silicona y el riesgo de enfermedades del tejido conectivo". New England Journal of Medicine . 342 (11): 781–790. doi : 10.1056/NEJM200003163421105 . PMID 10717013.
- ^ [1] Archivado el 27 de diciembre de 2005 en Wayback Machine .
- ^ [2] Archivado el 23 de junio de 2006 en Wayback Machine .
- ^ Tugwell P, Wells G, Peterson J, Welch V, Page J, Davison C, McGowan J, Ramroth D, Shea B (2001). "¿Los implantes mamarios de silicona causan trastornos reumatológicos? Una revisión sistemática para un panel científico nacional designado por el tribunal". Arthritis Rheum . 44 (11): 2477–84. doi :10.1002/1529-0131(200111)44:11<2477::AID-ART427>3.0.CO;2-Q. PMID 11710703.
- ^ Gorgojo L, Gonzalez J, Wisbaum W, Martin-Moreno J (30 de mayo de 2003). Riesgos para la salud que plantean los implantes de silicona en general, con especial atención a los implantes mamarios (PDF) (Informe). Archivado desde el original (PDF) el 29 de agosto de 2003. Consultado el 28 de enero de 2019 .
- ^ Neuhann-Lorenz C, Fedeles J, Eisenman-Klein M, Kinney B, Cunningham BL (2001). "Octava declaración de consenso de IQUAM: innovaciones transatlánticas, abril de 2009". Cirugía plástica y reconstructiva . 127 (3): 1368–1375. doi :10.1097/PRS.0b013e318206312e. PMID 21364439. S2CID 29112694.
- ^ Brown SL, Middleton MS, Berg WA, Soo MS, Pennello G (2000). "Prevalencia de rotura de implantes mamarios de gel de silicona revelada en imágenes por resonancia magnética en una población de mujeres en Birmingham, Alabama". American Journal of Roentgenology . 175 (4): 1057–1064. doi :10.2214/ajr.175.4.1751057. PMID 11000165.
- ^ "Riesgos y complicaciones de los implantes mamarios". Administración de Alimentos y Medicamentos de EE. UU. 28 de septiembre de 2020. Consultado el 14 de octubre de 2021 .
- ^ Walker PS, Walls B, Murphy DK (2009). "Implantes mamarios rellenos de solución salina de Natrelle: un estudio prospectivo de 10 años". Revista de cirugía estética . 29 (1): 19–25. doi :10.1016/j.asj.2008.10.001. PMID 19233001.
- ^ Eisenberg, TS (2021). "¿El sobrellenado de implantes mamarios inflables lisos rellenos de solución salina reduce la tasa de desinflado? Experiencia con 4761 pacientes de mamoplastia de aumento". Cirugía Plástica Estética . 45 (5): 1991–1999. doi : 10.1007/s00266-021-02198-3 . PMC 8481168 . PMID 33712871.
- ^ Hölmich LR, Vejborg IM, Conrad C, Sletting S, Høier-Madsen M, Fryzek JP, McLaughlin JK, Kjøller K, Wiik A, Friis S (2004). "Rotura de implante mamario de silicona no tratada". Cirugía Plástica y Reconstructiva . 114 (1): 204–214. doi :10.1097/01.PRS.0000128821.87939.B5. PMID 15220594. S2CID 25947224.
- ^ Katzin WE, Centeno JA, Feng LJ, Kiley M, Mullick FG (2001). "Patología de los ganglios linfáticos de pacientes con implantes mamarios: una evaluación histológica y espectroscópica". American Journal of Surgical Pathology . 29 (4): 506–11. doi :10.1097/01.pas.0000155145.60670.e4. PMID 15767806. S2CID 31982669. Archivado desde el original el 24 de mayo de 2009.
- ^ "Estudio de la rotura de implantes mamarios rellenos de gel de silicona (componente de resonancia magnética)". Manual del consumidor de implantes mamarios de la FDA - 2004. 22 de mayo de 2000. Archivado desde el original el 9 de junio de 2007. Consultado el 4 de mayo de 2007 .
- ^ abc "Complicaciones locales". Manual del consumidor de implantes mamarios de la FDA - 2004. 8 de junio de 2004. Archivado desde el original el 13 de mayo de 2007. Consultado el 4 de mayo de 2007 .
- ^ Resonancia magnética de un implante mamario de silicona roto Archivado el 26 de septiembre de 2013 en Wayback Machine 5 de abril de 2013
- ^ Hölmich LR, Friis S, Fryzek JP, Vejborg IM, Conrad C, Sletting S, Kjøller K, McLaughlin JK, Olsen JH (2003). "Incidencia de rotura de implantes mamarios de silicona". Arch. Surg . 138 (7): 801–806. doi :10.1001/archsurg.138.7.801. PMID 12860765.
- ^ Hedén P, Nava MB, van Tetering JP, Magalon G, Fourie le R, Brenner RJ, Lindsey LE, Murphy DK, Walker PS (2006). "Prevalencia de rotura en implantes mamarios de silicona Inamed". Cirugía Plástica y Reconstructiva . 118 (2): 303–308. doi :10.1097/01.prs.0000233471.58039.30. PMID 16874191. S2CID 30442865.
- ^ "Resumen de la FDA sobre cuestiones clínicas (documento de MS Word)". Administración de Alimentos y Medicamentos . Archivado desde el original el 8 de marzo de 2008.
- ^ Cunningham B, McCue J (2009). "Seguridad y eficacia de los implantes MemoryGel de Mentor a los 6 años". Cirugía Plástica y Reconstructiva . 33 (3): 440–444. doi :10.1007/s00266-009-9364-6. PMID 19437068. S2CID 25722841.
- ^ Hedén P, Boné B, Murphy DK, Slicton A, Walker PS (2006). "Implantes mamarios de silicona cohesiva Style 410: seguridad y eficacia entre 5 y 9 años después de la implantación". Cirugía Plástica y Reconstructiva . 118 (6): 1281–1287. doi :10.1097/01.prs.0000239457.17721.5d. PMID 17051096. S2CID 34380204.
- ^ Hölmich LR, Fryzek JP, Kjøller K, Breiting VB, Jørgensen A, Krag C, McLaughlin JK (2005). "El diagnóstico de la rotura de implantes mamarios de silicona: hallazgos clínicos comparados con los hallazgos en la resonancia magnética". Anales de cirugía plástica . 54 (6): 583–589. doi :10.1097/01.sap.0000164470.76432.4f. PMID 15900139. S2CID 39525474.
- ^ "Panel asesor de expertos sobre implantes mamarios: actas de las sesiones". HealthCanada. 29 de septiembre de 2005. Archivado desde el original el 7 de noviembre de 2007. Consultado el 4 de mayo de 2007 .
- ^ Song JW, Kim HM, Bellfi LT, Chung KC (2011). "El efecto de los sesgos en el diseño de estudios sobre la precisión diagnóstica de la resonancia magnética para detectar roturas de implantes mamarios de silicona: un metanálisis". Cirugía plástica y reconstructiva . 127 (3): 1029–1044. doi :10.1097/PRS.0b013e3182043630. PMC 3080104. PMID 21364405 .
- ^ AFP (18 de septiembre de 2011). «Los implantes mamarios son seguros, pero no de por vida, según expertos estadounidenses». The Independent . Archivado desde el original el 3 de agosto de 2016.
- ^ Barnsley GP, Sigurdson LJ, Barnsley SE (2006). "Implantes mamarios de superficie texturizada para la prevención de la contractura capsular en pacientes de aumento mamario: un metaanálisis de ensayos controlados aleatorizados". Cirugía plástica y reconstructiva . 117 (7): 2182–2190. doi :10.1097/01.prs.0000218184.47372.d5. PMID 16772915. S2CID 35420582.
- ^ Wong CH, Samuel M, Tan BK, Song C (2006). "Contractura capsular en el aumento mamario subglandular con implantes mamarios texturizados versus lisos: una revisión sistemática". Cirugía Plástica y Reconstructiva . 118 (5): 1224–1236. doi :10.1097/01.prs.0000237013.50283.d2. PMID 17016195. S2CID 29643167.
- ^ Handel N, Gutierrez J (mayo de 2006). "Seguridad y eficacia a largo plazo de los implantes mamarios recubiertos con espuma de poliuretano". Journal of Aesthetic Surgery . 26 (3): 265–274. doi : 10.1016/j.asj.2006.04.001 . PMID 19338905.
- ^ Mladick RA (1993). "Técnica de aumento mamario con solución salina submuscular "sin contacto". Revista de Cirugía Estética . 17 (3): 183–192. doi :10.1007/BF00636260. PMID 8213311. S2CID 39767802.
- ^ Adams WP, Rios JL, Smith SJ (2006). "Mejora de los resultados de los pacientes en cirugía estética y reconstructiva de mama mediante irrigación mamaria con triple antibiótico: estudio clínico prospectivo de seis años". Cirugía Plástica y Reconstructiva . 117 (1): 30–6. doi :10.1097/01.prs.0000185671.51993.7e. PMID 16404244. S2CID 35238465.
- ^ Planas J, Cervelli V, Planas G (2001). "Experiencia de cinco años en el tratamiento ultrasónico de contracturas mamarias". Cirugía Plástica Estética . 25 (2): 89–93. doi :10.1007/s002660010102. PMID 11349308. S2CID 2784003.
- ^ Schlesinger SL, Ellenbogen R, Desvigne MN, Svehlak S, Heck R (2002). "Zafirlukast (Accolate): Un nuevo tratamiento para la contractura capsular". Cirugía Plástica Estética . 22 (4): 329–36. doi : 10.1067/maj.2002.126753 . PMID 19331987.
- ^ Scuderi N, Mazzocchi M, Fioramonti P, Bistoni G (2006). "Los efectos del zafirlukast en la contractura capsular: informe preliminar". Cirugía Plástica Estética . 30 (5): 513–520. doi :10.1007/s00266-006-0038-3. PMID 16977359. S2CID 251008.
- ^ Silver H (1982). "Reducción de la contractura capsular con mamoplastia de aumento en dos etapas y energía electromagnética pulsada (terapia Diapulse)". Cirugía Plástica y Reconstructiva . 69 (5): 802–805. doi :10.1097/00006534-198205000-00013. PMID 7071225. S2CID 8451166.
- ^ Tebbetts JB (octubre de 2006). "Criterios de puntos destacados para la extracción de implantes mamarios sin reemplazo y criterios para minimizar las reoperaciones después del aumento mamario". Cirugía Plástica y Reconstructiva . 114 (5): 1258–1262. doi :10.1097/01.prs.0000136802.91357.cf. PMID 15457046.
- ^ Tebbetts JB (diciembre de 2006). "Logro de una tasa de reoperación del 0 % a los 3 años en un estudio de aprobación previa a la comercialización de mamoplastias de aumento de 50 casos consecutivos". Cirugía Plástica y Reconstructiva . 118 (6): 1453–7. doi :10.1097/01.prs.0000239602.99867.07. PMID 17051118. S2CID 27630646.
- ^ Breiting VB, Hölmich LR, Brandt B, Fryzek JP, Wolthers MS, Kjøller K, McLaughlin JK, Wiik A, Friis S (2004). "Estado de salud a largo plazo de mujeres danesas con implantes mamarios de silicona". Cirugía Plástica y Reconstructiva . 114 (1): 217–226. doi :10.1097/01.PRS.0000128823.77637.8A. PMID 15220596. S2CID 20584928.
- ^ Grigg, Martha; Bondurant, Stuart (2000). "Informe de un estudio del Instituto de Medicina". Información para mujeres sobre la seguridad de los implantes mamarios de silicona , a través del NCBI.
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Brinton, LA (2006). "Mortalidad entre pacientes de mamoplastia de aumento: una actualización". Epidemiología . 17 (2): 162–169. doi : 10.1097/01.ede.0000197056.84629.19 . PMID 16477256. S2CID 22285852.
- ^ "Etiquetado de implantes mamarios aprobados". Administración de Alimentos y Medicamentos de Estados Unidos . 3 de diciembre de 2021. Archivado desde el original el 11 de septiembre de 2019. Consultado el 19 de enero de 2022 .
- ^ Arepalli SR, Bezabeh S, Brown SL (2002). "Reacción alérgica al platino en implantes mamarios de silicona". Revista de efectos a largo plazo de implantes médicos . 12 (4): 299–306. doi :10.1615/jlongtermeffmedimplants.v12.i4.80. PMID 12627791.
- ^ "Antecedentes de la FDA sobre el platino en los implantes mamarios de silicona". Administración de Alimentos y Medicamentos de los Estados Unidos. 16 de junio de 2006. Archivado desde el original el 15 de julio de 2006.
- ^ Oficina del Comisionado. "Alertas de seguridad para productos médicos humanos - Implantes mamarios: actualización - Linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL)". www.fda.gov . Archivado desde el original el 28 de abril de 2018 . Consultado el 28 de abril de 2018 .
- ^ Swerdlow, Steven H.; Campo, Elías; Pileri, Stefano A.; Harris, Nancy Lee; Stein, Harald; Siebert, Reiner; Advani, Ranjana; Ghielmini, Michele; Salles, Gilles A.; Zelenetz, Andrew D.; Jaffe, Elaine S. (19 de mayo de 2016). "La revisión de 2016 de la clasificación de neoplasias linfoides de la Organización Mundial de la Salud". Sangre . 127 (20): 2375–2390. doi : 10.1182/sangre-2016-01-643569. ISSN 0006-4971. PMC 4874220 . PMID 26980727.
- ^ abc "Implantes mamarios: informes de dispositivos médicos sobre linfoma anaplásico de células grandes asociado a implantes mamarios". www.fda.gov . 20 de agosto de 2020 . Consultado el 18 de agosto de 2021 .
- ^ Miranda RN, Aladily TN, Prince HM, Kanagal-Shamanna R, de Jong D, Fayad LE, et al. (enero de 2014). "Linfoma anaplásico de células grandes asociado a implantes mamarios: seguimiento a largo plazo de 60 pacientes". Journal of Clinical Oncology . 32 (2): 114–20. doi :10.1200/JCO.2013.52.7911. PMC 4062709 . PMID 24323027.
- ^ ab Clemens, Mark. "Linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL) Archivado el 26 de marzo de 2017 en Wayback Machine " (2017).
- ^ Clemens MW, Horwitz SM (marzo de 2017). "Directrices de consenso de la NCCN para el diagnóstico y el tratamiento del linfoma anaplásico de células grandes asociado a implantes mamarios". Revista de cirugía estética . 37 (3): 285–289. doi : 10.1093/asj/sjw259 . PMID 28184418.
- ^ "Datos sobre el linfoma acromioclavicular asociado a implantes | The MD Anderson Foundation". www.mdanderson.org . Archivado desde el original el 2017-12-09 . Consultado el 2017-12-08 .
- ^ Cordeiro, Peter (20 de enero de 2020). "Riesgo de linfoma anaplásico de células grandes asociado a implantes mamarios (BIA-ALCL) en una cohorte de 3546 mujeres seguidas prospectivamente a largo plazo después de la reconstrucción con implantes mamarios texturizados". J Plast Reconstr Aesthet Surg . 73 (5): 841–846. doi :10.1016/j.bjps.2019.11.064. PMC 7247945 . PMID 32008941.
- ^ "ALCL asociado a implantes mamarios: Proyecto PROFILE | The Plastic Surgery Foundation". www.thepsf.org . Archivado desde el original el 2017-05-07 . Consultado el 2017-04-25 .
- ^ "Implantes mamarios: informes de carcinoma de células escamosas y varios linfomas en la cápsula alrededor de los implantes: comunicación de seguridad de la FDA". Administración de Alimentos y Medicamentos de EE. UU . . 8 de septiembre de 2022.
- ^ Johnson GW, Christ JE (1993). "Aumento de mama endoscópico: inserción transumbilical de implantes mamarios rellenos de solución salina". Cirugía plástica y reconstructiva . 92 (5): 801–8. doi :10.1097/00006534-199392050-00004. PMID 8415961.
- ^ Wallach SG (2004). "Maximización del uso de la incisión de la abdominoplastia". Cirugía Plástica y Reconstructiva . 113 (1): 411–417. doi :10.1097/01.PRS.0000091422.11191.1A. PMID 14707667. S2CID 44430032.
- ^ Graf RM, Bernardes A, Rippel R, Araujo LR, Damasio RC, Auersvald A (2003). "Implante mamario subfascial: un nuevo procedimiento". Cirugía Plástica y Reconstructiva . 111 (2): 904–908. doi :10.1097/01.PRS.0000041601.59651.15. PMID 12560720.
- ^ Tebbetts JB (2004). "¿La fascia proporciona una cobertura adicional y significativa sobre un implante mamario?". Cirugía plástica y reconstructiva . 113 (2): 777–779. doi :10.1097/01.PRS.0000104516.13465.96. PMID 14758271.
- ^ Tebbetts JB (2002). "Un sistema para la selección de implantes mamarios basado en las características del tejido del paciente y la dinámica del tejido blando del implante". Cirugía Plástica y Reconstructiva . 109 (4): 1396–1409. doi :10.1097/00006534-200204010-00030. PMID 11964998.
- ^ Pacik PT, Nelson CE, Werner C (2008). "Control del dolor en mamoplastia de aumento: seguridad y eficacia de catéteres permanentes en 644 pacientes consecutivas". Aesthet Surg J . 28 (3): 279–84. doi : 10.1016/j.asj.2008.02.001 . PMID 19083538.
- ^ Pacik PT, Nelson CE, Werner C (2008). "Control del dolor en mamoplastia de aumento con catéteres permanentes en 687 pacientes consecutivas: análisis de datos". Aesthet Surg J. 28 ( 6): 631–41. doi :10.1016/j.asj.2008.09.001. PMID 19083591. S2CID 13441800.
- ^ Tebbetts JB (2002). "Un sistema para la selección de implantes mamarios basado en las características del tejido del paciente y la dinámica del tejido blando del implante". Plast. Reconstr. Surg . 109 (4): 1396–409, discusión 1410–5. doi :10.1097/00006534-200204010-00030. PMID 11964998.
- ^ Tebbetts JB, Adams WP (2005). "Cinco decisiones críticas en el aumento de senos utilizando cinco mediciones en cinco minutos: el proceso de apoyo a la toma de decisiones de cinco pasos". Plast. Reconstr. Surg . 116 (7): 2005–16. doi :10.1097/01.prs.0000191163.19379.63. PMID 16327616. S2CID 11180810.
- ^ Tebbetts JB (2002). "Lograr un retorno predecible a las actividades normales en 24 horas después del aumento de senos: parte I. Refinamiento de las prácticas mediante el uso de principios de estudio de tiempo y movimiento". Plast. Reconstr. Surg . 109 (1): 273–90, discusión 291–2. doi :10.1097/00006534-200201000-00044. PMID 11786826. S2CID 26419990.
- ^ Tebbetts JB (2002). "Lograr un retorno predecible a las actividades normales en 24 horas después del aumento de senos: Parte II. Preparación de la paciente, técnicas quirúrgicas refinadas e instrumentación". Plast. Reconstr. Surg . 109 (1): 293–305, discusión 306–7. doi :10.1097/00006534-200201000-00046. PMID 11786828. S2CID 21392313.
- ^ "Elección de implantes mamarios" (Web) . Minneapolis Plastic Surgery, LTD. Archivado desde el original el 24 de noviembre de 2016. Consultado el 23 de noviembre de 2016 .
- ^ Zannis J (2017). Cuentos para Tagliacozzi: una mirada al interior de la cirugía plástica moderna. AuthorHouse. ISBN 9781524659073. Recuperado el 7 de junio de 2019 .
- ^ ab Stevens WG, Hirsch EM, Stoker DA, Cohen R (2006). "Desinflado in vitro de implantes mamarios precargados con solución salina". Cirugía Plástica y Reconstructiva . 118 (2): 347–349. doi :10.1097/01.prs.0000227674.65284.80. PMID 16874200. S2CID 41156555.
- ^ Arion HG (1965). "Prótesis retromamaria". Cuentas Rendus de la Sociedad Francesa de Ginecología . 5 .
- ^ Eisenberg TS (2009). "Los implantes de gel de silicona están de vuelta, ¿y qué?". American Journal of Cosmetic Surgery . 26 : 5–7. doi :10.1177/074880680902600103. S2CID 136191732.
- ^ Eisenberg TS (2022). "El implante mamario de solución salina subestimado". Cirugía Plástica Estética . 47 (2): 897–900. doi :10.1007/s00266-022-03106-z. PMID 36131136. S2CID 252437143.
- ^ Swanson E (2020). "Estudio prospectivo de implantes de solución salina versus implantes de gel de silicona para el aumento mamario subpectoral". Cirugía Plástica y Reconstructiva . 8 (6): e2882. doi :10.1097/GOX.0000000000002882. PMC 7339341 . PMID 32766047.
- ^ Cronin TD, Gerow FJ (1963). "Mamoplastia de aumento: una nueva prótesis de "sensación natural". Extracto de la serie de congresos internacionales de Medica . 66 : 41.
- ^ Luu HM, Hutter JC, Bushar HF (1998). "Un modelo farmacocinético basado en la fisiología para la 2,4-toluendiamina lixiviada de implantes mamarios cubiertos con espuma de poliuretano". Environ Health Perspect . 106 (7): 393–400. doi :10.2307/3434066. JSTOR 3434066. PMC 1533137 . PMID 9637796.
- ^ Hester TR, Tebbetts JB, Maxwell GP (2001). "La prótesis mamaria cubierta de poliuretano: hechos y ficción (II): una mirada al pasado y un "vistazo" al futuro". Cirugía Plástica Clínica . 28 (3): 579–86. doi :10.1016/S0094-1298(20)32397-X. PMID 11471963.
- ^ Brown MH, Shenker R, Silver SA (2005). "Implantes mamarios de gel de silicona cohesiva en cirugía estética y reconstructiva de mama". Cirugía Plástica y Reconstructiva . 116 (3): 768–779, discusión 779–1. doi :10.1097/01.prs.0000176259.66948.e7. PMID 16141814. S2CID 35392851.
- ^ Fruhstorfer BH, Hodgson EL, Malata CM (2004). "Experiencia temprana con una prótesis de gel de silicona cohesiva blanda anatómica en cirugía estética y reconstructiva de implantes mamarios". Anales de Cirugía Plástica . 53 (6): 536–542. doi :10.1097/01.sap.0000134508.43550.6f. PMID 15602249. S2CID 24661896.
- ^ Hedén P, Jernbeck J, Hober M (2001). "Aumento de senos con implantes anatómicos de gel cohesivo: la experiencia actual más grande del mundo". Clinics in Plastic Surgery . 28 (3): 531–552. doi :10.1016/S0094-1298(20)32393-2. PMID 11471959.
- ^ La lactancia materna después de la cirugía de mama Archivado el 30 de diciembre de 2010 en Wayback Machine , La Leche League, contiene referencias.
- ^ La lactancia materna y los implantes mamarios Archivado el 31 de diciembre de 2010 en Wayback Machine , Bibliografía seleccionada, abril de 2003, LLLI Center for Breastfeeding Information
- ^ ab Leche inorgánica: ¿Puede Kendra Wilkinson amamantar a su bebé a pesar de tener implantes? Archivado el 25 de enero de 2010 en Wayback Machine , Christopher Beam, Slate.com , 11 de diciembre de 2009
- ^ Handel N, Silverstein MJ, Gamagami P, Jensen JA, Collins A (1992). "Factores que afectan la visualización mamográfica de la mama después de una mamoplastia de aumento". JAMA . 268 (14): 1913–1917. doi :10.1001/jama.268.14.1913. PMID 1404718.
- ^ O'Keefe JR, Wilkinson JM, Spuur KM (junio de 2020). "Práctica actual en imágenes mamográficas de mama aumentada en Australia". Revista de ciencias de la radiación médica . 67 (2): 102–110. doi :10.1002/jmrs.374. PMC 7276184 . PMID 31981297.
- ^ Clark CP, Peters GN, O'Brien KM (1993). "Cáncer en la mama aumentada: diagnóstico y pronóstico". Cancer . 72 (7): 2170–4. doi : 10.1002/1097-0142(19931001)72:7<2170::AID-CNCR2820720717>3.0.CO;2-1 . PMID 8374874.
- ^ Skinner KA, Silberman H, Dougherty W, Gamagami P, Waisman J, Sposto R, Silverstein MJ (2001). "Cáncer de mama después de una mamoplastia de aumento". Ann Surg Oncol . 8 (2): 138–44. doi :10.1007/s10434-001-0138-x. PMID 11258778. S2CID 26010159.
- ^ ab Le GM, O'Malley CD, Glaser SL, Lynch CF, Stanford JL, Keegan TH, West DW (2005). "Implantes mamarios después de una mastectomía en mujeres con cáncer de mama en etapa temprana: prevalencia e impacto en la supervivencia". Breast Cancer Res . 7 (2): R184–93. doi : 10.1186/bcr974 . PMC 1064128 . PMID 15743498.
- ^ Handel N, Silverstein MJ (2006). "Diagnóstico y pronóstico del cáncer de mama en mujeres con prótesis mamarias aumentadas". Cirugía Plástica y Reconstructiva . 118 (3): 587–93. doi :10.1097/01.prs.0000233038.47009.04. PMID 16932162. S2CID 36277679.
- ^ Cunningham B (2006). "Diagnóstico y pronóstico del cáncer de mama en mujeres con prótesis mamarias aumentadas: discusión". Cirugía Plástica y Reconstructiva . 118 (3): 594–595. doi :10.1097/01.prs.0000233047.87102.8e. S2CID 220562548.
- ^ Schwartz GF, Veronesi U, Clough KB, Dixon JM, Fentiman IS, Heywang-Köbrunner SH, Holland R, Hughes KS, Mansel RE, Margolese R, Mendelson EB, Olivotto IA, Palazzo JP, Solin LJ (2006). "Conferencia de consenso sobre conservación de la mama". Revista del Colegio Americano de Cirujanos . 203 (2): 198–207. doi :10.1016/j.jamcollsurg.2006.04.009. PMID 16864033.
- ^ Lavigne E, Holowaty EJ, Pan SY, Villeneuve PJ, Johnson KC, Fergusson DA, et al. (abril de 2013). "Detección del cáncer de mama y supervivencia entre mujeres con implantes mamarios cosméticos: revisión sistemática y metaanálisis de estudios observacionales". BMJ . 346 (29 de abril 1): f2399. doi : 10.1136/bmj.f2399 . PMID 23637132.
- ^ Hwang ES, Lichtensztajn DY, Gomez SL, Fowble B, Clarke CA (abril de 2013). "Supervivencia después de lumpectomía y mastectomía para cáncer de mama invasivo en etapa temprana: el efecto de la edad y el estado del receptor hormonal". Cáncer . 119 (7): 1402–11. doi :10.1002/cncr.27795. PMC 3604076 . PMID 23359049.
- ^ ab "Eventos adversos relacionados con implantes mamarios durante la mamografía". Administración Federal de Medicamentos . 18 de enero de 2018. Archivado desde el original el 19 de septiembre de 2020.
- ^ Czerny V (1895). "Plastischer Ersatz der Brusthus durch ein Lipoma". Zentralblatt für Chirurgie . 27 : 72.
- ^ Glicenstein J (abril de 2007). "[Los primeros "rellenos", vaselina y parafina. Del milagro al desastre]". Annales de Chirurgie Plastique et Esthétique . 52 (2): 157–61. doi :10.1016/j.anplas.2006.05.003. PMID 16860452.
- ^ Comité del Instituto de Medicina (EE. UU.) sobre la seguridad de los implantes mamarios de silicona, Bondurant S, Ernster V, Herdman R, et al. (Comité de Seguridad de los Implantes Mamarios de Silicona) (1999). Bondurant S, Ernster V, Herdman R (eds.). Seguridad de los implantes mamarios de silicona. Instituto de Medicina. pag. 21. doi : 10.17226/9602. ISBN 0-309-06532-1. PMID 20669503. Archivado desde el original el 13 de marzo de 2007.
- ^ Anderson N (1997). "La ciencia de los litigios: lecciones de la controversia sobre los implantes mamarios de silicona". Revista de Derecho de la Facultad de Derecho de Nueva York . 41 (2): 401–07.
- ^ abcdefgh "Manual del consumidor de implantes mamarios de la FDA - 2004". Administración de Alimentos y Medicamentos . Archivado desde el original el 17 de septiembre de 2008.
- ^ Comité sobre la seguridad de los implantes mamarios de silicona del Instituto de Medicina (EE. UU.), Bondurant S, Ernster V, Herdman R (1999). Seguridad de los implantes mamarios de silicona - The National Academies Press . doi :10.17226/9602. ISBN 978-0-309-15740-7. Número de identificación personal 20669503.
{{cite book}}:|work=ignorado ( ayuda ) - ^ Grigg M, Bondurant S, Ernster VL, Herdman R (2000). Grigg M, Bondurant S, Ernster VL, Herdman R (eds.). Información para mujeres sobre la seguridad de los implantes mamarios de silicona - The National Academies Press . doi :10.17226/9618. ISBN 978-0-309-06593-1. Número de identificación personal 20669498.
{{cite book}}:|work=ignorado ( ayuda ) - ^ "Estudio de la FDA". Administración de Alimentos y Medicamentos . Archivado desde el original el 13 de enero de 2008.
- ^ "Aprobación de la FDA". fda.gov . Archivado desde el original el 30 de marzo de 2009 . Consultado el 28 de abril de 2018 .
- ^ "Aprobación de la FDA". fda.gov . Archivado desde el original el 26 de mayo de 2009 . Consultado el 28 de abril de 2018 .
- ^ "La FDA aprueba implantes mamarios rellenos de gel de silicona". FDA. Archivado desde el original el 26 de julio de 2008. Consultado el 1 de julio de 2008 .
- ^ "25 y 26 de marzo de 2019: Anuncio de la reunión del Panel de Dispositivos de Cirugía Plástica y General del Comité Asesor de Dispositivos Médicos". Administración de Alimentos y Medicamentos de los Estados Unidos . 25 de abril de 2019.
- ^ "La FDA solicita a Allergan que retire voluntariamente del mercado los implantes mamarios texturizados y expansores de tejido Natrelle BIOCELL para proteger a los pacientes: comunicado de seguridad de la FDA". Administración de Alimentos y Medicamentos de EE. UU . . 1 de junio de 2020.
- ^ ab "Preguntas y respuestas sobre implantes mamarios". Administración de Alimentos y Medicamentos de los Estados Unidos. Octubre de 2010. Archivado desde el original el 12 de noviembre de 2010.
Enlaces externos
- Artículo "Reconstrucción mamaria con implantes expansores" en Medscape
