Inmunoterapia
Este artículo tiene varios problemas. Ayúdenos a mejorarlo o a discutir estos problemas en la página de discusión . ( Aprenda cómo y cuándo eliminar estos mensajes )
|
| Inmunoterapia | |
|---|---|
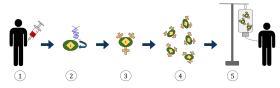 El diagrama anterior representa el proceso de la terapia de células T con receptores de antígenos quiméricos (CAR), un método de inmunoterapia que se está utilizando cada vez más en el tratamiento del cáncer. El resultado final debería ser la producción de células T equipadas que puedan reconocer y combatir las células cancerosas infectadas en el cuerpo.
| |
| Malla | D007167 |
| Código OPS-301 | 8-03 |
La inmunoterapia o terapia biológica es el tratamiento de enfermedades mediante la activación o supresión del sistema inmunológico . Las inmunoterapias diseñadas para provocar o amplificar una respuesta inmunitaria se clasifican como inmunoterapias de activación, mientras que las inmunoterapias que la reducen o suprimen se clasifican como inmunoterapias de supresión . La inmunoterapia se encuentra en fase de investigación preliminar por su potencial para tratar diversas formas de cáncer . [1] [2] [3] [4]
Las inmunoterapias basadas en células son eficaces para algunos tipos de cáncer. [5] [6] Las células efectoras inmunitarias, como los linfocitos , los macrófagos , las células dendríticas , las células asesinas naturales y los linfocitos T citotóxicos , trabajan juntas para defender al cuerpo contra el cáncer atacando a los antígenos anormales expresados en la superficie de las células tumorales. La inmunidad inducida por la vacuna contra la COVID-19 depende principalmente de una respuesta inmunomoduladora de las células T. [7]
Se han autorizado para uso médico terapias como el factor estimulante de colonias de granulocitos (G-CSF), los interferones , el imiquimod y las fracciones de membrana celular de bacterias . Otras terapias, como IL-2 , IL-7 , IL-12 , diversas quimiocinas , oligodesoxinucleótidos sintéticos de fosfato de citosina-guanosina (CpG) y glucanos , se encuentran en estudios clínicos y preclínicos.
Inmunomoduladores
Los inmunomoduladores son los agentes activos de la inmunoterapia. Se trata de una variedad de preparaciones recombinantes, sintéticas y naturales. [8]
| Clase | Agentes de ejemplo |
|---|---|
| Interleucinas | IL-2 , IL-7 , IL-12 |
| Citocinas | Interferones , G-CSF |
| Quimiocinas | CCL3 , CCL26 , CXCL7 |
| Fármacos imida inmunomoduladores (IMiD) | Talidomida y sus análogos ( lenalidomida , pomalidomida y apremilast ), vacuna BCG, [9] [10] y vacunas contra la Covid [11] [12] [7] |
| Otro | fosfato de citosina-guanosina, oligodesoxinucleótidos, glucanos |
Inmunoterapias de activación
Cáncer
El tratamiento del cáncer solía centrarse en matar o eliminar las células cancerosas y los tumores, con quimioterapia, cirugía o radiación. Estos tratamientos pueden ser muy eficaces y en muchos casos todavía se utilizan. En 2018, el Premio Nobel de Fisiología o Medicina fue otorgado a James P. Allison y Tasuku Honjo "por su descubrimiento de la terapia del cáncer mediante la inhibición de la regulación inmunitaria negativa". La inmunoterapia contra el cáncer intenta estimular el sistema inmunológico para destruir los tumores. Se utilizan diversas estrategias o se están investigando y probando. Se han publicado estudios controlados aleatorios en diferentes tipos de cáncer que dan como resultado un aumento significativo de la supervivencia y el período libre de enfermedad [2] y su eficacia aumenta entre un 20 y un 30 % cuando la inmunoterapia basada en células se combina con métodos de tratamiento convencionales. [2]
Una de las formas más antiguas de inmunoterapia contra el cáncer es el uso de la vacuna BCG , que originalmente se utilizó para vacunar contra la tuberculosis y que luego se descubrió que era útil en el tratamiento del cáncer de vejiga . [13] La inmunoterapia con BCG induce respuestas inmunitarias tanto locales como sistémicas. Los mecanismos por los cuales la inmunoterapia con BCG media la inmunidad tumoral han sido ampliamente estudiados, pero aún no se comprenden por completo. [14]
El uso de anticuerpos monoclonales en la terapia del cáncer se introdujo por primera vez en 1997 con rituximab , un anticuerpo anti-CD20 para el tratamiento del linfoma de células B. [15] Desde entonces, se han aprobado varios anticuerpos monoclonales para el tratamiento de diversas neoplasias hematológicas, así como para tumores sólidos. [16] [17]
La extracción de linfocitos G-CSF de la sangre y su expansión in vitro contra un antígeno tumoral antes de reinyectar las células con citocinas estimuladoras apropiadas . Las células luego destruyen las células tumorales que expresan el antígeno . [18] La inmunoterapia tópica utiliza una crema de mejora inmunológica ( imiquimod ) que produce interferón , lo que hace que las células T asesinas del receptor destruyan verrugas , [19] queratosis actínicas , cáncer de células basales , neoplasia intraepitelial vaginal , [20] cáncer de células escamosas, [21] [22] linfoma cutáneo, [23] y melanoma maligno superficial. [24] La inmunoterapia por inyección ("intralesional" o "intratumoral") utiliza paperas, cándida, la vacuna contra el VPH [25] [26] o inyecciones de antígeno tricofitina para tratar las verrugas (tumores inducidos por el VPH).
La transferencia de células adoptivas se ha probado en cáncer de pulmón [27] y otros tipos de cáncer, y el mayor éxito se ha logrado en el melanoma .
Cebado o vacunación con células dendríticas
Las células dendríticas (CD) pueden ser estimuladas para activar una respuesta citotóxica hacia un antígeno . Las células dendríticas, un tipo de célula presentadora de antígeno , se extraen de la persona que necesita la inmunoterapia. Luego, estas células se pulsan con un antígeno o lisado tumoral o se transfectan con un vector viral , lo que hace que muestren el antígeno. Tras la transfusión a la persona, estas células activadas presentan el antígeno a los linfocitos efectores ( células T auxiliares CD4+ , células T citotóxicas CD8+ y células B ). Esto inicia una respuesta citotóxica contra las células tumorales que expresan el antígeno (contra las cuales ahora se ha preparado la respuesta adaptativa). La primera inmunoterapia basada en células aprobada por la FDA, [28] la vacuna contra el cáncer Sipuleucel-T es un ejemplo de este enfoque. [29] La Corporación de Respuesta Inmunológica [30] (IRC) desarrolló esta inmunoterapia y licenció la tecnología a Dendreon, que obtuvo la autorización de la FDA.
Los enfoques actuales para la vacunación basada en DC se basan principalmente en la carga de antígeno en DC generadas in vitro a partir de monocitos o células CD34 +, activándolas con diferentes ligandos TLR , combinaciones de citocinas e inyectándolas nuevamente a los pacientes. Los enfoques de selección in vivo comprenden la administración de citocinas específicas (p. ej., Flt3L , GM-CSF ) y la selección de las DC con anticuerpos contra los receptores de lectina de tipo C o anticuerpos agonistas (p. ej., anti- CD40 ) que están conjugados con el antígeno de interés. Se están desarrollando activamente múltiples plataformas anti-CD40 de próxima generación. [31] Un enfoque futuro puede apuntar a subconjuntos de DC en función de sus receptores de lectina de tipo C o receptores de quimiocina expresados específicamente . Otro enfoque potencial es la generación de DC modificadas genéticamente a partir de células madre pluripotentes inducidas y el uso de DC cargadas con neoantígeno para inducir un mejor resultado clínico. [32]
Transferencia adoptiva de células T
La transferencia de células adoptivas in vitro cultiva células T autólogas extraídas para su posterior transfusión. [33]
Alternativamente, las células T modificadas genéticamente se crean mediante la recolección de células T y luego infectándolas con un retrovirus que contiene una copia de un gen del receptor de células T (TCR) que está especializado para reconocer antígenos tumorales. El virus integra el receptor en el genoma de las células T. Las células se expanden de forma no específica y/o se estimulan. Luego, las células se reinfunden y producen una respuesta inmunitaria contra las células tumorales. [34] La técnica se ha probado en melanomas metastásicos refractarios en estadio IV [33] y cáncer de piel avanzado . [35] [36] [37] El primer fármaco CAR-T aprobado por la FDA, Kymriah, utilizó este enfoque. Para obtener el suministro clínico y comercial de este CAR-T, Novartis compró la planta de fabricación, el sistema de distribución y contrató al equipo de producción que produjo Sipuleucel-T desarrollado por Dendreon y la Immune Response Corporation. [38]
Ya sea que las células T estén genéticamente modificadas o no, antes de la reinfusión, se requiere la linfodepleción del receptor para eliminar las células T reguladoras, así como los linfocitos endógenos no modificados que compiten con las células transferidas por las citocinas homeostáticas. [33] [39] [40] [41] La linfodepleción se puede lograr mediante quimioterapia mieloablativa , a la que se puede agregar irradiación corporal total para un mayor efecto. [42] Las células transferidas se multiplicaron in vivo y persistieron en la sangre periférica en muchas personas, a veces representando niveles del 75% de todas las células T CD8 + a los 6-12 meses después de la infusión. [43] A partir de 2012 [update], los ensayos clínicos para el melanoma metastásico estaban en curso en múltiples sitios. [44] Se observaron respuestas clínicas a la transferencia adoptiva de células T en pacientes con melanoma metastásico resistente a múltiples inmunoterapias. [45]
Inhibidores de puntos de control
Los anticuerpos anti-PD-1/PD-L1 y anti-CTLA-4 son los dos tipos de inhibidores de puntos de control disponibles actualmente para los pacientes. La aprobación de los anticuerpos anti-proteína 4 asociada a linfocitos T citotóxicos ( CTLA-4 ) y anti-proteína 1 de muerte celular programada ( PD-1 ) para uso humano ya ha dado como resultado mejoras significativas en los resultados de la enfermedad para varios tipos de cáncer. [46]
Aunque estas moléculas se descubrieron originalmente como moléculas que desempeñaban un papel en la activación de las células T o la apoptosis , investigaciones preclínicas posteriores demostraron su importante papel en el mantenimiento de la tolerancia inmunitaria periférica. [47]
Los inhibidores de puntos de control inmunitario están aprobados para tratar a algunos pacientes con una variedad de tipos de cáncer, incluidos melanoma , cáncer de mama , cáncer de vejiga , cáncer de cuello uterino , cáncer de colon , cáncer de pulmón , cáncer de cabeza y cuello o linfoma de Hodgkin . [48] [49]
Estas terapias han revolucionado la inmunoterapia contra el cáncer, ya que demostraron por primera vez en muchos años de investigación en el melanoma metastásico , que se considera uno de los cánceres humanos más inmunogénicos , una mejora en la supervivencia general, con un grupo cada vez mayor de pacientes que se benefician a largo plazo de estos tratamientos, aunque sigue siendo necesario tener precaución con subgrupos específicos. [47] [50] [51]
La próxima generación de inhibidores de puntos de control se dirige a otros receptores, como el gen 3 de activación de linfocitos ( LAG-3 ), el receptor de inmunoglobulina de células T y dominio de mucina 3 ( TIM3 ) y el receptor de inmunoglobulina de células T con dominios Ig e ITIM ( TIGIT ). Los anticuerpos contra estos receptores se han evaluado en estudios clínicos, pero aún no se han aprobado para su uso generalizado. [52]
Terapia de mejora inmunológica
La terapia de mejora inmunológica autóloga utiliza células asesinas naturales derivadas de la sangre periférica de una persona , linfocitos T citotóxicos, células epiteliales y otras células inmunes relevantes que se expanden in vitro y luego se vuelven a infundir. [53] La terapia se ha probado contra la hepatitis C , [54] [55] [56] el síndrome de fatiga crónica [57] [58] y la infección por HHV6 . [59]
Inmunoterapias de supresión
La supresión inmunitaria amortigua una respuesta inmunitaria anormal en enfermedades autoinmunes o reduce una respuesta inmunitaria normal para prevenir el rechazo de órganos o células trasplantados .
Medicamentos inmunosupresores
Los fármacos inmunosupresores se pueden utilizar para controlar el sistema inmunológico en el caso de trasplantes de órganos y enfermedades autoinmunes. Las respuestas inmunitarias dependen de la proliferación de linfocitos. La proliferación de linfocitos es la multiplicación de las células linfocitarias que se utilizan para combatir y recordar a los invasores extraños. [60] Los fármacos citostáticos son un tipo de fármaco inmunosupresor que ayuda a ralentizar el crecimiento de las células que se dividen rápidamente. Otro ejemplo de fármaco inmunosupresor son los glucocorticoides, que son inhibidores más específicos de la activación de los linfocitos. Los glucocorticoides funcionan emulando las acciones naturales de las glándulas suprarrenales del cuerpo para ayudar a suprimir el sistema inmunológico, lo que es útil en las enfermedades autoinmunes. [61] Alternativamente, los inhibidores de las inmunofilinas se dirigen más específicamente a la activación de los linfocitos T, el proceso por el cual los linfocitos T estimulan y comienzan a responder a un antígeno específico. [62] También existen anticuerpos inmunosupresores que se dirigen a los pasos de la respuesta inmunitaria para evitar que el cuerpo ataque sus tejidos, lo que es un problema en las enfermedades autoinmunes. [63] Existen varios otros medicamentos que modulan las respuestas inmunitarias y pueden usarse para inducir la regulación inmunitaria. Se observó en un ensayo preclínico que la regulación del sistema inmunológico por pequeñas moléculas inmunosupresoras como la vitamina D, la dexametasona y la curcumina podría ser útil para prevenir o tratar la inflación crónica. Dado que las moléculas se administran bajo un régimen de dosis baja y por vía subcutánea. Un estudio proporciona una demostración preclínica prometedora de la eficacia y la facilidad de preparación de inmunoliposomas cargados con valrubicina (Val-IL) como una nueva tecnología de nanopartículas para atacar a las células inmunosupresoras. Las Val-IL tienen el potencial de ser utilizadas como una terapia precisa y eficaz basada en la muerte celular dirigida a las células inmunosupresoras mediada por vesículas. [64]
Tolerancia inmunológica
El cuerpo no lanza naturalmente un ataque del sistema inmunológico contra sus propios tejidos. Los modelos generalmente identifican a las células T CD4+ como el centro de la respuesta autoinmune . La pérdida de tolerancia de las células T libera entonces a las células B y otras células efectoras inmunitarias sobre el tejido diana. La terapia tolerogénica ideal se dirigiría a los clones específicos de células T que coordinan el ataque autoinmune. [65]
Las terapias de tolerancia inmunitaria buscan restablecer el sistema inmunitario para que el cuerpo deje de atacar por error a sus propios órganos o células en una enfermedad autoinmunitaria o acepte tejido extraño en un trasplante de órganos . [66] Un enfoque terapéutico reciente [¿ cuándo? ] es la infusión de células inmunitarias reguladoras en los receptores de trasplantes. La transferencia de células inmunitarias reguladoras tiene el potencial de inhibir la actividad de los efectores. [67] [68]
La creación de tolerancia inmunitaria reduce o elimina la necesidad de inmunosupresión de por vida y los efectos secundarios asociados. Se ha probado en trasplantes, artritis reumatoide , diabetes tipo 1 y otros trastornos autoinmunes.
| Modalidad | Detalles | ||
|---|---|---|---|
| No específico del antígeno | Anticuerpos monoclonales | Agotando: | No agotable: |
| Trasplante de células madre hematopoyéticas | No mieloablativo | Mieloablativo | |
| Trasplante de células madre mesenquimales | |||
| Terapia con células T reguladoras | No específico del antígeno | Específico del antígeno | |
| Dosis bajas de IL-2 para expandir las células T reguladoras | |||
| Manipulación del microbioma | |||
| Antígeno específico | Terapia con péptidos | Subcutánea, intradérmica, transmucosa (oral, inhalada) Células dendríticas tolerogénicas, liposomas y nanopartículas | |
| Ligandos peptídicos alterados | |||
Inmunoterapia con alérgenos
La inmunoterapia también se puede utilizar para tratar las alergias . Mientras que los tratamientos para las alergias (como los antihistamínicos o los corticosteroides ) tratan los síntomas alérgicos, la inmunoterapia puede reducir la sensibilidad a los alérgenos , disminuyendo su gravedad. La inmunoterapia con alérgenos también puede denominarse desensibilización o hiposensibilización a los alérgenos. [71] La inmunoterapia puede producir beneficios a largo plazo. [72] La inmunoterapia es parcialmente eficaz en algunas personas e ineficaz en otras, pero ofrece a las personas con alergias la oportunidad de reducir o detener sus síntomas. [ cita requerida ]
La inmunoterapia subcutánea con alérgenos se introdujo por primera vez en 1911 a partir de la hipótesis de que las personas con fiebre del heno eran sensibles al polen de la hierba. Se desarrolló un proceso para crear un extracto extrayendo polen de fleo en agua destilada y luego hirviéndolo. Este se inyectaba a los pacientes en dosis cada vez mayores para ayudar a aliviar los síntomas. [73]
La inmunoterapia con alérgenos está indicada para personas extremadamente alérgicas o que no pueden evitar alérgenos específicos y cuando hay evidencia de una reacción mediada por IgE que se correlaciona con los síntomas del alérgeno. Estas reacciones mediadas por IgE se pueden identificar mediante una prueba de IgE en sangre o una prueba cutánea. Si un anticuerpo IgE específico es negativo, no hay evidencia de que la inmunoterapia con alérgenos sea efectiva para ese paciente.
Sin embargo, existen riesgos asociados con la inmunoterapia con alérgenos, ya que se trata de la administración de un agente al que se sabe que el paciente es altamente alérgico. Los pacientes tienen un mayor riesgo de sufrir anafilaxia mortal , reacción local en el lugar de la inyección o reacciones alérgicas sistémicas potencialmente mortales. [71]
Un método prometedor para tratar las alergias alimentarias es el uso de inmunoterapia oral (ITO). La ITO consiste en una exposición gradual a cantidades crecientes de alérgenos que puede llevar a que la mayoría de los sujetos toleren dosis de alimentos suficientes para prevenir una reacción en caso de exposición accidental. [74] Las dosis aumentan con el tiempo, a medida que la persona se vuelve desensibilizada. Esta técnica se ha probado en bebés para prevenir las alergias al maní. [75]
Terapias contra helmintos
Los huevos de tricocéfalo ( Trichuris suis ) y anquilostomas ( Necator americanus ) se han probado para enfermedades inmunológicas y alergias, y han demostrado ser beneficiosos en múltiples frentes, pero no se entiende completamente. Los científicos han descubierto que la respuesta inmune desencadenada por la excavación de larvas de anquilostomas para pasar a través de los pulmones y la sangre, por lo que la producción de mastocitos y anticuerpos específicos ahora están presentes. También reducen la inflamación o las respuestas vinculadas a las enfermedades autoinmunes, pero a pesar de esto, los efectos del anquilostoma se consideran negativos típicamente. [76] La terapia helmíntica se ha investigado como un tratamiento para la esclerosis múltiple remitente recurrente , [77] Crohn , [78] [79] [80] alergias y asma. [81] Si bien hay mucho que aprender sobre esto, muchos investigadores creen que el cambio en la respuesta inmune se debe a que los parásitos cambian a un sistema más antiinflamatorio o regulador, lo que a su vez disminuiría la inflamación y el daño inmunológico autoinfligido como se ve en la enfermedad de Crohn y la esclerosis múltiple. Específicamente, los pacientes con EM vieron tasas de recaída más bajas y síntomas más calmados en algunos casos cuando experimentaron con terapia helmíntica. [82] Los mecanismos hipotéticos incluyen la repolarización de la respuesta Th 1 / Th 2 [ 83] y la modulación de la función de las células dendríticas. [84] [85] Los helmintos regulan negativamente las citocinas proinflamatorias Th 1, interleucina-12 (IL-12), interferón-gamma (IFN-γ) y factor de necrosis tumoral alfa (TNF-α), al tiempo que promueven la producción de citocinas reguladoras Th 2 como IL-10 , IL-4 , IL-5 e IL-13 . [83] [86]
La coevolución con helmintos ha dado forma a algunos de los genes asociados con la expresión de interleucina y trastornos inmunológicos, como la enfermedad de Crohn , la colitis ulcerosa y la enfermedad celíaca . La relación de los helmintos con los humanos como huéspedes debe clasificarse como mutualista o simbiótica . [87] De alguna manera, la relación es simbiótica porque los propios gusanos necesitan al huésped (los humanos) para sobrevivir, porque este cuerpo les proporciona nutrientes y un hogar. Desde otra perspectiva, se podría razonar que es mutualista, siendo que la información anterior sobre los beneficios en los trastornos autoinmunes sigue siendo verdadera y respaldada. Además, algunos dicen que los gusanos pueden regular las bacterias intestinales. [88] Otra posibilidad es que se trate de una relación parasitaria, argumentando que los posibles riesgos de anemia y otros trastornos superan los beneficios, aunque esto está significativamente menos respaldado, siendo mucho más probable la investigación que alude al enfoque mutualista y simbiótico.
Véase también
- Modificador de la respuesta biológica
- Vacuna contra sepsis
- Inhibidor de puntos de control
- Inmunoterapia con interleucina-2
- Inmunoestimulante
- Microtrasplante
- Fotoinmunoterapia in vitro o in vivo [89] [90] [91] [92] [93] [94] [95]
Referencias
- ^ "Inmunoterapia | Memorial Sloan Kettering Cancer Center". mskcc.org . Archivado desde el original el 19 de octubre de 2019. Consultado el 27 de julio de 2017 .
- ^ abc Syn NL, Teng MW, Mok TS, Soo RA (diciembre de 2017). "Resistencia de novo y adquirida a la focalización de puntos de control inmunitario". The Lancet. Oncología . 18 (12): e731–e741. doi :10.1016/s1470-2045(17)30607-1. PMID 29208439.
- ^ Conforti L (febrero de 2012). "La red de canales iónicos en los linfocitos T, un objetivo para la inmunoterapia". Inmunología clínica . 142 (2): 105–106. doi :10.1016/j.clim.2011.11.009. PMID 22189042.
- ^ Wang S, Zimmermann S, Parikh K, Mansfield AS, Adjei AA (agosto de 2019). "Diagnóstico y tratamiento actuales del cáncer de pulmón de células pequeñas". Mayo Clinic Proceedings . 94 (8): 1599–1622. doi : 10.1016/j.mayocp.2019.01.034 . PMID 31378235.
- ^ Riley RS, June CH, Langer R, Mitchell MJ (marzo de 2019). "Tecnologías de administración para inmunoterapia contra el cáncer". Nature Reviews. Drug Discovery . 18 (3): 175–196. doi :10.1038/s41573-018-0006-z. PMC 6410566 . PMID 30622344.
- ^ Li Y, McBride DW, Tang Y, Doycheva D, Zhang JH, Tang Z (septiembre de 2023). "Inmunoterapia como tratamiento para el accidente cerebrovascular: utilización de células T reguladoras". Hemorragias cerebrales . 4 (3): 147–153. doi : 10.1016/j.hest.2023.02.003 . ISSN 2589-238X.
- ^ ab Geers D, Shamier MC, Bogers S, den Hartog G, Gommers L, Nieuwkoop NN, et al. (mayo de 2021). "Las variantes preocupantes del SARS-CoV-2 escapan parcialmente a las respuestas humorales pero no a las de las células T en los donantes convalecientes y vacunados de COVID-19". Science Immunology . 6 (59): eabj1750. doi : 10.1126/sciimmunol.abj1750 . PMC 9268159 . PMID 34035118.
- ^ Rizk JG, Kalantar-Zadeh K, Mehra MR, Lavie CJ, Rizk Y, Forthal DN (septiembre de 2020). "Terapia farmacoinmunomoduladora en COVID-19". Drugs . 80 (13): 1267–1292. doi : 10.1007/s40265-020-01367-z . PMC 7372203 . PMID 32696108.
- ^ "Inmunomoduladores y sus efectos secundarios". www.cancer.org . Archivado desde el original el 8 de abril de 2023 . Consultado el 6 de junio de 2021 .
- ^ Martino A, Casetti R, Poccia F (enero de 2007). "Mejora de la respuesta inmunitaria Th1 inducida por BCG a través de la activación de células T Vgamma9Vdelta2 con fármacos no peptídicos". Vaccine . 25 (6): 1023–1029. doi :10.1016/j.vaccine.2006.09.070. PMID 17118497.
- ^ Sahin U, Muik A, Derhovanessian E, Vogler I, Kranz LM, Vormehr M, et al. (octubre de 2020). "La vacuna contra la COVID-19 BNT162b1 genera respuestas de anticuerpos humanos y células T TH1". Nature . 586 (7830): 594–599. Bibcode :2020Natur.586..594S. doi : 10.1038/s41586-020-2814-7 . PMID 32998157.
- ^ Woldemeskel BA, Garliss CC, Blankson JN (mayo de 2021). "Las vacunas de ARNm del SARS-CoV-2 inducen respuestas amplias de células T CD4+ que reconocen las variantes del SARS-CoV-2 y el HCoV-NL63". The Journal of Clinical Investigation . 131 (10). doi :10.1172/JCI149335. PMC 8121504 . PMID 33822770.
- ^ Fuge O, Vasdev N , Allchorne P, Green JS (2015). "Inmunoterapia para el cáncer de vejiga". Investigación e informes en urología . 7 : 65–79. doi : 10.2147/RRU.S63447 . PMC 4427258. PMID 26000263 .
- ^ Pettenati C, Ingersoll MA (octubre de 2018). "Mecanismos de la inmunoterapia con BCG y sus perspectivas para el cáncer de vejiga". Nature Reviews. Urología . 15 (10): 615–625. doi :10.1038/s41585-018-0055-4. PMID 29991725. S2CID 49670901.
- ^ Salles G, Barrett M, Foà R, Maurer J, O'Brien S, Valente N, et al. (octubre de 2017). "Rituximab en neoplasias hematológicas de células B: una revisión de 20 años de experiencia clínica". Avances en terapia . 34 (10): 2232–2273. doi : 10.1007/s12325-017-0612-x . PMC 5656728 . PMID 28983798.
- ^ Hoos A (abril de 2016). "Desarrollo de fármacos inmunooncológicos: desde CTLA4 hasta PD1 y las próximas generaciones". Nature Reviews. Drug Discovery . 15 (4): 235–247. doi :10.1038/nrd.2015.35. PMID 26965203. S2CID 54550859.
- ^ Pento JT (noviembre de 2017). "Anticuerpos monoclonales para el tratamiento del cáncer". Anticancer Research . 37 (11): 5935–5939. doi : 10.21873/anticanres.12040 . PMC 3288558 . PMID 29061772.
- ^ Simpson RJ, Bigley AB, Agha N, Hanley PJ, Bollard CM (julio de 2017). "Movilización de células inmunes con ejercicio para la inmunoterapia contra el cáncer". Reseñas de ciencias del deporte y el ejercicio . 45 (3): 163–172. doi :10.1249/JES.0000000000000114. PMC 6814300. PMID 28418996 .
- ^ van Seters M, van Beurden M, ten Kate FJ, Beckmann I, Ewing PC, Eijkemans MJ, et al. (abril de 2008). "Tratamiento de la neoplasia intraepitelial vulvar con imiquimod tópico". The New England Journal of Medicine . 358 (14): 1465–1473. doi : 10.1056/NEJMoa072685 . PMID 18385498.
- ^ Buck HW, Guth KJ (octubre de 2003). "Tratamiento de la neoplasia intraepitelial vaginal (principalmente de bajo grado) con crema de imiquimod al 5%". Journal of Lower Genital Tract Disease . 7 (4): 290–293. doi :10.1097/00128360-200310000-00011. PMID 17051086. S2CID 44649376.
- ^ Järvinen R, Kaasinen E, Sankila A, Rintala E (agosto de 2009). "Eficacia a largo plazo de la terapia de mantenimiento con bacilo de Calmette-Guérin frente a la terapia de mantenimiento con instilación de mitomicina C en tumores TaT1 frecuentemente recurrentes sin carcinoma in situ: un análisis de subgrupos del estudio prospectivo y aleatorizado FinnBladder I con un seguimiento de 20 años". Urología Europea . 56 (2): 260–265. doi :10.1016/j.eururo.2009.04.009. PMID 19395154.
- ^ Davidson HC, Leibowitz MS, Lopez-Albaitero A, Ferris RL (septiembre de 2009). "Inmunoterapia para el cáncer de cabeza y cuello". Oral Oncology . 45 (9): 747–751. doi :10.1016/j.oraloncology.2009.02.009. PMC 8978306 . PMID 19442565.
- ^ Dani T, Knobler R (enero de 2009). "Fotoinmunoterapia extracorpórea-fotoféresis". Frontiers in Bioscience . 14 (14): 4769–4777. doi : 10.2741/3566 . PMID 19273388.
- ^ Eggermont AM, Schadendorf D (junio de 2009). "Melanoma e inmunoterapia". Clínicas de hematología y oncología de Norteamérica . 23 (3): 547–64, ix–x. doi :10.1016/j.hoc.2009.03.009. PMID 19464602.
- ^ Chuang CM, Monie A, Wu A, Hung CF (mayo de 2009). "La combinación del tratamiento con apigenina con la vacunación terapéutica con ADN del VPH genera efectos antitumorales terapéuticos mejorados". Journal of Biomedical Science . 16 (1): 49. doi : 10.1186/1423-0127-16-49 . PMC 2705346 . PMID 19473507.
- ^ Pawlita M, Gissmann L (abril de 2009). "[Papilomatosis respiratoria recurrente: ¿indicación de vacunación contra el VPH?]". Deutsche Medizinische Wochenschrift (en alemán). 134 (Suplemento 2): S100–S102. doi :10.1055/s-0029-1220219. PMID 19353471. S2CID 206295083.
- ^ Kang N, Zhou J, Zhang T, Wang L, Lu F, Cui Y, et al. (agosto de 2009). "Inmunoterapia adoptiva del cáncer de pulmón con células T gammadelta humanas expandidas con anticuerpos anti-TCRgammadelta inmovilizadas en sangre periférica". Cancer Biology & Therapy . 8 (16): 1540–1549. doi :10.4161/cbt.8.16.8950. PMID 19471115. S2CID 23222462.
- ^ Cheever MA, Higano CS (junio de 2011). "PROVENGE (Sipuleucel-T) en el cáncer de próstata: la primera vacuna terapéutica contra el cáncer aprobada por la FDA". Clinical Cancer Research . 17 (11): 3520–3526. doi : 10.1158/1078-0432.CCR-10-3126 . PMID 21471425. S2CID 135120.
- ^ Di Lorenzo G, Buonerba C, Kantoff PW (mayo de 2011). "Inmunoterapia para el tratamiento del cáncer de próstata". Nature Reviews. Oncología clínica . 8 (9): 551–561. doi :10.1038/nrclinonc.2011.72. PMID 21606971. S2CID 5337484.
- ^ "Sipuleucel-T: APC 8015, APC-8015, vacuna contra el cáncer de próstata--Dendreon". Medicamentos en I+D . 7 (3): 197–201. 2006. doi :10.2165/00126839-200607030-00006. PMID 16752945. S2CID 6427074.
- ^ Andersson H, Nyesiga B, Hermodsson T, Enell Smith K, Hägerbrand K, Lindstedt M, et al. (mayo de 2024). "Agonistas de CD40 de próxima generación para inmunoterapia contra el cáncer". Opinión de expertos sobre terapia biológica . 24 (5): 351–363. doi : 10.1080/14712598.2024.2357714 . PMID 38764393.
- ^ Sabado RL, Balan S, Bhardwaj N (enero de 2017). "Inmunoterapia basada en células dendríticas". Cell Research . 27 (1): 74–95. doi :10.1038/cr.2016.157. PMC 5223236 . PMID 28025976.
- ^ abc Rosenberg SA, Restifo NP, Yang JC, Morgan RA, Dudley ME (abril de 2008). "Transferencia de células adoptivas: un camino clínico hacia una inmunoterapia eficaz contra el cáncer". Nature Reviews. Cancer . 8 (4): 299–308. doi :10.1038/nrc2355. PMC 2553205 . PMID 18354418.
- ^ Morgan RA, Dudley ME, Wunderlich JR, Hughes MS, Yang JC, Sherry RM, et al. (octubre de 2006). "Regresión del cáncer en pacientes tras la transferencia de linfocitos modificados genéticamente". Science . 314 (5796): 126–129. Bibcode :2006Sci...314..126M. doi :10.1126/science.1129003. PMC 2267026 . PMID 16946036.
- ^ Hunder NN, Wallen H, Cao J, Hendricks DW, Reilly JZ, Rodmyre R, et al. (junio de 2008). "Tratamiento del melanoma metastásico con células T CD4+ autólogas contra NY-ESO-1". The New England Journal of Medicine . 358 (25): 2698–2703. doi :10.1056/NEJMoa0800251. PMC 3277288 . PMID 18565862.
- ^ "Programa y ponentes del simposio de 2008". Instituto de Investigación del Cáncer. Archivado desde el original el 15 de octubre de 2008.
- ^ Highfield R (18 de junio de 2008). «Un paciente con cáncer se recupera tras una inyección de células inmunitarias». The Telegraph . Archivado desde el original el 12 de septiembre de 2008. Consultado el 22 de diciembre de 2019 .
- ^ "Actualizado: Novartis compra la planta de Dendreon en Nueva Jersey". Fierce Pharma . 20 de diciembre de 2012. Archivado desde el original el 2023-06-07 . Consultado el 2021-12-09 .
- ^ Antony PA, Piccirillo CA, Akpinarli A, Finkelstein SE, Speiss PJ, Surman DR, et al. (marzo de 2005). "La inmunidad de las células T CD8+ contra un tumor/autoantígeno se ve aumentada por las células T auxiliares CD4+ y obstaculizada por las células T reguladoras naturales". Journal of Immunology . 174 (5): 2591–2601. doi :10.4049/jimmunol.174.5.2591. PMC 1403291 . PMID 15728465.
- ^ Gattinoni L, Finkelstein SE, Klebanoff CA, Antony PA, Palmer DC, Spiess PJ, et al. (octubre de 2005). "La eliminación de los sumideros de citocinas homeostáticas mediante linfodepleción mejora la eficacia de las células T CD8+ específicas de tumores transferidas de forma adoptiva". The Journal of Experimental Medicine . 202 (7): 907–912. doi :10.1084/jem.20050732. PMC 1397916 . PMID 16203864.
- ^ Dummer W, Niethammer AG, Baccala R, Lawson BR, Wagner N, Reisfeld RA, et al. (julio de 2002). "La proliferación homeostática de células T genera autoinmunidad antitumoral eficaz". The Journal of Clinical Investigation . 110 (2): 185–192. doi :10.1172/JCI15175. PMC 151053 . PMID 12122110.
- ^ Dudley ME, Yang JC, Sherry R, Hughes MS, Royal R, Kammula U, et al. (noviembre de 2008). "Terapia celular adoptiva para pacientes con melanoma metastásico: evaluación de regímenes preparatorios de quimiorradiación mieloablativa intensiva". Journal of Clinical Oncology . 26 (32): 5233–5239. doi :10.1200/JCO.2008.16.5449. PMC 2652090 . PMID 18809613.
- ^ Dudley ME, Wunderlich JR, Robbins PF, Yang JC, Hwu P, Schwartzentruber DJ, et al. (octubre de 2002). "Regresión del cáncer y autoinmunidad en pacientes después de la repoblación clonal con linfocitos antitumorales". Science . 298 (5594): 850–854. Bibcode :2002Sci...298..850D. doi :10.1126/science.1076514. PMC 1764179 . PMID 12242449.
- ^ Pilon-Thomas S, Kuhn L, Ellwanger S, Janssen W, Royster E, Marzban S, et al. (octubre de 2012). "Eficacia de la transferencia celular adoptiva de linfocitos infiltrantes de tumores después de la inducción de linfopenia para el melanoma metastásico". Journal of Immunotherapy . 35 (8): 615–620. doi :10.1097/CJI.0b013e31826e8f5f. PMC 4467830 . PMID 22996367.
- ^ Andersen R, Borch TH, Draghi A, Gokuldass A, Rana MA, Pedersen M, et al. (julio de 2018). "Las células T aisladas de pacientes con melanoma resistente a inhibidores de puntos de control son funcionales y pueden mediar la regresión tumoral". Anales de Oncología . 29 (7): 1575–1581. doi : 10.1093/annonc/mdy139 . PMID 29688262.
- ^ Seidel JA, Otsuka A, Kabashima K (28 de marzo de 2018). "Terapias anti-PD-1 y anti-CTLA-4 en el cáncer: mecanismos de acción, eficacia y limitaciones". Frontiers in Oncology . 8 : 86. doi : 10.3389/fonc.2018.00086 . PMC 5883082 . PMID 29644214.
- ^ ab Haanen JB, Robert C (2015). "Inhibidores de puntos de control inmunológico". Avances en la investigación de tumores . 42 : 55–66. doi :10.1159/000437178. ISBN 978-3-318-05589-4. Número de identificación personal 26382943.
- ^ "Inhibidores de puntos de control inmunitario - Instituto Nacional del Cáncer". Instituto Nacional del Cáncer . 2019-09-24. Archivado desde el original el 2023-10-22 . Consultado el 2020-08-24 .
- ^ "Inmunoterapia según el tipo de cáncer". Instituto de Investigación del Cáncer .
- ^ Queirolo P, Boutros A, Tanda E, Spagnolo F, Quaglino P (diciembre de 2019). "Inhibidores de puntos de control inmunitario para el tratamiento del melanoma metastásico: un modelo de inmunoterapia contra el cáncer". Seminarios en biología del cáncer . 59 : 290–297. doi :10.1016/j.semcancer.2019.08.001. hdl : 2318/1717353 . PMID: 31430555.
- ^ Moyers JT, Glitza Oliva IC (2021). "Inmunoterapia para el melanoma". Inmunoterapia . Avances en medicina experimental y biología. Vol. 1342. págs. 81–111. doi :10.1007/978-3-030-79308-1_3. ISBN 978-3-030-79307-4. Número PMID 34972963.
- ^ Cai L, Li Y, Tan J, Xu L, Li Y (septiembre de 2023). "Dirigidos a LAG-3, TIM-3 y TIGIT para la inmunoterapia contra el cáncer". Revista de hematología y oncología . 16 (1): 101. doi : 10.1186/s13045-023-01499-1 . PMC 10478462 . PMID 37670328.
- ^ Manjunath SR, Ramanan G, Dedeepiya VD, Terunuma H, Deng X, Baskar S, et al. (enero de 2012). "Terapia de mejora inmunitaria autóloga en el cáncer de ovario recurrente con metástasis: informe de un caso". Informes de casos en oncología . 5 (1): 114–118. doi :10.1159/000337319. PMC 3364094 . PMID 22666198.
- ^ Li Y, Zhang T, Ho C, Orange JS, Douglas SD, Ho WZ (diciembre de 2004). "Las células asesinas naturales inhiben la expresión del virus de la hepatitis C". Journal of Leukocyte Biology . 76 (6): 1171–1179. doi : 10.1189/jlb.0604372 . PMID 15339939.
- ^ Doskali M, Tanaka Y, Ohira M, Ishiyama K, Tashiro H, Chayama K, et al. (marzo de 2011). "Posibilidad de inmunoterapia adoptiva con células CD3 − CD56+ y CD3+CD56+ derivadas de sangre periférica para inducir actividad anticarcinoma hepatocelular y antivirus de la hepatitis C". Journal of Immunotherapy . 34 (2): 129–138. doi :10.1097/CJI.0b013e3182048c4e. PMID 21304407. S2CID 26385818.
- ^ Terunuma H, Deng X, Dewan Z, Fujimoto S, Yamamoto N (2008). "Potencial papel de las células NK en la inducción de respuestas inmunitarias: implicaciones para la inmunoterapia basada en células NK para cánceres e infecciones virales". Reseñas internacionales de inmunología . 27 (3): 93–110. doi :10.1080/08830180801911743. PMID 18437601. S2CID 27557213.
- ^ Véase DM, Tilles JG (1996). "Tratamiento con interferón alfa de pacientes con síndrome de fatiga crónica". Investigaciones inmunológicas . 25 (1–2): 153–164. doi :10.3109/08820139609059298. PMID 8675231.
- ^ Ojo-Amaize EA, Conley EJ, Peter JB (enero de 1994). "La disminución de la actividad de las células asesinas naturales se asocia con la gravedad del síndrome de disfunción inmunitaria por fatiga crónica". Clinical Infectious Diseases . 18 (Supl 1): S157–S159. doi :10.1093/clinids/18.Supplement_1.S157. PMID 8148445.
- ^ Kida K, Isozumi R, Ito M (diciembre de 2000). "Muerte de células infectadas por el virus del herpes humano tipo 6 por linfocitos cultivados con interleucina-2 o -12". Pediatrics International . 42 (6): 631–636. doi :10.1046/j.1442-200x.2000.01315.x. PMID 11192519. S2CID 11297558.
- ^ "Proliferación de linfocitos: una descripción general | Temas de ScienceDirect" www.sciencedirect.com . Consultado el 10 de mayo de 2024 .
- ^ "Proliferación de linfocitos: una descripción general | Temas de ScienceDirect" www.sciencedirect.com . Consultado el 10 de mayo de 2024 .
- ^ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (31 de diciembre de 2007). Biología molecular de la célula . doi :10.1201/9780203833445. ISBN 978-0-203-83344-5.
- ^ Qian Y, Dupps WJ, Meisler DM, Jeng BH (2010). "Desbridamiento epitelial para anomalías de la membrana basal epitelial asociadas con trastornos endoteliales". Revista Europea de Oftalmología . 04 (1): 70. doi :10.17925/eor.2010.04.01.70. ISSN 1756-1795.
- ^ Georgievski A, Bellaye PS, Tournier B, Choubley H, Pais de Barros JP, Herbst M, et al. (mayo de 2024). "Inmunoliposomas cargados con valrubicina para la muerte celular mediada por vesículas específicas en el tratamiento de cánceres hematológicos". Cell Death Dis . 15 (15(5):328): 328. doi :10.1038/s41419-024-06715-5. PMC 11088660 . PMID 38734740.
- ^ ab Rayner F, Isaacs JD (diciembre de 2018). "Tolerancia terapéutica en enfermedades autoinmunes". Seminarios sobre artritis y reumatismo . 48 (3): 558–562. doi :10.1016/j.semarthrit.2018.09.008. PMID 30348449. S2CID 53034800.
- ^ Rotrosen D, Matthews JB, Bluestone JA (julio de 2002). "La red de tolerancia inmunitaria: un nuevo paradigma para el desarrollo de terapias que inducen tolerancia". The Journal of Allergy and Clinical Immunology . 110 (1): 17–23. doi : 10.1067/mai.2002.124258 . PMID 12110811. S2CID 30884739.
- ^ Stolp J, Zaitsu M, Wood KJ (2019). "Tolerancia inmunológica y rechazo en el trasplante de órganos". Tolerancia inmunológica . Métodos en biología molecular. Vol. 1899. págs. 159-180. doi :10.1007/978-1-4939-8938-6_12. ISBN . 978-1-4939-8936-2. Número de identificación personal 30649772. Número de identificación personal 58542057.
- ^ McMurchy AN, Bushell A, Levings MK, Wood KJ (agosto de 2011). "Avanzando hacia la tolerancia: aplicación clínica de las células T reguladoras". Seminarios en inmunología . Avances en trasplantes. 23 (4): 304–313. doi : 10.1016 /j.smim.2011.04.001. PMC 3836227. PMID 21620722.
- ^ Baker KF, Isaacs JD (marzo de 2014). "Perspectivas de tolerancia terapéutica en humanos". Current Opinion in Rheumatology . 26 (2): 219–227. doi :10.1097/BOR.0000000000000029. PMC 4640179 . PMID 24378931.
- ^ Cooles FA, Isaacs JD (agosto de 2010). "Tratamiento para restablecer la tolerancia en la artritis inflamatoria: lecciones de otras enfermedades". Mejores prácticas e investigación. Reumatología clínica . Farmacoterapia: conceptos de patogénesis y tratamientos emergentes. 24 (4): 497–511. doi :10.1016/j.berh.2010.01.007. PMID 20732648.
- ^ ab Persaud Y, Memon RJ, Savliwala MN (2024). "Inmunoterapia para la alergia". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 30570988 . Consultado el 10 de mayo de 2024 .
- ^ Durham SR, Walker SM, Varga EM, Jacobson MR, O'Brien F, Noble W, et al. (agosto de 1999). "Eficacia clínica a largo plazo de la inmunoterapia con polen de gramíneas". The New England Journal of Medicine . 341 (7): 468–475. doi : 10.1056/NEJM199908123410702 . PMID 10441602. S2CID 14629112.
- ^ James C, Bernstein DI (febrero de 2017). "Inmunoterapia con alérgenos: una revisión actualizada de la seguridad". Current Opinion in Allergy & Clinical Immunology . 17 (1): 55–59. doi :10.1097/ACI.0000000000000335. ISSN 1528-4050. PMC 5644500 . PMID 27906697.
- ^ MacGinnitie AJ, Rachid R, Gragg H, Little SV, Lakin P, Cianferoni A, et al. (marzo de 2017). "El omalizumab facilita la desensibilización oral rápida para la alergia al maní". The Journal of Allergy and Clinical Immunology . 139 (3): 873–881.e8. doi : 10.1016/j.jaci.2016.08.010 . PMC 5369605 . PMID 27609658. S2CID 3626708.
- ^ "Inmunoterapia oral para la alergia al maní en niños pequeños". Institutos Nacionales de Salud (NIH) . 2022-02-07. Archivado desde el original el 2023-07-12 . Consultado el 2022-06-06 .
- ^ Loukas A, Prociv P (octubre de 2001). "Respuestas inmunitarias en infecciones por anquilostomas". Clinical Microbiology Reviews . 14 (4): 689–703, índice. doi :10.1128/CMR.14.4.689-703.2001. PMC 89000 . PMID 11585781.
- ^ Correale J, Farez M (febrero de 2007). "Asociación entre la infección parasitaria y las respuestas inmunitarias en la esclerosis múltiple". Anales de neurología . 61 (2): 97–108. doi :10.1002/ana.21067. PMID 17230481. S2CID 1033417.
- ^ Croese J, O'neil J, Masson J, Cooke S, Melrose W, Pritchard D, et al. (enero de 2006). "Un estudio de prueba de concepto que establece Necator americanus en pacientes con enfermedad de Crohn y donantes de reservorios". Gut . 55 (1): 136–137. doi :10.1136/gut.2005.079129. PMC 1856386 . PMID 16344586.
- ^ Reddy A, Fried B (enero de 2009). "Una actualización sobre el uso de helmintos para tratar la enfermedad de Crohn y otras enfermedades autoinmunes". Parasitology Research . 104 (2): 217–221. doi :10.1007/s00436-008-1297-5. PMID 19050918. S2CID 19279688.
- ^ Laclotte C, Oussalah A, Rey P, Bensenane M, Pluvinage N, Chevaux JB, et al. (Diciembre de 2008). "[Gelmintos y enfermedades inflamatorias intestinales]". Gastroenterologie Clinique et Biologique (en francés). 32 (12): 1064-1074. doi :10.1016/j.gcb.2008.04.030. PMID 18619749.
- ^ Zaccone P, Fehervari Z, Phillips JM, Dunne DW, Cooke A (octubre de 2006). "Gusanos parásitos y enfermedades inflamatorias". Inmunología parasitaria . 28 (10): 515–523. doi :10.1111/j.1365-3024.2006.00879.x. PMC 1618732 . PMID 16965287.
- ^ Donkers SJ, Kirkland MC, Charabati M, Osborne LC (2020). "Perspectivas de las personas con esclerosis múltiple sobre la inmunoterapia con helmintos". Revista internacional de atención de la EM . 22 (1): 43–51. doi :10.7224/1537-2073.2019-044. PMC 7041615 . PMID 32123528.
- ^ ab Brooker S, Bethony J, Hotez PJ (2004). "Infección humana por anquilostomas en el siglo XXI". Advances in Parasitology . 58 : 197–288. doi :10.1016/S0065-308X(04)58004-1. ISBN 9780120317585. PMC 2268732 . PMID 15603764.
- ^ Fujiwara RT, Cançado GG, Freitas PA, Santiago HC, Massara CL, Dos Santos Carvalho O, et al. (2009). "Infección por Necator americanus: una posible causa de la diferenciación de células dendríticas y el perfil de eosinófilos alterados en individuos con infección crónica". PLOS Neglected Tropical Diseases . 3 (3): e399. doi : 10.1371/journal.pntd.0000399 . PMC 2654967 . PMID 19308259.
- ^ Carvalho L, Sun J, Kane C, Marshall F, Krawczyk C, Pearce EJ (enero de 2009). "Serie de revisiones sobre helmintos, modulación inmunitaria y la hipótesis de la higiene: mecanismos subyacentes a la modulación de la función de las células dendríticas por parte de los helmintos". Inmunología . 126 (1): 28–34. doi :10.1111/j.1365-2567.2008.03008.x. PMC 2632707 . PMID 19120496.
- ^ Fumagalli M, Pozzoli U, Cagliani R, Comi GP, Riva S, Clerici M, et al. (junio de 2009). "Los parásitos representan una importante fuerza selectiva para los genes de interleucina y dan forma a la predisposición genética a las enfermedades autoinmunes". The Journal of Experimental Medicine . 206 (6): 1395–1408. doi :10.1084/jem.20082779. PMC 2715056 . PMID 19468064.
- ^ Reynolds LA, Finlay BB, Maizels RM (noviembre de 2015). "Cohabitación en el intestino: interacciones entre parásitos helmintos, microbiota bacteriana e inmunidad del huésped". Journal of Immunology . 195 (9): 4059–4066. doi :10.4049/jimmunol.1501432. PMC 4617609 . PMID 26477048.
- ^ Loke P, Lim YA (junio de 2015). "Helmintos y la microbiota: partes de la hipótesis de la higiene". Inmunología de parásitos . 37 (6): 314–23. doi :10.1111/pim.12193. PMC 4428757 . PMID 25869420.
- ^ Hong CH, Tang MR, Hsu SH, Yang CH, Tseng CS, Ko YC, et al. (septiembre de 2019). "Respuesta inmunitaria temprana mejorada de la proteína de membrana externa de leptospiras LipL32 estimulada por exposición a infrarrojos medios de banda estrecha". Revista de fotoquímica y fotobiología. B, Biología . 198 : 111560. Bibcode :2019JPPB..19811560H. doi :10.1016/j.jphotobiol.2019.111560. PMID 31336216. S2CID 198191485.
- ^ Chang HY, Li MH, Huang TC, Hsu CL, Tsai SR, Lee SC, et al. (febrero de 2015). "La proteómica cuantitativa revela redes interferidas por radiación infrarroja media en células de cáncer de mama". Journal of Proteome Research . 14 (2): 1250–1262. doi :10.1021/pr5011873. PMID 25556991.
- ^ Nagaya T, Okuyama S, Ogata F, Maruoka Y, Choyke PL, Kobayashi H (mayo de 2019). "Fotoinmunoterapia de infrarrojo cercano utilizando un difusor de fibra óptica para el tratamiento de la diseminación del cáncer gástrico peritoneal". Cáncer gástrico . 22 (3): 463–472. doi : 10.1007/s10120-018-0871-5 . PMC 7400986. PMID 30171392 .
- ^ Mitsunaga M, Ogawa M, Kosaka N, Rosenblum LT, Choyke PL, Kobayashi H (noviembre de 2011). "Fotoinmunoterapia infrarroja cercana in vivo selectiva para células cancerosas dirigida a moléculas de membrana específicas". Nature Medicine . 17 (12): 1685–1691. doi :10.1038/nm.2554. PMC 3233641 . PMID 22057348.
- ^ Sato K, Sato N, Xu B, Nakamura Y, Nagaya T, Choyke PL, et al. (agosto de 2016). "Depleción selectiva espacial de células T reguladoras asociadas a tumores con fotoinmunoterapia de infrarrojo cercano". Science Translational Medicine . 8 (352): 352ra110. doi : 10.1126/scitranslmed.aaf6843 . PMC 7780242 . PMID 27535621.
- ^ Nagaya T, Nakamura Y, Sato K, Harada T, Choyke PL, Kobayashi H (junio de 2016). "Microdistribución mejorada de conjugados anticuerpo-absorbente de fotones después de la fotoinmunoterapia inicial de infrarrojo cercano (NIR-PIT)". Journal of Controlled Release . 232 : 1–8. doi :10.1016/j.jconrel.2016.04.003. PMC 4893891 . PMID 27059723.
- ^ Zhen Z, Tang W, Wang M, Zhou S, Wang H, Wu Z, et al. (febrero de 2017). "Fotoinmunoterapia dirigida a proteínas de activación de fibroblastos mediada por nanojaulas de proteínas para mejorar la infiltración de células T citotóxicas y el control tumoral". Nano Letters . 17 (2): 862–869. Bibcode :2017NanoL..17..862Z. doi :10.1021/acs.nanolett.6b04150. PMID 28027646.
Enlaces externos
- Langreth R (12 de febrero de 2009). "Milagros contra el cáncer". Forbes .
- Sociedad Internacional de Terapia Biológica del Cáncer
- Simposios anuales internacionales sobre inmunoterapia contra el cáncer del Instituto de Investigación del Cáncer
- La historia detrás del innovador viaje celular de la inmunoterapia





