Síndrome del bebé azul
| Síndrome del bebé azul | |
|---|---|
| Otros nombres | Bebé azul, lactante cianótico, bebé cianótico, recién nacido cianótico |
 | |
| Un recién nacido cianótico o "bebé azul". Nótese la coloración azul de las puntas de los dedos. | |
| Especialidad | Pediatría , cirugía cardíaca |
El síndrome del bebé azul puede referirse a afecciones que causan cianosis, o coloración azulada de la piel, en los bebés como resultado de niveles bajos de oxígeno en la sangre. Este término se ha aplicado tradicionalmente a la cianosis como resultado de: [1]
- Cardiopatía cianótica , que es una categoría de defecto cardíaco congénito que produce niveles bajos de oxígeno en la sangre. [2] Esto puede ser causado por una reducción del flujo sanguíneo a los pulmones o por una mezcla de sangre oxigenada y desoxigenada. [2]
- Metahemoglobinemia , que es una enfermedad caracterizada por niveles elevados de metahemoglobina en la sangre. Los niveles elevados de metahemoglobina impiden que el oxígeno se libere a los tejidos y dan lugar a hipoxemia. [3]
Aunque estas son las causas más comunes de cianosis, existen otros factores potenciales que pueden causar un tinte azul en la piel o las mucosas de un bebé. Estos factores incluyen hipoventilación, diferencias de perfusión o ventilación en los pulmones y bajo gasto cardíaco de sangre oxigenada, entre otros. El síndrome del bebé azul o cianosis ocurre cuando la cantidad absoluta de hemoglobina desoxigenada > 3 g/dl, lo que típicamente se refleja en una saturación de O 2 de < 85 %. [1]
Ambas afecciones causan cianosis , o una coloración azulada de la piel o las membranas mucosas. [4] Normalmente, la sangre oxigenada se ve roja y la sangre desoxigenada tiene un aspecto más azul. [5] En los bebés con niveles bajos de oxígeno o una mezcla de sangre oxigenada y desoxigenada, la sangre puede tener un color azul o morado, lo que provoca cianosis. [6]
Signos y síntomas
El síntoma principal del síndrome del bebé azul es la cianosis. Según la causa subyacente de la cianosis, pueden aparecer síntomas adicionales: [7]
- Retraso en el crecimiento
- Letargo
- Aleteo nasal
- Latidos cardíacos rápidos
- Frecuencia respiratoria rápida
- Convulsiones
- Dificultad para respirar
Causas
El síndrome del bebé azul se ha atribuido a cardiopatías congénitas cianóticas y metahemoglobinemia, sin embargo, existen causas adicionales que podrían provocar que un bebé se vuelva cianótico, como: [8]
- Obstrucción de las vías respiratorias
- Disminución de la perfusión sanguínea
- Trastornos del control de la respiración (por ejemplo, episodios de apnea cianótica, convulsiones)
- Trastornos pulmonares (p. ej., hipertensión pulmonar, fibrosis quística)
- Síndrome de dificultad respiratoria [9]
Mecanismo
Enfermedad cardíaca cianótica
Ciertos tipos específicos de defectos cardíacos congénitos que hacen que la sangre pase directamente del lado derecho del corazón al lado izquierdo provocan cianosis. [10] En estos defectos, parte de la sangre que se bombea al cuerpo no ha sido oxigenada por los pulmones y, por lo tanto, aparecerá más azul. Los bebés con estos tipos de defectos cardíacos pueden tener un tinte azulado constante en la piel o pueden tener episodios temporales de cianosis. El grado de cianosis depende de la cantidad de sangre desoxigenada que se mezcla con sangre oxigenada antes de ser bombeada al cuerpo.
Las enfermedades cardíacas en las que hay una disminución del flujo sanguíneo a los pulmones, como la tetralogía de Fallot o la atresia de la válvula pulmonar, dan como resultado una menor oxigenación de la sangre. También existen enfermedades cardíacas, como la transposición de las grandes arterias o el tronco arterioso, que dan como resultado un aumento general del flujo sanguíneo a los pulmones, pero con un flujo limitado de sangre oxigenada al resto del cuerpo. Las enfermedades en las que hay un flujo sanguíneo deficiente a la circulación sistémica, como la coartación de la aorta, sugieren que el cuerpo no recibe la sangre oxigenada que necesita, con la consiguiente cianosis. [11]
Los cinco defectos cardíacos cianóticos más comunes que pueden provocar el síndrome del bebé azul incluyen los siguientes:
| Patología | Breve descripción | Epidemiología | Diagrama |
|---|---|---|---|
| 1. Tronco arterioso persistente (o permeable) | En lugar de que salgan del corazón dos vasos sanguíneos principales separados, hay un único vaso de salida común. [12] | 3-5/100.000 nacimientos [13] |  |
| 2. Transposición de los grandes vasos | Las posiciones de la arteria pulmonar y la aorta están invertidas: la aorta se conecta al ventrículo derecho y la arteria pulmonar se conecta al ventrículo izquierdo. [14] | 1-5/10.000 nacimientos [15] |  |
| 3. Atresia tricúspide | La válvula cardíaca que conecta la aurícula derecha con el ventrículo derecho no se forma correctamente, lo que interrumpe el flujo sanguíneo en el corazón. [16] | 1-9/100.000 nacimientos [17] | 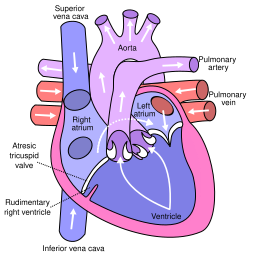 |
| 4. Tetralogía de Fallot | Un defecto cardíaco con cuatro características que incluyen una arteria pulmonar estrecha, un ventrículo derecho grueso, una aorta que se conecta a los ventrículos derecho e izquierdo y un orificio en la pared ventricular. [18] | 1-5/10.000 nacimientos [19] |  |
| 5. Conexión venosa pulmonar anómala | Las venas pulmonares que devuelven sangre oxigenada desde los pulmones no se conectan adecuadamente al corazón. [20] | 6-12/100.000 nacimientos [21] |  |
Metahemoglobinemia

La metahemoglobinemia puede ser adquirida o congénita. Se produce cuando el hierro de la hemoglobina se oxida de Fe 2+ a Fe 3+ , lo que provoca una mala unión del oxígeno . Además, el oxígeno que ya está unido se mantiene más fuertemente unido a la hemoglobina debido a una mayor afinidad, lo que da como resultado un menor aporte de oxígeno. Un nivel de metahemoglobina > 1,5 g/dl causa cianosis . La causa congénita más común es una deficiencia de la enzima citocromo b5 reductasa , que reduce la metahemoglobina en la sangre. [22]
Sin embargo, en los lactantes la causa más común de metahemoglobinemia se adquiere a través de la ingestión de nitratos ( NO−3) a través del agua de pozo o de los alimentos. Nitritos ( NO−2) producidas por la reducción microbiana del nitrato (directamente en el agua de bebida, o después de la ingestión por el infante, en su sistema digestivo) son oxidantes más poderosos que los nitratos y son el agente químico realmente responsable de la oxidación de Fe 2+ en Fe 3+ en el hemo tetrapirrol de la hemoglobina . Los infantes menores de 4 meses tienen mayor riesgo dado que beben más agua por peso corporal, tienen una menor actividad de NADH - citocromo b5 reductasa y tienen un mayor nivel de hemoglobina fetal que se convierte más fácilmente en metahemoglobina . Además, los infantes tienen un mayor riesgo después de un episodio de gastroenteritis debido a la producción de nitritos por las bacterias . [22] Las fuentes de nitrato pueden incluir fertilizantes utilizados en tierras agrícolas, vertederos de desechos o letrinas de pozo . [23] Por ejemplo, los niveles de nitrato están sujetos a monitoreo para cumplir con los estándares de calidad del agua potable en los Estados Unidos y otros países. [24] [25] El vínculo entre el síndrome del bebé azul y los nitratos en el agua potable es ampliamente aceptado, pero a partir de 2006 algunos estudios indicaron que otros contaminantes o fuentes de nitratos en la dieta también podrían desempeñar un papel en el síndrome. [26] [27] [28]
Diagnóstico
Al diagnosticar el síndrome del bebé azul, es importante realizar una historia clínica y un examen físico completos. Al obtener la historia clínica, es importante determinar el momento en que se presentaron los síntomas y preguntar sobre factores de riesgo o exposiciones, como antecedentes prenatales o acceso a agua de pozo. [29]

En el examen físico es importante visualizar dónde está presente la cianosis para diferenciar entre cianosis periférica y central . La cianosis central es típicamente visible como una decoloración azulada en todo el cuerpo y las membranas mucosas. Por el contrario, la cianosis periférica típicamente tiene una decoloración azulada en las extremidades. La cianosis se puede notar en los bebés alrededor de los labios, la lengua y el área sublingual, donde la piel es más delgada. [30] Además, es importante observar al bebé para detectar signos de dificultad respiratoria, visualizados como aleteo nasal, retracciones subcostales, etc. El examen debe incluir una evaluación respiratoria y cardíaca. [29]
Una de las herramientas clave para el diagnóstico es un oxímetro de pulso para determinar la saturación de oxígeno . Si bien la cianosis grave se puede notar fácilmente, una saturación de oxígeno tan baja como el 80 % causa solo una cianosis clínica leve que es difícil de ver. [6] Además, es útil una gasometría arterial; por ejemplo, en el caso de metahemoglobinemia, se puede esperar que la PO2 sea normal incluso con una saturación de oxígeno baja. Los estudios adicionales incluyen un hemograma completo, glucemia , hemocultivo, radiografía de tórax y una ecocardiografía . [29]
Los bebés con cianosis debido a una cardiopatía congénita suelen presentar síntomas horas o días después del nacimiento. Además de la cianosis, a menudo muestran signos de taquipnea (respiración rápida), un soplo cardíaco y una disminución de los pulsos periféricos. [6] [31] Si se sospecha una cardiopatía congénita en un recién nacido, es probable que los médicos realicen varias pruebas para evaluar el corazón, incluida una radiografía de tórax , un ecocardiograma y un electrocardiograma . [32] En la tetralogía de Fallot , los episodios en los que los bebés se vuelven cianóticos se denominan episodios de tetralogía y suelen ocurrir durante la alimentación o el llanto. [18] Cuando son mayores, los niños pueden ponerse en cuclillas para sentir alivio, ya que esto aumenta la resistencia vascular sistémica y hace que más sangre vaya hacia los pulmones, lo que resulta en una mayor oxigenación. [18]
Los bebés con cianosis debido a metahemoglobinemia también suelen presentar cianosis en el período neonatal, pero la oximetría de pulso puede estar falsamente elevada y no siempre revela una baja saturación de oxígeno en sangre. Se puede utilizar un cooxímetro para detectar los niveles de metahemoglobina en la sangre si se sospecha metahemoglobinemia, observando la diferencia entre la saturación de oxígeno en un gas en sangre arterial y la medición en un cooxímetro. Además, se puede obtener un nivel directo de metahemoglobina. [33]
Prevención/Detección
A partir del 22 de mayo de 2007, la Agencia de Protección Ambiental de los Estados Unidos ha establecido un nivel máximo de contaminante de 10 mg/L para el nitrato y 1 mg/L para el nitrito en el agua potable debido a los posibles efectos nocivos en los bebés. [34]
Se ha desarrollado una herramienta de detección para detectar defectos cardíacos críticos, es decir, lesiones cardíacas que requieren cirugía o intervención durante el primer año de vida. La detección de defectos cardíacos congénitos críticos debe realizarse en todos los recién nacidos después de 24 horas o poco antes del alta. La saturación de oxígeno se mide en la mano derecha y en cualquiera de los pies. [35]
Se considera que una prueba de detección es positiva si:
- Saturación de oxígeno < 90 % en cualquiera de las extremidades,
- Saturación de oxígeno 90-94 % en ambas extremidades en 3 mediciones separadas por una hora cada una,
- Diferencia de saturación de oxígeno > 3 % entre ambas extremidades en 3 mediciones separadas por una hora cada una.
Gestión
El tratamiento para el síndrome del bebé azul dependerá de la causa subyacente.
Al evaluar a un paciente por cianosis o dificultad respiratoria, se deben controlar los signos vitales, especialmente la frecuencia cardíaca y la saturación de oxígeno del paciente. Es beneficioso tener un acceso vascular establecido. En los recién nacidos, el oxímetro de pulso se coloca típicamente en la mano derecha para determinar la oxigenación preductal, refiriéndose a la oxigenación antes del conducto arterioso (conexión entre la aorta y la arteria pulmonar ). [36] Esto proporciona el nivel de oxigenación que reciben el corazón y el cerebro. Tradicionalmente, el oxígeno suplementario se administra de manera escalonada comenzando con oxígeno de flujo libre, progresando a ventilación con presión positiva o presión positiva continua en las vías respiratorias y terminando con intubación mecánica. La saturación de oxígeno objetivo es entre 85 y 95 %. Si un bebé requiere oxígeno suplementario durante un tiempo prolongado, debe calentarse y humidificarse para evitar la pérdida de calor. [36]
Enfermedad cardíaca cianótica
Algunos bebés que nacen con cardiopatía cianótica reciben un tratamiento con prostaglandina E1 después del nacimiento para mantener abierto el conducto arterioso y permitir que se bombee más sangre oxigenada al cuerpo. Muchos también reciben oxigenoterapia para aumentar el porcentaje de oxígeno en la sangre. La mayoría de estos bebés necesitarán una cirugía durante la infancia para corregir su defecto cardíaco estructural. [31]
Metahemoglobinemia grave
El tratamiento de primera línea para la metahemoglobinemia grave es el azul de metileno , un medicamento que reducirá la metahemoglobina en la sangre. Esto es posible porque el azul de metileno oxida el NADPH , que a su vez puede convertir la metahemoglobina nuevamente en hemoglobina. [33]
Epidemiología
De todos los bebés que nacen con cardiopatías congénitas, aproximadamente el 25 % presenta cianosis como consecuencia de ello. La tetralogía de Fallot es la cardiopatía cianótica más común. [37]
Se considera que la metahemoglobinemia es rara y la metahemoglobinemia adquirida se presenta con más frecuencia que la forma congénita. [38]
Resultados
En el caso de cardiopatías que causan cianosis, aproximadamente el 75 % de los bebés sobreviven hasta el año de edad y el 69 % hasta los 18 años. Estos individuos tienen un mayor riesgo de sufrir retraso en el desarrollo, insuficiencia cardíaca o trastornos del ritmo cardíaco. [37]
La metahemoglobinemia responde bien al tratamiento, su pronóstico está asociado con el nivel de metahemoglobinemia y el grado de daño a los órganos diana que pueda causar. Puede ocurrir la muerte cuando los niveles alcanzan el 70 %. [39]
Historia
La primera operación exitosa para tratar el síndrome del bebé azul causado por la tetralogía de Fallot ocurrió en la Universidad Johns Hopkins en 1944. A través de una colaboración entre la cardióloga pediátrica Helen Taussig , el cirujano Alfred Blalock y el técnico quirúrgico Vivien Thomas , se creó la derivación Blalock-Thomas-Taussig . El Dr. Taussig había reconocido que los niños con tetralogía de Fallot que también tenían un conducto arterioso persistente (CAP) generalmente vivían más tiempo, por lo que el trío intentó crear el mismo efecto que un CAP al unir la arteria subclavia a la arteria pulmonar, aliviando la cianosis del niño. [40] La operación se publicó en el Journal of the American Medical Association en 1945 e impactó en el manejo de los bebés azules en todo el mundo. [41]
Anna era el nombre de la perra que sobrevivió a la primera cirugía, considerada un procedimiento experimental en ese momento. Anna sobrevivió al primer bypass pulmonar después de haber sido operada dos veces. La segunda operación fue necesaria para reemplazar los puntos originales por otros flexibles. Después de su éxito con Anna, Blalock y Thomas tuvieron el coraje de realizar la primera cirugía a corazón abierto en Eileen Saxon en 1944. En 1950, la historia de Anna se convirtió en una película, y la película se ha exhibido en varias escuelas y otros grupos. [42]
Referencias
- ^ ab Pahal, Parul; Goyal, Amandeep (2024). "Cianosis central y periférica". StatPearls . StatPearls Publishing. PMID 32644593.
- ^ ab Enciclopedia MedlinePlus : Enfermedad cardíaca cianótica
- ^ Enciclopedia MedlinePlus : Metahemoglobinemia
- ^ Snider, HL (1990). "Cianosis". Métodos clínicos: historia clínica, examen físico y de laboratorio . Butterworths. ISBN 978-0-409-90077-4. Número de identificación personal 21250208.
- ^ Enciclopedia MedlinePlus : Coloración azulada de la piel
- ^ abc Silove, ED (1994). "Evaluación y manejo de la cardiopatía congénita en el recién nacido por el pediatra del distrito". Archivos de enfermedades en la infancia - Edición fetal y neonatal . 70 (1): F71–F74. doi :10.1136/fn.70.1.f71. PMC 1060995 . PMID 8117134.
- ^ Enlow, Elizabeth; Greenberg, James M. (2019). "Manifestaciones clínicas de enfermedades en el período neonatal". En Kliegman, Robert M.; St Geme, Joseph W. (eds.). Nelson Textbook of Pediatrics . Elsevier Health Sciences. págs. 910–913.e4. ISBN 978-0-323-56888-3.
- ^ Stack, Anne M (2006). "Cianosis". En Fleisher, Gary Robert; Ludwig, Stephen; Henretig, Fred M (eds.). Libro de texto de medicina de emergencia pediátrica . Lippincott Williams & Wilkins. ISBN 978-0-7817-5074-5.
- ^ Enciclopedia MedlinePlus : Síndrome de dificultad respiratoria neonatal
- ^ Lin, Pei-Yi; Hagan, Katherine; Fenoglio, Angela; Grant, P. Ellen; Franceschini, Maria Angela (16 de mayo de 2016). "Reducción del flujo sanguíneo cerebral y del metabolismo del oxígeno en neonatos extremadamente prematuros con hemorragia intraventricular de matriz germinal de bajo grado". Scientific Reports . 6 (1): 25903. Bibcode :2016NatSR...625903L. doi :10.1038/srep25903. PMC 4867629 . PMID 27181339.
- ^ Bernstein, Daniel. Nelson Textbook of Pediatrics . Elsevier Inc. págs. 2371–2373.
- ^ "Datos sobre el tronco arterioso". Defectos cardíacos congénitos . Centros para el Control y la Prevención de Enfermedades. 22 de noviembre de 2019.
- ^ Reservados, INSERM US14 – Todos los derechos. «Orphanet: Truncus arteriosus». www.orpha.net . Consultado el 20 de noviembre de 2019 .
{{cite web}}: CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ CDC (15 de noviembre de 2019). «Defectos cardíacos congénitos: dextrotransposición de las grandes arterias». Centros para el Control y la Prevención de Enfermedades . Consultado el 20 de noviembre de 2019 .
- ^ Reservados, INSERM US14 – Todos los derechos. «Orphanet: Transposición de las grandes arterias». www.orpha.net . Consultado el 20 de noviembre de 2019 .
{{cite web}}: CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ CDC (19 de noviembre de 2019). «Defectos cardíacos congénitos: datos sobre la atresia tricúspide | CDC». Centros para el Control y la Prevención de Enfermedades . Consultado el 20 de noviembre de 2019 .
- ^ Reservados, INSERM US14 – Todos los derechos. «Orphanet: Atresia tricuspídea». www.orpha.net . Consultado el 20 de noviembre de 2019 .
{{cite web}}: CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ abc "Datos sobre la tetralogía de Fallot". Defectos cardíacos congénitos . Centros para el Control y la Prevención de Enfermedades. 3 de febrero de 2023.
- ^ Reservados, INSERM US14 – Todos los derechos. «Orphanet: Tetralogía de Fallot». www.orpha.net . Consultado el 20 de noviembre de 2019 .
{{cite web}}: CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ CDC (19 de noviembre de 2019). «Defectos cardíacos congénitos: datos sobre la TAVPR | CDC». Centros para el Control y la Prevención de Enfermedades . Consultado el 20 de noviembre de 2019 .
- ^ "Retorno venoso pulmonar anómalo total". Manual de anestesia cardíaca pediátrica . 2017. págs. 107-111. doi :10.1002/9781119095569.ch16. ISBN . 978-1-119-09553-8.
- ^ abc Smith-Whitley, Kwiatkowski. Nelson Textbook of Pediatrics . Elsevier Inc. págs. 2540–2558.
- ^ Majumdar Deepanjan (2003). "El síndrome del bebé azul". Resonancia . 8 (10): 20–30. doi :10.1007/BF02840703. S2CID 117099503.
- ^ "Reglamento nacional sobre agua potable primaria". EPA: Agencia de Protección Ambiental de los Estados Unidos . 30 de noviembre de 2015. Consultado el 14 de julio de 2018 .
- ^ "Enfermedades relacionadas con el agua". Organización Mundial de la Salud . Archivado desde el original el 21 de abril de 2017. Consultado el 14 de julio de 2018 .
- ^ Fewtrell, Lorna (22 de julio de 2004). "Nitratos en el agua potable, metahemoglobinemia y carga mundial de enfermedades: un debate". Environmental Health Perspectives . 112 (14): 1371–1374. doi :10.1289/ehp.7216. PMC 1247562 . PMID 15471727.
- ^ van Grinsven, Hans JM; Ward, Mary H = 2006 (2006). "¿La evidencia sobre los riesgos para la salud asociados con la ingestión de nitratos justifica un aumento del estándar de nitratos para el agua potable?". Environ Health . 5 (1): 26. Bibcode :2006EnvHe...5...26V. doi : 10.1186/1476-069X-5-26 . PMC 1586190 . PMID 16989661.
{{cite journal}}: CS1 maint: nombres numéricos: lista de autores ( enlace ) - ^ Ward, Mary H.; deKok, Theo M.; Levallois, Patrick; Brender, Jean; Gulis, Gabriel; Nolan, Bernard T.; VanDerslice, James (23 de junio de 2005). "Informe del grupo de trabajo: Nitratos en el agua potable y salud: hallazgos recientes y necesidades de investigación". Environmental Health Perspectives . 113 (11): 1607–1614. doi :10.1289/ehp.8043. PMC 1310926 . PMID 16263519.
- ^ abc Bearl, David W.; Hill, Kevin (2019), Jain, Lucky; Suresh, Gautham K. (eds.), "Aproximación al lactante cianótico", Clinical Guidelines in Neonatology , Nueva York, NY: McGraw-Hill Education , consultado el 21 de enero de 2022
- ^ McMullen, Sarah M.; Patrick, Ward (marzo de 2013). "Cianosis". The American Journal of Medicine . 126 (3): 210–212. doi :10.1016/j.amjmed.2012.11.004. PMID 23410559. S2CID 244083635.
- ^ ab Khalil, Markus; Jux, Christian; Rueblinger, Lucie; Behrje, Johanna; Esmaeili, Anoosh; Schranz, Dietmar (abril de 2019). "Terapia aguda de recién nacidos con cardiopatía congénita crítica". Translational Pediatrics . 8 (2): 114–126. doi : 10.21037/tp.2019.04.06 . PMC 6514285 . PMID 31161078.
- ^ "Síntomas y diagnóstico de cardiopatías congénitas". www.heart.org . Consultado el 13 de noviembre de 2019 .
- ^ ab Da-Silva, Shonola S.; Sajan, Imran S.; Underwood, Joseph P. (agosto de 2003). "Metahemoglobinemia congénita: una causa poco frecuente de cianosis en el recién nacido: informe de un caso". Pediatría . 112 (2): e158–e161. doi : 10.1542/peds.112.2.e158 . PMID 12897322.
- ^ "Documento de archivo de la EPA de EE. UU.: nitratos y nitritos" (PDF) . EPA de EE. UU . . 22 de mayo de 2007. Archivado (PDF) del original el 30 de abril de 2022 . Consultado el 2 de marzo de 2023 .
- ^ "Defectos cardíacos congénitos críticos". CDC . Archivado desde el original el 11 de septiembre de 2014.
- ^ ab Academia Estadounidense de Pediatría y Asociación Estadounidense del Corazón (2016). Libro de texto de reanimación neonatal . Academia Estadounidense de Pediatría. págs. 33–65.
- ^ ab Ossa Galvis, Maria M.; Bhakta, Rupal T.; Tarmahomed, Abdulla; Mendez, Magda D. (2024). "Enfermedad cardíaca cianótica". StatPearls . StatPearls Publishing. PMID 29763177.
- ^ Ludlow, John T.; Wilkerson, Richard G.; Nappe, Thomas M. (2024). "Metahemoglobinemia". StatPearls . StatPearls Publishing. PMID 30726002.
- ^ Metahemoglobinemia en eMedicine
- ^ Thomas, Vivien T. (1998). Socios del corazón: Vivien Thomas y su trabajo con Alfred Blalock . University of Pennsylvania Press, Incorporated. ISBN 978-0-8122-1634-9.[ página necesaria ]
- ^ "Esa primera operación". Instituciones Médicas Johns Hopkins . Archivado desde el original el 12 de junio de 2020. Consultado el 13 de noviembre de 2019 .
- ^ Smith, Chris. «Información sobre Anna». Archivado desde el original el 31 de marzo de 2016. Consultado el 22 de julio de 2016 .