Tetralogía de Fallot
| Tetralogía de Fallot | |
|---|---|
| Otros nombres | Síndrome de Fallot, tétrada de Fallot, tetralogía de Steno-Fallot [1] |
 | |
| Diagrama de un corazón sano y uno con tetralogía de Fallot | |
| Especialidad | Cirugía cardíaca , pediatría |
| Síntomas | Episodios de coloración azulada en la piel , dificultad para respirar, soplo cardíaco , dedos en palillo de tambor [2] |
| Complicaciones | Frecuencia cardíaca irregular , regurgitación pulmonar [3] |
| Inicio habitual | Desde el nacimiento [4] |
| Causas | Desconocido [5] |
| Factores de riesgo | Alcohol , diabetes , >40, rubéola durante el embarazo [5] |
| Método de diagnóstico | Basado en los síntomas, ecocardiograma [6] |
| Diagnóstico diferencial | Transposición de las grandes arterias , síndrome de Eisenmenger , anomalía de Ebstein [7] |
| Tratamiento | Cirugía a corazón abierto [8] |
| Frecuencia | 1 de cada 2.000 bebés [4] |
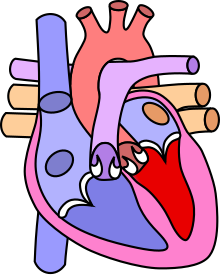
La tetralogía de Fallot ( TOF ), anteriormente conocida como tetralogía de Steno-Fallot, [9] es un defecto cardíaco congénito caracterizado por cuatro defectos cardíacos específicos. [4] Clásicamente, los cuatro defectos son: [4]
- estenosis pulmonar , que es el estrechamiento de la salida del ventrículo derecho;
- un defecto del tabique ventricular , que es un orificio que permite que la sangre fluya entre los dos ventrículos ;
- hipertrofia ventricular derecha , que es el engrosamiento del músculo ventricular derecho; y
- una aorta superpuesta , que es donde la aorta se expande para permitir que entre sangre de ambos ventrículos.
Al nacer, los niños pueden ser asintomáticos o presentar muchos síntomas graves. [10] Más tarde en la infancia, suelen haber episodios de coloración azulada en la piel debido a la falta de oxigenación suficiente, conocido como cianosis . [2] Cuando los bebés afectados lloran o defecan , pueden sufrir un "período de tet" en el que se vuelven cianóticos, tienen dificultad para respirar, se vuelven flácidos y, ocasionalmente, pierden el conocimiento . [2] Otros síntomas pueden incluir un soplo cardíaco , dedos en palillo de tambor y cansancio fácil al amamantar . [2]
La causa de la tetralogía de Fallot generalmente no se conoce. [5] Los factores de riesgo incluyen una madre que consume alcohol , tiene diabetes , tiene más de 40 años o contrae rubéola durante el embarazo . [5] : 62 También puede estar asociada con el síndrome de Down y otros defectos cromosómicos que causan defectos cardíacos congénitos. [11]
La TOF se trata típicamente con cirugía a corazón abierto durante el primer año de vida. [8] El momento de la cirugía depende de los síntomas y el tamaño del bebé. [8] El procedimiento implica aumentar el tamaño de la válvula pulmonar y las arterias pulmonares y reparar el defecto del tabique ventricular. [8] En los bebés que son demasiado pequeños, se puede realizar una cirugía temporal con planes para una segunda cirugía cuando el bebé sea más grande. [8] Con el cuidado adecuado, la mayoría de las personas afectadas viven hasta la edad adulta. [4] Los problemas a largo plazo pueden incluir una frecuencia cardíaca irregular y regurgitación pulmonar . [3]
La prevalencia de TOF se estima entre el 0,02 y el 0,04 %. [4] Aunque inicialmente se pensó que afectaba por igual a hombres y mujeres, estudios más recientes han descubierto que los hombres se ven afectados más que las mujeres. [4] [12] Es el defecto cardíaco congénito complejo más común y representa alrededor del 10 por ciento de los casos. [13] [14] Fue descrito inicialmente en 1671 por Niels Steensen . [1] [15] Una descripción más detallada fue publicada en 1888 por el médico francés Étienne-Louis Arthur Fallot , de quien recibe el nombre. [1] [16] La primera reparación quirúrgica total se llevó a cabo en 1954. [3]
Signos y síntomas

La tetralogía de Fallot produce una baja oxigenación de la sangre. Esto se debe a una mezcla de sangre oxigenada y desoxigenada en el ventrículo izquierdo a través del defecto septal ventricular (VSD) y al flujo preferencial de la sangre mezclada desde ambos ventrículos a través de la aorta debido a la obstrucción del flujo a través de la válvula pulmonar. Esto último se conoce como cortocircuito de derecha a izquierda . [17]
Los bebés con TOF (una enfermedad cardíaca cianótica) tienen una saturación baja de oxígeno en sangre. [17] La oxigenación de la sangre varía mucho de un paciente a otro dependiendo de la gravedad de los defectos anatómicos. [10] Los rangos típicos varían del 60% a alrededor del 90%. [17] Dependiendo del grado de obstrucción, los síntomas varían desde ninguna cianosis o cianosis leve hasta cianosis profunda al nacer. [10] Si el bebé no está cianótico, a veces se lo denomina "teta rosa". [18] Otros síntomas incluyen un soplo cardíaco que puede variar de casi imperceptible a muy fuerte, dificultad para alimentarse, falta de aumento de peso, retraso en el crecimiento y el desarrollo físico, respiración dificultosa (disnea) al hacer ejercicio, dedos en palillo de tambor y policitemia . [2] El bebé puede ponerse azul con la lactancia materna o el llanto. [2]
Las personas que nacen con tetralogía de Fallot tienen más probabilidades de sufrir trastornos psiquiátricos como el trastorno por déficit de atención e hiperactividad (TDAH) en etapas posteriores de la vida, posiblemente debido a cambios genéticos subyacentes que predisponen a ambas afecciones. [19]
Hechizos de Tet
Los bebés y niños con tetralogía de Fallot no reparada pueden desarrollar "episodios de tetralogía". [17] Estos son episodios de hipoxia aguda, caracterizados por falta de aire, cianosis, agitación y pérdida de conciencia. [20] : 200 Esto puede iniciarse por cualquier evento, como ansiedad, dolor, deshidratación o fiebre [20] , que conduce a una disminución de la saturación de oxígeno o que causa una disminución de la resistencia vascular sistémica, lo que a su vez conduce a un aumento de la derivación a través del defecto septal ventricular. [17] Por lo general, estos episodios disminuyen en frecuencia después de los primeros cuatro años de vida. [9]
Clínicamente, los episodios de tet se caracterizan por un aumento repentino y marcado de la cianosis seguido de síncope . [20] : 200
Los niños mayores suelen ponerse en cuclillas instintivamente durante un período de tet. [17] Esto aumenta la resistencia vascular sistémica y permite una reversión temporal del cortocircuito . Aumenta la presión en el lado izquierdo del corazón, disminuyendo el cortocircuito de derecha a izquierda, lo que disminuye la cantidad de sangre desoxigenada que ingresa a la circulación sistémica. [21] [22]
Causa
Si bien no se han identificado completamente las causas específicas de la TOF, existen diversos factores ambientales o genéticos que se han asociado con ella. Hasta ahora, alrededor del 20 % de los casos generales de cardiopatías congénitas se han debido a causas conocidas, como defectos genéticos y teratógenos , que son diversos factores que provocan anomalías en el desarrollo del embrión o defectos congénitos. [23] Sin embargo, en el otro 80 % de los casos se sabe poco acerca de su causa. [23]
Los factores genéticos relacionados con la TOF incluyen diversas mutaciones o deleciones genéticas. Las deleciones genéticas asociadas con la TOF incluyen la deleción del cromosoma 22, así como el síndrome de DiGeorge . [24]
Las asociaciones de genes específicos con TOF incluyen:
- JAG1 codifica ligandos de la familia de proteínas Notch y se expresa en gran medida en el corazón en desarrollo. [25] Las mutaciones del gen JAG1 pueden provocar un desarrollo cardíaco anormal asociado con TOF. [25]
- NKX2-5 codifica reguladores de la morfogénesis cardíaca para permitir el desarrollo adecuado del corazón. [26] Los defectos en este gen generalmente causan defectos septales y se han asociado con alrededor del 4 % de todos los casos de TOF. [27]
- ZFPM2 es otro regulador cardíaco involucrado en la regulación de GATA4. [28] Las mutaciones del gen ZFPM2 conducen a una producción reducida de GATA y se han observado en algunos casos de TOF. [28]
- El VEGF es un factor de crecimiento endotelial bien conocido que interviene en la vascularización del corazón. [29] Se ha demostrado que la disminución de la expresión del VEGF es un modificador del TOF. [29]
- NOTCH1 está involucrado en la vascularización de los tejidos y es el sitio más común de variaciones genéticas involucradas con TOF, representando el 7% de todos los casos de TOF. [30]
- TBX1 expresa progenitores involucrados en el desarrollo del ventrículo derecho. [31] Se han observado deleciones del cromosoma 22q11 que también eliminan el gen TBX1 en el 17 % de los casos de TOF. [31]
- La expresión del gen FLT4 conduce al receptor 3 del factor de crecimiento endotelial vascular ( VEGFR-3 ), que ayuda a la vascularización. [30] Las mutaciones de este gen se han asociado con TOF y representan el 2,4 % de todos los casos. [30]
- FOXC2 es otro gen involucrado en el desarrollo embrionario del sistema cardíaco. [32] Se ha demostrado que las mutaciones de este gen resultan en síndrome linfático disfuncional y TOF. [32]
- GATA4 ayuda al desarrollo cardíaco al ayudar a aumentar la producción de cardiomiocitos. [33] Se han observado mutaciones de este gen en varios casos familiares de TOF que suelen durar entre 2 y 3 generaciones. [32]
- FLNA es una proteína codificada por el gen del mismo nombre que une los filamentos de actina en redes en el citoplasma y ayuda a anclar las proteínas de membrana para el citoesqueleto de actina . Se observó que las mutaciones de este gen causaban TOF en algunos pacientes. [34]
Los factores ambientales que se han estudiado y que podrían estar asociados con TOF incluyen:
- Consumo materno de alcohol: Durante el desarrollo embrionario , muchos de los sistemas de procesamiento y filtración del cuerpo no están completamente desarrollados. [35] El cuerpo fetal no puede procesar el alcohol tan bien como los adultos, lo que puede conducir a un desarrollo inadecuado, incluida la cardiogénesis . [35] Si bien no se ha encontrado evidencia concluyente entre los efectos del consumo de alcohol y la TOF, se ha observado el consumo materno de alcohol en varios pacientes con TOF. [35]
- Tabaquismo materno: el tabaquismo materno se ha asociado con diversas complicaciones fetales, como parto prematuro y bajo peso al nacer, que pueden provocar TOF. [23] En el famoso estudio Baltimore-Washington, se informó que fumar más de un paquete por día durante el embarazo se asoció con dos desviaciones cardíacas específicas, ambas parte de la TOF: estenosis pulmonar y transposición con VSD. [23]
- Diabetes materna: la diabetes materna, la diabetes mellitus y la diabetes gestacional son factores de riesgo bien conocidos de cardiopatía coronaria fetal, incluida la tetralogía de Fallot. [36] Se ha demostrado que la diabetes materna aumenta el riesgo de deformaciones cardiovasculares, a saber, la transposición de grandes arterias, una de las cuatro deformaciones en la tetralogía de Fallot. [37] Los estudios también han analizado si la diabetes aumenta el riesgo de malformación o mala regulación del azúcar y han descubierto que la regulación del azúcar no afecta significativamente a las malformaciones cardíacas. [36] Los estudios retrospectivos han demostrado que las madres diabéticas con un buen control de la glucosa aún conservaban el riesgo elevado de cardiopatía coronaria. [36]
- Rubéola: La rubéola se caracteriza por ser una enfermedad viral contagiosa y leve, con consecuencias que a menudo pasan desapercibidas. [38] Se ha observado que la infección por rubéola durante el primer trimestre causa diversas malformaciones fetales, incluida la TOF. [38]
- Edad materna: Una edad materna avanzada, especialmente después de los 35 años, puede presentar diversos riesgos durante el embarazo debido a comorbilidades existentes, como hipertensión, diabetes, hipotiroidismo y consanguinidad. [39] Estos factores de riesgo pueden afectar el desarrollo fetal y provocar diversas afecciones fetales, como cardiopatía congénita (incluida la TOF), síndrome de Down y autismo. [39]
Los estudios de embriología muestran que la desalineación anterior del tabique aortopulmonar da como resultado la combinación clínica de un defecto del tabique ventricular (VSD), estenosis pulmonar y una aorta cabalgada . [20] : 200 La hipertrofia ventricular derecha se desarrolla progresivamente a partir de la resistencia al flujo sanguíneo a través del tracto de salida del ventrículo derecho . [10]
Fisiopatología
En individuos sanos, el corazón humano se desarrolla alrededor del día 20 de gestación, cuando los tubos endocárdicos externos se fusionan en un solo tubo cardíaco. A partir de entonces, el tubo cardíaco comienza a plegarse y se desarrolla en la aurícula y el ventrículo. El ventrículo derecho es dominante antes del nacimiento, recibe el 65% del retorno venoso al corazón y es el principal contribuyente del flujo sanguíneo a la parte inferior del cuerpo, la placenta y los pulmones. Aunque se desconoce la causa exacta de la TF, una asociación que se ha observado es una desviación anterior del tabique infundibular que da lugar a un VSD desalineado, con una aorta superpuesta que causa una obstrucción ventricular derecha posterior. [9]
Diferentes factores como la estenosis pulmonar también pueden contribuir a la obstrucción del flujo de salida del ventrículo derecho. Durante los episodios de tet, se observaría fisiológicamente una disminución de la resistencia vascular sistémica o un aumento de la resistencia pulmonar.
El principal defecto anatómico en la TF es la desviación anterior del tabique de salida pulmonar. [10] Este defecto produce un estrechamiento del tracto de salida del ventrículo derecho (TSVD), una anulación de la aorta y un VSD. [40]
Cuatro malformaciones
La " tetralogía " hace referencia a cuatro partes, lo que implica los cuatro defectos anatómicos del síndrome. [2] No debe confundirse con la teratología , un campo de la medicina que estudia el desarrollo anormal y las malformaciones congénitas (incluida la tetralogía de Fallot). A continuación se enumeran las cuatro malformaciones cardíacas que se presentan juntas en la tetralogía de Fallot:

| Condición | Descripción |
|---|---|
| Estenosis infundibular pulmonar | Estenosis del tracto de salida del ventrículo derecho. Puede ocurrir en la válvula pulmonar (estenosis valvular) o justo debajo de la válvula pulmonar (estenosis infundibular). [4] La estenosis pulmonar infundibular es causada principalmente por el crecimiento excesivo de la pared del músculo cardíaco (hipertrofia de las trabéculas septoparietales), [41] sin embargo, se cree que los eventos que conducen a la formación de la aorta superior también son una causa. La estenosis pulmonar es la principal causa de las malformaciones, y las otras malformaciones asociadas actúan como mecanismos compensatorios de la estenosis pulmonar. [42] El grado de estenosis varía entre individuos con TF y es el determinante principal de los síntomas y la gravedad. Esta malformación se describe con poca frecuencia como estenosis subpulmonar u obstrucción subpulmonar . [43] |
| Aorta cabalgando | Una válvula aórtica con conexión biventricular, es decir, que está situada por encima del defecto septal ventricular y conectada tanto al ventrículo derecho como al izquierdo. El grado en que la aorta está unida al ventrículo derecho se denomina su grado de "anulación". La raíz aórtica puede estar desplazada hacia adelante (anteriormente) o directamente por encima del defecto septal, pero siempre está ubicada anormalmente a la derecha de la raíz de la arteria pulmonar. El grado de anulación es extremadamente variable, ya que entre el 5 y el 95 % de la válvula está conectada al ventrículo derecho. [41] |
| Defecto del tabique ventricular (VSD) | Un orificio entre las dos cámaras inferiores (ventrículos) del corazón. El defecto se centra alrededor del aspecto más superior del tabique ventricular (tabique de salida) y, en la mayoría de los casos, es único y grande. En algunos casos, el engrosamiento del tabique (hipertrofia septal) puede estrechar los márgenes del defecto. [41] |
| Hipertrofia ventricular derecha | El ventrículo derecho es más musculoso de lo normal, lo que le da una apariencia característica en forma de bota ( coeur-en-sabot ) como se ve en la radiografía de tórax. Debido a la mala disposición del tabique ventricular externo, la pared del ventrículo derecho aumenta de tamaño para hacer frente a la mayor obstrucción del tracto de salida derecho. En la actualidad, se acepta generalmente que esta característica es una anomalía secundaria, ya que el nivel de hipertrofia tiende a aumentar con la edad. [44] |

Existe una variación anatómica entre los corazones de los individuos con tetralogía de Fallot. [10] Principalmente, el grado de obstrucción del tracto de salida del ventrículo derecho varía entre pacientes y generalmente determina los síntomas clínicos y la progresión de la enfermedad. [10]
Presumiblemente, esto surge de un crecimiento desigual del tabique aortopulmonar (también conocido como tabique de salida pulmonar). [20] : 199 La aorta es demasiado grande, por lo que "se sobrepasa", y esto "roba" a la arteria pulmonar, que por lo tanto está estenosada. Esto luego impide el cierre de la pared ventricular, por lo tanto, se produce una CIV, y esto aumenta las presiones en el lado derecho, por lo que el ventrículo derecho se hace más grande para soportar el trabajo. [20] : 199
Anomalías adicionales
Además, la tetralogía de Fallot puede presentarse con otras anomalías anatómicas, entre ellas: [24] : 66–68 [45]
- Estenosis de la arteria pulmonar izquierda , en el 40%
- una válvula pulmonar bicúspide, en el 60%
- Arco aórtico del lado derecho , en el 25%
- anomalías de la arteria coronaria , en el 10%
- un foramen oval permeable o un defecto del tabique auricular , en cuyo caso el síndrome a veces se denomina pentalogía de Fallot [46]
- un defecto del tabique auriculoventricular
- retorno venoso pulmonar parcial o totalmente anómalo
La tetralogía de Fallot con atresia pulmonar ( pseudotruncus arteriosus ) es una variante grave [47] en la que hay una obstrucción completa (atresia) del tracto de salida del ventrículo derecho, lo que provoca la ausencia del tronco pulmonar durante el desarrollo embrionario. [24] : 67–68 En estos individuos, la sangre se desvía completamente del ventrículo derecho al izquierdo, donde se bombea solo a través de la aorta. Los pulmones se perfunden a través de colaterales extensas de las arterias sistémicas y, a veces, también a través del conducto arterioso. [24] : 67–68
Diagnóstico

Existen tres pruebas diagnósticas útiles diferentes que se utilizan para el diagnóstico de la tetralogía de Fallot. [48] Estas incluyen una radiografía de tórax, un electrocardiograma y un ecocardiograma. [48] La ecocardiografía determina el diagnóstico final y generalmente ofrece suficiente información para la planificación del tratamiento quirúrgico. [48] Aproximadamente la mitad de todos los pacientes son diagnosticados ahora antes de nacer. [48] El diagnóstico diferencial es cuando los médicos diagnostican entre dos o más afecciones para los síntomas de una persona y esto puede incluir causas pulmonares primarias de cianosis, lesiones cardíacas cianóticas, estenosis pulmonar y troncos arteriales transpuestos. [48]
Radiografía de tórax
Antes de que se dispusiera de técnicas más sofisticadas, la radiografía de tórax era el método definitivo de diagnóstico. La apariencia anormal de " coeur-en-sabot " (bota) de un corazón con tetralogía de Fallot es clásicamente visible mediante radiografía de tórax, aunque la mayoría de los bebés con tetralogía pueden no mostrar este hallazgo. [49] La forma de bota se debe a la hipertrofia ventricular derecha presente en la tetralogía de Fallot. Los campos pulmonares a menudo están oscuros (ausencia de marcas pulmonares intersticiales) debido a la disminución del flujo sanguíneo pulmonar. [50] : 171–172
Electrocardiograma
El electrocardiograma (ECG) es uno de los procedimientos más básicos para evaluar el corazón. [51] Se aplican pequeños electrodos en áreas específicas del cuerpo, cerca del pecho, el brazo y el cuello. Los cables conductores conectan los electrodos a una máquina de ECG. Luego se mide la actividad eléctrica del corazón. [51] Los impulsos eléctricos naturales ayudan a mantener el flujo sanguíneo adecuado al coordinar las contracciones en diferentes áreas del corazón. [51] Estos impulsos se registran mediante un ECG, que muestra la velocidad, el ritmo, la intensidad y el momento de los impulsos eléctricos a medida que viajan a través del corazón. [51]
La electrocardiografía muestra hipertrofia ventricular derecha (HVD), junto con desviación del eje a la derecha. [24] La HVD se observa en el ECG como ondas R altas en la derivación V1 y ondas S profundas en la derivación V5-V6. [52]
Ecocardiograma
Los defectos cardíacos congénitos ahora se diagnostican con ecocardiografía , que es rápida, no implica radiación, es muy específica y puede realizarse antes del nacimiento. [53]
La ecocardiografía establece la presencia de TOF al demostrar un VSD, una hipertrofia ventricular derecha y una anulación de la válvula aórtica. Muchos pacientes reciben el diagnóstico antes del nacimiento. La ecocardiografía Doppler color (un tipo de ecocardiografía) mide el grado de estenosis pulmonar. Además, se realiza un control minucioso del conducto arterioso en el período neonatal para garantizar que haya un flujo sanguíneo adecuado a través de la válvula pulmonar. [24] [50] : 171–172
En algunos casos, la anatomía de la arteria coronaria no se puede visualizar con claridad mediante ecocardiograma. En este caso, se puede realizar un cateterismo cardíaco. [20] : 37, 201
Genética
Desde una perspectiva genética, es importante realizar pruebas de detección de DiGeorge en todos los bebés con TOF. [20] : 37, 201
Tratamiento
Hechizos de Tet
Los episodios de Tet se definen como episodios cianóticos que ocurren debido a la obstrucción del flujo de salida del ventrículo derecho. [54] Los episodios de Tet pueden ser desencadenados por varios factores, como llanto, taquipnea progresiva y respiración profunda, con síntomas que incluyen, entre otros, piel, uñas y labios azules, llanto profundo y dificultad para respirar. [55]
Los episodios de tetraciclina pueden tratarse con betabloqueantes como el propranolol , pero los episodios agudos requieren una intervención rápida con morfina o fentanilo intranasal [56] para reducir el esfuerzo ventilatorio, un vasopresor como la fenilefrina o la noradrenalina para aumentar la resistencia vascular sistémica y líquidos intravenosos para la expansión del volumen. [20] : 18, 201
El oxígeno (100%) puede ser eficaz en el tratamiento de los episodios porque es un potente vasodilatador pulmonar y vasoconstrictor sistémico. Esto permite un mayor flujo sanguíneo a los pulmones al disminuir el desvío de sangre desoxigenada del ventrículo derecho al izquierdo a través del VSD. También existen procedimientos simples, como la posición en cuclillas y la posición de rodillas sobre el pecho, que aumentan la resistencia vascular sistémica y disminuyen el desvío de derecha a izquierda de sangre desoxigenada hacia la circulación sistémica. [20] : 18, 201 [21]
Si los episodios son refractarios a los tratamientos anteriores, las personas suelen ser intubadas y sedadas. El tratamiento de último recurso para los episodios de tet es la oxigenación por membrana extracorpórea (ECMO) junto con la posibilidad de colocar una derivación de Blalock-Thomas-Taussig (derivación BTT). [20] : 18, 201
Reparación quirúrgica total
La reparación quirúrgica total de la TOF es una cirugía curativa. Se pueden utilizar diferentes técnicas para realizar la reparación de la TOF. Sin embargo, en la mayoría de los casos se utiliza un abordaje transatrial, a través de la arteria pulmonar. [57] : 153 La reparación consta de dos pasos principales: cierre de la CIV con un parche y reconstrucción del tracto de salida del ventrículo derecho. [58]
Esta cirugía a corazón abierto está diseñada para aliviar la estenosis del tracto de salida del ventrículo derecho mediante una resección cuidadosa del músculo y para reparar el VSD. [57] : 154 El tracto de salida del ventrículo derecho se puede reconstruir utilizando principalmente 2 procedimientos: un parche transanular (TAP) o un procedimiento de preservación de la válvula pulmonar (PVS). La decisión sobre el tipo de procedimiento depende de la anatomía individual (especialmente el tamaño de la válvula pulmonar). PVS mostró una mejor supervivencia general, supervivencia libre de eventos y menos regurgitación pulmonar a los 10, 20 y 30 años después de la operación. PVS se puede realizar con o sin ventriculotomía . Un estudio encontró una supervivencia general y libre de eventos y una tasa de regurgitación pulmonar similares entre los pacientes que se sometieron a PVS con ventriculotomía y los que no. [59]
Se puede realizar una cirugía reparadora o reconstructiva adicional en los pacientes según lo requiera su anatomía cardíaca particular. [57] : 153
El momento de la cirugía en pacientes asintomáticos suele ser entre los dos meses y el año de edad. [20] : 201–202 Sin embargo, en pacientes sintomáticos que muestran un empeoramiento de los niveles de oxígeno en sangre, episodios graves de tet (episodios cianóticos) o dependencia de prostaglandinas desde el período neonatal temprano (para mantener abierto el conducto arterioso) deben planificarse con bastante urgencia [20] : 201–202
Las posibles complicaciones de la reparación quirúrgica incluyen defecto septal ventricular residual, obstrucción residual del tracto de salida, bloqueo auriculoventricular completo, arritmias, aneurisma del parche de salida del ventrículo derecho e insuficiencia de la válvula pulmonar. [58] : 59 Las complicaciones a largo plazo más comúnmente incluyen regurgitación de la válvula pulmonar y arritmias. [60]
La reparación total de la tetralogía de Fallot inicialmente conllevaba un alto riesgo de mortalidad, pero este riesgo ha disminuido de manera constante a lo largo de los años. En la actualidad, la cirugía se realiza a menudo en bebés de un año de edad o menores con una mortalidad perioperatoria inferior al 5 %. [20] : 205 Después de la cirugía, la mayoría de los pacientes disfrutan de una vida activa sin síntomas. [20] : 205 Actualmente, la supervivencia a largo plazo es cercana al 90 %. [20] : 167 Hoy en día, la población adulta con tetralogía de Fallot continúa creciendo y es uno de los defectos cardíacos congénitos más comunes que se observan en las clínicas ambulatorias para adultos. [5] : 100–101
Cirugía paliativa
Inicialmente, la cirugía implicó la formación de una anastomosis latero-terminal entre la arteria subclavia y la arteria pulmonar , es decir, una derivación arterial sistémica a pulmonar. [58] : 57 Esto redirigió una gran parte de la sangre parcialmente oxigenada que salía del corazón hacia el cuerpo hacia los pulmones, aumentando el flujo a través del circuito pulmonar y aliviando los síntomas. La primera cirugía de derivación Blalock-Thomas-Taussig se realizó en Eileen Saxon, de 15 meses , el 29 de noviembre de 1944 con resultados espectaculares. [61]
La derivación de Potts [62] y la derivación de Waterston-Cooley [63] [64] son otros procedimientos de derivación que se desarrollaron con el mismo propósito y que ya no se utilizan.
En la actualidad, no se suele realizar cirugía paliativa en bebés con TOF, excepto en casos extremos. [17] : 173 Por ejemplo, en bebés sintomáticos, se puede realizar una reparación en dos etapas (colocación inicial de una derivación sistémica a arterial seguida de una reparación quirúrgica total). [65] Las posibles complicaciones incluyen flujo sanguíneo pulmonar inadecuado, distorsión de la arteria pulmonar, crecimiento inadecuado de las arterias pulmonares y atresia pulmonar adquirida. [58] : 59
Enfoques para la reparación quirúrgica
Después de años de experiencia en reparación quirúrgica de la tetralogía de Fallot, la atención se desplazó a la evidencia emergente de que la insuficiencia pulmonar a largo plazo es perjudicial para la función ventricular derecha y el pronóstico clínico. [66] [67] Como resultado, se ha intensificado la búsqueda de procedimientos quirúrgicos para aliviar la obstrucción del tracto de salida del ventrículo derecho y minimizar la regurgitación pulmonar. [66] [67]
Una reconstrucción del tracto de salida del ventrículo derecho restringido con un parche de Dacron emparejado con una expansión nominal del anillo pulmonar o un abordaje de preservación del anillo produjo resultados de reparación completa primaria en 94 bebés con TOF. [66] [67] El tamaño del anillo pulmonar fue mayor en los bebés tratados con la última técnica, como se predijo. [66] [67] Después de un seguimiento promedio de alrededor de ocho años, el primer grupo tuvo una PR más alta que moderada, pero no hubo una diferencia significativa en la independencia de la PR severa después de diez años. [66] [67]
Además, no hubo diferencia significativa en la dilatación del ventrículo derecho entre las dos técnicas. [66] [67] Finalmente, encontraron que reconstruir el anillo pulmonar en TOF con solo una pequeña incisión transanular y un parche rígido de Dacron para inhibir la extensión del anillo pulmonar durante la fase de crecimiento normal produce los mismos beneficios a largo plazo que preservar la integridad completa del anillo pulmonar. [66] [67]
Complicaciones
Corto plazo
Los defectos septales ventriculares residuales y el bloqueo persistente del flujo de salida del ventrículo derecho son problemas comunes en el período posoperatorio inmediato. Pueden ocurrir arritmias como taquicardia ventricular, fibrilación/aleteo auricular y taquicardia por reentrada intraauricular después de la reparación de la tetralogía. [9] En el caso de la taquicardia de complejo amplio, el ECG probablemente mostrará patrones de bloqueo de la rama derecha o de la rama izquierda del haz de His. Los pacientes que se han sometido a una reparación cardíaca pueden sufrir muerte cardíaca súbita. Los factores de riesgo de ritmos cardíacos anormales incluyen:
- Edad (en el momento de la reparación) [9]
- Género masculino [9]
- Bloqueo cardíaco completo transitorio más allá del tercer día postoperatorio [9]
- Duración del QRS mayor a 180 milisegundos [9]
A largo plazo
Los pacientes adultos con cardiopatía congénita están aumentando a una tasa de alrededor del 5% por año, superando a la población pediátrica. [9] La sobrecarga de volumen del ventrículo derecho por insuficiencia pulmonar, aneurisma del ventrículo derecho por parche de salida o ventriculotomía, obstrucción de la arteria pulmonar distal, hipertrofia ventricular, agrandamiento de la cámara, disfunción biventricular y dilatación e insuficiencia de la raíz aórtica son todas complicaciones a largo plazo observadas en estos pacientes. [9] La arritmia, la insuficiencia cardíaca y las complicaciones de las reoperaciones son las tres causas principales de muerte en individuos con tetralogía de Fallot corregida. La duración del QRS mayor de 180 milisegundos, la edad avanzada en el momento de la reparación (más de tres años), la insuficiencia significativa de la válvula pulmonar o de la válvula tricúspide, antecedentes de síncope, contracciones ventriculares prematuras multifocales y taquicardia ventricular son algunos de los factores asociados con la muerte súbita después de 30 años del procedimiento. [68] La insuficiencia pulmonar es la causa más frecuente de reoperación y los criterios de reemplazo valvular pulmonar se han basado tradicionalmente en la gravedad de la fracción regurgitante en una resonancia magnética o una tomografía computarizada. Los índices de volumen telesistólico y telediastólico del ventrículo derecho e izquierdo, las fracciones de eyección y la existencia de un aneurisma que genere un flujo de salida obstructivo son todos parámetros observados en esta investigación. La intolerancia al ejercicio, los signos y síntomas de insuficiencia cardíaca, el síncope y la taquicardia ventricular prolongada son todos síntomas posibles. También se puede utilizar un método de válvula pulmonar transcatéter para reemplazar una válvula pulmonar. [68]
Embarazo
En comparación con la población obstétrica general, las mujeres que se repararon completamente la tetralogía de Fallot tienen resultados similares. [69] El grado de regurgitación pulmonar con disfunción ventricular derecha o izquierda, así como el nivel de hipertensión pulmonar, están vinculados a un mayor riesgo de complicaciones del embarazo. [69] La muerte fetal es más probable en mujeres que tienen hipertensión ventricular derecha moderada o que se han sometido a una derivación paliativa. En comparación con el 0,8% de la población general, los hijos de mujeres con tetralogía tienen una probabilidad del 3 al 5% de desarrollar una cardiopatía congénita. Si está presente la deleción 22q11, existe un 50% de probabilidad de transferir el cromosoma dañado, con un alto riesgo de una anomalía cardíaca congénita. [69]
Pronóstico
Sin tratamiento, la tetralogía de Fallot rápidamente produce hipertrofia ventricular derecha progresiva debido al aumento de la resistencia causado por el estrechamiento del tronco pulmonar. [20] : 199 Esto progresa a insuficiencia cardíaca que comienza en el ventrículo derecho y a menudo conduce a insuficiencia cardíaca izquierda y miocardiopatía dilatada. La tasa de mortalidad depende de la gravedad de la tetralogía de Fallot. Si no se trata, la tetralogía de Fallot conlleva una tasa de mortalidad del 35% en el primer año de vida y una tasa de mortalidad del 50% en los primeros tres años de vida. [60] Los pacientes con tetralogía de Fallot sin tratamiento rara vez progresan a la edad adulta. [60]
Los pacientes que se han sometido a una reparación quirúrgica total de la tetralogía de Fallot han mejorado la hemodinámica y a menudo tienen una función cardíaca buena a excelente después de la operación con algo de intolerancia al ejercicio (clase I-II de la New York Heart Association). [70] El resultado a largo plazo suele ser excelente para la mayoría de los pacientes, sin embargo, los defectos posquirúrgicos residuales como regurgitación pulmonar, estenosis de la arteria pulmonar, VSD residual, disfunción ventricular derecha, obstrucción del tracto de salida del ventrículo derecho pueden afectar la expectativa de vida y aumentar la necesidad de una nueva operación. [20] : 205
Las complicaciones cardiovasculares y cerebrovasculares en pacientes con cardiopatía congénita reparada, como la tetralogía de Fallot, ocurren a una edad más temprana en comparación con los sujetos sanos. [71] La regurgitación pulmonar crónica y la dilatación y disfunción del ventrículo derecho también son comunes. [72]
Dentro de los 30 años posteriores a la corrección, el 50% de los pacientes requerirán una nueva operación. [60] La causa más común de reoperación es una válvula pulmonar con fugas ( insuficiencia de la válvula pulmonar ). [60] Esto generalmente se corrige con un procedimiento llamado reemplazo de la válvula pulmonar . [24] : 136
Un factor pronóstico común en la TOF es el desarrollo de lesión por isquemia-reperfusión . La protección miocárdica insuficiente se considera una de las principales causas de muerte en la corrección de la TOF. [73] [74]
Comorbilidades
Existen muchas condiciones comórbidas que pueden ocurrir con la TOF que pueden exacerbar la condición. A menudo, la TOF puede presentarse con bajo peso al nacer y prematuridad. En ambos casos, se observó un aumento de la mortalidad y la morbilidad. [75] También se observaron diferencias en la mecánica auricular y ventricular derecha y la rigidez hepática en adultos con TOF reparada, así como atresia pulmonar y estenosis pulmonar persistente. [76] En pacientes con atresia pulmonar, hay una falla completa del flujo hacia adelante desde el ventrículo derecho a la vasculatura arterial pulmonar. Como tal, el flujo sanguíneo pulmonar depende completamente de la derivación de la circulación sistémica, típicamente a través de un conducto arterioso persistente. La fisiopatología de la TOF junto con el arterioso pulmonar es atribuible únicamente a defectos de las arterias pulmonares. Incluso después de la atención quirúrgica, estos pacientes siguen teniendo un mayor riesgo de estenosis arterial pulmonar e hipertensión pulmonar . [77]
También se observó que la enfermedad de Danon , que es un trastorno genético poco frecuente, complica la TOF. En particular, la elongación del complejo QRS y un intervalo PR acortado . Las anomalías genéticas encontradas en la TOF pueden conducir al diagnóstico temprano de la enfermedad de Danon, lo que ayuda a mejorar los resultados pronósticos. [78]
Epidemiología
La prevalencia de la tetralogía de Fallot se estima en 0,02-0,04%, lo que corresponde a aproximadamente 200 a 400 casos por millón de nacidos vivos. [79] [12] Representa el 7-10% de todas las anomalías cardíacas congénitas, lo que la convierte en el defecto cardíaco cianótico más común. [5] : 100–101 Aunque inicialmente se creía que los hombres y las mujeres se veían afectados por igual, estudios más recientes han demostrado que la TOF afecta a los hombres más que a las mujeres. [80] [12] Aproximadamente 1 de cada 100 recién nacidos es diagnosticado con un defecto cardíaco congénito, de los cuales el 10% son diagnosticados con TOF. [12] Genéticamente, se asocia más comúnmente con el síndrome de Down y el síndrome de DiGeorge. [5] [24] Se sabe que el síndrome de Down y otros trastornos cromosómicos ocurren junto con defectos cardíacos congénitos como la TOF. [12]
Historia
La tetralogía de Fallot fue descrita inicialmente en 1671 por el investigador danés Niels Steensen . [1] [15] También conocido como Nicolaus Steno en latín, Stensen fue un pionero en anatomía y geología, y su trabajo realizó una importante contribución específica a los campos de la anatomía y patología cardíaca. [9] Una descripción adicional fue publicada en 1888 por el médico francés Étienne-Louis Arthur Fallot , en cuyo honor recibió el nombre. [1] [16] En 1924, Maude Elizabeth Seymour Abbott, una cardióloga pediátrica de Montreal, Canadá, la denominó tetralogía de Fallot. [81]
El breve artículo "Disección de un feto monstruoso en París" de 1671 describió por primera vez las afecciones que más tarde se conocerían en conjunto como TOF. En particular, destacó la formación inusual de arterias, la estenosación de la arteria pulmonar, la ausencia del conducto arterioso, una aorta cabalgadora y la circulación cardíaca fetal en la que la sangre se redirigía a la aorta desde la arteria pulmonar. [9] Más de cien años después, en 1777, el médico holandés Eduard Sandifort informó sobre lo que él llamó el paciente "el niño azul". Este paciente, que tenía 16 meses, inicialmente se pensó que tenía asma , aunque una autopsia post mortem reveló una malformación cardíaca sin conducto arterioso ni ligamento arterioso, lo que indica que el niño podría haber muerto de TOF. [9] El médico escocés William Hunter informó sobre otro paciente de 13 años en 1782. Hunter describió al paciente, junto con otros tres, como pacientes de cianosis después de un examen póstumo en 1774. [9]
Otros casos, como los presentados por Pulteney (1785), Abernethy (1793), Bell (1797), Dorsey (1812) y Farre (1814) también contribuyeron a la comprensión moderna de la TOF. El primer caso informado de TOF se produjo en Estados Unidos en la Universidad de Pensilvania en 1816, y más casos fueron informados por Peacock (1858 y 1869), Widman (1881) y, finalmente, Fallot (1888), en cuyo honor se nombró la enfermedad. [9] Fallot fue el primero en describir elegantemente las cuatro características clave que la diferencian de otras afecciones cardíacas cianóticas, y fue prominente en la descalificación del foramen oval permeable como una quinta característica. Fallot inicialmente se refirió a ella como "La maladie bleue", que en francés significa "la enfermedad azul" o "cyanose cardiaque", que se traduce como "cianosis cardíaca". [9]
La primera reparación quirúrgica se llevó a cabo en 1944 en Johns Hopkins. [82] El procedimiento fue realizado por el cirujano Alfred Blalock y la cardióloga Helen B. Taussig , con Vivien Thomas también brindando contribuciones sustanciales y figurando como asistente. [3] Esta primera cirugía fue representada en la película Something the Lord Made . [61] En realidad, fue Helen Taussig quien convenció a Alfred Blalock de que la derivación iba a funcionar. Eileen Saxon, de 15 meses, fue la primera persona en recibir una derivación Blalock-Thomas-Taussig . [61] Además, el procedimiento Blalock-Thomas-Taussig, inicialmente el único tratamiento quirúrgico disponible para la tetralogía de Fallot, era paliativo pero no curativo. La primera reparación total de la tetralogía de Fallot fue realizada por un equipo dirigido por C. Walton Lillehei en la Universidad de Minnesota en 1954 en un niño de 11 años. [83] La reparación total en bebés ha tenido éxito desde 1981, y las investigaciones indican que tiene una tasa de mortalidad comparativamente baja. [70] Hoy en día, la población adulta con TOF continúa creciendo y es uno de los defectos cardíacos congénitos más comunes que se observan en las clínicas ambulatorias para adultos. [5] : 100–101
Trastornos relacionados
Las siguientes enfermedades presentan síntomas comparables a los de la tetralogía de Fallot. Para el diagnóstico diferencial, la comparación entre estos trastornos aporta información valiosa.
Defectos del tabique auricular
Los defectos del tabique auricular (CIA) son un tipo de anomalía cardíaca congénita en la que existe una pequeña abertura entre las dos aurículas del corazón. [84] [12] La carga en el lado derecho del corazón aumenta como resultado de estas anomalías, al igual que el flujo sanguíneo a los pulmones. [84] [12] Esto conduce a un flujo sanguíneo excesivo a los pulmones y una mayor carga de trabajo en el lado derecho del corazón. [84] [12] Otro hallazgo común asociado con los CIA es la hipertrofia ventricular derecha, también conocida como agrandamiento del ventrículo derecho. [12]
Defectos del tabique ventricular
Los defectos del tabique ventricular (VSD, por sus siglas en inglés) son un tipo de anomalía cardíaca congénita en la que falta uno de los ventrículos. [85] [12] Dos aurículas y un ventrículo grande son comunes en bebés con anomalías congénitas. [85] [12] Los síntomas de estas enfermedades incluyen una frecuencia respiratoria inusualmente alta (taquipnea), un tono azulado en la piel (cianosis), sibilancia, latidos cardíacos rápidos (taquicardia) y/o un hígado anormalmente agrandado, que son similares a los de otros problemas cardíacos congénitos (hepatomegalia). [85] [12] Los VSD también pueden provocar una acumulación de líquido alrededor del corazón, lo que puede provocar insuficiencia cardíaca congestiva. [85] [12]
Defecto del tabique auriculoventricular
El defecto del tabique auriculoventricular (DAV) es una cardiopatía congénita poco frecuente que se caracteriza por un desarrollo defectuoso de los tabiques y las válvulas del corazón. [86] [12] La insuficiencia cardíaca congestiva es común en los bebés con la versión completa de la afección. [86] [12] El líquido se acumula en otras partes del cuerpo, en particular en los pulmones. [86] [12] La congestión pulmonar (disnea) puede provocar dificultades respiratorias. [86] [12]
Estenosis de la válvula mitral
La estenosis de la válvula mitral es una anomalía cardíaca poco común que puede ocurrir al nacer (congénita) o desarrollarse más tarde en la vida (adquirida). [87] [12] El estrechamiento aberrante de la abertura de la válvula mitral caracteriza esta condición. [87] [12] Hay dos versiones de esta condición conocidas como congénita y adquirida que se caracterizan por diferentes síntomas. [12] Los síntomas de la estenosis de la válvula mitral congénita incluyen una amplia gama, como infecciones respiratorias, dificultades para respirar, palpitaciones cardíacas y tos. [12] Los síntomas de la estenosis de la válvula mitral adquirida también incluyen una amplia gama, como pérdida de conciencia, angina, debilidad general y malestar abdominal. [12]
Casos notables
- Shaun White , [88] snowboarder y skater profesional estadounidense.
- Beau Casson , [89] jugador de críquet australiano
- Dennis McEldowney , [90] autor y editor neozelandés
- Max Page , el "Pequeño Darth Vader" de Volkswagen en el anuncio del Super Bowl de 2011 [91]
- Billy Kimmel, hijo del presentador de programas de entrevistas Jimmy Kimmel ; el diagnóstico de Billy llevó a Kimmel a hablar sobre el acceso a la atención médica en su programa Jimmy Kimmel Live! [92]
Véase también
Referencias
- ^ abcde Lehn M. "La tetralogía de Fallot". ¿Quién la nombró? Archivado desde el original el 3 de octubre de 2016 . Consultado el 2 de octubre de 2016 .
- ^ abcdefg "¿Cuáles son los signos y síntomas de la tetralogía de Fallot?". NHLBI . 1 de julio de 2011. Archivado desde el original el 5 de octubre de 2016. Consultado el 2 de octubre de 2016 .
- ^ abcd Warnes CA (julio de 2005). "El adulto con cardiopatía congénita: ¿nacido para ser malo?". Journal of the American College of Cardiology . 46 (1): 1–8. doi : 10.1016/j.jacc.2005.02.083 . PMID 15992627.
- ^ abcdefgh "¿Qué es la tetralogía de Fallot?". NHLBI . 1 de julio de 2011. Archivado desde el original el 4 de octubre de 2016. Consultado el 2 de octubre de 2016 .
- ^ abcdefgh Roos-Hesselink JW, Johnson MR (2017). Embarazo y cardiopatía congénita . Cham: Springer. pág. 62. ISBN 9783319389134.OCLC 969644876 .
- ^ "¿Cómo se diagnostica la tetralogía de Fallot?". NHLBI . 1 de julio de 2011. Archivado desde el original el 29 de abril de 2017. Consultado el 7 de mayo de 2017 .
- ^ Prasad R, Kahan S, Mohan P (2007). En una página: Cardiología. Lippincott Williams & Wilkins. ISBN 9780781764964Archivado desde el original el 15 de mayo de 2021. Consultado el 15 de septiembre de 2017 .
- ^ abcde "¿Cómo se trata la tetralogía de Fallot?". NHLBI . 1 de julio de 2011. Archivado desde el original el 5 de octubre de 2016. Consultado el 2 de octubre de 2016 .
- ^ abcdefghijklmnop Diaz-Frias J, Guillaume M (2021). "Tetralogía de Fallot". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 30020660. Archivado desde el original el 2020-08-12 . Consultado el 2021-12-05 .
- ^ abcdefg Hay WW, Levin MJ, Deterding RR, Abzug MJ (2 de mayo de 2016). Diagnóstico y tratamiento actuales: pediatría (23ª ed.). Nueva York. ISBN 9780071848541.OCLC 951067614 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ "¿Qué causa la tetralogía de Fallot?". NHLBI . 1 de julio de 2011. Archivado desde el original el 5 de octubre de 2016. Consultado el 2 de octubre de 2016 .
- ^ abcdefghijklmnopqrstu v "Tetralogía de Fallot". NORD (Organización Nacional de Enfermedades Raras) . Archivado desde el original el 2021-11-10 . Consultado el 21-11-2021 .
- ^ Yuh DD (2014). Libro de texto de cirugía cardiotorácica de Johns Hopkins (2.ª ed.). Nueva York: McGraw-Hill Companies. ISBN 9780071663502.OCLC 828334087 .
- ^ "Tipos de defectos cardíacos congénitos". NHLBI . 1 de julio de 2011. Archivado desde el original el 5 de octubre de 2016 . Consultado el 2 de octubre de 2016 .
- ^ ab Van Praagh R (2009). "La primera conferencia conmemorativa de Stella van Praagh: la historia y la anatomía de la tetralogía de Fallot". Seminarios en cirugía torácica y cardiovascular. Cirugía cardíaca pediátrica anual . 12 : 19–38. doi :10.1053/j.pcsu.2009.01.004. PMID 19349011.
- ^ ab Fallot A (1888). Contribución a la anatomía patológica de la enfermedad azul (cianosa cardíaca), por le Dr. A. Fallot, ... (en francés). Marsella: Impr. de Barlatier-Feissat. págs. 77–93. OCLC 457786038.
- ^ abcdefg Abdulla R (2011). Enfermedades cardíacas en niños: guía para pediatras . Nueva York: Springer. pp. 169-170. ISBN 9781441979940.OCLC 719361786 .
- ^ "Tetralogía de Fallot: descripción general". eMedicine . Archivado desde el original el 23 de diciembre de 2008 . Consultado el 2 de enero de 2009 .
- ^ Russell MW, Chung WK, Kaltman JR, Miller TA (marzo de 2018). "Avances en la comprensión de los determinantes genéticos de la cardiopatía congénita y su impacto en los resultados clínicos". Revista de la Asociación Estadounidense del Corazón . 7 (6). doi :10.1161/JAHA.117.006906. PMC 5907537 . PMID 29523523.
- ^ abcdefghijklmnopqr Munoz R, Morell V, Cruz E, Vetterly C (2010). Cuidados críticos de niños con cardiopatías: conceptos médicos y quirúrgicos básicos . Londres: Springer-Verlag. p. 18. ISBN 9781848822627.OCLC 663096154 .
- ^ ab Murakami T (noviembre de 2002). "Squatting: the hemodynamic change is induced by enhanced aortic wave reflection" (En cuclillas: el cambio hemodinámico es inducido por una reflexión mejorada de la onda aórtica). American Journal of Hypertension (Revista estadounidense de hipertensión ). 15 (11): 986–988. doi : 10.1016/S0895-7061(02)03085-6 . PMID: 12441219.
- ^ Guntheroth WG, Mortan BC, Mullins GL, Baum D (marzo de 1968). "Retorno venoso con posición rodilla-pecho y en cuclillas en la tetralogía de Fallot". American Heart Journal . 75 (3): 313–318. doi :10.1016/0002-8703(68)90087-2. PMID 5638470.
- ^ abcd Wang X, Li P, Chen S, Xi L, Guo Y, Guo A, Sun K (febrero de 2014). "Influencia de los genes y el medio ambiente en los defectos cardíacos congénitos familiares". Molecular Medicine Reports . 9 (2): 695–700. doi : 10.3892/mmr.2013.1847 . PMID 24337398.
- ^ abcdefgh Francois LG, Bove EL, Hraška V, Morell VO, Spray TL (2016). Cirugía de anomalías conotruncales . Cham. ISBN 9783319230573. OCLC 945874817.
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )[ página necesaria ] - ^ ab Eldadah ZA, Hamosh A, Biery NJ, Montgomery RA, Duke M, Elkins R, Dietz HC (enero de 2001). "Tetralogía familiar de Fallot causada por mutación en el gen jagged1". Genética Molecular Humana . 10 (2): 163–169. doi : 10.1093/hmg/10.2.163 . PMID 11152664.
- ^ Chung IM, Rajakumar G (enero de 2016). "Genética de los defectos cardíacos congénitos: el gen NKX2-5, un factor clave". Genes . 7 (2): 6. doi : 10.3390/genes7020006 . PMC 4773750 . PMID 26805889.
- ^ Goldmuntz E, Geiger E, Benson DW (noviembre de 2001). "Mutaciones de NKX2.5 en pacientes con tetralogía de Fallot". Circulation . 104 (21): 2565–2568. doi : 10.1161/hc4601.098427 . PMID 11714651.
- ^ ab Pizzuti A, Sarkozy A, Newton AL, Conti E, Flex E, Digilio MC, et al. (noviembre de 2003). "Mutaciones del gen ZFPM2/FOG2 en casos esporádicos de tetralogía de Fallot". Human Mutation . 22 (5): 372–377. doi :10.1002/humu.10261. PMID 14517948. S2CID 21531781.
- ^ ab Lambrechts D, Devriendt K, Driscoll DA, Goldmuntz E, Gewillig M, Vlietinck R, et al. (junio de 2005). "El haplotipo de VEGF de baja expresión aumenta el riesgo de tetralogía de Fallot: un estudio de asociación basado en la familia". Journal of Medical Genetics . 42 (6): 519–522. doi :10.1136/jmg.2004.026443. PMC 1736071 . PMID 15937089.
- ^ abc Page DJ, Miossec MJ, Williams SG, Monaghan RM, Fotiou E, Cordell HJ, et al. (febrero de 2019). "La secuenciación del exoma completo revela los principales contribuyentes genéticos a la tetralogía de Fallot no sindrómica". Investigación de la circulación . 124 (4): 553–563. doi :10.1161/CIRCRESAHA.118.313250. PMC 6377791 . PMID 30582441.
- ^ ab Griffin HR, Töpf A, Glen E, Zweier C, Stuart AG, Parsons J, et al. (octubre de 2010). "Un estudio sistemático de variantes en TBX1 en la tetralogía de Fallot no sindrómica identifica una nueva deleción de 57 pares de bases que reduce la actividad transcripcional, pero no encuentra evidencia de asociación con variantes comunes". Heart . 96 (20): 1651–1655. doi :10.1136/hrt.2010.200121. PMC 2976076 . PMID 20937753.
- ^ abc Morgenthau A, Frishman WH (marzo-abril de 2018). "Orígenes genéticos de la tetralogía de Fallot". Cardiology in Review . 26 (2): 86-92. doi :10.1097/CRD.0000000000000170. PMID 29045289. S2CID 46781422.
- ^ Zhou P, He A, Pu WT (enero de 2012). Bruneau BG (ed.). "Capítulo cinco: Regulación de la actividad transcripcional de GATA4 en el desarrollo y la enfermedad cardiovascular". Temas actuales en biología del desarrollo . Desarrollo del corazón. 100. Academic Press: 143–169. doi :10.1016/B978-0-12-387786-4.00005-1. PMID 22449843.
- ^ Kalayinia S, Maleki M, Mahdavi M, Mahdieh N (noviembre de 2021). "La secuenciación del exoma completo revela una nueva mutación del gen FLNA en una familia iraní con tetralogía de Fallot no sindrómica". Medicina de laboratorio . 52 (6): 614–618. doi :10.1093/labmed/lmab018. PMID 33942857.
- ^ abc Zhu Y, Romitti PA, Caspers Conway KM, Shen DH, Sun L, Browne ML, et al. (julio de 2015). "Consumo de alcohol materno periconcepcional y defectos cardíacos congénitos". Birth Defects Research. Parte A, Teratología clínica y molecular . 103 (7): 617–629. doi :10.1002/bdra.23352. PMC 7668305. PMID 26118863 .
- ^ abc Priest JR, Yang W, Reaven G, Knowles JW, Shaw GM (diciembre de 2015). "Niveles de glucosa materna a mitad del embarazo y riesgo de cardiopatía congénita en la descendencia". JAMA Pediatrics . 169 (12): 1112–1116. doi :10.1001/jamapediatrics.2015.2831. PMC 4996656 . PMID 26457543.
- ^ Petropoulos AC (1 de marzo de 2004). "Cardiopatía congénita y diabetes materna". Archivos de enfermedades de la infancia . 89 (3). BMJ Publishing Group Ltd y Royal College of Paediatrics and Child Health: 211. ISSN 0003-9888. Archivado desde el original el 17 de noviembre de 2021. Consultado el 17 de noviembre de 2021 .
- ^ ab Yazigi A, De Pecoulas AE, Vauloup-Fellous C, Grangeot-Keros L, Ayoubi JM, Picone O (febrero de 2017). "Anormalidades fetales y neonatales debidas al síndrome de rubéola congénita: una revisión de la literatura". The Journal of Maternal-Fetal & Neonatal Medicine . 30 (3): 274–278. doi :10.3109/14767058.2016.1169526. PMID 27002428. S2CID 43897118.
- ^ ab Hashim ST, Alamri RA, Bakraa R, Rawas R, Farahat F, Waggass R (marzo de 2020). "La asociación entre la edad materna y la prevalencia de cardiopatías congénitas en recién nacidos de 2016 a 2018 en un único centro cardíaco en Jeddah, Arabia Saudita". Cureus . 12 (3): e7463. doi : 10.7759/cureus.7463 . PMC 7188012 . PMID 32351842.
- ^ Jameson JL, Kasper DL, Fauci AS, Hauser SL, Longo DL, Loscalzo J (2018). Principios de medicina interna de Harrison (20.ª edición). Nueva York. ISBN 9781259644047.OCLC 990065894 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace )[ página necesaria ] - ^ abc Gatzoulis MA, Webb GD, Daubeney PE. (2005) Diagnóstico y tratamiento de la cardiopatía congénita en adultos . Churchill Livingstone, Filadelfia. ISBN 0-443-07103-9 . [ página necesaria ]
- ^ Bartelings MM, Gittenberger-de Groot AC (agosto de 1991). "Consideraciones morfogenéticas sobre malformaciones congénitas del tracto de salida. Parte 1: Tronco arterial común y tetralogía de Fallot". Revista Internacional de Cardiología . 32 (2): 213–230. doi :10.1016/0167-5273(91)90329-N. PMID 1917172.
- ^ Anderson RH, Weinberg PM (febrero de 2005). "La anatomía clínica de la tetralogía de Fallot". Cardiología en los jóvenes . 15 (Supl. 1): 38–47. doi :10.1017/s1047951105001010. PMID 15934690. S2CID 31250764.
- ^ Anderson RH, Tynan M (diciembre de 1988). "Tetralogía de Fallot: una revisión centenaria". Revista Internacional de Cardiología . 21 (3): 219–232. doi :10.1016/0167-5273(88)90100-3. PMID 3068155.
- ^ Hennein HA, Mosca RS, Urcelay G, Crowley DC, Bove EL (febrero de 1995). "Resultados intermedios después de la reparación completa de la tetralogía de Fallot en neonatos". The Journal of Thoracic and Cardiovascular Surgery . 109 (2): 332–342, 344, discusión 342–343. doi : 10.1016/S0022-5223(95)70395-0 . PMID 7531798.
- ^ Cheng TO (1995). "Pentalogía de Cantrell vs. pentalogía de Fallot". Revista del Instituto del Corazón de Texas . 22 (1): 111–112. PMC 325224 . PMID 7787464.
- ^ Farouk A, Zahka K, Siwik E, Erenberg F, Al-Khatib Y, Golden A, et al. (febrero de 2009). "Enfoque individualizado para el tratamiento quirúrgico de la tetralogía de Fallot con atresia pulmonar". Cardiología en los jóvenes . 19 (1): 76–85. doi :10.1017/S1047951108003430. PMID 19079949. S2CID 2529238.
- ^ abcde Bailliard F, Anderson RH (enero de 2009). "Tetralogía de Fallot". Orphanet Journal of Rare Diseases . 4 : 2. doi : 10.1186/1750-1172-4-2 . PMC 2651859 . PMID 19144126.
- ^ Weerakkody Y. "Tetralogía de Fallot: artículo de referencia sobre radiología". radiopaedia.org . Archivado desde el original el 20 de febrero de 2012.
- ^ ab Abdulla R (2011). Enfermedades cardíacas en niños: guía para pediatras . Nueva York: Springer. pp. 169–70. ISBN 9781441979940.OCLC 719361786 .
- ^ abcd Woods A (abril de 1952). "El electrocardiograma en la tetralogía de Fallot". British Heart Journal . 14 (2): 193–203. doi :10.1136/hrt.14.2.193. PMC 479443 . PMID 14916062.
- ^ "Hipertrofia ventricular derecha (HVD) • LITFL • Diagnóstico de la biblioteca de ECG". La vida en el carril rápido . 2018-08-01. Archivado desde el original el 2019-01-22 . Consultado el 2019-01-21 .
- ^ "Defectos cardíacos congénitos | Instituto Nacional del Corazón, los Pulmones y la Sangre (NHLBI)" www.nhlbi.nih.gov . Archivado desde el original el 2018-10-22 . Consultado el 2019-02-01 .
- ^ Wu IL, Tseng JC (junio de 2015). "Embolia pulmonar en un paciente con tetralogía de Fallot: un desafío diagnóstico". The American Journal of Emergency Medicine . 33 (6): 865.e5–865.e6. doi :10.1016/j.ajem.2014.12.061. PMID 25619873.
- ^ Gawalkar AA (3 de diciembre de 2021). «Manejo del episodio de Tet: una revisión actualizada» (PDF) . Current Research in Emergency Medicine . 1 (1): 1–2. doi :10.54026/CREM/1002. S2CID 248489949. Archivado (PDF) del original el 3 de diciembre de 2021. Consultado el 3 de diciembre de 2021 .
- ^ Tsze DS, Vitberg YM, Berezow J, Starc TJ, Dayan PS (julio de 2014). "Tratamiento de la tetralogía de Fallot en un episodio hipóxico con fentanilo intranasal". Pediatría . 134 (1): e266–e269. doi :10.1542/peds.2013-3183. PMID 24936003. S2CID 2996572.
- ^ abc Mavroudis C, Backer CL, Idriss RF (2015). Atlas de cirugía cardíaca pediátrica . Londres. ISBN 9781447153191.OCLC 926915143 .
{{cite book}}: Mantenimiento de CS1: falta la ubicación del editor ( enlace ) - ^ abcd Corno AF, Festa GP (2009). Defectos cardíacos congénitos: toma de decisiones para cirugía cardíaca. Volumen 3, Tomografía computarizada y resonancia magnética . Darmstadt: Steinkopff. ISBN 9783798517196.OCLC 433550801 .
- ^ Ono, Yoshikazu; Hoashi, Takaya; Imai, Kenta; Okuda, Naoki; Komori, Motoki; Kurosaki, Kenichi; Ichikawa, Hajime (1 de marzo de 2022). "Impacto de la ventriculotomía derecha para la reparación de la tetralogía de Fallot con un procedimiento de conservación de la válvula pulmonar". JTCVS Abierto . 9 : 191-205. doi :10.1016/j.xjon.2021.10.061. ISSN 2666-2736. PMC 9390402 . PMID 36003424.
- ^ abcde Chessa M, Giamberti A (2012). El ventrículo derecho en adultos con tetralogía de Fallot . Milán: Springer. pag. 155.ISBN 9788847023581.OCLC 813213115 .
- ^ abc "Derivación Blalock-Taussig". Primeras operaciones . The Johns Hopkins Medical Institutions. Archivado desde el original el 2007-11-30 . Consultado el 2007-11-15 .
- ^ Boshoff D, Budts W, Daenen W, Gewillig M (enero de 2005). "Cierre transcatéter de un shunt de Potts con posterior reparación quirúrgica de la tetralogía de Fallot". Cateterismo e intervenciones cardiovasculares . 64 (1): 121–123. doi :10.1002/ccd.20247. PMID 15619282. S2CID 46528126.
- ^ Daehnert I, Wiener M, Kostelka M (mayo de 2005). "Tratamiento con stent recubierto de la estenosis de la arteria pulmonar derecha y la derivación de Waterston". Anales de cirugía torácica . 79 (5): 1754–1755. doi :10.1016/j.athoracsur.2003.11.059. PMID 15854971.
- ^ "Derivación de la arteria sistémica a la pulmonar para paliación". eMedicine.com . Archivado desde el original el 2008-12-29 . Consultado el 2009-01-02 .
- ^ Munoz RA (2010). Cuidados críticos de niños con cardiopatías: conceptos médicos y quirúrgicos básicos . Londres: Springer-Verlag. p. 217. ISBN 9781848822627.OCLC 663096154 .
- ^ abcdefg Bové T (enero de 2017). "Reparación quirúrgica de la tetralogía de Fallot: la búsqueda de la reparación 'ideal'". Pediatría traslacional . 6 (1): 64–66. doi : 10.21037/tp.2016.11.02 . PMC 5253268 . PMID 28164034.
- ^ abcdefg van der Ven JP, van den Bosch E, Bogers AJ, Helbing WA (29 de agosto de 2019). "Resultados actuales y tratamiento de la tetralogía de Fallot". F1000Research . 8 : F1000 Faculty Rev–1530. doi : 10.12688/f1000research.17174.1 . PMC 6719677 . PMID 31508203.
- ^ ab Singab H (15 de julio de 2021). "Revisión de: 'La circulación derivada de la resonancia magnética de flujo 4D se correlaciona con la disfunción ventricular derecha en pacientes con tetralogía de Fallot'". Qeios . doi : 10.32388/ab6qgw . S2CID 237843363.
- ^ abc Singh Y, Thomson J (noviembre de 2011). "Complicaciones durante el cateterismo cardíaco diagnóstico en niños con tetralogía de Fallot". Pediatric Research . 70 : 279. doi : 10.1038/pr.2011.504 . ISSN 0031-3998. S2CID 6071354.
- ^ ab Cobanoglu A, Schultz JM (julio de 2002). "Corrección total de la tetralogía de Fallot en el primer año de vida: resultados tardíos". Anales de Cirugía Torácica . 74 (1): 133–138. doi : 10.1016/s0003-4975(02)03619-6 . PMID: 12118745.
- ^ Wykretowicz A, Trojnarska O, Guzik P, Katarzyska A (marzo de 2007). "Rigidez arterial en pacientes adultos con cardiopatía congénita cianótica". Cardiopatía congénita . 2 (2): 134–138. doi :10.1111/j.1747-0803.2007.00087.x. PMID 18377491.
- ^ Loke YH, Capuano F, Cleveland V, Mandell JG, Balaras E, Olivieri LJ (agosto de 2021). "Más allá del tamaño: la vorticidad y la pérdida de energía se correlacionan con la disfunción ventricular derecha y la intolerancia al ejercicio en la tetralogía de Fallot reparada". Revista de resonancia magnética cardiovascular . 23 (1): 98. doi : 10.1186/s12968-021-00789-2 . PMC 8377822 . PMID 34412634.
- ^ Wu Q, Wang T, Chen S, Zhou Q, Li H, Hu N, et al. (marzo de 2018). "Efectos protectores cardíacos del preacondicionamiento isquémico remoto en niños sometidos a cirugía de reparación de tetralogía de Fallot: un ensayo controlado aleatorizado". Revista Europea del Corazón . 39 (12): 1028–1037. doi :10.1093/eurheartj/ehx030. PMC 6018784 . PMID 28329231.
- ^ Ji Q, Mei Y, Wang X, Feng J, Wusha D, Cai J, Zhou Y (2011). "Efecto del poscondicionamiento isquémico en la corrección de la tetralogía de Fallot". Revista Internacional del Corazón . 52 (5): 312–317. doi : 10.1536/ihj.52.312 . PMID 22008443. S2CID 27528923.
- ^ Boghossian NS (2011). Supervivencia y morbilidad entre bebés con muy bajo peso al nacer y anomalías cromosómicas (Tesis). Universidad de Iowa. doi :10.17077/etd.lm364r03.
- ^ Li VW, So EK, Li W, Chow PC, Cheung YF (octubre de 2021). "Interacción entre la función auricular derecha y la rigidez hepática en adultos con lesiones obstructivas del flujo de salida del ventrículo derecho reparadas". Revista Europea del Corazón: Imágenes Cardiovasculares . 22 (11): 1285–1294. doi :10.1093/ehjci/jeaa344. PMID 33367540.
- ^ Quinlan CA, Latham GJ, Joffe D, Ross FJ (septiembre de 2021). "Consideraciones perioperatorias y anestésicas en la tetralogía de Fallot con atresia pulmonar". Seminarios en anestesia cardiotorácica y vascular . 25 (3): 218–228. doi :10.1177/10892532211027395. PMID 34380349. S2CID 236990212.
- ^ Shimozono T, Ueno K, Shiokawa N, Ohno S, Kawano Y (agosto de 2021). "Diagnóstico temprano de la enfermedad de Danon infantil complicada por tetralogía de Fallot". Pediatrics International . 63 (8): 988–990. doi :10.1111/ped.14542. PMID 34086384. S2CID 235335431.
- ^ Child JS (julio de 2004). "Tetralogía de Fallot y embarazo: pronóstico y profecía". Journal of the American College of Cardiology . 44 (1): 181–183. doi : 10.1016/j.jacc.2004.04.009 . PMID 15234430.
- ^ "¿Qué es la tetralogía de Fallot?". NHLBI . 1 de julio de 2011. Archivado desde el original el 4 de octubre de 2016. Consultado el 2 de octubre de 2016 .
- ^ Abbott ME, Dawson WT (1924). "La clasificación clínica de la cardiopatía congénita, con observaciones sobre su anatomía patológica, diagnóstico y tratamiento". Int Clin . 4 : 156–188.
- ^ Sun B (8 de febrero de 2007). «Vivien Thomas ayudó a desarrollar la operación del 'bebé azul' en Johns Hopkins». Baltimoresun.com . Archivado desde el original el 14 de febrero de 2019. Consultado el 17 de febrero de 2019 .
- ^ Lillehei CW, Cohen M, Warden HE, Read RC, Aust JB, Dewall RA, Varco RL (septiembre de 1955). "Corrección quirúrgica intracardíaca con visión directa de la tetralogía de Fallot, la pentalogía de Fallot y los defectos de atresia pulmonar; informe de los primeros diez casos". Anales de cirugía . 142 (3): 418–442. doi :10.1097/00000658-195509000-00010. PMC 1465089 . PMID 13249340.
- ^ abc Thorne S, Clift P, eds. (octubre de 2011). "Defectos del tabique auricular (CIA)". Oxford Medicine Online : 93–104. doi :10.1093/med/9780199228188.003.0013. ISBN 978-0-19-172592-0.
- ^ abcd Dakkak W, Oliver TI (2021). "Defecto del tabique ventricular". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 29261884. Archivado desde el original el 28 de octubre de 2021 . Consultado el 1 de diciembre de 2021 .
- ^ abcd Ahmed I, Anjum F (2021). "Defecto del tabique auriculoventricular". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 32965865 . Consultado el 1 de diciembre de 2021 .
- ^ ab Shah SN, Sharma S (2021). "Estenosis mitral". StatPearls . Treasure Island (FL): StatPearls Publishing. PMID 28613493. Archivado desde el original el 25 de febrero de 2021 . Consultado el 1 de diciembre de 2021 .
- ^ Yen YW (7 de julio de 2003). "Double Ripper". SI.com – SI Adventure . Archivado desde el original el 30 de enero de 2009. Consultado el 2 de enero de 2009 .
- ^ Brown A, Saltau C (6 de junio de 2008). «Nuevo giro en el asombroso viaje de Casson: críquet y deporte». The Sydney Morning Herald . Archivado desde el original el 8 de junio de 2008. Consultado el 2 de enero de 2009 .
- ^ "McEldowney, Dennis". New Zealand Book Council . Archivado desde el original el 2008-10-16 . Consultado el 2009-02-28 .
- ^ Inbar M (7 de febrero de 2011). «'Little Darth Vader' revela el rostro detrás de la Fuerza». NBC News . Archivado desde el original el 25 de agosto de 2013. Consultado el 17 de noviembre de 2019 .
- ^ McCluskey M (26 de diciembre de 2017). "Asistente de Jimmy Kimmel en todas las ocasiones en las que se ha vuelto político". Time . Archivado desde el original el 27 de febrero de 2018. Consultado el 23 de febrero de 2018 .
Enlaces externos
- ¿Qué es la tetralogía de Fallot? en los Institutos Nacionales de Salud
- Entender el corazón de su hijo: Tetralogía de Fallot de la British Heart Foundation
