Rifamicina
 | |
 | |
| Datos clínicos | |
|---|---|
| Nombres comerciales | Aemcolo |
| AHFS / Drogas.com | Monografía |
| MedlinePlus | a619010 |
| Datos de licencia |
|
| Vías de administración | Por la boca |
| Código ATC | |
| Estatus legal | |
| Estatus legal |
|
| Identificadores | |
| Número CAS |
|
| Identificador de centro de PubChem |
|
| Banco de medicamentos |
|
| Araña química |
|
| UNIVERSIDAD |
|
| BARRIL |
|
| EBICh |
|
| Química biológica |
|
| Datos químicos y físicos | |
| Fórmula | C37H47NO12 |
| Masa molar | 697,778 g·mol −1 |
| Modelo 3D ( JSmol ) |
|
| |
| |
Las rifamicinas son un grupo de antibióticos sintetizados de forma natural por la bacteria Amycolatopsis rifamycinica o artificialmente. Son una subclase de la familia más amplia de las ansamicinas . Las rifamicinas son especialmente eficaces contra las micobacterias y, por lo tanto, se utilizan para tratar la tuberculosis , la lepra y las infecciones por el complejo Mycobacterium avium (MAC).
El grupo de la rifamicina incluye los fármacos clásicos de la rifamicina, así como los derivados de la rifamicina, rifampicina (o rifampicina), rifabutina , rifapentina , rifalazil y rifaximina . La rifamicina, que se comercializa bajo el nombre comercial Aemcolo, está aprobada en los Estados Unidos para el tratamiento de la diarrea del viajero en algunas circunstancias. [1] [2] [3]
El nombre "rifamicina" (originalmente "rifomicina") se deriva de la película francesa Rififi de 1955. [ 4 ] : S402
Bacteria
El Streptomyces mediterranei fue aislado por primera vez en 1957 a partir de una muestra de suelo recogida cerca de la ciudad costera de Saint Raphael , en el sur de Francia. El nombre se lo dieron originalmente dos microbiólogos que trabajaban con la empresa farmacéutica italiana Group Lepetit SpA en Milán , la italiana Grazia Beretta y Pinhas Margalith de Israel. [5]
En 1969, la bacteria fue rebautizada como Nocardia mediterranei cuando otro científico llamado Thiemann descubrió que tenía una pared celular típica de la especie Nocardia. Luego, en 1986, la bacteria fue rebautizada nuevamente como Amycolatopsis mediterranei , como la primera especie de un nuevo género, porque un científico llamado Lechevalier descubrió que la pared celular carece de ácido micólico y no puede ser infectada por los fagos Nocardia y Rhodococcus. Basándose en secuencias de ARN ribosómico 16S , Bala et al. rebautizaron la especie en 2004 como Amycolatopsis rifamycinica .
Primeros medicamentos
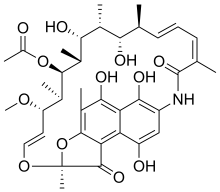
Las rifamicinas fueron aisladas por primera vez en 1957 a partir de un cultivo de fermentación de Streptomyces mediterranei en el laboratorio de Gruppo Lepetit SpA en Milán por dos científicos llamados Piero Sensi y Maria Teresa Timbal, en colaboración con el científico israelí Pinhas Margalith. Inicialmente, se descubrió una familia de antibióticos estrechamente relacionados denominados Rifamycin A, B, C, D, E. El único componente de esta mezcla lo suficientemente estable como para aislarlo en forma pura era la Rifamycin B, que lamentablemente era poco activa. Sin embargo, estudios posteriores demostraron que, si bien la Rifamycin B era esencialmente inactiva, se oxidaba e hidrolizaba espontáneamente en soluciones acuosas para producir la altamente activa Rifamycin S. La simple reducción de la Rifamycin S produjo la forma de hidroquinona llamada Rifamycin SV, que se convirtió en el primer miembro de esta clase en ingresar al uso clínico como antibiótico intravenoso. Una modificación química posterior de la Rifamycin SV produjo un análogo mejorado, la Rifamide, que también se introdujo en la práctica clínica, pero que se limitó de manera similar al uso intravenoso. Después de un extenso programa de modificación, finalmente se produjo la rifampicina, que está disponible por vía oral y se ha convertido en un pilar del tratamiento de la tuberculosis [4].
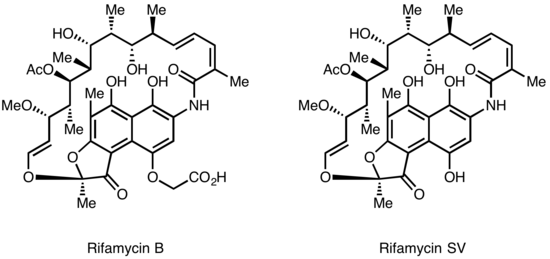
Lepetit solicitó protección de patente para la rifamicina B en el Reino Unido en agosto de 1958 y en los EE. UU. en marzo de 1959. La patente británica GB921045 se concedió en marzo de 1963 y la patente estadounidense 3.150.046 se concedió en septiembre de 1964. Se considera ampliamente que el fármaco ayudó a superar el problema de la tuberculosis resistente a los medicamentos en la década de 1960.
Ensayos clínicos
Las rifamicinas se han utilizado para el tratamiento de muchas enfermedades, siendo la más importante la tuberculosis relacionada con el VIH. Una revisión sistemática de ensayos clínicos sobre regímenes alternativos para la prevención de la tuberculosis activa en individuos VIH negativos con TB latente encontró que un régimen semanal, directamente observado, de rifapentina con isoniazida durante tres meses fue tan eficaz como un régimen diario, autoadministrado de isoniazida durante nueve meses. Pero el régimen de rifapentina-isoniazida tuvo tasas más altas de finalización del tratamiento y tasas más bajas de hepatotoxicidad . Sin embargo, la tasa de eventos adversos limitantes del tratamiento fue mayor en el régimen de rifapentina-isoniazida. [6]
Las rifamicinas tienen un mecanismo de acción único, inhibiendo selectivamente la ARN polimerasa dependiente del ADN bacteriano , y no muestran resistencia cruzada con otros antibióticos en el uso clínico. Sin embargo, a pesar de su actividad contra bacterias resistentes a otros antibióticos , las propias rifamicinas sufren una frecuencia bastante alta de resistencia. Debido a esto, la rifampicina y otras rifamicinas se utilizan típicamente en combinación con otros fármacos antibacterianos. Esto se practica rutinariamente en la terapia de la tuberculosis y sirve para prevenir la formación de mutantes que son resistentes a cualquiera de los fármacos en la combinación. La rifampicina mata rápidamente las cepas de bacilos de división rápida, así como las células "persistentes", que permanecen biológicamente inactivas durante largos períodos de tiempo que les permiten evadir la actividad de los antibióticos. [7] Además, la rifabutina y la rifapentina se han utilizado contra la tuberculosis adquirida en pacientes VIH positivos. Aunque el tratamiento de la tuberculosis sigue siendo el uso más importante de la rifampicina, un problema creciente con infecciones bacterianas graves resistentes a múltiples fármacos ha llevado al uso de combinaciones de antibióticos que contienen rifampicina para tratarlas.
Mecanismo de acción
La actividad antibacteriana de las rifamicinas se basa en la inhibición de la síntesis de ARN dependiente del ADN bacteriano. [8] Esto se debe a la alta afinidad de las rifamicinas por la ARN polimerasa procariota . La selectividad de las rifamicinas depende del hecho de que tienen una afinidad muy pobre por la enzima mamífera análoga. Los datos de la estructura cristalina del antibiótico unido a la ARN polimerasa indican que la rifamicina bloquea la síntesis al provocar fuertes choques estéricos con el oligonucleótido en crecimiento (mecanismo de "oclusión estérica"). [9] [10] Si la rifamicina se une a la polimerasa después de que haya comenzado el proceso de extensión de la cadena, no se observa inhibición en la biosíntesis, lo que es coherente con un mecanismo de oclusión estérica. La resistencia de alto nivel de un solo paso a las rifamicinas ocurre como resultado de un solo cambio de aminoácido en la ARN polimerasa dependiente del ADN bacteriano.
Biosíntesis
La primera información sobre la biosíntesis de las rifamicinas provino de estudios que utilizaron el isótopo estable Carbono-13 y espectroscopia de RMN para establecer el origen del esqueleto carbonado. Estos estudios mostraron que la cadena ansa se derivaba del acetato y el propionato , en común con otros antibióticos policétidos . Se demostró que el cromóforo naftalénico derivaba de una unidad de propionato acoplada con una fracción amino de siete carbonos de origen desconocido. El esquema general de biosíntesis comienza con la unidad de partida poco común, el ácido 3-amino-5-hidroxibenzoico ( AHBA ), a través de la vía policétida de tipo I ( PKS I ) en la que la extensión de la cadena se realiza utilizando 2 unidades de acetato y 8 de propionato. [11] Se cree que el AHBA se originó a partir de la vía Shikimate , sin embargo, esto no se incorporó al mecanismo biosintético. Esto se debe a la observación de que 3 análogos de aminoácidos se convirtieron en AHBA en extractos libres de células de A. mediterranei . [12]
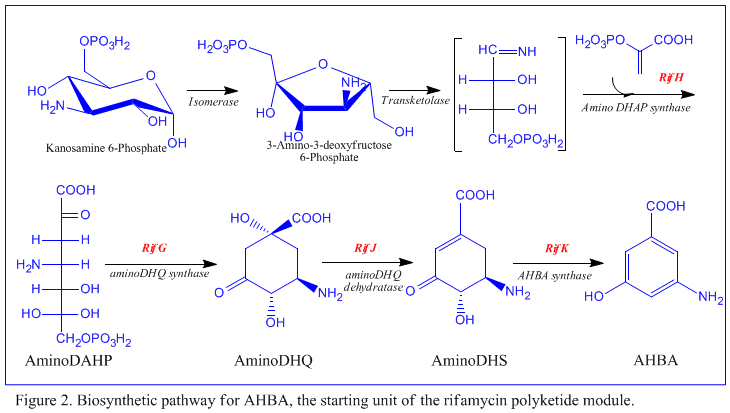
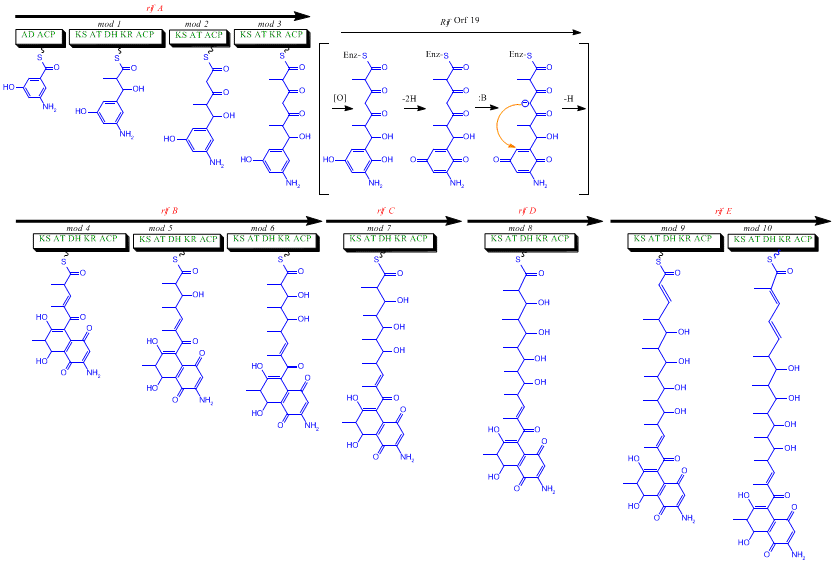

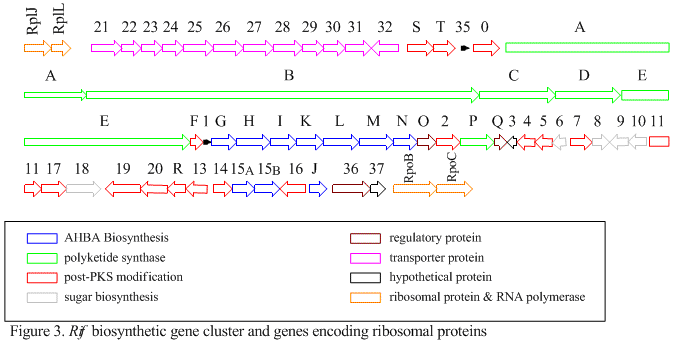
El grupo rif es responsable de la biosíntesis de rifamicinas. Contiene los genes rifG a rifN , que se ha demostrado que biosintetizan AHBA.[10] Se cree que RifK , rifL , rifM y rifN actúan como transaminasas para formar el precursor de AHBA, la kanosamina. [13] [14] "RifH" codifica la aminoDAHP sintasa que cataliza la condensación entre 1-desoxi-1-imino-d-eritrosa 4-fosfato y fosfoenolpiruvato . [15] RifA a rifE codifican un módulo de policétido sintasa de tipo I, siendo el módulo de carga una péptido sintetasa no ribosómica . En total, rifA-E ensambla un undecacétido lineal y es seguido por rifF , que codifica una amida sintasa y hace que el undecacétido se libere y forme una estructura de macrolactama. Además, el grupo rif contiene varias proteínas reguladoras y genes glicosiladores que parecen estar silenciados. Otros tipos de genes parecen realizar modificaciones postsintasa del policétido original.
Derivados
Lepetit introdujo la rifampicina, una rifamicina activa por vía oral, en 1966. [16] La rifabutina , un derivado de la rifamicina S, fue inventada por el fabricante de medicamentos italiano Achifar en 1975 y llegó al mercado estadounidense en 1992. [16] Hoechst Marion Roussel (ahora parte de Aventis ) introdujo la rifapentina en el mercado estadounidense en 1998, y Achifar la sintetizó en 1965. [17] El uso de rifapentina sigue siendo poco común como tratamiento para la tuberculosis pulmonar , y el tratamiento con rifapentina se administra sobre la base de una cuidadosa selección de los pacientes. [18]
La rifaximina es una rifamicina oral comercializada en los EE. UU. por Salix Pharmaceuticals que se absorbe mal en el intestino. Se ha utilizado para tratar la encefalopatía hepática y la diarrea del viajero . [19]
Rifamicinas disponibles
- Rifampicina o Rifampicina
- Rifabutina
- Rifapentina
- Rifaximina
- Aemcolo [20] [21]
Referencias
- ^ Lin SW, Lin CJ, Yang JC (agosto de 2017). "Rifamycin SV MMX para el tratamiento de la diarrea del viajero". Opinión de expertos sobre farmacoterapia . 18 (12): 1269–1277. doi :10.1080/14656566.2017.1353079. PMID 28697313. S2CID 8853242.
- ^ "La FDA aprueba un nuevo fármaco para tratar la diarrea del viajero". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) (Nota de prensa). 16 de noviembre de 2018. Consultado el 19 de noviembre de 2018 .
- ^ "Paquete de aprobación de medicamentos: Aemcolo (rifamicina)". Administración de Alimentos y Medicamentos de Estados Unidos (FDA) . 21 de diciembre de 2018. Consultado el 27 de diciembre de 2019 .
- ^ ab Sensi, P. (1983). "Historia del desarrollo de la rifampicina". Clinical Infectious Diseases . 5 (Supl. 3): S402–S406. doi :10.1093/clinids/5.Supplement_3.S402. PMID 6635432.
- ^ Margalith P, Beretta G (1960). "Rifomicina. XI. Estudio taxonómico de Streptomyces mediterranei nov. sp". Mycopathologia et Mycologia Applicata . 13 (4): 321–330. doi :10.1007/BF02089930. ISSN 0301-486X. S2CID 23241543.
- ^ Sharma SK, Sharma A, Kadhiravan T, Tharyan P (julio de 2013). "Rifamicinas (rifampicina, rifabutina y rifapentina) en comparación con isoniazida para la prevención de la tuberculosis en personas VIH-negativas con riesgo de tuberculosis activa". Base de Datos Cochrane de Revisiones Sistemáticas . 2013 (7): CD007545. doi :10.1002/14651858.CD007545.pub2. PMC 6532682. PMID 23828580 .
- ^ Pozniak AL, Miller R, Ormerod LP (marzo de 1999). "El tratamiento de la tuberculosis en personas infectadas por el VIH". SIDA . 13 (4): 435–445. doi : 10.1097/00002030-199907300-00035 . PMID 10197371.
- ^ Calvori C, Frontali L, Leoni L, Tecce G (julio de 1965). "Efecto de la rifamicina en la síntesis de proteínas". Nature . 207 (995): 417–418. Bibcode :1965Natur.207..417C. doi :10.1038/207417a0. PMID 4957347. S2CID 4144738.
- ^ Campbell EA, Korzheva N, Mustaev A, Murakami K, Nair S, Goldfarb A, Darst SA (marzo de 2001). "Mecanismo estructural de la inhibición de la ARN polimerasa bacteriana por rifampicina". Cell . 104 (6): 901–912. doi : 10.1016/S0092-8674(01)00286-0 . PMID 11290327. S2CID 8229399.
- ^ Feklistov A, Mekler V, Jiang Q, Westblade LF, Irschik H, Jansen R, et al. (septiembre de 2008). "Las rifamicinas no funcionan mediante modulación alostérica de la unión de Mg2+ al centro activo de la ARN polimerasa". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 105 (39): 14820–14825. Bibcode :2008PNAS..10514820F. doi : 10.1073/pnas.0802822105 . PMC 2567451 . PMID 18787125.
- ^ Lancini G, Cavalleri B (1997). "Vancomicina y otros glicopéptidos". En Strohl GR (ed.). Biotecnología de los antibióticos . Nueva York, EE. UU.: Marcel Dekker. pág. 521.
- ^ Floss HG, Yu TW (febrero de 2005). "Rifamicina: modo de acción, resistencia y biosíntesis". Chemical Reviews . 105 (2): 621–632. doi :10.1021/cr030112j. PMID 15700959.
- ^ Guo J, Frost JW (septiembre de 2002). "Biosíntesis de kanosamina: una fuente probable del átomo de nitrógeno de la vía del aminoshikimato". Journal of the American Chemical Society . 124 (36): 10642–10643. doi :10.1021/ja026628m. PMID 12207504.
- ^ Arakawa K, Müller R, Mahmud T, Yu TW, Floss HG (septiembre de 2002). "Caracterización de la vía aminoshikimato en etapa temprana en la formación de ácido 3-amino-5-hidroxibenzoico: la proteína RifN convierte específicamente la kanosamina en kanosamina 6-fosfato". Journal of the American Chemical Society . 124 (36): 10644–10645. doi :10.1021/ja0206339. PMID 12207505.
- ^ Guo J, Frost JW (enero de 2002). "Biosíntesis de 1-desoxi-1-imino-D-eritrosa 4-fosfato: un metabolito definitorio en la vía del aminoshikimato". Journal of the American Chemical Society . 124 (4): 528–529. doi :10.1021/ja016963v. PMID 11804477.
- ^ ab Reddy DS, Sinha A, Kumar A, Saini VK (noviembre de 2022). "Reingeniería y reutilización de fármacos: un enfoque significativo y rápido para el descubrimiento de fármacos contra la tuberculosis". Archiv der Pharmazie . 355 (11): e2200214. doi :10.1002/ardp.202200214. PMID 35841594. S2CID 250582950.
- ^ Guglielmetti L, Günther G, Leu C, Cirillo D, Duarte R, García-Basteiro AL, et al. (mayo de 2022). "Acceso a la rifapentina en Europa: preocupación creciente sobre el componente clave del tratamiento de la tuberculosis". La revista respiratoria europea . 59 (5). doi : 10.1183/13993003.00388-2022 . PMC 9186306 . PMID 35589114.
- ^ Munsiff SS, Kambili C, Ahuja SD (diciembre de 2006). "Rifapentina para el tratamiento de la tuberculosis pulmonar". Enfermedades infecciosas clínicas . 43 (11): 1468–1475. doi : 10.1086/508278 . PMID : 17083024.
- ^ Ojetti V, Lauritano EC, Barbaro F, Migneco A, Ainora ME, Fontana L, et al. (junio de 2009). "Farmacología de la rifaximina e implicaciones clínicas". Opinión de expertos sobre metabolismo y toxicología de fármacos . 5 (6): 675–682. doi :10.1517/17425250902973695. PMID 19442033. S2CID 41970585.
- ^ "Comprimidos de liberación retardada de AEMCOLO (rifamicina), para uso oral" (PDF) . Aries Pharmaceuticals, Inc . Administración de Alimentos y Medicamentos de los Estados Unidos. 2018.
- ^ "Aemcolo Oral: Usos, efectos secundarios, interacciones, imágenes, advertencias y dosis". WebMD .
Lectura adicional
- Sensi P, Margalith P, Timbal MT (1959). "Rifomicina, un nuevo antibiótico; informe preliminar". Il Farmaco; Edición Científica . 14 (2): 146-147. PMID 13639988.- el artículo que anuncia el descubrimiento de las rifamicinas.
- Thiemann JE, Zucco G, Pelizza G (1969). "Una propuesta para la transferencia de Streptomyces mediterranei Margalith y Beretta 1960 al género Nocardia como Nocardia mediterranea (Margalith y Beretta) comb. nov". Archiv für Mikrobiologie . 67 (2): 147–155. Bibcode :1969ArMic..67..147T. doi :10.1007/BF00409680. PMID 5386179. S2CID 19596120.- el artículo que renombró Streptomyces mediterranei como Nocardia mediterranei .
- Lechevalier MP, Prauser H, Labeda DP, Ruan JS (enero de 1986). "Dos nuevos géneros de actinomicetos nocardioformes: Amycolata gen. nov. y Amycolatopsis gen. nov". Revista internacional de microbiología sistemática y evolutiva . 36 (1): 29–37. doi : 10.1099/00207713-36-1-29 .- el artículo que renombró Nocardia mediterranei como Amycolatopsis mediterranei .
- Bala S, Khanna R, Dadhwal M, Prabagaran SR, Shivaji S, Cullum J, Lal R (julio de 2004). "Reclasificación de Amycolatopsis mediterranei DSM 46095 como Amycolatopsis rifamycinica sp. nov". Revista Internacional de Microbiología Sistemática y Evolutiva . 54 (parte 4): 1145-1149. doi : 10.1099/ijs.0.02901-0 . PMID 15280283.- el periódico con el último cambio de nombre

