Agente oxidante


Un agente oxidante (también conocido como oxidante , oxidante , receptor de electrones o aceptor de electrones ) es una sustancia en una reacción química redox que gana o " acepta "/"recibe" un electrón de un agente reductor (llamado reductor , reductor o donador de electrones ). En otras palabras, un oxidante es cualquier sustancia que oxida otra sustancia. El estado de oxidación , que describe el grado de pérdida de electrones , del oxidante disminuye mientras que el del reductor aumenta; esto se expresa diciendo que los oxidantes "experimentan reducción" y "se reducen" mientras que los reductores "experimentan oxidación" y "se oxidan". Los agentes oxidantes comunes son el oxígeno , el peróxido de hidrógeno y los halógenos .
En un sentido, un agente oxidante es una especie química que experimenta una reacción química en la que gana uno o más electrones. En ese sentido, es un componente de una reacción de oxidación-reducción (redox). En el segundo sentido, un agente oxidante es una especie química que transfiere átomos electronegativos, generalmente oxígeno, a un sustrato. La combustión , muchos explosivos y las reacciones redox orgánicas implican reacciones de transferencia de átomos.
Aceptadores de electrones
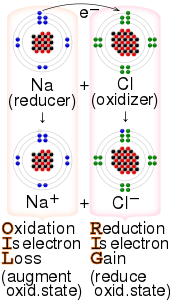
Los aceptores de electrones participan en las reacciones de transferencia de electrones . En este contexto, el agente oxidante se denomina aceptor de electrones y el agente reductor se denomina donador de electrones . Un agente oxidante clásico es el ion ferrocenio Fe(C
5yo
5)+
2, que acepta un electrón para formar Fe(C 5 H 5 ) 2 . Uno de los aceptores más fuertes disponibles comercialmente es " Magic blue ", el catión radical derivado de N(C 6 H 4 -4-Br) 3 . [2]
Se encuentran disponibles tabulaciones extensas de la clasificación de las propiedades de aceptación de electrones de varios reactivos (potenciales redox), consulte Potencial de electrodo estándar (página de datos) .
Reactivos de transferencia de átomos
En el uso más común, un agente oxidante transfiere átomos de oxígeno a un sustrato. En este contexto, el agente oxidante puede denominarse reactivo de oxigenación o agente de transferencia de átomos de oxígeno (OAT). [3] Algunos ejemplos incluyen MnO−
4( permanganato ), CrO2−
4( cromato ), OsO 4 ( tetróxido de osmio ) y, especialmente, ClO−
4( perclorato ). Nótese que estas especies son todas óxidos .
En algunos casos, estos óxidos también pueden servir como aceptores de electrones, como lo ilustra la conversión de MnO−
4a MnO2−
4, es decir, permanganato a manganato .
Agentes oxidantes comunes
- Oxígeno (O 2 )
- Ozono (O 3 )
- Peróxido de hidrógeno (H 2 O 2 ) y otros peróxidos inorgánicos , reactivo de Fenton
- Flúor (F 2 ), cloro (Cl 2 ) y otros halógenos
- Ácido nítrico (HNO 3 ) y compuestos de nitrato como el nitrato de potasio (KNO 3 ), el oxidante de la pólvora negra.
- Clorato de potasio (KClO 3 )
- Ácido peroxidisulfúrico (H 2 S 2 O 8 )
- Ácido peroximonosulfúrico (H 2 SO 5 )
- Hipoclorito , clorito , clorato , perclorato y otros oxianiones halogenados análogos
- Fluoruros de cloro , bromo y yodo
- Compuestos de cromo hexavalente como los ácidos crómico y dicrómico y el trióxido de cromo , el clorocromato de piridinio (PCC) y compuestos de cromato/dicromato como el dicromato de sodio ( Na2Cr2O7 ) .
- Compuestos de permanganato como el permanganato de potasio (KMnO 4 )
- Perborato de sodio ( [Na+
]
2· [B
2Oh
4(OH)
4]2−
) - Óxido nitroso (N 2 O), dióxido de nitrógeno / tetróxido de dinitrógeno (NO 2 / N 2 O 4 )
- Bismutato de sodio (NaBiO 3 )
- Compuestos de cerio (IV) como el nitrato de amonio cérico y el sulfato cérico
- Dióxido de plomo (PbO 2 )
Definición de materiales peligrosos
La definición de mercancía peligrosa de un agente oxidante es una sustancia que puede causar o contribuir a la combustión de otro material. [4] Según esta definición, algunos materiales que los químicos analíticos clasifican como agentes oxidantes no se clasifican como agentes oxidantes en el sentido de materiales peligrosos. Un ejemplo es el dicromato de potasio , que no pasa la prueba de mercancía peligrosa de un agente oxidante.
El Departamento de Transporte de los Estados Unidos define específicamente los agentes oxidantes. Existen dos definiciones de agentes oxidantes reguladas por las regulaciones del DOT. Estas dos son Clase 5 ; División 5.1(a)1 y Clase 5; División 5.1(a)2. La División 5.1 "significa un material que puede, generalmente al producir oxígeno, causar o mejorar la combustión de otros materiales". La División 5.(a)1 del código DOT se aplica a los oxidantes sólidos "si, cuando se prueba de acuerdo con el Manual de Pruebas y Criterios de las Naciones Unidas (IBR, consulte § 171.7 de este subcapítulo), su tiempo de combustión promedio es menor o igual al tiempo de combustión de una mezcla de bromato de potasio/celulosa 3:7". El apartado 5.1(a)2 del código DOT se aplica a los oxidantes líquidos "si, al probarse de acuerdo con el Manual de Pruebas y Criterios de las Naciones Unidas, se enciende espontáneamente o su tiempo medio para un aumento de presión de 690 kPa a 2070 kPa es menor que el tiempo de una mezcla de ácido nítrico (65 por ciento)/celulosa 1:1". [5]
Agentes oxidantes comunes y sus productos
| Agente | Producto(s) |
|---|---|
| O2 oxígeno | Varios, incluidos los óxidos H 2 O y CO 2 |
| O3 ozono | Varios, incluidas cetonas, aldehídos y H 2 O; véase ozonólisis. |
| F 2 flúor | F − |
| Cl 2 cloro | Cl − |
| Br 2 bromo | Br − |
| Yodo 2 | Yo − , yo− 3 |
| ClO − hipoclorito | Cl − , H2O |
| ClO− 3 clorato | Cl − , H2O |
| Ácido nítrico HNO3 | NO óxido nítrico NO 2 dióxido de nitrógeno |
| dióxido de azufre SO2 | S azufre ( proceso Claus , producción de ultramar , más comúnmente agente reductor) |
| Cromo hexavalente CrO 3 trióxido de cromo CrO2− 4 cromato Cr 2Oh2− 7 dicromato | Cr3 + , H2O |
| MnO− 4 permanganato MnO2− 4 manganato | Mn 2+ (ácido) o MnO 2 (básico) |
| Pentafluoruro de antimonio SbF5 | SbF 6 - hexafluoroantimoniato o trifluoruro de antimonio SbF 3 |
| Hexafluoruro de platino PtF6 | PtF 6 - hexafluoroplatinato |
| RuO 4 tetróxido de rutenio OsO 4 Tetróxido de osmio | En síntesis orgánica a escala de laboratorio |
| H 2 O 2 , otros peróxidos | Varios, incluidos óxidos y H 2 O |
| Compuestos tálicos de Tl(III) | Compuestos talosos de Tl(I), en síntesis orgánica a escala de laboratorio |
Véase también
- Combustión : Reacción química entre un combustible y el oxígeno.
- Aceptor de electrones – Entidad química capaz de aceptar electrones.
- Donante de electrones : Entidad química capaz de donar electrones a otra entidad.
- Electrosíntesis – Síntesis de compuestos químicos en una celda electroquímica.
- Oxidación orgánica : Reacción redox que tiene lugar con compuestos orgánicos.Páginas que muestran descripciones breves de los objetivos de redireccionamiento
- Reacción redox orgánica : reacción redox que tiene lugar con compuestos orgánicos.
- Agente reductor : Especie química que dona un electrón a otra especie en una reacción redox.
- Electrón solvatado : electrón libre en una solución, generalmente amoníaco líquido.
Referencias
- ^ "Metales". Bitesize . BBC. Archivado desde el original el 3 de noviembre de 2022.
- ^ NG Connelly, WE Geiger (1996). "Agentes redox químicos para la química organometálica". Chemical Reviews . 96 (2): 877–910. doi :10.1021/cr940053x. PMID 11848774.
- ^ Smith, Michael B.; March, Jerry (2007), Química orgánica avanzada: reacciones, mecanismos y estructura (6.ª ed.), Nueva York: Wiley-Interscience, ISBN 978-0-471-72091-1
- ^ Código australiano de mercancías peligrosas, sexta edición
- ^ 49 CFR 172.127 Requisitos generales para envíos y embalajes; Subparte D
