Potencial de electrodo estándar (página de datos)
Los datos a continuación tabulan los potenciales de electrodo estándar ( E °), en voltios relativos al electrodo de hidrógeno estándar (SHE), en:
- Temperatura 298,15 K (25,00 °C; 77,00 °F);
- Concentración efectiva (actividad) 1 mol/L para cada especie acuosa o amalgamada (aleada con mercurio);
- Actividad unitaria para cada disolvente y especie sólida o líquida pura; y
- Presión parcial absoluta 101,325 kPa (1,00000 atm; 1,01325 bar) para cada reactivo gaseoso: la convención en la mayoría de los datos de la literatura, pero no el estado estándar actual (100 kPa).
Las variaciones de estas condiciones ideales afectan el voltaje medido a través de la ecuación de Nernst .
Los potenciales de electrodo de semirreacciones elementales sucesivas no se pueden sumar directamente. Sin embargo, los cambios de energía libre de Gibbs correspondientes (∆ G °) deben satisfacer
- ∆ G ° = – z FE ° ,
donde se transfieren z electrones y la constante de Faraday F es el factor de conversión que describe los Coulombs transferidos por mol de electrones. Se pueden sumar esas energías libres de Gibbs.
Por ejemplo, a partir de Fe 2+ + 2 e − ⇌ Fe( s ) (–0,44 V) , la energía para formar un átomo neutro de Fe( s ) a partir de un ion Fe 2+ y dos electrones es 2 × 0,44 eV = 0,88 eV, o 84 907 J/(mol e − ). Ese valor también es la energía de formación estándar (∆ G f °) para un ion Fe 2+ , ya que e − y Fe( s ) tienen energía de formación cero.
Los datos de distintas fuentes pueden provocar inconsistencias en las tablas. Por ejemplo: A partir de la aditividad de las energías de Gibbs, se debe tener Pero esa ecuación no se cumple exactamente con los valores citados.
Tabla de potenciales de electrodos estándar
Leyenda: ( s ) – sólido; ( l ) – líquido; ( g ) – gas; ( aq ) – acuoso (predeterminado para todas las especies cargadas); ( Hg ) – amalgama; negrita – ecuaciones de electrólisis del agua.
| Elemento | Semirreacción | E° (voltio) | Electrones transferidos | |||
|---|---|---|---|---|---|---|
| Oxidante | ⇌ | Reductor | ||||
| Sr | Sr+ + y − | ⇌ | Sr( s ) | -4.101 | 1 | |
| California | California+ + y − | ⇌ | Ca( s ) | -3.8 | 1 | |
| El | El4+ + y − | ⇌ | El3+ | -3.6 | 1 | |
| Pr | Pr3+ + y − | ⇌ | Pr2+ | -3.1 | 1 | |
| norte | 3 N 2( g ) + 2 H + + 2 e − | ⇌ | 2 HN 3( aq ) | -3.09 | 2 | |
| Li | Li+ + y − | ⇌ | Yo ( s ) | -3.0401 | 1 | |
| norte | norte 2( g ) + 4 H 2 O + 2 e − | ⇌ | 2NH 2OH ( ac ) + 2 OH − | -3.04 | 2 | |
| Cs | Cs+ + y − | ⇌ | Cs( s ) | -3.026 | 1 | |
| California | Ca(OH) 2+ 2 y − | ⇌ | Ca ( s ) + 2OH− | -3.02 | 2 | |
| Sí. | Sí.3+ + y − | ⇌ | Sí.2+ | -3 | 1 | |
| Licenciado en Letras | Ba(OH) 2+ 2 y − | ⇌ | Ba ( s ) + 2OH− | -2,99 | 2 | |
| Rb | Rb+ + y − | ⇌ | Rb( s ) | -2,98 | 1 | |
| K | K+ + y − | ⇌ | K( s ) | -2.931 | 1 | |
| Licenciado en Letras | Licenciado en Letras2+ + 2 y − | ⇌ | Ba( s ) | -2.912 | 2 | |
| La | La(OH) 3( s ) + 3 e − | ⇌ | La( s ) + 3OH− | -2.9 | 3 | |
| Es | Es+ + y − | ⇌ | De( s ) | -2.9 | 1 | |
| Sr | Sr2+ + 2 y − | ⇌ | Sr( s ) | -2.899 | 2 | |
| Sr | Sr(OH) 2+ 2 y − | ⇌ | Sr( s ) + 2OH − | -2,88 | 2 | |
| California | California2+ + 2 y − | ⇌ | Ca( s ) | -2.868 | 2 | |
| Li | Li+ + C 6( s ) + e − | ⇌ | Licenciado en Derecho 6( s ) | -2,84 | 1 | |
| UE | UE2+ + 2 y − | ⇌ | Yo( s ) | -2.812 | 2 | |
| Real academia de bellas artes | Real academia de bellas artes2+ + 2 y − | ⇌ | Ra( s ) | -2.8 | 2 | |
| Hola | Hola3+ + y − | ⇌ | Ho2 + | -2.8 | 1 | |
| Libro | Libro3+ + y − | ⇌ | Libro2+ | -2.8 | 1 | |
| Yb | Yb2+ + 2 y − | ⇌ | Yb( s ) | -2,76 | 2 | |
| N / A | N / A+ + y − | ⇌ | Na( s ) | -2,71 | 1 | |
| Mg | Mg+ + y − | ⇌ | Mg( s ) | -2.7 | 1 | |
| Dakota del Norte | Dakota del Norte3+ + y − | ⇌ | Dakota del Norte2+ | -2.7 | 1 | |
| Mg | Mg (OH) 2+ 2 y − | ⇌ | Mg( s ) + 2OH- | -2,69 | 2 | |
| Pequeño | Pequeño2+ + 2 y − | ⇌ | Pequeño( s ) | -2,68 | 2 | |
| Ser | Ser 2Oh2− 3+ 3 H 2 O + 4 e − | ⇌ | 2Be( s ) + 6OH − | -2,63 | 4 | |
| P.m | P.m3+ + y − | ⇌ | P.m2+ | -2.6 | 1 | |
| Por favor | Por favor3+ + y − | ⇌ | Por favor2+ | -2.6 | 1 | |
| No | No2+ + 2 y − | ⇌ | No | -2.5 | 2 | |
| alta frecuencia | HfO (OH) 2+ H2O + 4 e− | ⇌ | Hf( s ) + 4OH− | -2.5 | 4 | |
| El | El (OH) 4+ 4 y − | ⇌ | El( los ) + 4 OH − | -2,48 | 4 | |
| Maryland | Maryland2+ + 2 y − | ⇌ | Maryland | -2.4 | 2 | |
| Yo soy | Yo soy2+ + 2 y − | ⇌ | Tm( s ) | -2.4 | 2 | |
| La | La3+ + 3 y − | ⇌ | La( s ) | -2.379 | 3 | |
| Y | Y3+ + 3 y − | ⇌ | Y( s ) | -2.372 | 3 | |
| Mg | Mg2+ + 2 y − | ⇌ | Mg( s ) | -2.372 | 2 | |
| Carolina del Sur | ScF 3 ( ac ) + 3 H + + 3 e − | ⇌ | Sc( s ) + 3HF( ac ) | -2,37 | 3 | |
| Zr | ZrO(OH) 2( s ) + H 2 O + 4 e − | ⇌ | Zr( s ) + 4OH − | -2,36 | 4 | |
| Pr | Pr3+ + 3 y − | ⇌ | Pr( s ) | -2.353 | 3 | |
| Este | Este3+ + 3 y − | ⇌ | Este( s ) | -2.336 | 3 | |
| Sí. | Sí.3+ + 3 y − | ⇌ | Es( son ) | -2.331 | 3 | |
| Hola | Hola3+ + 3 y − | ⇌ | Yo( s ) | -2,33 | 3 | |
| Alabama | yo 2Al O− 3+ H2O + 3e− | ⇌ | Al( s ) + 4OH− | -2,33 | 3 | |
| Dakota del Norte | Dakota del Norte3+ + 3 y − | ⇌ | Nd( s ) | -2.323 | 3 | |
| Yo soy | Yo soy3+ + 3 y − | ⇌ | Tm( s ) | -2.319 | 3 | |
| Alabama | Al(OH) 3( s ) + 3 e − | ⇌ | Al( s ) + 3OH− | -2,31 | 3 | |
| Pequeño | Pequeño3+ + 3 y − | ⇌ | Pequeño( s ) | -2.304 | 3 | |
| Fm | Fm2 + + 2e− | ⇌ | Fm | -2.3 | 2 | |
| Soy | Soy3+ + y − | ⇌ | Soy2+ | -2.3 | 1 | |
| Por favor | Por favor3+ + 3 y − | ⇌ | Di( s ) | -2.295 | 3 | |
| Lu | Lu3+ + 3 y − | ⇌ | Lu( s ) | -2,28 | 3 | |
| Carolina del Sur | FSC+ 2+ 2H + + 3e − | ⇌ | Sc( s ) + 2HF( l ) | -2,28 | 3 | |
| Tuberculosis | Tuberculosis3+ + 3 y − | ⇌ | tuberculosis( s ) | -2,28 | 3 | |
| Dios | Dios3+ + 3 y − | ⇌ | Dios ( s ) | -2.279 | 3 | |
| yo | yo 2( g ) + 2 e − | ⇌ | 2 horas− | -2,23 | 2 | |
| Es | Es2+ + 2 y − | ⇌ | Es( s ) | -2,23 | 2 | |
| P.m | P.m2+ + 2 y − | ⇌ | Pm( s ) | -2.2 | 2 | |
| Yo soy | Yo soy3+ + y − | ⇌ | TM 2+ | -2.2 | 1 | |
| Por favor | Por favor2+ + 2 y − | ⇌ | Di( s ) | -2.2 | 2 | |
| C.A | C.A3+ + 3 y − | ⇌ | Ac( s ) | -2.2 | 3 | |
| Yb | Yb3+ + 3 y − | ⇌ | Yb( s ) | -2,19 | 3 | |
| Cf | Cf2+ + 2 y − | ⇌ | Cf( s ) | -2.12 | 2 | |
| Dakota del Norte | Dakota del Norte2+ + 2 y − | ⇌ | Nd( s ) | -2.1 | 2 | |
| Hola | Hola2+ + 2 y − | ⇌ | Yo( s ) | -2.1 | 2 | |
| Carolina del Sur | Carolina del Sur3+ + 3 y − | ⇌ | Sc( s ) | -2.077 | 3 | |
| Alabama | AlF3−6 + 3 e− | ⇌ | Al ( s ) + 6 F− | -2.069 | 3 | |
| Centímetro | Centímetro3+ + 3 y − | ⇌ | cm( s ) | -2.04 | 3 | |
| Pu | Pu3+ + 3 y − | ⇌ | Pu( s ) | -2.031 | 3 | |
| Pr | Pr2+ + 2 y − | ⇌ | Pr( s ) | -2 | 2 | |
| Sí. | Sí.2+ + 2 y − | ⇌ | Es( son ) | -2 | 2 | |
| UE | UE3+ + 3 y − | ⇌ | Yo( s ) | -1.991 | 3 | |
| Lr | Lr3+ + 3 y − | ⇌ | Lr | -1,96 | 3 | |
| Cf | Cf3+ + 3 y − | ⇌ | Cf( s ) | -1,94 | 3 | |
| Es | Es3+ + 3 y − | ⇌ | Es( s ) | -1,91 | 3 | |
| Pensilvania | Pensilvania4+ + y − | ⇌ | Pensilvania3+ | -1.9 | 1 | |
| Soy | Soy2+ + 2 y − | ⇌ | Soy( s ) | -1.9 | 2 | |
| El | El4+ + 4 y − | ⇌ | El( los ) | -1.899 | 4 | |
| Fm | Fm3+ + 3 y − | ⇌ | Fm | -1,89 | 3 | |
| norte | N2 ( g ) + 2H2O ( l ) + 4H ++ 2e− | ⇌ | 2NH3OH + | -1,87 | 2 | |
| Notario público | Notario público3+ + 3 y − | ⇌ | Np( s ) | -1.856 | 3 | |
| Ser | Ser2+ + 2 y − | ⇌ | Ser( es ) | -1.847 | 2 | |
| PAG | yo 2correos− 2+ y − | ⇌ | P( s ) + 2OH− | -1,82 | 1 | |
| tú | tú3+ + 3 y − | ⇌ | A nosotros ) | -1.798 | 3 | |
| Sr | Sr2+ + 2 y − | ⇌ | Sr( Hg ) | -1.793 | 2 | |
| B | yo 2BIENVENIDOS− 3+ H2O + 3e− | ⇌ | B( s ) + 4OH− | -1,79 | 3 | |
| El | Sin embargo 2+ 4H + + 4e − | ⇌ | El( los ) + 2 H 2 O | -1.789 | 4 | |
| alta frecuencia | HfO2+ + 2H + + 4e − | ⇌ | Hf ( s ) + H2O | -1.724 | 4 | |
| PAG | OHP2− 3+ 2 H 2 O + 3 e − | ⇌ | P( s ) + 5OH− | -1,71 | 3 | |
| Si | SiO2− 3+ 3 H 2 O + 4 e − | ⇌ | Si( s ) + 6OH− | -1.697 | 4 | |
| Alabama | Alabama3+ + 3 y − | ⇌ | Al ( s ) | -1.662 | 3 | |
| Sí | Sí2+ + 2 y − | ⇌ | Ti( s ) | -1,63 | 2 | |
| Zr | ZrO 2( s ) + 4 H + + 4 e − | ⇌ | Zr ( s ) + 2H2O | -1.553 | 4 | |
| Zr | Zr4+ + 4 y − | ⇌ | Zr( s ) | -1,45 | 4 | |
| Sí | Sí3+ + 3 y − | ⇌ | Ti( s ) | -1,37 | 3 | |
| Sí | TiO ( s ) + 2 H + + 2 e − | ⇌ | Ti ( s ) + H2O | -1.31 | 2 | |
| B | B(OH)− 4+ 4 H 2 O ( l ) + 8 e − | ⇌ | Bhután− 4+ 8OH- | -1,24 | 8 | |
| Georgia | GaO(OH)− 2+ H 2 O ( l ) + 3 e − | ⇌ | Ga( s ) + 3OH− | -1,22 | 3 | |
| Sí | Sí 2Oh 3( s ) + 2 H + + 2 e − | ⇌ | 2TiO ( s ) + H2O | -1,23 | 2 | |
| Zinc | Zn(OH)2− 4+ 2 y − | ⇌ | Zn( s ) + 4OH − | -1.199 | 2 | |
| Minnesota | Minnesota2+ + 2 y − | ⇌ | Mn( s ) | -1.185 | 2 | |
| Fé | Hierro (CN)4− 6+ 6 H + + 2 e − | ⇌ | Fe( s ) + 6HCN( ac ) | -1,16 | 2 | |
| do | C ( s ) + 3H2O ( l ) + 2e− | ⇌ | CH3OH ( l ) + 2OH− | -1.148 | 2 | |
| Cr | cromo (CN)3− 6+ y − | ⇌ | cromo (CN)4− 6 | -1.143 | 1 | |
| Te | Te ( s ) + 2 e − | ⇌ | Te2− | -1.143 | 2 | |
| V | V2+ + 2 y − | ⇌ | V( s ) | -1,13 | 2 | |
| Nótese bien | Nótese bien3+ + 3 y − | ⇌ | Número( s ) | -1.099 | 3 | |
| Sn | Sn ( s ) + 4H ++ 4e− | ⇌ | Sueño 4( g ) | -1.07 | 4 | |
| Correos | Po ( s ) + 2e− | ⇌ | Correos2− | -1.021 | 2 | |
| Cr | [Cr(edta)(H2O ) ] − + e − | ⇌ | [Cr(edta)(H2O ) ] 2− | -0,99 | 1 | |
| PAG | 2 H 3 PO 4 ( ac ) + 2 H + + 2 e - | ⇌ | (H 2 PO 3 ) 2 ( ac ) + H 2 O ( l ) | -0,933 | 2 | |
| do | CO2− 3+ 3 H + + 2 e − | ⇌ | OHC− 2+ H2O ( l ) | -0,93 | 2 | |
| Sí | TiO2+ + 2H + + 4e − | ⇌ | Ti ( s ) + H2O | -0,93 | 4 | |
| Si | SiO 2( cuarzo ) + 4 H + + 4 e − | ⇌ | Si ( s ) + 2H2O | -0,909 | 4 | |
| Cr | Cr2+ + 2 y − | ⇌ | Cr( s ) | -0,9 | 2 | |
| B | B(OH) 3( ac ) + 3 H + + 3 e − | ⇌ | B ( s ) + 3H2O | -0,89 | 3 | |
| Fé | Fe(OH) 2( s ) + 2 e − | ⇌ | Fe( s ) + 2OH− | -0,89 | 2 | |
| Fé | Fé 2Oh 3( s ) + 3 H 2 O + 2 e − | ⇌ | 2Fe (OH) 2( s ) + 2OH − | -0,86 | 2 | |
| yo | 2H2O + 2e− | ⇌ | yo 2( g ) + 2OH − | -0,8277 | 2 | |
| Bi | Bi ( s ) + 3H ++ 3e− | ⇌ | Bosnia y Herzegovina 3 | -0,8 | 3 | |
| Zinc | Zinc2+ + 2 y − | ⇌ | Zn( Hg ) | -0,7628 | 2 | |
| Zinc | Zinc2+ + 2 y − | ⇌ | Zn( s ) | -0,7618 | 2 | |
| Ejército de reserva | Ejército de reserva 2Oh 5( s ) + 10 H + + 10 e − | ⇌ | 2 Ta ( s ) + 5 H 2 O | -0,75 | 10 | |
| Te | 2Te( s ) + 2e − | ⇌ | Te2− 2 | -0,74 | 2 | |
| Ni | Ni(OH) 2( s ) + 2 e − | ⇌ | Ni( s ) + 2OH− | -0,72 | 2 | |
| Nótese bien | Nb2O5 ( s ) + 10H ++ 10e− | ⇌ | 2Nb( s ) + 5 H2O ( l ) | -0,7 | 10 | |
| Ag | Ag 2S ( s ) + 2e− | ⇌ | 2Ag( s ) + S2− ( aq ) | -0,69 | 2 | |
| Te | Te2− 2+ 4 H + + 2 e − | ⇌ | 2H2Te ( g ) | -0,64 | 2 | |
| Sb | Sb(OH)− 4+ 3 y − | ⇌ | Sb( s ) + 4OH − | -0,639 | 3 | |
| Au | [Au(CN) 2]− + y − | ⇌ | Au ( s )+ 2CN− | -0,6 | 1 | |
| Ejército de reserva | Ejército de reserva3+ + 3 y − | ⇌ | Ta( s ) | -0,6 | 3 | |
| Pb | PbO ( s ) + H 2 O + 2 e − | ⇌ | Pb( s ) + 2OH- | -0,580 | 2 | |
| Sí | 2TiO 2( s ) + 2 H + + 2 e − | ⇌ | Sí 2Oh 3( s ) + H 2 O | -0,56 | 2 | |
| Georgia | Georgia3+ + 3 y − | ⇌ | Gas( s ) | -0,549 | 3 | |
| tú | tú4+ + y − | ⇌ | tú3+ | -0,52 | 1 | |
| PAG | yo 3correos 2( ac ) + H + + e − | ⇌ | P( blanco ) [nota 1] + 2 H 2 O | -0,508 | 1 | |
| PAG | yo 3correos 3( ac ) + 2 H + + 2 e − | ⇌ | yo 3correos 2( ac ) + H2O | -0,499 | 2 | |
| Ni | NiO 2( s ) + 2 H 2 O + 2 e − | ⇌ | Ni(OH) 2( s ) + 2OH − | -0,49 | 2 | |
| Sb | Sb(OH)− 6+ 2 y − | ⇌ | Sb(OH)− 4+ 2OH- | -0,465 | 2 | |
| PAG | yo 3correos 3( ac ) + 3 H + + 3 e − | ⇌ | P( rojo ) [nota 1] + 3 H 2 O | -0,454 | 3 | |
| Bi | Bi 2 O 3 ( s ) + 3 H 2 O ( l ) + 6 mi - | ⇌ | Bi( s ) + 6OH− | -0,452 | 6 | |
| Ejército de reserva | TaF2− 7+ 7 H + + 5 e − | ⇌ | Ta( s ) + 7HF( l ) | -0,45 | 5 | |
| En | En3+ + 2 y − | ⇌ | En + | -0,444 | 2 | |
| Cu | Cu(CN)− 2+ y − | ⇌ | Cu( s )+ 2CN− | -0,44 | 1 | |
| Fé | Fé2+ + 2 y − | ⇌ | Fe( s ) | -0,44 | 2 | |
| do | 2 CO 2( g ) + 2 H + + 2 e − | ⇌ | HOOCCOOH ( acrílico ) | -0,43 | 2 | |
| Cr | Cr3+ + y − | ⇌ | Cr2+ | -0,407 | 1 | |
| Cd | Cd2+ + 2 y − | ⇌ | Cd( s ) | -0,4 | 2 | |
| Sí | Sí3+ + y − | ⇌ | Sí2+ | -0,37 | 1 | |
| Cu | Cu 2O ( s ) + H 2 O + 2 e − | ⇌ | 2Cu( s ) + 2OH − | -0,36 | 2 | |
| Pb | PbSO 4( s ) + 2 e − | ⇌ | Pb ( s )+ SO2− 4 | -0,3588 | 2 | |
| Pb | PbSO 4( s ) + 2 e − | ⇌ | Pb( Hg ) + SO2− 4 | -0,3505 | 2 | |
| UE | UE3+ + y − | ⇌ | UE2+ | -0,35 | 1 | |
| En | En3+ + 3 y − | ⇌ | En( s ) | -0,34 | 3 | |
| El | El+ + y − | ⇌ | Tl( s ) | -0,34 | 1 | |
| En | Ge ( s ) + 4H ++ 4e− | ⇌ | GeH 4( g ) | -0,29 | 4 | |
| Co | Co2+ + 2 y − | ⇌ | Co( s ) | -0,28 | 2 | |
| PAG | yo 3correos 4( ac ) + 2 H + + 2 e − | ⇌ | yo 3correos 3( ac ) + H2O | -0,276 | 2 | |
| norte | N2 ( g ) + 8H ++ 6e− | ⇌ | 2NH+ 4 | -0,27 | 6 | |
| V | V3+ + y − | ⇌ | V2+ | -0,26 | 1 | |
| Ni | Ni2+ + 2 y − | ⇌ | Ni( s ) | -0,257 | 2 | |
| S | 2HSO− 4+ 2H + + 2e− | ⇌ | S2O2− 6+ 2 H 2 O ( l ) | -0,253 | 2 | |
| Como | Como ( s ) + 3 H + + 3 e − | ⇌ | Ceniza 3( g ) | -0,23 | 3 | |
| norte | N2 ( g ) + 5H ++ 4e− | ⇌ | N2H+ 5 | -0,23 | 4 | |
| Georgia | Georgia+ + y − | ⇌ | Gas( s ) | -0,2 | 1 | |
| Ag | AgI ( s ) + e − | ⇌ | Ag( s )+ I− | -0,15224 | 1 | |
| En | GeO2 ( s ) + 4H ++ 4e− | ⇌ | Ge( s ) + 2H2O ( l ) | -0,15 | 4 | |
| Mes | Mugir 2( s ) + 4 H + + 4 e − | ⇌ | Mo( s ) + 2 H2O | -0,15 | 4 | |
| Si | Si ( s ) + 4H ++ 4e− | ⇌ | SiH 4( g ) | -0,14 | 4 | |
| Sn | Sn2+ + 2 y − | ⇌ | Sn( s ) | -0,13 | 2 | |
| Oh | Oh 2( g ) + H + + e − | ⇌ | Ahi• 2( aq ) | -0,13 | 1 | |
| En | En + + e − | ⇌ | En( s ) | -0,126 | 1 | |
| Pb | Pb2+ + 2 y − | ⇌ | Pb( s ) | -0,126 | 2 | |
| Yo | YO 2( s ) + 4 H + + 4 e − | ⇌ | W ( s ) + 2 H 2 O | -0,12 | 4 | |
| En | Geo 2( s ) + 2 H + + 2 e − | ⇌ | GeO ( s ) + H2O | -0,118 | 2 | |
| PAG | P ( rojo ) + 3 H + + 3 e − | ⇌ | Filipinas 3( g ) | -0,111 | 3 | |
| do | CO 2( g ) + 2 H + + 2 e − | ⇌ | HCOOH ( ac .) | -0,11 | 2 | |
| Sí | Se ( s ) + 2 H + + 2 e − | ⇌ | yo 2Sí ( g ) | -0,11 | 2 | |
| do | CO 2( g ) + 2 H + + 2 e − | ⇌ | CO ( g ) + H2O | -0,11 | 2 | |
| Sn | α- SnO ( s ) + 2 H + + 2 e − | ⇌ | Sn ( s ) + H2O | -0,104 | 2 | |
| Cu | Cu(NH 3)+ 2+ y − | ⇌ | Cu( s )+ 2NH 3( aq ) | -0,1 | 1 | |
| Nótese bien | Nb2O5 ( s ) + 10H ++ 4e− | ⇌ | 2 Nb3+ + 5 H2O ( l ) | -0,1 | 4 | |
| Yo | YO 3( ac ) + 6 H + + 6 e − | ⇌ | W ( s ) + 3H2O | -0,09 | 6 | |
| Sn | SnO 2( s ) + 2 H + + 2 e − | ⇌ | α - SnO( s ) + H2O | -0,088 | 2 | |
| Fé | Fé 3Oh 4( s ) + 8 H + + 8 e − | ⇌ | 3Fe ( s ) + 4H2O | -0,085 | 8 | |
| V | VOH2+ + H + + e − | ⇌ | V2+ + H2O ( l ) | -0,082 | 1 | |
| PAG | P ( blanco ) + 3 H + + 3 e − | ⇌ | Filipinas 3( g ) | -0,063 | 3 | |
| norte | N2O ( g ) + H2O ( l ) + 6H ++ 4e− | ⇌ | 2NH3OH + | -0,05 | 4 | |
| Fé | Fé3+ + 3 y − | ⇌ | Fe( s ) | -0,04 | 3 | |
| do | HCOOH ( acuoso ) + 2 H + + 2 e − | ⇌ | HCHO ( ac . ) + H2O | -0,034 | 2 | |
| yo | 2H + + 2e− | ⇌ | yo 2( g ) | 0 | 2 | |
| Ag | AgBr ( s ) + e− | ⇌ | Ag( s ) + Br− | 0,07133 | 1 | |
| S | S 4Oh2− 6+ 2 y − | ⇌ | 2 S 2Oh2− 3 | 0,08 | 2 | |
| norte | norte 2( g ) + 2 H 2 O + 6 H + + 6 e − | ⇌ | 2NH 4OH ( ac ) | 0,092 | 6 | |
| Hg | HgO ( s ) + H 2 O + 2 e − | ⇌ | Hg( l ) + 2OH− | 0,0977 | 2 | |
| Cu | Cu(NH 3)2+ 4+ y − | ⇌ | Cu(NH 3)+ 2+ 2NH 3( aq ) | 0,1 | 1 | |
| Ru | Ru(NH 3)3+ 6+ y − | ⇌ | Ru(NH 3)2+ 6 | 0,1 | 1 | |
| norte | norte 2yo 4( ac ) + 4 H 2 O + 2 e − | ⇌ | 2NH+ 4+ 4OH- | 0,11 | 2 | |
| Mes | yo 2Mugir 4( ac ) + 6 H + + 6 e − | ⇌ | Mo( s ) + 4 H2O | 0,11 | 6 | |
| En | En4+ + 4 y − | ⇌ | Ge( s ) | 0,12 | 4 | |
| do | C ( s ) + 4 H + + 4 e − | ⇌ | es 4( g ) | 0,13 | 4 | |
| do | HCHO ( ac ) + 2 H + + 2 e − | ⇌ | es 3OH ( ac ) | 0,13 | 2 | |
| S | S ( s ) + 2 H + + 2 e − | ⇌ | yo 2S ( g ) | 0,144 | 2 | |
| Sb | Sb 2 O 3 ( s ) + 6 H + + 6 mi - | ⇌ | 2Sb( s ) + 3H2O | 0,15 | 6 | [6] : 789 |
| Sn | Sn4+ + 2 y − | ⇌ | Sn2+ | 0,151 | 2 | |
| S | HSO− 4+ 3 H + + 2 e − | ⇌ | ENTONCES 2( ac ) + 2 H 2 O | 0,158 | 2 | |
| Cu | Cu2+ + y − | ⇌ | Cu+ | 0,159 | 1 | |
| tú | OU2+ 2+ y − | ⇌ | OU+ 2 | 0,163 | 1 | |
| S | ENTONCES2− 4+ 4 H + + 2 e − | ⇌ | ENTONCES 2( ac ) + 2 H 2 O | 0,17 | 2 | |
| Sí | TiO2+ + 2 H + + e − | ⇌ | Sí3+ + H2O | 0,19 | 1 | |
| Sb | SbO+ + 2H + + 3e − | ⇌ | Sb ( s ) + H2O | 0,2 | 3 | |
| Fé | 3 Fe 2Oh 3(s) + 2 H + + 2 e − | ⇌ | 2 Fe 3Oh 4(s ) + H2O | 0,22 | 2 | |
| Ag | AgCl ( s ) + e − | ⇌ | Ag( s ) + Cl− | 0,22233 | 1 | |
| Como | yo 3ASO 3( ac ) + 3 H + + 3 e − | ⇌ | Como( s ) + 3 H2O | 0,24 | 3 | |
| Ru | Ru3+ ( aq ) + e − | ⇌ | Ru2+ ( aq ) | 0,249 | 1 | |
| Pb | PbO2 ( s ) + H2O + 2e− | ⇌ | α- PbO ( s ) + 2 OH − | 0,254 | 2 | |
| En | GeO( s ) + 2 H + + 2 e − | ⇌ | Ge ( s ) + H2O | 0,26 | 2 | |
| Hg | Hg2Cl2 ( s ) + 2e− | ⇌ | 2Hg( l ) + 2Cl − | 0,27 | 2 | |
| tú | OU+ 2+ 4 H + + e − | ⇌ | tú4+ + 2H2O | 0,273 | 1 | |
| Re | Re3+ + 3 y − | ⇌ | Re( s ) | 0.300 | 3 | |
| En | En + e − | ⇌ | En − | 0.3 | 1 | |
| Bi | Bi3+ + 3 y − | ⇌ | Bi( s ) | 0,308 | 3 | |
| do | 2HCNO + 2 H + + 2 e − | ⇌ | ( CN ) 2 + 2H2O | 0.330 | 2 | |
| Cu | Cu2+ + 2 y − | ⇌ | Cu( s ) | 0,337 | 2 | |
| V | En voz alta2+ + 2 H + + e − | ⇌ | V3+ + H2O | 0,337 | 1 | |
| Sb | Sb 2 O 4 ( s ) + 2 H + + 2 mi - | ⇌ | Sb2O3 ( s ) + H2O ( l ) | 0,342 | 2 | |
| En | En + + 2 e − | ⇌ | En - | 0,36 | 2 | |
| Fé | [Fe(CN) 6]3− + y − | ⇌ | [Fe(CN) 6]4− | 0,3704 | 1 | |
| do | ( CN ) 2 + 2H + + 2e− | ⇌ | 2HCN | 0,373 | 2 | |
| PAG | (H 2 PO 3 ) 2 ( ac ) + 2 H + + 2 e - | ⇌ | 2H3PO3 | 0,38 | 2 | |
| S | 2SO 2 ( ac ) + 2 H + + 2 e − | ⇌ | S2O2− 3+ H2O ( l ) | 0,4 | 2 | |
| Oh | Oh 2( g ) + 2 H 2 O + 4 e − | ⇌ | 4OH − ( ac . ) | 0,401 | 4 | |
| Mes | yo 2Mugir 4+ 6 H + + 3 e − | ⇌ | Mes3+ + 4H2O | 0,43 | 3 | |
| Ru | Ru2+ ( aq ) + 2 e − | ⇌ | Ru | 0,455 | 2 | |
| V | VO ( OH) + + 2H + + e− | ⇌ | VOH2+ + H2O ( l ) | 0,481 | 1 | |
| do | es 3OH ( ac ) + 2 H + + 2 e − | ⇌ | es 4( g ) + H 2 O | 0,5 | 2 | |
| S | ENTONCES 2( ac ) + 4 H + + 4 e − | ⇌ | S ( s ) + 2H2O | 0,5 | 4 | |
| S | 4 SO 2( ac ) + 4 H + + 8 e − | ⇌ | S 4 O2− 6+ 2 H 2 O ( l ) | 0,51 | 8 | |
| Cu | Cu+ + y − | ⇌ | Cu( s ) | 0,52 | 1 | |
| do | CO2 ( g ) + 2 H + + 2 e − | ⇌ | C ( s ) + H2O | 0,52 | 2 | |
| I | I− 3+ 2 y − | ⇌ | 3 yo− | 0,53 | 2 | |
| Te | TeO2 ( s ) + 4H ++ 4e− | ⇌ | Te( s ) + 2 H2O ( l ) | 0,53 | 4 | |
| Cu | Cu2+ + Cl − + e − | ⇌ | CuCl ( s ) | 0,54 | 1 | |
| I | I 2( s ) + 2 e − | ⇌ | 2 yo− | 0,54 | 2 | |
| Au | [AuI 4]− + 3 y − | ⇌ | Au( s )+ 4I− | 0,56 | 3 | |
| Como | yo 3ASO 4( ac ) + 2 H + + 2 e − | ⇌ | yo 3ASO 3( ac ) + H2O | 0,56 | 2 | |
| S | S2O2− 6+ 4 H + + 2 e − | ⇌ | 2H2SO3 | 0,569 | 2 | |
| Au | [AuI 2]− + y − | ⇌ | Au( s )+ 2I− | 0,58 | 1 | |
| Minnesota | MnO− 4+ 2 H 2 O + 3 e − | ⇌ | MnO 2( s ) + 4OH − | 0,595 | 3 | |
| S | S 2Oh2− 3+ 6 H + + 4 e − | ⇌ | 2S ( s ) + 3H2O | 0.6 | 4 | |
| Fé | Fc+ + y − | ⇌ | Fc( s ) | 0,63 | 1 | |
| Mes | yo 2Mugir 4( ac ) + 2 H + + 2 e − | ⇌ | Mugir 2( s ) + 2H2O | 0,65 | 2 | |
| norte | HN 3 ( ac ) + 11 H + + 8 e - | ⇌ | 3NH+ 4 | 0,69 | 8 | |
| Oh | Oh 2( g ) + 2 H + + 2 e − | ⇌ | yo 2Oh 2( aq ) | 0,695 | 2 | |
| Sb | Sb 2 O 5 ( s ) + 4 H + + 4 mi - | ⇌ | Sb2O3 ( s ) + 2H2O | 0,699 | 4 | |
| do | 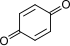 + 2H + + 2e− + 2H + + 2e− | ⇌ |  | 0,6992 | 2 | |
| V | H2V10O4− 28+ 24 H + + 10 e − | ⇌ | 10 VO ( OH ) + + 8 H2O ( l ) | 0,723 | 10 | |
| En | Cloruro de potasio2− 6+ 2 y − | ⇌ | Cloruro de potasio2− 4+ 2 cl− | 0,726 | 2 | |
| Fé | Fé 2Oh 3(s) + 6 H + + 2 e − | ⇌ | 2 Fe2+ + 3H2O | 0,728 | 2 | |
| Sí | yo 2SEO (optimización para motores de búsqueda) 3( ac ) + 4 H + + 4 e − | ⇌ | Se( s ) + 3 H2O | 0,74 | 4 | |
| En | AtO + + 2H + + 2e− | ⇌ | En + + H 2 O | 0,74 | 2 | |
| El | El3+ + 3 y − | ⇌ | Tl( s ) | 0,741 | 3 | |
| No | No3+ + y − | ⇌ | No2+ | 0,75 | 1 | |
| En | Cloruro de potasio2− 4+ 2 y − | ⇌ | Pt( s ) + 4Cl− | 0,758 | 2 | |
| Es | BrO − + H 2 O ( l ) + 2 mi − | ⇌ | Br − + 2OH − | 0,76 | 2 | |
| Correos | Po 4+ + 4 e − | ⇌ | Correos | 0,76 | 4 | |
| S | (SCN) 2 + 2 e − | ⇌ | 2SCN- | 0,769 | 2 | |
| Fé | Fé3+ + y − | ⇌ | Fé2+ | 0,771 | 1 | |
| Hg | Hg2+ 2+ 2 y − | ⇌ | 2Hg( l ) | 0,7973 | 2 | |
| Ag | Ag+ + y − | ⇌ | Ag( s ) | 0,7996 | 1 | |
| norte | 2 NO− 3( ac ) + 4 H + + 2 e − | ⇌ | norte 2Oh 4( g ) + 2 H 2 O | 0.803 | 2 | |
| Fé | 2FeO2− 4+ 5 H2O + 6 e− | ⇌ | Fé 2Oh 3( s ) + 10 OH − | 0,81 | 6 | |
| Au | [AuBr 4]− + 3 y − | ⇌ | Au( s ) + 4Br− | 0,85 | 3 | |
| Hg | Hg2+ + 2 y − | ⇌ | Hg( l ) | 0,85 | 2 | |
| Ir | [IrCl 6]2− + y − | ⇌ | [IrCl 6]3− | 0,87 | 1 | |
| Minnesota | MnO− 4+ H + + e − | ⇌ | HMnO− 4 | 0.9 | 1 | |
| Correos | Po 4+ + 2 e − | ⇌ | Po2 + | 0.9 | 2 | |
| Hg | 2Hg2+ + 2 y − | ⇌ | Hg2+ 2 | 0,91 | 2 | |
| Pd | Pd2+ + 2 y − | ⇌ | Pd( s ) | 0,915 | 2 | |
| Au | [AuCl 4]− + 3 y − | ⇌ | Au( s ) + 4 Cl− | 0,93 | 3 | |
| norte | NO− 3+ 3 H + + 2 e − | ⇌ | HNO2 ( ac . ) | 0,94 | 2 | |
| Minnesota | MnO 2( s ) + 4 H + + e − | ⇌ | Minnesota3+ + 2H2O | 0,95 | 1 | |
| norte | NO− 3( ac ) + 4 H + + 3 e − | ⇌ | NO ( g ) + 2 H 2 O ( l ) | 0,958 | 3 | |
| Au | [AuBr 2]− + y − | ⇌ | Au( s ) + 2Br− | 0,96 | 1 | |
| Fé | Fé 3Oh 4(s) + 8 H + + 2 e − | ⇌ | 3 Fe2+ + 4H2O | 0,98 | 2 | |
| Xe | [HXeO 6]3− + 2H2O + 2e− | ⇌ | [HXeO 4]− + 4OH- | 0,99 | 2 | |
| norte | HNO 2 ( ac ) + H + + e − | ⇌ | NO ( g ) + H2O ( l ) | 0,996 | 1 | |
| En | HAtO + H + + e − | ⇌ | En + H2O | 1.0 | 1 | |
| V | [VO 2]+ ( ac ) + 2 H + + e − | ⇌ | [VOZ EN VOZ]2+ ( ac ) + H2O | 1 | 1 | |
| Te | yo 6TeO 6( ac ) + 2 H + + 2 e − | ⇌ | TeO 2( s ) + 4H2O | 1.02 | 2 | |
| norte | NO2 ( g ) + 2H ++ 2e− | ⇌ | NO( g ) + H2O ( l ) | 1.03 | 2 | |
| Es | Es− 3+ 2 y − | ⇌ | 3 habitaciones− | 1.05 | 2 | |
| Sb | Sb 2 O 5 ( s ) + 2 H + + 2 mi - | ⇌ | Sb2O4 ( s ) + H2O ( l ) | 1.055 | 2 | |
| I | ICl− 2+ y − | ⇌ | 2 cl− + yo( s ) | 1.06 | 1 | |
| Es | Es 2( l ) + 2 e − | ⇌ | 2 habitaciones− | 1.066 | 2 | |
| norte | N2O4 ( g ) + 2H ++ 2e− | ⇌ | 2HNO2 | 1.07 | 2 | |
| Es | Es 2( aq ) + 2 e − | ⇌ | 2 habitaciones− | 1.0873 | 2 | |
| Ru | RuO 2+ 4 H + + 2 e − | ⇌ | Ru2+ ( ac ) + 2 H 2 O | 1.120 | 2 | |
| Cu | Cu2+ + 2 CN− + y − | ⇌ | Cu(CN)− 2 | 1.12 | 1 | |
| I | IO− 3+ 5 H + + 4 e − | ⇌ | HIO( ac .) + 2 H 2 O | 1.13 | 4 | |
| Oh | H 2 O 2 ( ac ) + H + + e − | ⇌ | H2O ( l ) + HO • | 1.14 | 1 | |
| Au | [AuCl 2]− + y − | ⇌ | Au( s ) + 2 Cl− | 1.15 | 1 | |
| Sí | HSeO− 4+ 3 H + + 2 e − | ⇌ | yo 2SEO (optimización para motores de búsqueda) 3( ac ) + H2O | 1.15 | 2 | |
| Ag | Ag 2O ( s ) + 2 H + + 2 e − | ⇌ | 2Ag ( s ) + H2O | 1.17 | 2 | |
| Cl | ClO− 3+ 2 H + + e − | ⇌ | ClO 2( g ) + H 2 O | 1.175 | 1 | |
| Xe | [HXeO 6]3− + 5 H2O + 8 e− | ⇌ | Xe( g ) + 11OH − | 1.18 | 8 | |
| En | En2+ + 2 y − | ⇌ | Pt( s ) | 1.188 | 2 | |
| Cl | ClO 2( g ) + H + + e − | ⇌ | HClO 2( aq ) | 1.19 | 1 | |
| I | 2 IO− 3+ 12 H + + 10 e − | ⇌ | I 2( s ) + 6 H2O | 1.2 | 10 | |
| Minnesota | MnO 2( s ) + 4 H + + 2 e − | ⇌ | Minnesota2+ + 2H2O | 1.224 | 2 | |
| Oh | Oh 2( g ) + 4 H + + 4 e − | ⇌ | 2H2O | 1.229 | 4 | |
| norte | N2H+ 5+ 3 H + + 2 e − | ⇌ | 2NH+ 4 | 1.28 | 2 | |
| Cl | ClO− 4+ 2H + + 2e− | ⇌ | ClO− 3+ H2O | 1.23 | 2 | |
| Ru | [Ru(bipi)] 3]3+ + y − | ⇌ | [Ru(bipi)] 3]2+ | 1.24 | 1 | |
| Xe | [HXeO 4]− + 3 H2O + 6 e− | ⇌ | Xe( g ) + 7OH − | 1.24 | 6 | |
| norte | 2NO− 3+ 12 H + + 10 e − | ⇌ | N2 ( g ) + 6H2O ( l ) | 1.25 | 10 | |
| El | El3+ + 2 y − | ⇌ | El+ | 1.25 | 2 | |
| norte | 2 HNO 2 ( ac ) + 4 H + + 4 e − | ⇌ | N2O ( g ) + 3H2O ( l ) | 1.297 | 4 | |
| Cr | Cr 2Oh2− 7+ 14 H + + 6 e − | ⇌ | 2 créditos3+ + 7H2O | 1.33 | 6 | |
| norte | NH3OH + + 2H + + 2e− | ⇌ | NUEVA HAMPSHIRE+ 4+ H2O ( l ) | 1.35 | 2 | |
| Cl | Cl 2( g ) + 2 e − | ⇌ | 2 cl− | 1.36 | 2 | |
| Ru | RuO− 4( ac ) + 8 H + + 5 e − | ⇌ | Ru2+ ( ac ) + 4 H2O | 1.368 | 5 | |
| Ru | RuO 4+ 4H + + 4e − | ⇌ | RuO 2+ 2H2O | 1.387 | 4 | |
| Co | Arrullo 2( s ) + 4 H + + e − | ⇌ | Co3+ + 2H2O | 1.42 | 1 | |
| norte | 2NH 3OH+ + H + + 2 e − | ⇌ | norte 2yo+ 5+ 2H2O | 1.42 | 2 | |
| I | 2 HIO ( ac ) + 2 H + + 2 e − | ⇌ | I 2( s ) + 2H2O | 1.44 | 2 | |
| Es | Hermano− 3+ 5 H + + 4 e − | ⇌ | HBrO( ac . ) + 2 H2O | 1.447 | 4 | |
| Pb | β-PbO 2( s ) + 4 H + + 2 e − | ⇌ | Pb2+ + 2H2O | 1.46 | 2 | |
| Pb | α-PbO 2( s ) + 4 H + + 2 e − | ⇌ | Pb2+ + 2H2O | 1.468 | 2 | |
| Es | 2 Hermanos− 3+ 12 H + + 10 e − | ⇌ | Es 2( l ) + 6 H 2 O | 1.48 | 10 | |
| En | HAtO3 + 4H ++ 4e− | ⇌ | HAtO + 2 H2O | 1.5 | 4 | |
| Minnesota | MnO− 4+ 8 H + + 5 e − | ⇌ | Minnesota2+ + 4H2O | 1.51 | 5 | |
| Oh | Ahi• 2+ H + + e − | ⇌ | yo 2Oh 2( aq ) | 1.51 | 1 | |
| Au | Au3+ + 3 y − | ⇌ | Au( s ) | 1.52 | 3 | |
| Ru | RuO2− 4( ac ) + 8 H + + 4 e − | ⇌ | Ru2+ ( ac ) + 4 H2O | 1.563 | 4 | |
| norte | 2NO( g ) + 2H + + 2e− | ⇌ | N2O ( g ) + H2O ( l ) | 1,59 | 2 | |
| Ni | NiO 2( s ) + 2 H + + 2 e − | ⇌ | Ni2+ + 2OH- | 1,59 | 2 | |
| Este | Este4+ + y − | ⇌ | Este3+ | 1.61 | 1 | |
| Cl | 2HClO( ac .) + 2 H + + 2 e − | ⇌ | Cl 2( g ) + 2 H 2 O | 1.63 | 2 | |
| I | IO− 4+ 2H + + 2e− | ⇌ | IO− 3+ H2O | 1.64 | 2 | |
| Ag | Ag 2Oh 3( s ) + 6 H + + 4 e − | ⇌ | 2 de agosto+ + 3H2O | 1.67 | 4 | |
| Cl | HClO 2( ac ) + 2 H + + 2 e − | ⇌ | HClO( ac . ) + H2O | 1.67 | 2 | |
| Pb | Pb4+ + 2 y − | ⇌ | Pb2+ | 1.69 | 2 | |
| Minnesota | MnO− 4+ 4 H + + 3 e − | ⇌ | MnO 2( s ) + 2H2O | 1.7 | 3 | |
| Es | Hermano− 4+ 2H + + 2e− | ⇌ | Hermano− 3+ H2O | 1,74 | 2 | |
| Ag | AgO ( s ) + 2H ++ e− | ⇌ | Ag+ + H2O | 1,77 | 1 | |
| norte | N2O ( g ) + 2H ++ 2e− | ⇌ | N2 ( g ) + H2O ( l ) | 1,77 | 2 | [6] : 789 |
| Oh | yo 2Oh 2( ac ) + 2 H + + 2 e − | ⇌ | 2H2O | 1,78 | 2 | |
| Au | Au+ + y − | ⇌ | Au( s ) | 1.83 | 1 | |
| Co | Co3+ + y − | ⇌ | Co2+ | 1,92 | 1 | |
| Ag | Ag2+ + y − | ⇌ | Ag+ | 1,98 | 1 | |
| Oh | S 2Oh2− 8+ 2 y − | ⇌ | 2 SO2− 4 | 2.01 | 2 | |
| Oh | Oh 3( g ) + 2 H + + 2 e − | ⇌ | Oh 2( g ) + H 2 O | 2.075 | 2 | |
| Minnesota | HMnO− 4+ 3 H + + 2 e − | ⇌ | MnO 2( s ) + 2H2O | 2.09 | 2 | |
| Xe | XeO 3( ac ) + 6 H + + 6 e − | ⇌ | Xe ( g ) + 3H2O | 2.12 | 6 | |
| Xe | yo 4XeO 6( ac ) + 8 H + + 8 e − | ⇌ | Xe ( g ) + 6H2O | 2.18 | 8 | |
| Fé | FeO2− 4+ 8 H + + 3 e − | ⇌ | Fé3+ + 4H2O | 2.2 | 3 | |
| Xe | XeF 2( ac ) + 2 H + + 2 e − | ⇌ | Xe( g ) + 2HF( ac ) | 2.32 | 2 | |
| Oh | HO• + H + + e − | ⇌ | H2O ( l ) | 2.38 | 1 | |
| Xe | yo 4XeO 6( ac ) + 2 H + + 2 e − | ⇌ | XeO 3( ac ) + 3 H2O | 2.42 | 2 | |
| F | F 2( g ) + 2 e − | ⇌ | 2F− | 2.87 | 2 | |
| Centímetro | Cm 4+ + e – | ⇌ | Cm3 + | 3.0 | 1 | |
| F | F 2( g ) + 2 H + + 2 e − | ⇌ | 2HF( ac .) | 3.077 | 2 | |
| Tuberculosis | Tuberculosis 4+ + e – | ⇌ | Tuberculosis 3+ | 3.1 | 1 | |
| Pr | Pr 4+ + e – | ⇌ | Pr3 + | 3.2 | 1 | |
| Kr | KrF 2( aq ) + 2 e − | ⇌ | Kr( g )+ 2F− ( aq ) | 3.27 | 2 | |
Véase también
- La serie galvánica enumera los potenciales de los electrodos en agua salada
- Potenciales de reducción aparentes estándar en bioquímica a pH 7
- Serie de reactividad#Comparación con potenciales de electrodos estándar
Notas
- ^ ab No especificado en la referencia indicada, pero asumido debido a la diferencia entre el valor −0,454 y el calculado por (2×(−0,499) + (−0,508))/3 = −0,502, que coincide exactamente con la diferencia entre los valores de fósforo blanco (−0,063) y rojo (−0,111) en equilibrio con PH 3 .
Referencias
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br bs bt bu por Lide, David R., ed. (2006). Manual CRC de Química y Física (87ª ed.). Boca Ratón, FL: CRC Press . ISBN 0-8493-0487-3.
- ^ Greenwood y Earnshaw, pág. 1263
- ^ abcde Bratsch, Stephen G. (29 de julio de 1988) [1 de marzo de 1988]. "Potenciales de electrodos estándar y coeficientes de temperatura en agua a 298,15 K" (PDF) . Journal of Physical and Chemical Reference Data . 18 (1). American Institute of Physics (publicado en 1989): 1–21. doi :10.1063/1.555839 – vía NIST.
- ^ abcde Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ abcdefghijklmnopq Vanýsek, Petr (2011). "Serie electroquímica". En Haynes, William M. (ed.). CRC Handbook of Chemistry and Physics (92.ª ed.). CRC Press. págs. 5-80-9. ISBN 978-1-4398-5512-6.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo bp bq br bs bt bu bv bw bx by bz ca cb cc cd Atkins, Peter; Overton, Tina; Rourke, Jonathan; Weller, Mark; Armstrong, Fraser; Hagerman, Michael (2010). Química inorgánica (5.ª ed.). Nueva York: WH Freeman. ISBN. 978-1-42-921820-7.
- ^ abcdefghijklm Atkins, Peter W. (1997). Química física (6.ª ed.). WH Freeman. ISBN 9780716734659.
- ^ abcdefghijklmnopqrstu v Petr Vanysek. "Serie electroquímica" (PDF) . depa.fquim.unam.mx . Archivado desde el original (PDF) el 16 de septiembre de 2021.
- ^ David R. Lide, ed., CRC Handbook of Chemistry and Physics, versión de Internet 2005, http://www.hbcpnetbase.com Archivado el 24 de julio de 2017 en Wayback Machine , CRC Press, Boca Raton, FL, 2005.
- ^ abcdefghijklmnopqrstu vwxyz aa ab Vanýsek, Petr (2012). "Serie electroquímica". En Haynes, William M. (ed.). Manual de química y física (93.ª ed.). CRC Press. págs. 5–80. ISBN 9781439880494.
- ^ Aylward, Gordon; Findlay, Tristán (2008). Datos químicos del SI (6ª ed.). Wiley. ISBN 978-0-470-81638-7.
- ^ abcde "información de compuestos". Hierro . WebElements Tabla periódica de los elementos.
- ^ abcdefghijklmnopqrstu Bard, Allen J.; Parsons, Roger; Jordan, Joseph (1985). Potenciales estándar en solución acuosa. CRC Press. ISBN 978-0-8247-7291-8.
- ^ Brown, Susan A.; Brown, Paul L. (2020). "El diagrama de pH-potencial del polonio". La química acuosa del polonio y la aplicación práctica de su termoquímica . Elsevier. doi :10.1016/b978-0-12-819308-2.00004-8. ISBN 978-0-12-819308-2. Número de identificación del sujeto 213141476.
- ^ abcdefghij Bard, AJ; Faulkner, LR (2001). Métodos electroquímicos. Fundamentos y aplicaciones (2.ª ed.). Wiley. ISBN 9781118312803.
- ^ abcdefghijkl Lee, J. L. (1983) [1977]. Una nueva química inorgánica concisa (3.ª ed.). Londres / Wokingham, Berkshire: English Language Book Society y Van Nostrand Reinhold (Reino Unido). pág. 107. ISBN 0-442-30179-0. OL 4079768W – vía Internet Archive .
- ^ Pourbaix, Marcel (1966). Atlas de equilibrios electroquímicos en soluciones acuosas . Houston, Texas; Cebelcor, Bruselas: NACE International. OCLC 475102548.
- ^ abc Pang, Suh Cem; Chin, Suk Fun; Anderson, Marc A. (julio de 2007). "Equilibrios redox de óxidos de hierro en dispersiones de magnetita de base acuosa: efecto del pH y el potencial redox". J. Colloid Interface Sci . 311 (1): 94–101. Bibcode :2007JCIS..311...94P. doi :10.1016/j.jcis.2007.02.058. PMID 17395194. Consultado el 26 de marzo de 2017 .
- ^ abcdef Greenwood y Earnshaw, pág. 1077
- ^ abc Lavrukhina, Avgusta Konstantinovna; Pozdni︠a︡kov, Aleksandr Aleksandrovich (1970). Química analítica del tecnecio, prometio, astato y francio . Ann Arbor: Editores científicos de Ann Arbor-Humphrey. pag. 237.ISBN 0-250-39923-7.OCLC 186926 .
- ^ ab Champion, J.; Alliot, C.; Renault, E.; Mokili, BM; Chérel, M.; Galland, N.; Montavon, G. (16 de diciembre de 2009). "Potenciales redox estándar de astato y especiación en medio ácido" (PDF) . The Journal of Physical Chemistry A . 114 (1). Sociedad Química Estadounidense (ACS): 576–582. doi :10.1021/jp9077008. ISSN 1089-5639. PMID 20014840. S2CID 15738065.
- ^ Rock, Peter A. (febrero de 1966). "El potencial de oxidación estándar del electrodo de ferrocianuro-ferricianuro a 25° y la entropía del ion ferrocianuro". The Journal of Physical Chemistry . 70 (2): 576–580. doi :10.1021/j100874a042. ISSN 0022-3654.
- ^ Pavlishchuk, Vitaly V.; Addison, Anthony W. (enero de 2000). "Constantes de conversión para potenciales redox medidos frente a diferentes electrodos de referencia en soluciones de acetonitrilo a 25 °C". Inorganica Chimica Acta . 298 (1): 97–102. doi :10.1016/S0020-1693(99)00407-7.
- ^ Toyoshima, A.; Kasamatsu, Y.; Tsukada, K.; Asai, M.; Kitatsuji, Y.; Ishii, Y.; Toume, H.; Nishinaka, I.; Haba, H.; Ooe, K.; Sato, W.; Shinohara, A.; Akiyama, K.; Nagame, Y. (8 de julio de 2009). "Oxidación del elemento 102, nobelio, con cromatografía en columna electrolítica de flujo en escala átomo a tiempo". Revista de la Sociedad Química Estadounidense . 131 (26): 9180–1. doi :10.1021/ja9030038. PMID 19514720.
- ^ Kaufmann, HP (1925). "Das freie Rhodan und seine Anwendung in der Maßanalyse. Eine neue Kennzahl der Fette" [Rodanio sin consolidar y su aplicación al análisis elemental: una nueva técnica de medición de grasas]. Archiv der Pharmazie und Berichte der Deutschen Pharmazeutischen Gesellschaft (en alemán). 263 : 675–721 - vía HathiTrust .
- ^ abcdefg "información de compuestos". Xenon . WebElements Tabla periódica de los elementos.
- ^ ab Cotton, F. Albert ; Wilkinson, Geoffrey ; Murillo, Carlos A.; Bochmann, Manfred (1999), Química inorgánica avanzada (6.ª ed.), Nueva York: Wiley-Interscience, ISBN 0-471-19957-5.
- ^ abcde Ghosh, Abhik; Berg, Steffen (2014). Flecha empujando en química inorgánica: un enfoque lógico a la química de los elementos del grupo principal . Hoboken: Wiley. p. 12. ISBN 978-1-118-17398-5.
- ^ abc Appelman, Evan H. (1 de abril de 1973). "Compuestos inexistentes. Dos casos clínicos". Accounts of Chemical Research . 6 (4). American Chemical Society (ACS): 113–117. doi :10.1021/ar50064a001. ISSN 0001-4842.
- ^ Courtney, Arlene. "Química de oxidación-reducción de los elementos". Capítulo 412 Química inorgánica avanzada: materiales de lectura . Universidad de Western Oregon.
- ^ Leszczyński, PJ; Grochala, W. (2013). "Oxidantes catiónicos fuertes: descomposición térmica, estructura electrónica y magnetismo de sus compuestos" (PDF) . Acta Chim. Slov . 60 (3): 455–470. PMID 24169699. Archivado (PDF) desde el original el 2022-10-09.
Enlaces externos
- Chemistry LibreTexts (2021-04-26). «P1: Potenciales de reducción estándar por elemento». Chemistry LibreTexts . Consultado el 2021-11-30 .
- Universidad Estatal de California, Northridge (CSUN). "Potenciales de reducción estándar" (PDF) . csun.edu . Archivado (PDF) del original el 2017-12-15 . Consultado el 2021-11-30 .
- Wardman, Peter (1989). "Potenciales de reducción de pares de un electrón que involucran radicales libres en solución acuosa" (PDF) . srd.nist.gov . Archivado (PDF) desde el original el 2022-10-09 . Consultado el 2021-11-30 .
- http://www.jesuitnola.org/upload/clark/Refs/red_pot.htm Archivado el 20 de julio de 2008 en Wayback Machine.
- https://web.archive.org/web/20150924015049/http://www.fptl.ru/biblioteka/spravo4niki/handbook-of-Chemistry-and-Physics.pdf
- http://hyperphysics.phy-astr.gsu.edu/Hbase/tables/electpot.html#c1

