Porfiria cutánea tardía
| Porfiria cutánea tardía | |
|---|---|
| Otros nombres | PCT |
 | |
| Ampolla en la mano de una persona con porfiria cutánea tarda | |
| Especialidad | Endocrinología |
La porfiria cutánea tardía es el subtipo más común de porfiria . [1] La enfermedad recibe su nombre porque es una porfiria que a menudo se presenta con manifestaciones cutáneas más adelante en la vida. El trastorno es el resultado de niveles bajos de la enzima responsable del quinto paso en la producción del hemo . El hemo es una molécula vital para todos los órganos del cuerpo. Es un componente de la hemoglobina , la molécula que transporta el oxígeno en la sangre.
La porfiria hepatoeritropoyética se ha descrito como una forma homocigótica de porfiria cutánea tarda, [2] aunque también puede ser causada si ocurren dos mutaciones diferentes en el mismo locus.
Síntomas y signos
La porfiria cutánea tarda (PCT) se reconoce como el subtipo más prevalente de enfermedades porfídicas. [3]
La PCT se caracteriza por onicólisis y formación de ampollas en la piel en las zonas que reciben niveles más altos de exposición a la luz solar. La causa principal es una deficiencia de la uroporfirinógeno descarboxilasa (UROD), una enzima citosólica que es un paso en la vía enzimática que conduce a la síntesis del hemo. Detrás de la causa directa hay una serie de factores de riesgo genéticos y ambientales. [4]
Los pacientes a los que se les diagnostica PCT suelen buscar tratamiento tras el desarrollo de fotosensibilidades que causan ampollas y erosiones en las zonas expuestas de la piel . Esto suele observarse en la cara, las manos, los antebrazos y la parte inferior de las piernas. La curación es lenta y deja cicatrices . Aunque las ampollas son las manifestaciones cutáneas más comunes de la PCT, también se producen otras manifestaciones cutáneas como la hiperpigmentación (similar a un bronceado) y la hipertricosis (principalmente en las mejillas). La PCT es una enfermedad crónica, con síntomas externos que a menudo remiten y recurren como resultado de múltiples factores. Además de las lesiones cutáneas, la enfermedad hepática crónica es muy común en pacientes con PCT esporádica. Esto implica fibrosis hepática (cicatrización del hígado) e inflamación . Sin embargo, los problemas hepáticos son menos comunes en pacientes con la forma hereditaria de la enfermedad . [5] Además, los pacientes a menudo orinarán de color rojo vino con una mayor concentración de uroporfirina I debido a su deficiencia enzimática. [6]
Deficiencias de vitaminas, minerales y enzimas.
Ciertas deficiencias de vitaminas y minerales son comunes en personas con porfiria cutánea tardía. Las deficiencias más comunes son betacaroteno , [7] retinol, [8] vitamina A [9] y vitamina C. El betacaroteno es necesario para sintetizar vitamina A y la vitamina A es necesaria para sintetizar retinol. La falta de proteína transportadora de retinol se debe a la falta de retinol, que es necesario para desencadenar su producción. [9]
Las porfirinas interactúan con el hierro, absorbiendo fotones para crear especies reactivas de oxígeno, que es el mecanismo de acción que causa las ampollas dolorosas y que pican en la PCT. [7] Las especies reactivas de oxígeno consumen los antioxidantes de la piel betacaroteno, vitamina E y vitamina C. La suplementación con estas tres vitaminas reduce la oxidación y potencialmente disminuye la gravedad de la formación de ampollas. [10] Ninguna de las tres vitaminas puede inhibir los efectos dañinos de las porfirinas oxidadas, específicamente las uroporfirinas y las coproporfirinas, pero las tres trabajando juntas de forma sinérgica son capaces de neutralizar sus efectos dañinos. [ cita requerida ]
Genética
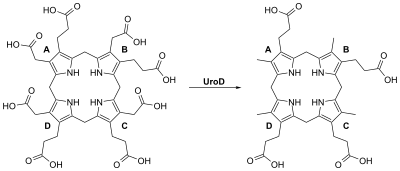

Las mutaciones hereditarias en el gen UROD causan alrededor del 20% de los casos (el 80% restante no tiene mutaciones en el gen UROD y se clasifican como esporádicos). El UROD produce una enzima llamada uroporfirinógeno III descarboxilasa , que es fundamental para el proceso químico que conduce a la producción del hemo. La actividad de esta enzima suele reducirse en un 50% en todos los tejidos de las personas con la forma hereditaria de la enfermedad. [ cita requerida ]
Factores no genéticos como el exceso de hierro o factores parcialmente genéticos como el trastorno por consumo de alcohol y otros enumerados anteriormente pueden aumentar la demanda de hemo y las enzimas necesarias para producir hemo. La combinación de esta mayor demanda y la actividad reducida de la uroporfirinógeno descarboxilasa altera la producción de hemo y permite que los subproductos del proceso se acumulen en el cuerpo, lo que desencadena los signos y síntomas de la porfiria cutánea tarda. [ cita requerida ]
El gen HFE produce una proteína que ayuda a las células a regular la absorción de hierro desde el tracto digestivo hasta las células del cuerpo. Ciertas mutaciones en el gen HFE causan hemocromatosis (un trastorno por sobrecarga de hierro ). Las personas que tienen estas mutaciones también tienen un mayor riesgo de desarrollar porfiria cutánea tardía. [ cita requerida ]
En el 20% de los casos en que se hereda la porfiria cutánea tarda, se hereda con un patrón autosómico dominante , lo que significa que una copia del gen alterado es suficiente para disminuir la actividad enzimática y causar los signos y síntomas del trastorno. [ cita requerida ]
Otro
Aunque las deficiencias hereditarias de la uroporfirinógeno descarboxilasa suelen conducir al desarrollo de la PCT, existen varios factores de riesgo que pueden causar y exacerbar los síntomas de esta enfermedad. Uno de los factores de riesgo más comunes observados es la infección por el virus de la hepatitis C. [11] Una revisión de una colección de estudios sobre la PCT señaló la infección por hepatitis C en el 50 % de los casos documentados de PCT. Otros factores de riesgo incluyen el trastorno por consumo de alcohol, el exceso de hierro (de suplementos de hierro y de cocinar en sartenes de hierro fundido) y la exposición a hidrocarburos cíclicos clorados y al Agente Naranja . [ cita requerida ]
Puede ser un fenómeno paraneoplásico . [12]
Factores exacerbantes
- Alcohol [13]
- Estrógeno
- Hierro [14]
- Virus de la hepatitis C [15]
Patogenesia
La porfiria cutánea tardía es causada principalmente por la deficiencia de uroporfirinógeno descarboxilasa (UROD). La uroporfirinógeno descarboxilasa se presenta en la naturaleza como un homodímero de dos subunidades. Participa en el quinto paso de la vía de síntesis del hemo y es activa en el citosol. Esta conversión enzimática da como resultado el coproporfirinógeno III como producto primario. Esto se logra mediante la eliminación en el sentido de las agujas del reloj de los cuatro grupos carboxilo presentes en la molécula cíclica de uroporfirinógeno III. Por lo tanto, una deficiencia en esta enzima causa la acumulación antes mencionada de uroporfirinógeno y porfirinógeno heptacarboxílico , y en menor medida de porfirinógeno hexacarboxílico y porfirinógeno pentacarboxílico en la orina, lo que puede ser útil en el diagnóstico de este trastorno. [16] [17]
Los síntomas dermatológicos de la PCT que incluyen ampollas y lesiones en las áreas de la piel expuestas al sol son causados por una acumulación de compuestos de porfirinas (específicamente uroporfirinógeno) cerca de la superficie de la piel que han sido oxidados por radicales libres o luz solar. [18] Las porfirinas oxidadas inician la desgranulación de los mastocitos dérmicos , [19] que liberan proteasas que catabolizan las proteínas circundantes. [20] Esto inicia un ciclo de retroalimentación positiva mediada por células que coincide con la descripción de una reacción de hipersensibilidad retardada tipo 4. [ cita requerida ] Las ampollas resultantes, por lo tanto, no aparecen inmediatamente, sino que comienzan a aparecer 2-3 días después de la exposición al sol. Debido a la estructura altamente conjugada de las porfirinas que involucra enlaces de carbono simples y dobles alternados, estos compuestos exhiben un color púrpura oscuro, lo que resulta en la decoloración observada en la piel. La ingesta excesiva de alcohol disminuye la producción de hepcidina , lo que conduce a una mayor absorción de hierro del intestino y un aumento del estrés oxidativo. Este estrés oxidativo conduce entonces a la inhibición de la descarboxilasa del uroporfirinógeno, creando un exceso de uroporfirinógeno III que se oxida desde los porfirinógenos relativamente inofensivos a su forma oxidada de porfirinas. [21] Los casos concentrados de estrés oxidativo (alcohol, trauma físico, estrés psicológico, etc.) hacen que el hígado sangre estas porfirinas al torrente sanguíneo, donde luego son susceptibles a la oxidación. [ cita requerida ]
La fuerte asociación de la PCT con la infección por el virus de la hepatitis C no se entiende del todo. Los estudios han sugerido que el efecto citopático del virus sobre los hepatocitos puede provocar la liberación de hierro libre. Este hierro puede alterar la actividad del citocromo p450, liberando especies de oxígeno activadas. Estas pueden oxidar el sustrato de la UROD, el uroporfirinógeno, lo que puede provocar la inhibición de la UROD y provocar una actividad deficiente de esta enzima clave. [22]
El consumo excesivo de alcohol se asocia frecuentemente con la inducción de PCT [23] y el agravamiento de un diagnóstico preexistente del trastorno. Se cree que lo hace al causar daño oxidativo a las células hepáticas, lo que da como resultado especies oxidadas de uroporfirinógeno que inhiben la actividad de la UROD hepática. También se cree que aumenta la absorción de hierro en las células hepáticas, lo que lleva a una mayor oxidación del uroporfirinógeno mediante la liberación de especies de oxígeno activado. Además, la exposición a hidrocarburos cíclicos clorados puede provocar una deficiencia en la actividad de la descarboxilasa del uroporfirinógeno, lo que provoca la acumulación de un exceso de uroporfirinógeno. Además, se ha demostrado que el alcohol aumenta la actividad de la sintetasa del ácido delta-aminolevulínico (ALA sintetasa), el paso enzimático limitante de la velocidad en la síntesis del hemo en las mitocondrias, en ratas. [24] Por lo tanto, el consumo de alcohol puede aumentar la producción de uroporfirinógeno, exacerbando los síntomas en personas con porfiria cutánea tarda. [ cita requerida ]
Diagnóstico
Aunque el síntoma más común de la PCT es la aparición de lesiones cutáneas y ampollas, su apariencia no es concluyente. Las pruebas de laboratorio suelen revelar niveles elevados de uroporfirinógeno en la orina, lo que clínicamente se denomina uroporfirinogenuria. Además, se recomienda encarecidamente realizar pruebas para detectar factores de riesgo comunes, como hepatitis C y hemocromatosis , ya que su alta prevalencia en pacientes con PCT puede requerir tratamiento adicional. Si la PCT tiene apariencia clínica, pero los análisis de laboratorio son negativos, se debe considerar seriamente el diagnóstico de pseudoporfiria . [ cita requerida ]
Clasificación
Algunas fuentes dividen la PCT en dos tipos: esporádica y familiar. [2] Otras fuentes incluyen un tercer tipo, [25] pero este es menos común.
| Tipo | OMI | Descripción |
|---|---|---|
| Tipo I ("esporádico") | 176090 | La porfiria cutánea tardía de tipo I, la forma esporádica, se manifiesta por una deficiencia de UROD que se observa únicamente en las células hepáticas y en ninguna otra parte del cuerpo. Genéticamente, estos individuos no presentan deficiencia del gen UROD, aunque se cree que otros factores genéticos, como la deficiencia de HFE (que provoca hemocromatosis y acumulación de hierro en el hígado), desempeñan un papel clave. Por lo general, en estos individuos, una variedad de factores de riesgo, como el trastorno por consumo de alcohol y la infección por el virus de la hepatitis C, se presentan simultáneamente para dar lugar a la manifestación clínica de la PCT. |
| Tipo II ("familiar") | 176100 | Los pacientes que presentan PCT de tipo II tienen una deficiencia específica en el gen UROD, que se transmite de generación en generación según un patrón autosómico dominante. Quienes poseen esta deficiencia son heterocigotos para el gen UROD. No muestran una falta total de uroporfirinógeno descarboxilasa funcional, sino solo una forma deficiente de la enzima que se caracteriza por una conversión reducida de uroporfirinógeno a coproporfirinógeno. Por lo tanto, la expresión de uroporfirinógeno descarboxilasa estará reducida en todo el cuerpo de estos individuos, mientras que en los pacientes de tipo I se encuentra aislada en el hígado. Si bien esta deficiencia genética es la principal distinción entre PCT de tipo I y tipo II, los factores de riesgo mencionados anteriormente se observan a menudo en pacientes que presentan PCT de tipo II. De hecho, muchas personas que poseen el gen UROD deficiente a menudo pasan toda su vida sin tener una manifestación clínica de los síntomas de PCT. |
| Tipo III | - | El tipo menos frecuente es el III, que no difiere del I en que los pacientes poseen genes UROD normales. A pesar de ello, la PCT tipo III se observa en más de un miembro de la familia, lo que indica un componente genético no relacionado con la expresión de la uroporfirinógeno descarboxilasa. |
Un estudio utilizó el 74% como punto de corte para la actividad de UROD, y los pacientes por debajo de ese número se clasificaron como tipo II, y los superiores como tipo III si había antecedentes familiares, y tipo I si no los había. [26]
Se han observado variantes genéticas asociadas con la hemocromatosis en pacientes con PCT, [13] lo que puede ayudar a explicar la PCT hereditaria no asociada con UROD.
Tratamiento
Dado que la PCT es una enfermedad crónica, el tratamiento más eficaz es el tratamiento integral de la enfermedad. En primer lugar, es fundamental que los pacientes diagnosticados con PCT eviten el consumo de alcohol, los suplementos de hierro, la exposición excesiva a la luz solar (especialmente en verano), así como el estrógeno y los hidrocarburos cíclicos clorados, que pueden exacerbar el trastorno. Además, el tratamiento del exceso de hierro (debido a la hemocromatosis común en los pacientes con PCT) se puede lograr mediante una flebotomía , mediante la cual se drena sistemáticamente la sangre del paciente. Se ha descubierto que una deficiencia de hierro limítrofe tiene un efecto protector al limitar la síntesis del hemo. En ausencia de hierro, que se debe incorporar a la porfirina formada en el último paso de la síntesis, el ARNm de la 5-aminolevulinato sintasa eritroide (ALAS-2) se bloquea mediante la unión de una proteína citosólica de unión al elemento sensible al hierro (IRE), y se inhibe la transcripción de esta enzima clave. [27]
Se pueden utilizar dosis bajas de antipalúdicos . [28] La cloroquina ingerida por vía oral se absorbe completamente en el intestino y se concentra preferentemente en el hígado, el bazo y los riñones. [29] Actúan eliminando el exceso de porfirinas del hígado mediante el aumento de la tasa de excreción formando un complejo de coordinación con el centro de hierro de la porfirina, así como un enlace de hidrógeno intramolecular entre una cadena lateral de propionato de la porfirina y el átomo de nitrógeno de quinuclidina protonado de cualquiera de los alcaloides. [30] Debido a la presencia del átomo de cloro, todo el complejo es más soluble en agua, lo que permite que los riñones lo eliminen preferentemente del torrente sanguíneo y lo expulsen a través de la orina. [29] [31] [32] El tratamiento con cloroquina puede inducir ataques de porfiria en los primeros meses de tratamiento debido a la movilización masiva de porfirinas del hígado al torrente sanguíneo. [29] La remisión completa se puede observar en un plazo de 6 a 12 meses, ya que cada dosis de antipalúdico solo puede eliminar una cantidad finita de porfirinas y, por lo general, hay décadas de acumulación para eliminarlas. Originalmente, se usaban dosis más altas para tratar la afección, pero ya no se recomiendan debido a la toxicidad hepática. [33] [34] Finalmente, debido a la fuerte asociación entre la PCT y la hepatitis C, el tratamiento de la hepatitis C (si está presente) es vital para el tratamiento eficaz de la PCT. La cloroquina , la hidroxicloroquina y la venesección se emplean típicamente en la estrategia de manejo. [35]
Epidemiología
Se estima que la prevalencia de la PCT es de 1 en 10.000. [36] Se estima que el 80% de los casos de porfiria cutánea tardía son esporádicos. La frecuencia exacta no está clara porque muchas personas con la afección nunca presentan síntomas y las que sí los presentan suelen ser diagnosticadas erróneamente con cualquier cosa que vaya desde fotodermatitis idiopática y alergias estacionales hasta urticaria . [ cita requerida ]
Referencias
- ^ Phillips, JD; Bergonia, HA; Reilly, CA; Franklin, MR; Kushner, JP (2007). "Un inhibidor de porfometeno de la uroporfirinógeno descarboxilasa causa porfiria cutánea tardía". Actas de la Academia Nacional de Ciencias . 104 (12): 5079–84. Bibcode :2007PNAS..104.5079P. doi : 10.1073/pnas.0700547104 . JSTOR 25427147. PMC 1820519 . PMID 17360334.
- ^ ab "porfiria cutánea tardía" en el Diccionario médico de Dorland
- ^ Danton, Malcolm; Lim, Chang Kee (2007). "Inhibidor de porfometeno de la uroporfirinógeno descarboxilasa: análisis mediante cromatografía líquida de alto rendimiento/espectrometría de masas en tándem con ionización por electrospray". Cromatografía biomédica . 21 (7): 661–3. doi :10.1002/bmc.860. PMID 17516469.
- ^ Kushner, JP; Barbuto, AJ; Lee, GR (1976). "Un defecto enzimático heredado en la porfiria cutánea tardía: disminución de la actividad de la uroporfirinógeno descarboxilasa". Journal of Clinical Investigation . 58 (5): 1089–97. doi :10.1172/JCI108560. PMC 333275 . PMID 993332.
- ^ Di Padua, C.; Marchesi, L.; Cainelli, T.; Gori, G.; Podenzani, SA; Rovagnati, P.; Rizzardini, M.; Cantoni, L. (1983). "Efectos de la flebotomía sobre el patrón de porfirina urinaria y la histología hepática en pacientes con porfiria cutánea tardía". La Revista Estadounidense de Ciencias Médicas . 285 (1): 2–12. doi :10.1097/00000441-198301000-00001. PMID 6824014. S2CID 23741767.
- ^ Goljan, EF (2011). Patología (3.ª ed., reimpresión revisada). Filadelfia, PA: Mosby/Elsevier. [ página necesaria ]
- ^ ab Rocchi, E.; Estela, AM; Cassanelli, M.; Borghi, A.; Nardella, N.; Seio, Y.; Casalgrandi, G. (1 de julio de 1995). "Vitaminas liposolubles y carotenoides naturales en la porfiria cutánea tarda". Revista europea de investigación clínica . 25 (7): 510–514. doi :10.1111/j.1365-2362.1995.tb01737.x. PMID 7556369. S2CID 44998779.
- ^ Rocchi, E.; Casalgrandi, G.; Masini, A.; Giovannini, F.; Ceccarelli, D.; Ferrali, M.; Marchini, S.; Ventura, E. (1 de diciembre de 1999). "Factores pro y antioxidantes circulantes en los trastornos del metabolismo del hierro y las porfirinas". Revista Italiana de Gastroenterología y Hepatología . 31 (9): 861–867. PMID 10669994.
- ^ ab Benoldi, D.; Manfredi, G.; Pezzarossa, E.; Allegra, F. (1 de diciembre de 1981). "Proteína de unión al retinol en la piel humana normal y en trastornos cutáneos". The British Journal of Dermatology . 105 (6): 659–665. doi :10.1111/j.1365-2133.1981.tb00976.x. PMID 7032574. S2CID 23170672.
- ^ Böhm, F.; Edge, R.; Foley, S.; Lange, L.; Truscott, TG (31 de diciembre de 2001). "Inhibición antioxidante de la fototoxicidad celular inducida por porfirina". Journal of Photochemistry and Photobiology B: Biology . 65 (2–3): 177–183. Bibcode :2001JPPB...65..177B. doi :10.1016/s1011-1344(01)00259-7. PMID 11809377.
- ^ Azim, James; McCurdy, H; Moseley, RH (2008). "Porfiria cutánea tardía como complicación del tratamiento de la hepatitis C crónica". Revista Mundial de Gastroenterología . 14 (38): 5913–5. doi : 10.3748/wjg.14.5913 . PMC 2751904 . PMID 18855993.
- ^ Sökmen, M; Demirsoy, H; Ersoy, O; Gökdemir, G; Akbayir, N; Karaca, C; Özdil, K; Kesici, B; Calişkan, C; Yilmaz, B (2007). "Porfiria cutánea tarda paraneoplásica asociada a colangiocarcinoma: reporte de caso". La Revista Turca de Gastroenterología . 18 (3): 200–5. PMID 17891697.
- ^ ab Frank, J; Poblete-Gutiérrez, P; Weiskirchen, R; Gressner, O; Merk, HF; Lammert, F (2006). "Desviaciones de la secuencia del gen de la hemocromatosis en pacientes alemanes con porfiria cutánea tardía" (PDF) . Physiological Research . 55 (Suppl 2): S75–83. doi :10.33549/physiolres.930000.55.S2.75. PMID 17298224. S2CID 1787139.
- ^ Sampietro, M; Fiorelli, G; Fargion, S (1999). "Sobrecarga de hierro en porfiria cutánea tarda". Hematológica . 84 (3): 248–53. PMID 10189391.
- ^ "Porfiria cutánea tardía (PCT)". 2020-01-12.
- ^ "Pruebas de porfirina". 7 de mayo de 2020.
- ^ Jackson, AH; Ferramola, AM; Sancovich, HA; Evans, N; Matlin, SA; Ryder, DJ; Smith, SG (1976). "Intermediarios de porfirinógeno hepta- y hexa-carboxílicos en la biosíntesis del grupo hemo". Anales de investigación clínica . 8 (Supl. 17): 64–9. PMID 1008499.
- ^ Miller, Dennis M.; Woods, James S. (1993). "Porfirinas urinarias como indicadores biológicos del estrés oxidativo en el riñón". Farmacología bioquímica . 46 (12): 2235–41. doi :10.1016/0006-2952(93)90614-3. PMID 8274157.
- ^ Brun, Atle; Sandberg, Sverre (1991). "Mecanismos de fotosensibilidad en pacientes porfíricos con especial énfasis en la protoporfiria eritropoyética". Journal of Photochemistry and Photobiology B: Biology . 10 (4): 285–302. Bibcode :1991JPPB...10..285B. doi :10.1016/1011-1344(91)80015-A. PMID 1791486.
- ^ Lim, HW (1989). "Mecanismos de fototoxicidad en la porfiria cutánea tardía y la protoporfiria eritropoyética". Immunology Series . 46 : 671–85. PMID 2488874.
- ^ Ryan Caballés, F.; Sendi, Hossein; Bonkovsky, Herbert L. (2012). "Hepatitis C, porfiria cutánea tarda y hierro en el hígado: una actualización". Hígado Internacional . 32 (6): 880–93. doi :10.1111/j.1478-3231.2012.02794.x. PMC 3418709 . PMID 22510500.
- ^ Ryan Caballés, F.; Sendi, Hossein; Bonkovsky, Herbert L. (julio de 2012). "Hepatitis C, porfiria cutánea tardía y hierro hepático: una actualización". Hígado Internacional . 32 (6): 880–893. doi :10.1111/j.1478-3231.2012.02794.x. ISSN 1478-3223. PMC 3418709 . PMID 22510500.
- ^ Porfiria cutánea tardía en eMedicine
- ^ Held, H. (2009). "Efecto del alcohol en la síntesis de hemo y porfirina Interacción con fenobarbital y pirazol". Digestión . 15 (2): 136–46. doi :10.1159/000197995. PMID 838185.
- ^ Méndez, M.; Poblete-Gutiérrez, P.; García-Bravo, M.; Wiederholt, T.; Morán-Jiménez, MJ; Merk, HF; Garrido-Astray, MC; Frank, J.; Fontanellas, A.; Enríquez De Salamanca, R. (2007). "Heterogeneidad molecular de la porfiria cutánea tarda familiar en España: Caracterización de 10 nuevas mutaciones en el gen UROD". Revista británica de dermatología . 157 (3): 501–7. doi :10.1111/j.1365-2133.2007.08064.x. hdl : 11268/5436 . PMID 17627795. S2CID 43785629.
- ^ Cruz-Rojo, J; Fontanellas, A; Morán-Jiménez, MJ; Navarro-Ordóñez, S; García-Bravo, M; Méndez, M; Muñoz-Rivero, MC; De Salamanca, RE (2002). "Factores precipitantes/agravantes de la porfiria cutánea tarda en pacientes españoles". Biología Celular y Molecular (Noisy-le-Grand, Francia) . 48 (8): 845–52. PMID 12699242.
- ^ Thunell, S (2000). "Porfirinas, metabolismo de las porfirinas y porfirias. I. Actualización". Revista escandinava de investigación clínica y de laboratorio . 60 (7): 509–40. doi :10.1080/003655100448310. PMID 11202048. S2CID 8470078.
- ^ Singal, Ashwani K.; Kormos-Hallberg, Csilla; Lee, Chul; Sadagoparamanujam, Vaithamanithi M.; Grady, James J.; Freeman, Daniel H.; Anderson, Karl E. (2012). "La hidroxicloroquina en dosis bajas es tan eficaz como la flebotomía en el tratamiento de pacientes con porfiria cutánea tardía". Gastroenterología Clínica y Hepatología . 10 (12): 1402–9. doi :10.1016/j.cgh.2012.08.038. PMC 3501544 . PMID 22985607.
- ^ abc "Informes de cumplimiento". www.accessdata.fda.gov .
- ^ De Villiers, Katherine A.; Gildenhuys, Johandie; Le Roex, Tanya (2012). "Complejos de protoporfirina IX de hierro (III) de los alcaloides antipalúdicos de quina quinina y quinidina". Biología Química ACS . 7 (4): 666–71. doi :10.1021/cb200528z. PMID 22276975.
- ^ Asghari-Khiavi, Mehdi; Vongsvivut, Jitraporn; Perepichka, Inna; Mechler, Adam; Wood, Bayden R.; McNaughton, Don; Bohle, D. Scott (2011). "Interacción de fármacos antipalúdicos a base de quinolina con ferriprotoporfirina IX, un estudio de espectroscopia de estado sólido". Journal of Inorganic Biochemistry . 105 (12): 1662–9. doi :10.1016/j.jinorgbio.2011.08.005. PMID 22079977.
- ^ Alumasa, John N.; Gorka, Alexander P.; Casabianca, Leah B.; Comstock, Erica; De Dios, Angel C.; Roepe, Paul D. (2011). "La funcionalidad hidroxilo y un N proximal rígido son necesarios para formar un nuevo complejo no covalente de quinina-hemo". Journal of Inorganic Biochemistry . 105 (3): 467–75. doi :10.1016/j.jinorgbio.2010.08.011. PMC 3010338 . PMID 20864177.
- ^ Sweeney, GD; Saunders, SJ; Dowdle, EB; Eales, L (1965). "Efectos de la cloroquina en pacientes con porfiria cutánea del tipo "sintomático"". British Medical Journal . 1 (5445): 1281–5. doi :10.1136/bmj.1.5445.1281. PMC 2166040 . PMID 14278818.
- ^ Scholnick, Perry L.; Epstein, John; Marver, Harvey S. (1973). "La base molecular de la acción de la cloroquina en la porfiria cutánea tardía". Revista de dermatología investigativa . 61 (4): 226–32. doi : 10.1111/1523-1747.ep12676478 . PMID 4744026.
- ^ Sarkany, RPE (2001). "El tratamiento de la porfiria cutánea tardía". Dermatología clínica y experimental . 26 (3): 225–32. doi :10.1046/j.1365-2230.2001.00825.x. PMID 11422163. S2CID 35585037.
- ^ Arceci, Robert.; Hann, Ian M.; Smith, Owen P. (2006). Hematólogo pediátrico . Malden MA: Blackwell. ISBN 978-1-4051-3400-2.[ página necesaria ]
Enlaces externos
- Porfiria cutánea tardía en la Oficina de Enfermedades Raras del NIH