Hepcidina
| HAMP | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
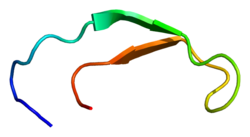 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadores | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Alias | HAMP , HEPC, HFE2B, LEAP1, PLTR, péptido antimicrobiano de hepcidina | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificaciones externas | OMIM : 606464; MGI : 2153530; HomoloGene : 81623; Tarjetas genéticas : HAMP; OMA :HAMP - ortólogos | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidatos | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Hepcidina | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Estructura de la solución de hepcidina-25. [5] | |||||||||
| Identificadores | |||||||||
| Símbolo | Hepcidina | ||||||||
| Pfam | PF06446 | ||||||||
| Interprofesional | IPR010500 | ||||||||
| SCOP2 | 1m4f / ALCANCE / SUPFAM | ||||||||
| Superfamilia OPM | 153 | ||||||||
| Proteína OPM | 1 minuto y 4 segundos | ||||||||
| |||||||||
| péptido antimicrobiano hepcidina | |||||||
|---|---|---|---|---|---|---|---|
| Identificadores | |||||||
| Símbolo | HAMP | ||||||
| Gen NCBI | 57817 | ||||||
| HGNC | 15598 | ||||||
| OMI | 606464 | ||||||
| Secuencia de referencia | Número nuevo_021175 | ||||||
| Protección unificada | P81172 | ||||||
| Otros datos | |||||||
| Lugar | Crónica 19 q13.1 | ||||||
| |||||||
La hepcidina es una proteína que en los seres humanos está codificada por el gen HAMP . La hepcidina es un regulador clave de la entrada de hierro a la circulación en los mamíferos. [6]
Durante las condiciones en las que el nivel de hepcidina es anormalmente alto, como la inflamación , el hierro sérico disminuye debido al atrapamiento de hierro dentro de los macrófagos y las células hepáticas y la disminución de la absorción intestinal de hierro. Esto generalmente conduce a anemia debido a una cantidad inadecuada de hierro sérico disponible para el desarrollo de los glóbulos rojos . Cuando el nivel de hepcidina es anormalmente bajo, como en la hemocromatosis , se produce una sobrecarga de hierro debido al aumento del eflujo de hierro mediado por ferroportina desde el almacenamiento y al aumento de la absorción intestinal de hierro.
Estructura
La hepcidina se sintetiza inicialmente como una preprohormona de 84 aminoácidos (preprohepcidina) que sufre escisiones secuenciales para formar la hormona madura y activa. La primera escisión por la peptidasa señal elimina el péptido señal N-terminal de 24 aminoácidos , creando una prohepcidina de 60 aminoácidos. La convertasa similar a la furina [7] y la α-1 antitripsina [8] luego escinden la prohepcidina para eliminar una prorregión de 35 aminoácidos, lo que da como resultado la hepcidina bioactiva y madura de 25 aminoácidos. También existen isoformas más cortas de hepcidina, con 20 y 22 aminoácidos, que tienen una actividad reguladora del hierro mínima. Solo los 9 aminoácidos N-terminales son esenciales para la actividad biológica de la hepcidina, específicamente su capacidad para unirse a la ferroportina y regular el metabolismo del hierro.
Estructuralmente, la hepcidina es un polipéptido fuertemente plegado con un 32% de carácter de lámina beta y una estructura terciaria en horquilla estabilizada por cuatro enlaces disulfuro entre ocho residuos de cisteína (estructura crucial). La estructura de la hepcidina se ha dilucidado mediante RMN en solución, [9] revelando que se interconvierte entre dos conformaciones a diferentes temperaturas. El análisis de rayos X de un cocristal con Fab confirmó una estructura similar a la estructura de RMN de alta temperatura. [10]
Función

La hepcidina es un regulador del metabolismo del hierro. Inhibe el transporte de hierro al unirse al canal de exportación de hierro ferroportina que se encuentra en la membrana plasmática basolateral de los enterocitos intestinales y la membrana plasmática de las células reticuloendoteliales ( macrófagos ), lo que finalmente da como resultado la degradación de la ferroportina en los lisosomas . [11] [12] Se ha demostrado que la hepcidina puede unirse a la cavidad central de la ferroportina, ocluyendo así la exportación de hierro de la célula. Esto sugiere que la hepcidina puede regular la exportación de hierro independientemente de la endocitosis y la ubiquitinación de la ferroportina , y por lo tanto es rápidamente inducible y reversible. [13] [14]
En los enterocitos, esto impide la transmisión de hierro al sistema porta hepático , reduciendo así la absorción de hierro de la dieta. En los macrófagos, la inhibición de la ferroportina hace que el hierro se almacene dentro de la célula. El aumento de la actividad de la hepcidina es parcialmente responsable de la menor disponibilidad de hierro observada en la anemia de la inflamación crónica, como la insuficiencia renal ; esto puede explicar por qué los pacientes con insuficiencia renal terminal pueden no responder al reemplazo de hierro oral. [15]
Cualquiera de las diversas mutaciones en la hepcidina dará lugar a hemocromatosis juvenil . La mayoría de los casos de hemocromatosis juvenil son causados por mutaciones en la hemojuvelina . [16] Las mutaciones en TMPRSS6 pueden causar anemia a través de la desregulación de la hepcidina. [17]
La hepcidina tiene una fuerte actividad antimicrobiana contra la cepa ML35P de Escherichia coli y Neisseria cinerea y una actividad antimicrobiana más débil contra Staphylococcus epidermidis , Staphylococcus aureus y Streptococcus agalactiae . También es activa contra el hongo Candida albicans , pero no tiene actividad contra Pseudomonas aeruginosa . [18]
Regulación
La creación (síntesis) y secreción de hepcidina por el hígado está controlada por las reservas de hierro, la inflamación (la hepcidina es un reactante de fase aguda ), la hipoxia y la producción de glóbulos rojos ( eritropoyesis ). [19] En respuesta a las grandes reservas de hierro, se induce la producción de proteína morfogénica ósea (BMP), que se une a los receptores de los hepatocitos e induce la expresión de hepcidina a través de la vía SMAD . [20] La inflamación provoca un aumento en la producción de hepcidina al liberar la molécula de señalización interleucina-6 (IL-6) , que se une a un receptor y regula positivamente el gen HAMP a través de la vía JAK/STAT . [20] La hipoxia regula negativamente la producción de hepcidina a través de la producción del factor de transcripción factor inducible por hipoxia (HIF), que en condiciones normales es degradado por von Hippel-Lindau (VHL) y la prolil deshidrogenasa (PHD). Sin embargo, cuando se induce la hipoxia, la PHD se inactiva, lo que permite que el HIF regule negativamente la producción de hepcidina. La eritropoyesis disminuye la producción de hepcidina a través de la producción de eritropoyetina (EPO), que se ha demostrado que regula negativamente la producción de hepcidina. [20]
La anemia grave se asocia con niveles bajos de hepcidina, incluso en presencia de inflamación. [21] Se ha identificado que la eritroferrona , producida en los glóbulos rojos ( eritroblastos ), inhibe la hepcidina, proporcionando así más hierro para la síntesis de hemoglobina en situaciones como la eritropoyesis por estrés. [22] [23]
Se ha demostrado que la vitamina D reduce la hepcidina, tanto en modelos celulares que analizan la transcripción como cuando se administra en grandes dosis a voluntarios humanos. El funcionamiento óptimo de la hepcidina puede requerir niveles adecuados de vitamina D en la sangre. [24]
Historia
La hepcidina fue descrita y nombrada inicialmente en enero de 1998, [18] después de que se observó que se producía en el hígado y parecía tener propiedades bactericidas (que matan bacterias). Se publicaron descripciones detalladas en 2000-2001. [25] [26] [27] Aunque se sintetiza principalmente en el hígado, se sintetizan cantidades más pequeñas en otros tejidos como las células grasas . [28]
La hepcidina se descubrió por primera vez en la orina y el suero sanguíneo humanos . [29] Poco después de este descubrimiento, los investigadores descubrieron que la producción de hepcidina en ratones aumenta en condiciones de sobrecarga de hierro, así como de inflamación. Los ratones modificados genéticamente para sobreexpresar hepcidina murieron poco después del nacimiento con una deficiencia grave de hierro, lo que nuevamente sugiere que la hepcidina desempeña un papel central y no redundante en la regulación del hierro.
La primera evidencia que relacionaba la hepcidina con la enfermedad conocida como anemia inflamatoria provino del laboratorio de Nancy Andrews en Boston, cuando los investigadores analizaron el tejido de dos pacientes con tumores hepáticos que presentaban una anemia microcítica grave que no respondía a los suplementos de hierro . El tejido tumoral parecía producir hepcidina en exceso y contenía grandes cantidades de ARNm de hepcidina . La extirpación quirúrgica de los tumores curó la anemia. [ cita requerida ]
En conjunto, estos descubrimientos sugieren que la hepcidina regula la absorción de hierro en el cuerpo.

Importancia clínica
Existen muchas enfermedades en las que la falta de absorción adecuada del hierro contribuye a la deficiencia de hierro y a la anemia ferropénica . El tratamiento dependerá de los niveles de hepcidina presentes, ya que es poco probable que el tratamiento oral sea eficaz si la hepcidina bloquea la absorción enteral; en estos casos, sería adecuado el tratamiento con hierro parenteral . Los estudios han demostrado que la medición de la hepcidina ayudaría a establecer el tratamiento óptimo para un paciente [30] , pero como no está ampliamente disponible, se utiliza la proteína C reactiva (PCR) como marcador sustituto.
El consumo crónico de alcohol puede provocar una acumulación excesiva de hierro en el hígado, lo que puede contribuir al desarrollo de la enfermedad hepática alcohólica . El consumo crónico de alcohol puede aumentar la acumulación de hierro al inhibir la expresión del gen de la hepcidina . Los principales mecanismos parecen ser el aumento del estrés oxidativo a través de su metabolito acetaldehído y la inhibición de la liberación de interleucina 6 (IL-6) de los macrófagos ; cada una de estas acciones reduce la expresión y la actividad de unión al ADN del factor de transcripción C/EBPα , que de otro modo estimularía la expresión de hepcidina. [31]
La beta talasemia , una de las anemias congénitas más comunes , surge de la falla parcial o completa para sintetizar beta-globina , un componente de la hemoglobina . La absorción excesiva de hierro es una de las principales características de la beta talasemia y puede conducir a una morbilidad y mortalidad graves. Los análisis seriados de ratones beta talasémicos indican que los niveles de hemoglobina disminuyen con el tiempo, mientras que la concentración de hierro en el hígado , el bazo y los riñones aumenta significativamente. La sobrecarga de hierro se asocia con niveles bajos de hepcidina. Los pacientes con beta talasemia también tienen niveles bajos de hepcidina. Las observaciones llevaron a los investigadores a plantear la hipótesis de que se absorbe más hierro en la beta talasemia del que se requiere para la eritropoyesis . El aumento de la expresión de hepcidina en ratones beta talasémicos limita la sobrecarga de hierro y también disminuye la formación de globinas unidas a la membrana insolubles y especies reactivas de oxígeno, y mejora la anemia. [32] Los ratones con mayor expresión de hepcidina también demostraron un aumento en la vida útil de sus glóbulos rojos , reversión de la eritropoyesis ineficaz y la esplenomegalia , y un aumento en los niveles de hemoglobina total. A partir de estos datos, los investigadores sugirieron que las terapias para aumentar los niveles de hepcidina o actuar como agonistas de la hepcidina podrían ayudar a tratar la absorción anormal de hierro en individuos con beta talasemia y trastornos relacionados. [33] En estudios posteriores con ratones, [34] se ha sugerido que la eritroferrona es el factor responsable de la supresión de la hepcidina. La corrección de los niveles de hepcidina y hierro en estos ratones no mejoró su anemia. [34]
Referencias
- ^ abc GRCh38: Lanzamiento de Ensembl 89: ENSG00000105697 – Ensembl , mayo de 2017
- ^ abc GRCm38: Lanzamiento de Ensembl 89: ENSMUSG00000056978 – Ensembl , mayo de 2017
- ^ "Referencia de PubMed humana:". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ "Referencia de PubMed sobre ratón". Centro Nacional de Información Biotecnológica, Biblioteca Nacional de Medicina de EE. UU .
- ^ PDB : 1M4F ; Hunter HN, Fulton DB, Ganz T, Vogel HJ (octubre de 2002). "La estructura de la solución de la hepcidina humana, una hormona peptídica con actividad antimicrobiana que está implicada en la captación de hierro y la hemocromatosis hereditaria". The Journal of Biological Chemistry . 277 (40): 37597–37603. doi : 10.1074/jbc.M205305200 . PMID 12138110.
- ^ Ganz T (agosto de 2003). "Hepcidina, un regulador clave del metabolismo del hierro y mediador de la anemia inflamatoria". Blood . 102 (3): 783–788. doi : 10.1182/blood-2003-03-0672 . PMID 12663437.
- ^ Valore EV, Ganz T (2008). "El procesamiento postraduccional de la hepcidina en los hepatocitos humanos está mediado por la prohormona convertasa furina". Células sanguíneas, moléculas y enfermedades . 40 (1): 132–138. doi :10.1016/j.bcmd.2007.07.009. PMC 2211381 . PMID 17905609.
- ^ Pandur E, Nagy J, Poór VS, Sarnyai A, Huszár A, Miseta A, Sipos K (abril de 2009). "La alfa-1 antitripsina se une a la preprohepcidina intracelularmente y a la prohepcidina en el suero". El Diario FEBS . 276 (7): 2012-2021. doi : 10.1111/j.1742-4658.2009.06937.x . PMID 19292870. S2CID 28974553.
- ^ Hunter, Howard N.; Fulton, D. Bruce; Ganz, Tomas; Vogel, Hans J. (4 de octubre de 2002). "La estructura de la solución de la hepcidina humana, una hormona peptídica con actividad antimicrobiana que está implicada en la captación de hierro y la hemocromatosis hereditaria". The Journal of Biological Chemistry . 277 (40): 37597–37603. doi : 10.1074/jbc.M205305200 . ISSN 0021-9258. PMID 12138110.
- ^ PDB : 3H0T ; Jordan JB, Poppe L, Haniu M, Arvedson T, Syed R, Li V, et al. (septiembre de 2009). "Revisión de la hepcidina, conectividad, dinámica y estructura del disulfuro". The Journal of Biological Chemistry . 284 (36): 24155–24167. doi : 10.1074/jbc.M109.017764 . PMC 2782009 . PMID 19553669.
- ^ Rossi E (agosto de 2005). "Hepcidina: la hormona reguladora del hierro". The Clinical Biochemist. Reseñas . 26 (3): 47–49. PMC 1240030. PMID 16450011 .
- ^ Gulec S, Anderson GJ, Collins JF (agosto de 2014). "Aspectos mecanicistas y reguladores de la absorción intestinal de hierro". American Journal of Physiology. Fisiología gastrointestinal y hepática . 307 (4): G397–G409. doi :10.1152/ajpgi.00348.2013. PMC 4137115. PMID 24994858 .
- ^ Aschemeyer S, Qiao B, Stefanova D, Valore EV, Sek AC, Ruwe TA, et al. (febrero de 2018). "El análisis de la estructura y la función de la ferroportina define el sitio de unión y un mecanismo de acción alternativo de la hepcidina". Blood . 131 (8): 899–910. doi :10.1182/blood-2017-05-786590. PMC 5824336 . PMID 29237594.
- ^ Nemeth E, Ganz T (junio de 2021). "La interacción hepcidina-ferroportina controla la homeostasis sistémica del hierro". Revista internacional de ciencias moleculares . 22 (12): 6493. doi : 10.3390/ijms22126493 . PMC 8235187 . PMID 34204327.
- ^ Ashby DR, Gale DP, Busbridge M, Murphy KG, Duncan ND, Cairns TD, et al. (mayo de 2009). "Los niveles plasmáticos de hepcidina están elevados pero responden a la terapia con eritropoyetina en la enfermedad renal". Kidney International . 75 (9): 976–981. doi : 10.1038/ki.2009.21 . PMID 19212416.
- ^ Core AB, Canali S, Babitt JL (2014). "Señalización de la hemojuvelina y la proteína morfogenética ósea (BMP) en la homeostasis del hierro". Frontiers in Pharmacology . 5 : 104. doi : 10.3389/fphar.2014.00104 . PMC 4026703 . PMID 24860505.
- ^ Anemia por deficiencia de hierro: nuevos conocimientos para los profesionales de la salud: edición de 2011. Scholarly Media LLC. Diciembre de 2012. ISBN 978-1-4649-8960-5.
- ^ ab "Hepcidina P81172". UniProt . 15 de diciembre de 1998.
{{cite web}}: CS1 maint: estado de la URL ( enlace ) - ^ Zhao N, Zhang AS, Enns CA (junio de 2013). "Regulación del hierro por hepcidina". The Journal of Clinical Investigation . 123 (6): 2337–2343. doi :10.1172/JCI67225. PMC 3668831 . PMID 23722909.
- ^ abc Rishi G, Wallace DF, Subramaniam VN (marzo de 2015). "Hepcidina: regulación del regulador maestro del hierro". Bioscience Reports . 35 (3). doi :10.1042/bsr20150014. PMC 4438303 . PMID 26182354.
- ^ Abuga KM, Muriuki JM, Uyoga SM, Mwai K, Makale J, Mogire RM, et al. (julio de 2022). "Regulación de la hepcidina en niños kenianos con malaria grave y bacteriemia por Salmonella no tifoidea". Haematologica . 107 (7): 1589–1598. doi :10.3324/haematol.2021.279316. PMC 9244826 . PMID 34498446. S2CID 237454351.
- ^ Koury MJ. "Eritroferrona: un eslabón perdido en la regulación del hierro". The Hematologist . Sociedad Estadounidense de Hematología. Archivado desde el original el 28 de enero de 2019. Consultado el 26 de agosto de 2015 .
- ^ Kautz L, Jung G, Valore EV, Rivella S, Nemeth E, Ganz T (julio de 2014). "Identificación de la eritroferrona como regulador eritroide del metabolismo del hierro". Nature Genetics . 46 (7): 678–684. doi :10.1038/ng.2996. PMC 4104984 . PMID 24880340.
- ^ Bacchetta J, Zaritsky JJ, Sea JL, Chun RF, Lisse TS, Zavala K, et al. (marzo de 2014). "Supresión de la hepcidina reguladora del hierro por la vitamina D". Revista de la Sociedad Americana de Nefrología . 25 (3): 564–572. doi :10.1681/ASN.2013040355. PMC 3935584 . PMID 24204002.
- ^ Krause A, Neitz S, Mägert HJ, Schulz A, Forssmann WG, Schulz-Knappe P, Adermann K (septiembre de 2000). "LEAP-1, un nuevo péptido humano con enlaces disulfuro, exhibe actividad antimicrobiana". FEBS Letters . 480 (2–3): 147–150. doi : 10.1016/S0014-5793(00)01920-7 . PMID 11034317. S2CID 9161764.
- ^ Pigeon C, Ilyin G, Courselaud B, Leroyer P, Turlin B, Brissot P, Loréal O (marzo de 2001). "Un nuevo gen específico del hígado de ratón, que codifica una proteína homóloga al péptido antimicrobiano humano hepcidina, se sobreexpresa durante la sobrecarga de hierro". The Journal of Biological Chemistry . 276 (11): 7811–7819. doi : 10.1074/jbc.M008923200 . PMID 11113132.
- ^ Park CH, Valore EV, Waring AJ, Ganz T (marzo de 2001). "Hepcidina, un péptido antimicrobiano urinario sintetizado en el hígado". The Journal of Biological Chemistry . 276 (11): 7806–7810. doi : 10.1074/jbc.M008922200 . PMID 11113131.
- ^ Bekri S, Gual P, Anty R, Luciani N, Dahman M, Ramesh B, et al. (septiembre de 2006). "El aumento de la expresión de hepcidina en el tejido adiposo en la obesidad grave es independiente de la diabetes y la EHNA". Gastroenterología . 131 (3): 788–796. doi : 10.1053/j.gastro.2006.07.007 . PMID 16952548.
- ^ Kemna EH, Tjalsma H, Willems HL, Swinkels DW (enero de 2008). "Hepcidina: del descubrimiento al diagnóstico diferencial". Haematologica . 93 (1): 90–97. doi : 10.3324/haematol.11705 . hdl : 2066/70062 . PMID 18166790.
- ^ Bregman DB, Morris D, Koch TA, He A, Goodnough LT (febrero de 2013). "Los niveles de hepcidina predicen la falta de respuesta a la terapia oral con hierro en pacientes con anemia por deficiencia de hierro". American Journal of Hematology . 88 (2): 97–101. doi : 10.1002/ajh.23354 . PMID 23335357. S2CID 42656065.
- ^ Ferrao K, Ali N, Mehta KJ (diciembre de 2022). "Hierro y proteínas relacionadas con el hierro en consumidores de alcohol: aspectos celulares y clínicos". J Mol Med (Berl) . 100 (12): 1673–1689. doi :10.1007/s00109-022-02254-8. PMC 9691479. PMID 36214835. Consultado el 4 de noviembre de 2024 .
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ) - ^ Gardenghi S, Ramos P, Marongiu MF, Melchiori L, Breda L, Guy E, et al. (diciembre de 2010). "Hepcidina como herramienta terapéutica para limitar la sobrecarga de hierro y mejorar la anemia en ratones β-talasémicos". The Journal of Clinical Investigation . 120 (12): 4466–4477. doi :10.1172/JCI41717. PMC 2993583 . PMID 21099112.
- ^ Kroot JJ, Tjalsma H, Fleming RE, Swinkels DW (diciembre de 2011). "Hepcidina en trastornos del hierro en humanos: implicaciones diagnósticas". Química clínica . 57 (12): 1650–1669. doi : 10.1373/clinchem.2009.140053 . hdl : 2066/97956 . PMID 21989113.
- ^ ab Moura IC, Hermine O (octubre de 2015). "Eritroferrona: ¿el eslabón perdido en la β-talasemia?". Blood . 126 (17): 1974–1975. doi : 10.1182/blood-2015-09-665596 . PMID 26494918.
Lectura adicional
Enlaces externos
- hepcidina en los encabezados de materias médicas (MeSH) de la Biblioteca Nacional de Medicina de EE. UU.
- Intrinsic LifeSciences: centro de investigación de hepcidina, The BioIron Company
- Hepcidinanalysis.com - Servicio para la medición de hepcidina: investigación científica, pacientes y ensayos clínicos
- Página del banco de datos de proteínas
- tienda de péptidos
- PDBe-KB proporciona una descripción general de toda la información de estructura disponible en el PDB para la hepcidina humana