Fluorodesoxiglucosa (18F)
 | |
| Nombres | |
|---|---|
| Nombre IUPAC 2-desoxi-2-[ 18F ]fluoroglucosa | |
| Identificadores | |
Modelo 3D ( JSmol ) |
|
| Abreviaturas | [ 18 F]FDG |
| 2047723 | |
| EBICh | |
| Química biológica | |
| Araña química | |
| BARRIL | |
Identificador de centro de PubChem |
|
| UNIVERSIDAD | |
Panel de control CompTox ( EPA ) |
|
| |
| Propiedades | |
| C6H1118FO5 | |
| Masa molar | 181,1495 g mol −1 |
| Punto de fusión | 170 a 176 [1] °C (338 a 349 °F; 443 a 449 K) |
| Farmacología | |
| V09IX04 ( OMS ) | |
| |
| Intravenoso | |
| Farmacocinética : | |
| 6- Fosforilación | |
| 110 min (al 70%) 16 min (al 20%) | |
| 20% de radiactividad excretada por vía renal en dos horas | |
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |
[ 18 F]Fluorodesoxiglucosa ( INN ), o fluorodesoxiglucosa F 18 ( USAN y USP ), también llamada comúnmente fluorodesoxiglucosa y abreviada [ 18 F]FDG, 2-[ 18 F]FDG o FDG , es un radiofármaco , específicamente un radiotrazador , utilizado en la modalidad de imágenes médicas tomografía por emisión de positrones (PET). Químicamente, es 2-desoxi-2-[ 18 F]fluoro- D -glucosa , un análogo de la glucosa , con el radionúclido emisor de positrones flúor-18 sustituido por el grupo hidroxilo normal en la posición C-2 en la molécula de glucosa.
La captación de [ 18 F]FDG por los tejidos es un marcador de la captación tisular de glucosa , que a su vez está estrechamente relacionada con ciertos tipos de metabolismo tisular . Después de inyectar [ 18 F]FDG a un paciente, un escáner PET puede formar imágenes bidimensionales o tridimensionales de la distribución de [ 18 F]FDG dentro del cuerpo.
Desde su desarrollo en 1976, la [ 18 F]FDG ha tenido una profunda influencia en la investigación en neurociencias . [2] El descubrimiento posterior en 1980 de que la [ 18 F]FDG se acumula en los tumores sustenta la evolución de la PET como una herramienta clínica importante en el diagnóstico del cáncer. [3] La [ 18 F]FDG es ahora el radiotrazador estándar utilizado para la neuroimagen PET y el tratamiento de pacientes con cáncer. [4]
Las imágenes pueden ser evaluadas por un médico nuclear o un radiólogo para proporcionar diagnósticos de diversas afecciones médicas.
Historia
En 1968, el Dr. Josef Pacák, Zdeněk Točík y Miloslav Černý del Departamento de Química Orgánica de la Universidad Charles de Checoslovaquia fueron los primeros en describir la síntesis de FDG. [5] Más tarde, en la década de 1970, Tatsuo Ido y Al Wolf del Laboratorio Nacional de Brookhaven fueron los primeros en describir la síntesis de FDG marcada con flúor-18. [6] El compuesto fue administrado por primera vez a dos voluntarios humanos normales por Abass Alavi en agosto de 1976 en la Universidad de Pensilvania. Las imágenes cerebrales obtenidas con un escáner nuclear ordinario (no PET) demostraron la concentración de [ 18 F]FDG en ese órgano (ver la referencia histórica a continuación).
Consulte la figura comparativa a continuación para conocer más sobre la historia de la molécula de FDG.

Síntesis
[ 18 F]FDG se sintetizó por primera vez mediante fluoración electrofílica con [ 18 F]F 2 . [6] Posteriormente, se ideó una "síntesis nucleofílica" con el mismo radioisótopo.
Al igual que con todos los radioligandos marcados con 18 F radiactivos , el flúor-18 debe producirse inicialmente como anión fluoruro en un ciclotrón . La síntesis del trazador radiactivo [ 18 F]FDG completo comienza con la síntesis del radiotrazador fluoruro no unido, ya que el bombardeo del ciclotrón destruye las moléculas orgánicas del tipo que se usa habitualmente para los ligandos y, en particular, destruiría la glucosa.
La producción de flúor-18 mediante ciclotrones se puede lograr mediante el bombardeo de neón-20 con deuterones , pero generalmente se realiza mediante el bombardeo de protones de agua enriquecida con 18 O, lo que provoca una reacción (pn) (a veces llamada "reacción de knockout", un tipo común de reacción nuclear con alta probabilidad en la que un protón entrante "elimina" un neutrón) en el 18 O. Esto produce iones de [ 18 F]fluoruro ([ 18 F]F − ) disueltos "sin portador" en el agua. La vida media de 109,8 minutos del flúor-18 hace necesaria una química rápida y automatizada después de este punto.
Las sales de fluoruro anhidro, que son más fáciles de manipular que el gas flúor, se pueden producir en un ciclotrón. [7] Para lograr esta química, el [ 18 F]F − se separa del disolvente acuoso atrapándolo en una columna de intercambio iónico y se eluye con una solución de acetonitrilo de 2,2,2-criptando y carbonato de potasio. La evaporación del eluato da [(crypt-222)K] + [ 18 F]F − ( 2 ) .
El anión fluoruro es nucleófilo , pero se requieren condiciones anhidras para evitar reacciones competitivas que involucren al hidróxido, que también es un buen nucleófilo. El uso del criptando para secuestrar los iones potasio evita el apareamiento iónico entre los iones potasio y fluoruro libres, lo que hace que el anión fluoruro sea más reactivo.
El intermedio 2 se trata con el triflato de manosa protegido ( 1 ); el anión fluoruro desplaza al grupo saliente del triflato en una reacción S N 2 , dando lugar a la desoxiglucosa fluorada protegida ( 3 ). La hidrólisis básica elimina los grupos protectores de acetilo, dando lugar al producto deseado ( 4 ) después de eliminar el criptando mediante intercambio iónico: [8] [9]
Mecanismo de acción, productos metabólicos finales y tasa metabólica.
[ 18 F]FDG, como análogo de la glucosa, es absorbido por células que consumen mucha glucosa, como el cerebro, los adipocitos marrones , los riñones y las células cancerosas, donde la fosforilación impide que la glucosa vuelva a liberarse de la célula, una vez que ha sido absorbida. El grupo 2-hidroxilo (–OH) en la glucosa normal es necesario para una mayor glucólisis (metabolismo de la glucosa al dividirla), pero a [ 18 F]FDG le falta este 2-hidroxilo. Por lo tanto, al igual que su molécula hermana 2-desoxi- D -glucosa , la FDG no puede metabolizarse más en las células. El [ 18 F]FDG-6-fosfato formado cuando [ 18 F]FDG entra en la célula no puede salir de la célula antes de la desintegración radiactiva . Como resultado, la distribución de [ 18 F]FDG es un buen reflejo de la distribución de la absorción y fosforilación de glucosa por las células del cuerpo.
El flúor presente en [ 18 F]FDG se desintegra radiactivamente mediante desintegración beta a 18 O − . Después de captar un protón H + de un ion hidronio en su entorno acuoso, la molécula se convierte en glucosa-6-fosfato marcada con "oxígeno pesado" no radiactivo e inocuo en el hidroxilo de la posición C-2. La nueva presencia de un 2-hidroxilo permite ahora que se metabolice normalmente de la misma manera que la glucosa ordinaria, produciendo productos finales no radiactivos.
Aunque en teoría toda la [ 18 F]FDG se metaboliza como se ha indicado anteriormente con una semivida de eliminación de la radiactividad de 110 minutos (la misma que la del flúor-18), los estudios clínicos han demostrado que la radiactividad de la [ 18 F]FDG se reparte en dos fracciones principales. Alrededor del 75% de la actividad del flúor-18 permanece en los tejidos y se elimina con una semivida de 110 minutos, presumiblemente [ cita requerida ] al desintegrarse en el lugar a O-18 para formar [ 18 O]O-glucosa-6-fosfato, que no es radiactiva (esta molécula puede metabolizarse pronto a dióxido de carbono y agua, después de que la transmutación nuclear del flúor a oxígeno cese para impedir el metabolismo). Otra fracción de [ 18 F]FDG, que representa aproximadamente el 20% de la actividad total del flúor-18 de una inyección, se excreta por vía renal dos horas después de una dosis de [ 18 F]FDG, con una semivida rápida de aproximadamente 16 minutos (esta porción hace que el sistema colector renal y la vejiga sean prominentes en una tomografía por emisión de positrones normal). Esta semivida biológica corta indica que esta porción del 20% de la actividad total del trazador del flúor-18 se elimina por vía renal mucho más rápidamente de lo que el propio isótopo puede desintegrarse. A diferencia de la glucosa normal, el FDG no se reabsorbe completamente en el riñón. [10] Debido a esta orina de 18 F que se excreta rápidamente, la orina de un paciente sometido a una tomografía por emisión de positrones puede ser especialmente radiactiva durante varias horas después de la administración del isótopo. [11]
Toda la radiactividad de [ 18 F]FDG, tanto el 20% que se excreta rápidamente en las primeras horas de la orina que se produce después del examen, como el 80% que permanece en el paciente, se desintegra con una vida media de 110 minutos (poco menos de dos horas). Por lo tanto, dentro de las 24 horas (13 vidas medias después de la inyección), la radiactividad en el paciente y en cualquier orina inicialmente eliminada que pueda haber contaminado la ropa de cama u objetos después del examen PET se habrá desintegrado a 2 −13 = 1 ⁄ 8192 de la radiactividad inicial de la dosis. En la práctica, a los pacientes a los que se les ha inyectado [ 18 F]FDG se les dice que eviten la proximidad de personas especialmente sensibles a la radiación, como bebés, niños y mujeres embarazadas, durante al menos 12 horas (7 vidas medias, o desintegración a 1 ⁄ 128 de la dosis radiactiva inicial).
Producción
Alliance Medical y Siemens Healthcare son [ ¿cuándo? ] los únicos productores en el Reino Unido. [ cita requerida ] Una dosis de FDG en Inglaterra cuesta [ ¿cuándo? ] alrededor de £130. En Irlanda del Norte, donde hay un único proveedor, las dosis cuestan hasta £450. [12] IBA Molecular North America y Zevacor Molecular, ambas propiedad de Illinois Health and Science (IBAM fue adquirida el 1 de agosto de 2015), PETNET Solutions de Siemens (una subsidiaria de Siemens Healthcare) y Cardinal Health [13] son productores en los EE. UU. [14] [15] [16] [17]
Distribución
El compuesto marcado [ 18 F]FDG tiene una vida útil relativamente corta, dominada por la desintegración física del flúor-18, con una vida media de 109,8 minutos, o algo menos de dos horas. Aun así, esta vida media es lo suficientemente larga como para permitir el envío del compuesto a instalaciones de escaneo PET remotas, a diferencia de otros radioisótopos médicos como el carbono-11. Debido a las regulaciones de transporte para compuestos radiactivos, la entrega se realiza normalmente mediante transporte por carretera especialmente autorizado, pero los medios de transporte también pueden incluir servicios de jets comerciales pequeños dedicados. El transporte por aire permite expandir el área de distribución alrededor de un sitio de producción de [ 18 F]FDG para entregar el compuesto a centros de escaneo PET incluso a cientos de millas de distancia.
Recientemente, los ciclotrones in situ con protección integral y estaciones químicas portátiles para fabricar [ 18 F]FDG han acompañado a los escáneres PET a hospitales remotos. Esta tecnología es prometedora en el futuro, ya que reemplazará parte de la lucha por transportar [ 18 F]FDG desde el lugar de fabricación hasta el lugar de uso. [18]
Aplicaciones
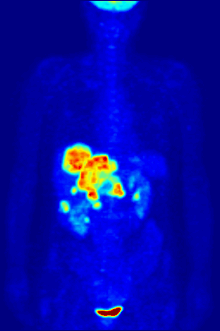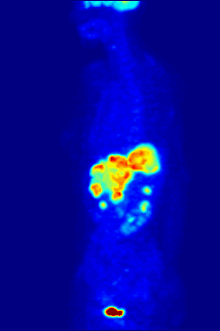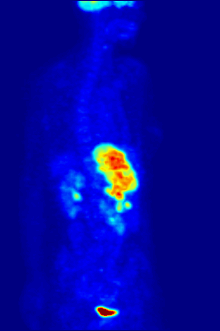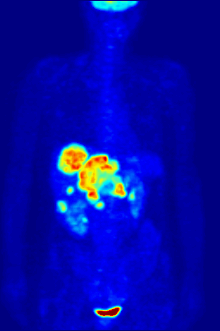
En la obtención de imágenes PET, la [ 18 F]FDG se utiliza principalmente para obtener imágenes de tumores en oncología , donde se realiza una exploración PET estática con [ 18 F]FDG y se analiza la captación de [ 18 F]FDG del tumor en términos de valor de captación estandarizado (SUV). La PET/TC con FDG se puede utilizar para evaluar el metabolismo de la glucosa en el corazón y el cerebro . La [ 18 F]FDG es captada por las células y posteriormente fosforilada por la hexoquinasa (cuya forma mitocondrial está muy elevada en tumores malignos de rápido crecimiento). [19] La [ 18 F]FDG fosforilada no se puede metabolizar más y, por lo tanto, es retenida por tejidos con alta actividad metabólica, como la mayoría de los tipos de tumores malignos. Como resultado, la FDG-PET se puede utilizar para el diagnóstico, la estadificación y el seguimiento del tratamiento de los cánceres, [20] en particular en la enfermedad de Hodgkin , el linfoma no Hodgkin , el cáncer colorrectal , el cáncer de mama , el melanoma y el cáncer de pulmón . También se ha aprobado su uso en el diagnóstico de la enfermedad de Alzheimer .
En aplicaciones de escaneo corporal para buscar tumores o enfermedades metastásicas, una dosis de [ 18 F]-FDG en solución (típicamente de 5 a 10 milicurios o 200 a 400 MBq ) típicamente se inyecta rápidamente en un goteo salino que corre por una vena, en un paciente que ha estado en ayunas durante al menos seis horas, y que tiene un nivel de azúcar en sangre adecuadamente bajo. (Esto es un problema para algunos diabéticos; por lo general, los centros de escaneo PET no administrarán el isótopo a pacientes con niveles de glucosa en sangre superiores a aproximadamente 180 mg/dL = 10 mmol/L, y dichos pacientes deben ser reprogramados). Luego, el paciente debe esperar aproximadamente una hora para que el azúcar se distribuya y sea absorbido por los órganos que usan glucosa, un tiempo durante el cual la actividad física debe mantenerse al mínimo, para minimizar la absorción del azúcar radiactivo en los músculos (esto causa artefactos no deseados en el escaneo, interfiriendo con la lectura, especialmente cuando los órganos de interés están dentro del cuerpo en lugar de dentro del cráneo). Luego, se coloca al paciente en el escáner PET para una serie de uno o más exámenes que pueden durar desde 20 minutos hasta una hora (a menudo, solo se puede obtener una imagen de aproximadamente un cuarto de la longitud del cuerpo a la vez).
Véase también
Referencias
- ^ Pacák J, Točík Z, Černý M (1969). "Síntesis de 2-desoxi-2-fluoro-D-glucosa". Revista de la Sociedad Química D: Comunicaciones Químicas . 1969 (2): 77. doi :10.1039/C29690000077.
- ^ Newberg A, Alavi A, Reivich M (enero de 2002). "Determinación de la función cerebral regional con imágenes FDG-PET en trastornos neuropsiquiátricos". Seminarios en Medicina Nuclear . 32 (1): 13–34. doi :10.1053/snuc.2002.29276. PMID 11839066.
- ^ Som P, Atkins HL, Bandoypadhyay D, Fowler JS, MacGregor RR, Matsui K, et al. (julio de 1980). "Un análogo de glucosa fluorada, 2-fluoro-2-desoxi-D-glucosa (F-18): trazador no tóxico para la detección rápida de tumores". Revista de Medicina Nuclear . 21 (7): 670–5. PMID 7391842.
- ^ Kelloff GJ, Hoffman JM, Johnson B, Scher HI, Siegel BA, Cheng EY, et al. (abril de 2005). "Progreso y promesa de la obtención de imágenes FDG-PET para el tratamiento de pacientes con cáncer y el desarrollo de fármacos oncológicos". Clinical Cancer Research . 11 (8): 2785–808. doi : 10.1158/1078-0432.CCR-04-2626 . PMID 15837727.
- ^ Pacák J, Točík Z, Černý M (1969). "Síntesis de 2-desoxi-2-fluoro-D-glucosa". Revista de la Sociedad Química D: Comunicaciones Químicas (2): 77. doi :10.1039/C29690000077.
- ^ ab Ido T, Wan CN, Casella V, Fowler JS, Wolf AP, Reivich M, Kuhl DE (1978). "Análogos de 2-desoxi-D-glucosa marcados: 2 -desoxi-2-fluoro-D-glucosa, 2-desoxi-2-fluoro-D-manosa y 14 C-2-desoxi-2-fluoro-D-glucosa marcados con 18 F". J Labeled Compounds Radiopharm . 24 (2): 174–183. doi :10.1002/jlcr.2580140204.
- ^ Janet Miller, Desarrollo de radiofármacos en el Hospital General de Massachusetts (PDF) , archivado desde el original (PDF) el 11 de febrero de 2015 , consultado el 12 de junio de 2013
- ^ Fowler JS, Ido T (enero de 2002). "Enfoque inicial y posterior para la síntesis de 18FDG". Seminarios en Medicina Nuclear . 32 (1): 6–12. doi :10.1053/snuc.2002.29270. PMID 11839070.
- ^ Yu S (octubre de 2006). "Revisión de la síntesis y el control de calidad de F-FDG". Revista de imágenes e intervención biomédicas . 2 (4): e57. doi :10.2349/biij.2.4.e57. PMC 3097819 . PMID 21614337.
- ^ Moran, JK, Lee, HB y Blaufox, MD (1999). Optimización de la excreción urinaria de FDG durante la obtención de imágenes PET. The Journal of Nuclear Medicine, 40(8), 1352.
- ^ "Información sobre el medicamento fludesoxiglucosa" . Consultado el 19 de abril de 2024 .
- ^ "Temores de 'monopolio' por un contrato de escaneo de 350 millones de libras esterlinas". Local Government Chronicle. 12 de febrero de 2015. Consultado el 22 de febrero de 2015 .
- ^ "¿Cuál es el impacto de la Parte 212 del Título 21 del CFR?". Cardinal Health . 2021.
- ^ "Fludesoxiglucosa F 18 - inyección de fludesoxiglucosa f-18". DailyMed . 8 de mayo de 2018 . Consultado el 29 de enero de 2020 .
- ^ "Fluorodesoxiglucosa (F-18 FDG)". Archivado desde el original el 25 de julio de 2015 . Consultado el 24 de julio de 2015 .
- ^ "Directorio del Código Nacional de Medicamentos", Administración de Alimentos y Medicamentos de los Estados Unidos , consultado el 5 de febrero de 2016. [ enlace roto ]
- ^ Matthews M (19 de septiembre de 2013). "Soluciones PETNET de Siemens para ayudar a la red de oncología de EE. UU." Axis Imaging News . Consultado el 5 de febrero de 2016 .
- ^ Lisa Fratt (2003). "Radiation Testing and PET Minding the Radiopharmaceutical Store". Imágenes médicas. Archivado desde el original el 20 de noviembre de 2008.
- ^ Bustamante E, Pedersen PL (septiembre de 1977). "Glucólisis aeróbica elevada de células de hepatoma de rata en cultivo: función de la hexoquinasa mitocondrial". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 74 (9): 3735–9. Bibcode :1977PNAS...74.3735B. doi : 10.1073/pnas.74.9.3735 . PMC 431708 . PMID 198801.
- ^ Hofman MS, Hicks RJ (octubre de 2016). "Cómo leemos la PET/CT oncológica con FDG". Cancer Imaging . 16 (1): 35. doi : 10.1186/s40644-016-0091-3 . PMC 5067887 . PMID 27756360.




