Pneumonia por micoplasma
The article's lead section may need to be rewritten. The reason given is: too short. (October 2024) |
| Pneumonia por micoplasma | |
|---|---|
| Clasificación científica | |
| Dominio: | Bacteria |
| Filo: | Micoplasma matota |
| Clase: | Mollicutes |
| Orden: | Micoplasmatales |
| Familia: | Micoplasmatáceas |
| Género: | Micoplasma |
| Especies: | M. pneumoniae |
| Nombre binomial | |
| Pneumonia por micoplasma Somerson y otros, 1963 | |
Mycoplasma pneumoniae es una especie de bacteria de células muy pequeñas que carece de pared celular , en la clase Mollicutes . M. pneumoniae es un patógeno humano que causa la enfermedad Mycoplasma pneumoniae , una forma de neumonía bacteriana atípica relacionada con la enfermedad por crioaglutininas . M. pneumoniae se caracteriza por la ausencia de una pared celular de peptidoglicano y la resistencia resultante a muchos agentes antibacterianos activos en la pared celular .
La persistencia de las infecciones por M. pneumoniae incluso después del tratamiento está asociada con su capacidad para imitar la composición de la superficie de la célula huésped .
Descubrimiento e historia
En 1898, Nocard y Roux aislaron un agente que se suponía era la causa de la neumonía del ganado y lo llamaron microbe de la peripneumonie [1] [2] [3] [4] [5] [6] Los microorganismos de otras fuentes, que tenían propiedades similares al organismo de la pleuroneumonía (PPO) del ganado, pronto llegaron a conocerse como organismos similares a la pleuroneumonía (PPLO), pero su verdadera naturaleza permaneció desconocida. [1] [2] [3] [4] Más tarde se demostró que muchos PPLO eran la causa de neumonías y artritis en varios animales inferiores. [1] [7] [8] [9]
En 1944, Monroe Eaton utilizó huevos embrionados de gallina para cultivar un agente que se pensaba que era la causa de la neumonía atípica primaria humana (PAP), comúnmente conocida como "neumonía atípica errante". [10] Este organismo desconocido se conoció como el "agente Eaton". [11] En ese momento, el uso de huevos embrionados por parte de Eaton, que luego se utilizaron para cultivar virus, respaldó la idea de que el agente Eaton era un virus. Sin embargo, se sabía que la PAP era susceptible de tratamiento con antibióticos de amplio espectro , lo que hacía sospechar una etiología viral. [1] [2] [7] [12] [13]
Robert Chanock , un investigador del NIH que estaba estudiando el agente Eaton como virus, visitó el Instituto Wistar en Filadelfia en 1961 para obtener un cultivo celular de una cepa de células humanas normales desarrollada por Leonard Hayflick . Se sabía que esta cepa celular era exquisitamente sensible para aislar y cultivar virus humanos. Chanock le contó a Hayflick sobre su investigación sobre el agente Eaton y su creencia de que su naturaleza viral era cuestionable. Aunque Hayflick sabía poco sobre la investigación actual sobre este agente, su tesis doctoral se había realizado sobre enfermedades animales causadas por PPLO. Hayflick sabía que muchos animales inferiores sufrían neumonías causadas por PPLO (que más tarde se denominarían micoplasmas ). Hayflick razonó que el agente Eaton podría ser un micoplasma y no un virus. Chanock nunca había oído hablar de los micoplasmas y, a pedido de Hayflick, le envió yema de huevo que contenía el agente Eaton. [1] [4] [14] [15] [16] [17]
Utilizando una nueva formulación de agar y medio fluido que había ideado, [14] Hayflick aisló un micoplasma único de la yema de huevo. Chanock y Hayflick pronto demostraron que éste era el agente causante de la PAP. [14] [18] [19] [20] Cuando este descubrimiento fue conocido por Emmy Klieneberger-Nobel del Lister Institute en Londres, la principal autoridad mundial en estos organismos, sugirió que el organismo se llamara Mycoplasma hayflickiae . [21] Hayflick se opuso a favor de Mycoplasma pneumoniae . [22] [23]
Este microorganismo de vida libre más pequeño fue el primero en ser aislado y se demostró que era la causa de una enfermedad humana. Por su descubrimiento, Hayflick recibió el Premio Presidencial de la Organización Internacional de Micoplasmología. El microscopio invertido con el que Hayflick descubrió el Mycoplasma pneumoniae se conserva en el Instituto Smithsoniano . [20]
Taxonomía y clasificación
El término micoplasma ( mykes significa hongo y plasma , que significa formado) se deriva del crecimiento similar al de los hongos de algunas especies de micoplasma. [6] Los micoplasmas se clasificaron como Mollicutes (“mollis”, que significa suave y “cutis”, que significa piel) en 1960 debido a su pequeño tamaño y genoma , falta de pared celular , bajo contenido de G+C y necesidades nutricionales inusuales . [6] [24]
Los micoplasmas, que se encuentran entre los organismos autorreplicantes más pequeños, son especies parásitas que carecen de pared celular y espacio periplásmico , tienen genomas reducidos y actividad metabólica limitada. [6] [25] [26] M. pneumoniae también ha sido designada como una especie que no fermenta arginina . [25] Los micoplasmas se clasifican además por la composición de la secuencia del ARNr 16s . Todos los micoplasmas del grupo pneumoniae poseen variaciones similares del ARNr 16s exclusivas del grupo, de las cuales M. pneumoniae tiene una variación del 6,3% en las regiones conservadas , que sugieren micoplasmas formados por evolución degenerativa del grupo eubacteriano grampositivo que incluye bacilos , estreptococos y lactobacilos . [6] [24] [25] M. pneumoniae es un miembro de la familia Mycoplasmataceae y del orden Mycoplasmatales . [6]
Biología celular
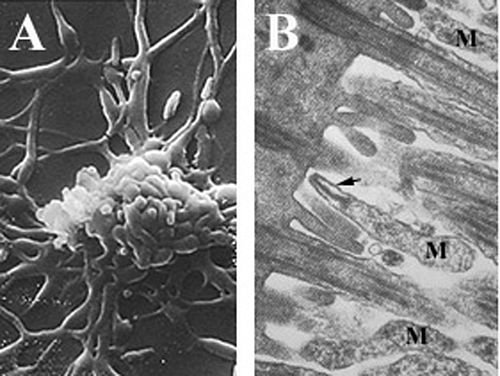
Las células de Mycoplasma pneumoniae tienen una forma alargada de aproximadamente 0,1–0,2 μm (100–200 nm ) de ancho y 1–2 μm (1000-2000 nm) de largo. El tamaño extremadamente pequeño de las células significa que no se pueden examinar con microscopio óptico ; se requiere un estereomicroscopio para ver la morfología de las colonias de M. pneumoniae , que suelen tener menos de 100 μm de largo. [6] La incapacidad de sintetizar una pared celular de peptidoglicano se debe a la ausencia de genes que codifiquen su formación y da como resultado una mayor importancia en el mantenimiento de la estabilidad osmótica para evitar la desecación . [6] La falta de una pared celular también requiere un mayor soporte de la membrana celular (reforzada con esteroles), que incluye un citoesqueleto rígido compuesto por una intrincada red de proteínas y, potencialmente, una cápsula extracelular para facilitar la adherencia a la célula huésped . [6] M. pneumoniae son las únicas células bacterianas que poseen colesterol en su membrana celular (obtenido del huésped) y poseen más genes que codifican variaciones de lipoproteínas de membrana que otros micoplasmas, [25] lo que se cree que está asociado con su estilo de vida parasitario. Las células de M. pneumoniae también poseen un orgánulo de unión , que se utiliza en la motilidad de deslizamiento del organismo mediante un mecanismo desconocido. [6]
Genómica y reconstrucción metabólica
La secuenciación del genoma de M. pneumoniae en 1996 reveló que tiene un tamaño de 816.394 pb. [24] El genoma contiene 687 genes que codifican proteínas, de las cuales aproximadamente el 56,6% codifican enzimas metabólicas esenciales ; en particular las implicadas en la glucólisis y la fermentación de ácidos orgánicos . [6] [24] [25] [27] En consecuencia, M. pneumoniae es muy susceptible a la pérdida de función enzimática por mutaciones genéticas , ya que los únicos sistemas de amortiguación contra la pérdida funcional por mutaciones puntuales son el mantenimiento de la vía de la pentosa fosfato y el metabolismo de los nucleótidos . [27] Se sugiere que la pérdida de función en otras vías se compensa con el metabolismo de la célula huésped. [27] Además de la potencial pérdida de la función de la vía, el genoma reducido de M. pneumoniae carece por completo de una serie de vías, incluyendo el ciclo del TCA , la cadena de transporte de electrones respiratorios y las vías de biosíntesis de aminoácidos , ácidos grasos , colesterol y purinas y pirimidinas . [6] [25] [27] Estas limitaciones hacen que M. pneumoniae dependa de sistemas de importación para adquirir bloques de construcción esenciales de su huésped o del medio ambiente que no se pueden obtener a través de vías glucolíticas . [25] [27] Junto con la producción de proteínas y ARN costosa en energía , una gran parte del metabolismo energético se ejerce para mantener gradientes de protones (hasta el 80%) debido a la alta relación de área de superficie a volumen de las células de M. pneumoniae . Solo el 12 – 29% del metabolismo energético se dirige al crecimiento celular , que es inusualmente bajo para las células bacterianas, y se cree que es una adaptación de su estilo de vida parasitario. [27]
A diferencia de otras bacterias, M. pneumoniae utiliza el codón UGA para codificar el triptófano en lugar de usarlo como codón de terminación. [6] [24]
Metabolómica comparativa
Mycoplasma pneumoniae tiene un metaboloma reducido en comparación con otras especies bacterianas . [28] Esto significa que el patógeno tiene menos reacciones metabólicas en comparación con otras especies bacterianas como B. subtilis y Escherichia coli . [28] [29]

Como Mycoplasma pneumoniae tiene un genoma reducido, tiene un menor número de rutas generales y enzimas metabólicas, lo que contribuye a su metaboloma más lineal. [28] Un metaboloma lineal hace que Mycoplasma pneumoniae sea menos adaptable a factores externos. [28] Además, como Mycoplasma pneumoniae tiene un genoma reducido, la mayoría de sus enzimas metabólicas son esenciales. [28] Esto contrasta con otro organismo modelo, Escherichia coli , en el que solo el 15% de sus enzimas metabólicas son esenciales. [28] En resumen, la topología lineal del metaboloma de Mycoplasma pneumoniae conduce a una eficiencia reducida en sus reacciones metabólicas, pero aún mantiene niveles similares de concentraciones de metabolitos, energética celular, adaptabilidad y expresión genética global. [28]
| Especies | M. pneumoniae | L. lactis | B. subtilis | E. coli |
|---|---|---|---|---|
| Promedio de número de caminos | 8.17 | 5.37 | 7.54 | 6.12 |
La tabla anterior muestra la longitud media del recorrido de los metabolomas de M. pneumoniae , E. coli , L. lactis y B. subtilis . [28] Este número describe, esencialmente, el número medio de reacciones que ocurren en el metaboloma. Mycoplasma pneumoniae , en promedio, tiene un alto número de reacciones por recorrido dentro de su metaboloma en comparación con otras especies bacterianas modelo. [28]
Un efecto del metaboloma único de Mycoplasma pneumoniae es su mayor tiempo de duplicación. [28] El patógeno tarda mucho más tiempo en duplicarse en promedio en comparación con otras bacterias modelo. [28] Esto puede deberse al hecho de que el metaboloma de Mycoplasma pneumoniae es menos eficiente que el de Escherichia coli . [28]
El metaboloma de Mycoplasma pneumoniae también puede ser informativo para analizar su patogénesis. [31] Un estudio exhaustivo de la red metabólica de este organismo ha llevado a la identificación de biomarcadores que potencialmente pueden revelar la presencia de las extensas complicaciones que puede causar la bacteria. [31] La metabolómica se utiliza cada vez más como una herramienta útil para la verificación de biomarcadores de patógenos infecciosos. [31]
Patogenicidad

Mycoplasma pneumoniae parasita el epitelio del tracto respiratorio de los humanos. [6] Se cree que la adherencia a las células epiteliales respiratorias ocurre a través del orgánulo de unión, seguida de la evasión del sistema inmunológico del huésped mediante la localización intracelular y el ajuste de la composición de la membrana celular para imitar la membrana de la célula huésped. [ cita requerida ] Mycoplasma pneumoniae crece exclusivamente parasitando mamíferos. La reproducción , por lo tanto, depende de la unión a una célula huésped. Según Waites y Talkington, la reproducción especializada ocurre por " fisión binaria , vinculada temporalmente con la duplicación de su orgánulo de unión, que migra al polo opuesto de la célula durante la replicación y antes de la separación del nucleoide ". [6] Las mutaciones que afectan la formación del orgánulo de unión no solo obstaculizan la motilidad y la división celular , sino que también reducen la capacidad de las células de M. pneumoniae para adherirse a la célula huésped. [25]
Citoadherencia
La adherencia de M. pneumoniae a una célula huésped (normalmente una célula del tracto respiratorio , pero ocasionalmente un eritrocito o una célula del revestimiento urogenital ) es el evento iniciador de la enfermedad neumónica y los síntomas relacionados. [6] El orgánulo de unión especializado es una extensión celular polar , densa en electrones y alargada que facilita la motilidad y la adherencia a las células huésped. [6] [25] Está compuesto por un filamento central rodeado por un espacio intracitoplasmático , junto con una serie de adhesinas y proteínas estructurales y accesorias localizadas en la punta del orgánulo. [6] [25] Se sabe que una variedad de proteínas contribuyen a la formación y funcionalidad del orgánulo de unión, incluidas las proteínas accesorias HMW1–HMW5, P30, P56 y P90 que confieren estructura y soporte de adhesina, y P1, P30 y P116 que están involucradas directamente en la unión. [6] [32] [33] Esta red de proteínas participa no solo en el inicio de la formación y adhesión de orgánulos de unión, sino también en la motilidad . [33] La adhesina P1 (proteína sensible a la tripsina) es una proteína de 120 kDa altamente agrupada en la superficie de la punta del orgánulo de unión en micoplasmas virulentos . [6] [33] [34] Tanto la presencia de P1 como su concentración en la superficie celular son necesarias para la unión de M. pneumoniae a la célula huésped. Se ha demostrado que las células de M. pneumoniae tratadas con anticuerpos monoclonales específicos para el extremo C inmunogénico de la adhesina P1 inhiben su capacidad de unirse a la superficie de la célula huésped en aproximadamente un 75%, lo que sugiere que P1 es un componente principal en la adherencia. [6] [32] [33] Estos anticuerpos también disminuyeron la capacidad de la célula para deslizarse rápidamente, lo que puede contribuir a una menor adherencia al huésped al obstaculizar su capacidad para localizar una célula huésped. [32] Además, las mutaciones en P1 o la degradación por tratamiento con tripsina producen células de M. pneumoniae avirulentas . [6] La pérdida de proteínas en el citoesqueleto involucradas en la localización de P1 en la estructura de la punta, como HMW1–HMW3, también causa avirulencia.debido a la falta de agrupamiento de adhesinas. [33] [34] Otra proteína que se considera que desempeña un papel importante en la adherencia es P30, ya que las células de M. pneumoniae con mutaciones en esta proteína o que han tenido anticuerpos generados contra P30 son incapaces de adherirse a las células huésped. [6] [25] P30 no está involucrado en la localización de P1 en la estructura de la punta ya que P1 se trafica al orgánulo de unión en mutantes P30, sino que puede funcionar como una adhesina accesoria de unión al receptor . [25] [34] Los mutantes P30 también muestran características morfológicas distintivas , como lóbulos múltiples y una forma redondeada en lugar de alargada, lo que sugiere que P30 puede interactuar con el citoesqueleto durante la formación del orgánulo de unión. [25] Varios componentes de la superficie celular eucariota se han implicado en la adherencia de las células de M. pneumoniae al epitelio del tracto respiratorio . Entre ellos se encuentran los sialoglicoconjugados , los glicolípidos sulfatados , las glicoproteínas , la fibronectina y los receptores de ácido neuramínico . [6] [32] [35] Las lectinas en la superficie de las células bacterianas son capaces de unir cadenas de oligosacáridos en los glicolípidos y las glicoproteínas para facilitar la unión, además de las proteínas TU y la piruvato deshidrogenasa E1 β , que se unen a la fibronectina. [6] [32]

Localización intracelular
Mycoplasma pneumoniae se fusiona con las células huésped y sobrevive intracelularmente . Por lo tanto, puede evadir la detección del sistema inmunológico del huésped , resistir el tratamiento con antibióticos y atravesar las barreras mucosas . [6] [26] Además de la proximidad física cercana de M. pneumoniae y las células huésped, la falta de pared celular y componentes peculiares de la membrana celular , como el colesterol , pueden facilitar la fusión. La localización interna puede producir infecciones crónicas o latentes, ya que M. pneumoniae es capaz de persistir , sintetizar ADN y replicarse dentro de la célula huésped incluso después del tratamiento con antibióticos. [26] Se desconoce el mecanismo exacto de localización intracelular, sin embargo, el potencial de secuestro citoplasmático dentro del huésped explica la dificultad de eliminar por completo las infecciones por M. pneumoniae en individuos afectados. [6]
Respuesta inmune
Además de evadir el sistema inmunitario del huésped mediante la localización intracelular, M. pneumoniae puede cambiar la composición de su membrana celular para imitar la membrana de la célula huésped y evitar la detección por parte de las células del sistema inmunitario . Las células de M. pneumoniae poseen una serie de antígenos proteicos y glicolípidos que provocan respuestas inmunitarias , pero la variación de estos antígenos de superficie permitiría que la infección persistiera el tiempo suficiente para que las células de M. pneumoniae se fusionaran con las células huésped y escaparan a la detección. La similitud entre las composiciones de M. pneumoniae y las membranas celulares humanas también puede dar lugar a respuestas autoinmunitarias en varios órganos y tejidos. [6]
Citotoxicidad y efectos sobre el organismo
El principal efecto citotóxico de M. pneumoniae es la alteración local de la estructura tisular y celular a lo largo del epitelio del tracto respiratorio debido a su unión a las células huésped. La unión de la bacteria a las células huésped puede provocar la pérdida de cilios , una reducción del metabolismo , la biosíntesis y la importación de macromoléculas y, finalmente, las células infectadas pueden desprenderse del revestimiento epitelial . [6] El daño local también puede ser el resultado de la adquisición de lactoferrina y la posterior formación de radicales hidroxilo , aniones superóxido y peróxido . [6]
En segundo lugar, M. pneumoniae produce un factor de virulencia único conocido como toxina del síndrome de dificultad respiratoria adquirida en la comunidad (CARDS). [36] La toxina CARDS probablemente ayuda en la colonización y las vías patogénicas de M. pneumoniae, lo que conduce a inflamación y disfunción de las vías respiratorias.
El tercer factor de virulencia es la formación de peróxido de hidrógeno en las infecciones por M. pneumoniae . [6] Cuando M. pneumoniae se une a los eritrocitos , el peróxido de hidrógeno se difunde desde la bacteria a la célula huésped sin que sea desintoxicado por la catalasa o la peroxidasa , dañando así la célula huésped al reducir el glutatión , dañar las membranas lipídicas y causar la desnaturalización de las proteínas , es decir, la oxidación del hemo y la hemólisis . [6] [35]
Más recientemente se ha demostrado que el peróxido de hidrógeno desempeña un papel menor o nulo en la hemólisis, pero que el sulfuro de hidrógeno es el verdadero culpable. [37]
Los efectos citotóxicos de las infecciones por M. pneumoniae se traducen en síntomas comunes como tos e irritación pulmonar que pueden persistir durante meses después de que la infección haya remitido. La inflamación local y la hiperreactividad por la producción de citocinas inducida por la infección se han asociado con enfermedades crónicas como el asma bronquial y también se han vinculado con la progresión de los síntomas en personas con fibrosis quística y EPOC . [6]
Actividad antimicrobiana
Las infecciones pueden tratarse con antibióticos orales de la familia de los macrólidos , que actúan inhibiendo la biosíntesis de proteínas de Mycoplasma . Históricamente, la eritromicina es el fármaco más antiguo. Como primera opción, se utilizan azitromicina o claritromicina , ya que tienen una farmacocinética más conveniente que la eritromicina: solo necesitan tomarse una o dos veces y no cuatro veces al día y tienen menos efectos secundarios. Alternativamente, se pueden utilizar tetraciclinas (p. ej., doxiciclina) y flúor respiratorio (p. ej., levofloxacino o moxifloxacino ); tienen un perfil de efectos secundarios indeseables en los niños. Los betalactámicos como la penicilina son completamente ineficaces, porque se dirigen a la síntesis de la pared celular.
Resistencia
La resistencia a los macrólidos se ha descrito ya en 1967; sin embargo, la resistencia ha ido aumentando con el aumento de su uso desde el año 2000. La resistencia en la década de 2020 ha sido más alta en Asia, hasta el 100%, mientras que las tasas en los Estados Unidos han variado del 3,5% al 13%. Una mutación de una sola base en la región V del ARNr 23S, como A2063/2064G [38] es responsable de más del 90% de las infecciones resistentes a los macrólidos. [39]
Dado que no se realizan cultivos de rutina ni pruebas de susceptibilidad , ya que M. pneumoniae es difícil de cultivar, los médicos seleccionarán un antibiótico basándose en una estimación de la resistencia local, la respuesta al tratamiento (es decir, cambiar si el tratamiento es refractario) y otros factores. [38]
Véase también
| Videos externos | |
|---|---|
 Robert Chanock y el agente Eaton, entrevista a Leonard Hayflick, 61.ª de 187 partes, Web of Stories . [19] Robert Chanock y el agente Eaton, entrevista a Leonard Hayflick, 61.ª de 187 partes, Web of Stories . [19] |
Referencias
- ^ abcde Hayflick L, Chanock RM (junio de 1965). "Especies de Mycoplasma del hombre". Bacteriological Reviews . 29 (2): 185–221. doi :10.1128/mmbr.29.2.185-221.1965. PMC 441270 . PMID 14304038.
- ^ abc Hayflick, L. (mayo de 1965). "La especie micoplasmática (PPLO) del hombre". Transacciones de la Academia de Ciencias de Nueva York . Serie II. 27 (7): 817–827. doi :10.1111/j.2164-0947.1965.tb02241.x. PMID 14333465.
- ^ ab Hayflick, L. (1967). Hayflick, L. (ed.). Biología de los micoplasmas . Segunda Conferencia sobre la Biología de los Micoplasmas. Vol. 143. Anales de la Academia de Ciencias de Nueva York. págs. 5-6.
- ^ abc Hayflick, L., ed. (1969). Los Mycoplasmatales y la fase L de las bacterias. Nueva York, NY: Appleton-Century-Crofts. ISBN 9780608123905.
- ^ Marmion, BP (1990). "Agente Eaton: ciencia y aceptación científica: un comentario histórico". Reseñas de enfermedades infecciosas . 12 (2): 338–353. doi :10.1093/clinids/12.2.338. PMID 2109871.
- ^ abcdefghijklmnopqrstu vwxyz aa ab ac ad ae af ag Waites KB, Talkington DF (octubre de 2004). "Mycoplasma pneumoniae y su papel como patógeno humano". Clinical Microbiology Reviews . 17 (4): 697–728. doi :10.1128/CMR.17.4.697-728.2004. PMC 523564 . PMID 15489344.
- ^ ab Razin S, Hayflick L (marzo de 2010). "Aspectos destacados de la investigación sobre micoplasma: una perspectiva histórica". Biologicals . 38 (2): 183–190. doi :10.1016/j.biologicals.2009.11.008. PMID 20149687.
- ^ Hayflick, L. (1956). El crecimiento de organismos similares a la pleuroneumonía humana y aviar en cultivos de tejidos e in ovo, y la caracterización de un agente infeccioso que causa tendovaginitis con artritis en pollos (tesis doctoral). Universidad de Pensilvania.
- ^ Hayflick L, Stinebring WR (enero de 1960). "Crecimiento intracelular de organismos similares a la pleuroneumonía (PPLO) en cultivo de tejidos e in ovo". Anales de la Academia de Ciencias de Nueva York . 79 (10): 433–449. Bibcode :1960NYASA..79..433H. doi :10.1111/j.1749-6632.1960.tb42709.x. PMID 14400338. S2CID 21089254.
- ^ Eaton MD, Meiklejohn G, van Herick W (junio de 1944). "Estudios sobre la etiología de la neumonía atípica primaria: un agente filtrable transmisible a ratas algodoneras, hámsteres y embriones de pollo". The Journal of Experimental Medicine . 79 (6): 649–668. doi :10.1084/jem.79.6.649. PMC 2135382 . PMID 19871393.
- ^ Dajani AS, Clyde WA, Denny FW (junio de 1965). "Infección experimental con Mycoplasma pneumoniae (agente de Eaton)". Revista de Medicina Experimental . 121 (6): 1071–1086. doi :10.1084/jem.121.6.1071. PMC 2138014 . PMID 14319403.
- ^ Hayflick, L. (1969). "Biología fundamental de la clase Mollicutes, orden Mycoplasmatales". En Hayflick, L. (ed.). Los Mycoplasmatales y la fase L de las bacterias. Nueva York, NY: Appleton-Century-Crofts. ISBN 9780608123905.
- ^ Hayflick, L. (1971). "Biología de los Mycoplasmatales". En Madoff, S. (ed.). Micoplasmas y las formas L de las bacterias . Nueva York, NY: Gordon and Breach. doi :10.1002/jobm.19720120516.
- ^ abc Hayflick, L. (1965). "Cultivos de tejidos y micoplasmas". Informes de Texas sobre biología y medicina . 23 (1): 285–303. PMID 5833547.
- ^ Hayflick, L. (1966). "El papel de los micoplasmas en las enfermedades humanas". The New Physician . Diciembre: 328–333, 348–350.
- ^ Hayflick, L. (1972). Micoplasmas como patógenos . Simposio Fundación CIBA: Micoplasmas Patógenos. Ámsterdam, Países Bajos: Elsevier Excerpta Medica. págs. 17–31.
- ^ Hayflick, L. (4 de octubre de 1993). "Aislamiento e identificación de un micoplasma como agente etiológico de la neumonía atípica primaria en humanos". Cita Classic. Current Contents . 40 : 8.
- ^ Chanock RM, Hayflick L, Barile MF (enero de 1962). "Crecimiento en medio artificial de un agente asociado con neumonía atípica y su identificación como PPLO". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 48 (1): 41–49. Bibcode :1962PNAS...48...41C. doi : 10.1073/pnas.48.1.41 . PMC 285494 . PMID 13878126.
- ^ ab "Robert Chanock y el agente Eaton". Web of Stories . 8 de agosto de 2012.
- ^ ab Sharrer, T. (2007). "Microscopios invertidos Leitz, circa 1958". The Scientist . 21 (3): 96.
- ^ Klieneberger-Nobel, E. (1980). Memorias (edición en inglés). Londres, Reino Unido: Academic Press. ISBN 0-12-414850-6.
- ^ Chanock, RM (mayo de 1963). "Mycoplasma pneumoniae: nomenclatura propuesta para el organismo de neumonía atípica (agente Eaton)". Science . 140 (3567): 662. Bibcode :1963Sci...140..662C. doi :10.1126/science.140.3567.662. PMID 14020096. S2CID 34513645.
- ^ Edward DG, Freundt EA, Chanock RM, Fabricant J, Hayflick L, Lemcke RM, et al. (marzo de 1967). "Recomendaciones sobre la nomenclatura del orden Mycoplasmatales". Science . 155 (3770): 1694–1696. Bibcode :1967Sci...155.1694E. doi : 10.1126/science.155.3770.1694 . PMID 6020298.
- ^ abcde Weisburg WG, Tully JG, Rose DL, Petzel JP, Oyaizu H, Yang D, et al. (diciembre de 1989). "Un análisis filogenético de los micoplasmas: base para su clasificación". Journal of Bacteriology . 171 (12): 6455–67. doi :10.1128/jb.171.12.6455-6467.1989. PMC 210534 . PMID 2592342.
- ^ abcdefghijklm Romero-Arroyo CE, Jordan J, Peacock SJ, Willby MJ, Farmer MA, Krause DC (febrero de 1999). "La proteína P30 de Mycoplasma pneumoniae es necesaria para la adherencia a la citaradiación y está asociada con el desarrollo celular adecuado". Journal of Bacteriology . 181 (4): 1079–87. doi :10.1128/JB.181.4.1079-1087.1999. PMC 93483 . PMID 9973332.
- ^ abc Dallo SF, Baseman JB (noviembre de 2000). "Replicación intracelular del ADN y supervivencia a largo plazo de micoplasmas patógenos". Patogénesis microbiana . 29 (5): 301–9. doi :10.1006/mpat.2000.0395. PMID 11031124.
- ^ abcdef Wodke JA, Puchałka J, Lluch-Senar M, Marcos J, Yus E, Godinho M, et al. (2013). "Disección del metabolismo energético en Mycoplasma pneumoniae a través del modelado metabólico a escala del genoma". Biología de sistemas moleculares . 9 : 653. doi :10.1038/msb.2013.6. PMC 3658275 . PMID 23549481.
- ^ abcdefghijkl Yus E, Maier T, Michalodimitrakis K, van Noort V, Yamada T, Chen WH, et al. (noviembre de 2009). "Impacto de la reducción del genoma en el metabolismo bacteriano y su regulación". Science . 326 (5957): 1263–1268. Bibcode :2009Sci...326.1263Y. doi :10.1126/science.1177263. PMID 19965476. S2CID 17576843.
- ^ Chowdhury S, Hepper S, Lodi MK, Saier MH, Uetz P (abril de 2021). "El interactoma proteico de la glucólisis en Escherichia coli". Proteomes . 9 (2): 16. doi : 10.3390/proteomes9020016 . PMC 8167557 . PMID 33917325.
- ^ "VÍA KEGG: Glucólisis/Gluconeogénesis – Mycoplasma pneumoniae 309". www.genome.jp . Consultado el 27 de octubre de 2022 .
- ^ abc Li J, Luu LD, Wang X, Cui X, Huang X, Fu J, et al. (diciembre de 2022). "El análisis metabolómico revela posibles biomarcadores y la patogénesis subyacente implicada en la neumonía por Mycoplasma pneumoniae". Microbios emergentes e infecciones . 11 (1): 593–605. doi : 10.1080/22221751.2022.2036582 . PMC 8865114 . PMID 35094669.
- ^ abcde Drasbek M, Christiansen G, Drasbek KR, Holm A, Birkelund S (noviembre de 2007). "Interacción entre la proteína P1 de Mycoplasma pneumoniae y los receptores en las células HEp-2". Microbiología . 153 (Pt 11): 3791–3799. doi : 10.1099/mic.0.2007/010736-0 . PMID 17975088.
- ^ abcde Baseman JB, Cole RM, Krause DC, Leith DK (septiembre de 1982). "Base molecular de la citadsorción de Mycoplasma pneumoniae". Journal of Bacteriology . 151 (3): 1514–22. doi :10.1128/JB.151.3.1514-1522.1982. PMC 220433 . PMID 6809731.
- ^ abc Hahn TW, Willby MJ, Krause DC (marzo de 1998). "HMW1 es necesaria para el tráfico de citoadhesina P1 al orgánulo de unión en Mycoplasma pneumoniae". Journal of Bacteriology . 180 (5): 1270–6. doi :10.1128/JB.180.5.1270-1276.1998. PMC 107017 . PMID 9495768.
- ^ ab Sobeslavsky O, Prescott B, Chanock RM (septiembre de 1968). "Adsorción de Mycoplasma pneumoniae a receptores de ácido neuramínico de varias células y posible papel en la virulencia". Journal of Bacteriology . 96 (3): 695–705. doi :10.1128/JB.96.3.695-705.1968. PMC 252361 . PMID 4183967.
- ^ "CDC Mycoplasma Pneumoniae". CDC . Consultado el 23 de septiembre de 2015 .
- ^ Großhennig, Stephanie; Ischebeck, Till; Gibhardt, Johannes; Busse, Julia; Feussner, Ivo; Stülke, Jörg (abril de 2016). "El sulfuro de hidrógeno es un nuevo factor de virulencia potencial de Mycoplasma pneumoniae: caracterización de la inusual cisteína desulfurasa/desulfhidrasa HapE". Microbiología molecular . 100 (1): 42–54. doi :10.1111/mmi.13300. ISSN 0950-382X. PMID 26711628.
- ^ ab Lanata, Mariana M.; Wang, Huanyu; Everhart, Kathy; Moore-Clingenpeel, Melisa; Ramilo, Octavio; Leber, Amy (junio de 2021). "Infecciones por Mycoplasma pneumoniae resistentes a macrólidos en niños, Ohio, EE. UU." Enfermedades infecciosas emergentes . 27 (6): 1588–1597. doi :10.3201/eid2706.203206. ISSN 1080-6040. PMC 8153876 . PMID 34013867.
- ^ Cheng, Jie; Liu, Ya; Zhang, Guangli; Tan, Liping; Luo, Zhengxiu (julio de 2024). "Eficacia de la azitromicina en niños con neumonía por Mycoplasma pneumoniae mutado". Infección y resistencia a fármacos . 17 : 2933–2942. doi : 10.2147/idr.s466994 . ISSN 1178-6973. PMC 11249021 . PMID 39011344.
Este artículo incorpora texto de dominio público de los CDC según se cita.
Lectura adicional
- Baseman JB, Reddy SP, Dallo SF (octubre de 1996). "Interacción entre las proteínas de superficie del micoplasma, las células de las vías respiratorias y las manifestaciones proteicas de las infecciones humanas mediadas por micoplasma". American Journal of Respiratory and Critical Care Medicine . 154 (4 Pt 2): S137–44. doi :10.1164/ajrccm/154.4_Pt_2.S137. PMID 8876532.
- Razin S, Yogev D, Naot Y (diciembre de 1998). "Biología molecular y patogenicidad de micoplasmas". Microbiology and Molecular Biology Reviews . 62 (4): 1094–156. doi :10.1128/MMBR.62.4.1094-1156.1998. PMC 98941 . PMID 9841667.
- Kashyap S, Sarkar M (abril de 2010). "Neumonía por micoplasma: características clínicas y tratamiento". Lung India . 27 (2): 75–85. doi : 10.4103/0970-2113.63611 . PMC 2893430 . PMID 20616940.
- Narita M (septiembre de 2009). "Patogénesis de las manifestaciones neurológicas de la infección por Mycoplasma pneumoniae". Neurología pediátrica . 41 (3): 159–66. doi :10.1016/j.pediatrneurol.2009.04.012. PMID 19664529.
- Ferwerda A, Moll HA, de Groot R (agosto de 2001). "Infecciones del tracto respiratorio por Mycoplasma pneumoniae en niños: una revisión de medidas diagnósticas y terapéuticas". Revista Europea de Pediatría . 160 (8): 483–91. doi :10.1007/s004310100775. PMID 11548186. S2CID 9131256.
- Esposito S, Droghetti R, Bosis S, Claut L, Marchisio P, Principi N (agosto de 2002). "Secreción de citocinas en niños con infección aguda por Mycoplasma pneumoniae y sibilancias". Pediatric Pulmonology . 34 (2): 122–7. doi :10.1002/ppul.10139. PMID 12112778. S2CID 1386332.
- Ríos AM, Mejías A, Chávez-Bueno S, Fonseca-Aten M, Katz K, Hatfield J, et al. (Agosto 2004). "Impacto de la terapia con cetromicina (ABT-773) en los índices microbiológicos, histológicos, inmunológicos y respiratorios en un modelo murino de infección de las vías respiratorias inferiores por Mycoplasma pneumoniae". Agentes antimicrobianos y quimioterapia . 48 (8): 2897–904. doi :10.1128/AAC.48.8.2897-2904.2004. PMC 478543. PMID 15273098.
- Véase también los comentarios de Hayflick sobre el libro de Meredith Wadman, "The Vaccine Race: Science, Politics and the Human Costs of Defeating Disease", 2017 Errores en el libro "The Vaccine Race"
Enlaces externos
- Genoma de Mycoplasma pneumoniae
- Cepa tipo de Mycoplasma pneumoniae en BacDive – la base de metadatos de diversidad bacteriana
- Mycoplasmoides pneumoniae en VetBact
