Cadherina

Las cadherinas (denominadas así por su "adhesión dependiente del calcio") son moléculas de adhesión celular importantes para la formación de uniones adherentes que permiten que las células se adhieran entre sí. [1] Las cadherinas son una clase de proteínas transmembrana de tipo 1 y dependen de los iones de calcio (Ca 2+ ) para funcionar, de ahí su nombre. La adhesión entre células está mediada por dominios de cadherina extracelulares, mientras que la cola citoplasmática intracelular se asocia con numerosos adaptadores y proteínas de señalización, denominados colectivamente el adhesisoma de cadherina .
Fondo
Esta sección puede contener una cantidad excesiva de detalles intrincados que pueden interesar solo a una audiencia en particular . ( Julio de 2023 ) |
La familia de las cadherinas es esencial para mantener el contacto célula-célula y regular los complejos citoesqueléticos. La superfamilia de las cadherinas incluye cadherinas, protocadherinas , desmogleínas , desmocolinas y más. [2] [3] En cuanto a la estructura, comparten repeticiones de cadherina , que son los dominios de unión al Ca 2+ extracelular . Existen múltiples clases de moléculas de cadherina, cada una designada con un prefijo para los tejidos con los que se asocia. Las cadherinas clásicas mantienen el tono de los tejidos formando un homodímero en cis, mientras que las cadherinas desmosómicas son heterodímeras. [4] La porción intracelular de las cadherinas clásicas interactúa con un complejo de proteínas que permite la conexión al citoesqueleto de actina. Aunque las cadherinas clásicas desempeñan un papel en la formación de capas celulares y la formación de estructuras, las cadherinas desmosómicas se centran en resistir el daño celular. Las cadherinas desmosómicas mantienen la función de los desmosomas, es decir, contrarrestar la tensión mecánica de los tejidos. De manera similar a las cadherinas clásicas, las cadherinas desmosómicas tienen un único dominio transmembrana, cinco repeticiones EC y un dominio intracelular. Existen dos tipos de cadherinas desmosómicas: las desmogleínas y las desmocolinas. Estas contienen un anclaje intracelular y una secuencia similar a la cadherina (ICS). Las proteínas adaptadoras que se asocian con las cadherinas desmosómicas son la placoglobina (relacionada con la β-catenina), las placofilinas (subfamilia de la catenina p120) y las desmoplaquinas. La función principal de las desmoplaquinas es unirse al filamento intermedio mediante la interacción con la placoglobina, que se une a la ICS de las desmogleínas, las desmocolinas y las placofilinas. [4] Las cadherinas atípicas, como CELSR1 , conservan las repeticiones extracelulares y las actividades de unión de las otras cadherinas, pero pueden diferir significativamente en su estructura y suelen estar involucradas en la transmisión de señales de desarrollo en lugar de adhesión. [5]
Las células que contienen un subtipo específico de cadherina tienden a agruparse excluyendo otros tipos, tanto en el cultivo celular como durante el desarrollo . [6] Por ejemplo, las células que contienen N-cadherina tienden a agruparse con otras células que expresan N-cadherina. Sin embargo, la velocidad de mezcla en experimentos de cultivo celular puede afectar el grado de especificidad homotípica. [7] Además, varios grupos han observado afinidad de unión heterotípica (es decir, unión de diferentes tipos de cadherina entre sí) en varios ensayos. [8] [9] Un modelo actual propone que las células distinguen los subtipos de cadherina basándose en la especificidad cinética en lugar de la especificidad termodinámica, ya que los diferentes tipos de enlaces homotípicos de cadherina tienen diferentes tiempos de vida. [10]
Estructura

Las cadherinas se sintetizan como polipéptidos y sufren muchas modificaciones postraduccionales para convertirse en las proteínas que median la adhesión y el reconocimiento entre células. [11] Estos polipéptidos tienen aproximadamente entre 720 y 750 aminoácidos de longitud. Cada cadherina tiene un pequeño componente citoplasmático C-terminal, un componente transmembrana y el resto de la proteína es extracelular (fuera de la célula). El componente transmembrana consiste en repeticiones de glucoproteínas de cadena simple . [12] Debido a que las cadherinas dependen del Ca 2+ , tienen cinco repeticiones de dominio extracelular en tándem que actúan como sitio de unión para los iones Ca 2+ . [13] Su dominio extracelular interactúa con dos conformaciones de dímeros trans independientes : dímeros de intercambio de hebras (dímeros S) y dímeros X. [13] Hasta la fecha, se han identificado y secuenciado más de 100 tipos de cadherinas en humanos. [14]
La funcionalidad de las cadherinas depende de la formación de dos subunidades idénticas, conocidas como homodímeros. [12] Las cadherinas homodímeras crean adhesión célula-célula con cadherinas presentes en las membranas de otras células al cambiar la conformación de cis -dímeros a trans -dímeros. [12] Una vez que se ha formado la adhesión célula-célula entre cadherinas presentes en las membranas celulares de dos células diferentes, se pueden realizar uniones adherentes cuando los complejos proteicos, generalmente compuestos de α-, β- y γ-cateninas , se unen a la porción citoplasmática de la cadherina. [12] Las proteínas reguladoras incluyen p-120 catenina, -catenina, -catenina y vinculina . La unión de p-120 catenina y -catenina al homodímero aumenta la estabilidad de la cadherina clásica. La -catenina se une al complejo p120-catenina, donde la vinculina se une indirectamente al citoesqueleto de actina. [4] Sin embargo, el complejo cadherina-catenina también puede unirse directamente a la actina sin la ayuda de la vinculina. Además, la fuerza de adhesión de la cadherina puede aumentar mediante la desfosforilación de la p120-catenina y la unión de la -catenina y la vinculina.
Función
Desarrollo
Las cadherinas se comportan como receptores y ligandos para otras moléculas. Durante el desarrollo, su comportamiento ayuda a posicionar adecuadamente las células: son responsables de la separación de las diferentes capas de tejido y de la migración celular. [15] En las primeras etapas del desarrollo, las E-cadherinas (cadherinas epiteliales) se expresan en mayor medida. Muchas cadherinas están especificadas para funciones específicas en la célula y se expresan de forma diferencial en un embrión en desarrollo. Por ejemplo, durante la neurulación , cuando se forma una placa neural en un embrión, los tejidos que residen cerca de los pliegues neurales craneales tienen una expresión reducida de N-cadherinas. [16] Por el contrario, la expresión de las N-cadherinas permanece inalterada en otras regiones del tubo neural que se encuentran en el eje anteroposterior del vertebrado. [16] Las N-cadherinas tienen diferentes funciones que mantienen la estructura celular, la adhesión célula-célula, las adherencias internas. Participan en gran medida en el mantenimiento de la capacidad del corazón estructurado debido al bombeo y liberación de sangre. Debido a la contribución de las N-cadherinas que se adhieren fuertemente entre los cardiomiocitos , el corazón puede superar la fractura, la deformación y la fatiga que pueden resultar de la presión arterial. [17] La N-cadherina participa en el desarrollo del corazón durante la embriogénesis , especialmente en la clasificación del mesodermo precardíaco. Las N-cadherinas se expresan de forma robusta en el mesodermo precardíaco, pero no desempeñan un papel en el linaje cardíaco. Un embrión con mutación de N-cadherina todavía forma el tubo cardíaco primitivo; sin embargo, los ratones deficientes en N-cadherina tendrán dificultades para mantener el desarrollo de los cardiomiocitos. [17] Los miocitos de estos ratones terminarán con miocitos disociados que rodean la capa de células endocárdicas cuando no puedan preservar la adhesión celular debido a que el corazón comienza a bombear. Como resultado, el tracto de salida cardíaco se bloqueará causando hinchazón cardíaca. La expresión de diferentes tipos de cadherinas en las células varía dependiendo de la diferenciación y especificación específicas de un organismo durante el desarrollo. Las cadherinas desempeñan un papel vital en la migración de células a través de la transición epitelial-mesenquimal , que requiere que las cadherinas formen uniones adherentes con las células vecinas. En las células de la cresta neural, que son células transitorias que surgen en el organismo en desarrollo durante la gastrulación y funcionan en la formación de patrones del plan corporal de los vertebrados, las cadherinas son necesarias para permitir la migración de células para formar tejidos u órganos. [16]Además, también se ha demostrado que las cadherinas, que son responsables del evento de transición epitelial-mesenquimal en el desarrollo temprano, son fundamentales en la reprogramación de células adultas específicas hacia un estado pluripotente, formando células madre pluripotentes inducidas (iPSC). [1]
Después del desarrollo, las cadherinas desempeñan un papel en el mantenimiento de la estructura celular y tisular, y en el movimiento celular. [14] La regulación de la expresión de cadherinas puede ocurrir a través de la metilación del promotor, entre otros mecanismos epigenéticos. [18]
Metástasis tumoral
El complejo E-cadherina-catenina desempeña un papel fundamental en la adhesión celular; la pérdida de esta función se ha asociado con un aumento de la invasividad y la metástasis de los tumores. [19] La supresión de la expresión de E-cadherina se considera uno de los principales eventos moleculares responsables de la disfunción en la adhesión entre células, que puede conducir a la invasión local y, en última instancia, al desarrollo de tumores. Debido a que las E-cadherinas desempeñan un papel importante en la supresión tumoral, también se las conoce como "supresores de la invasión". [20]
Además, la sobreexpresión de las cadherinas tipo 5, 6 y 17 solas o en combinación puede provocar metástasis del cáncer, y las investigaciones en curso tienen como objetivo bloquear su capacidad de funcionar como ligandos para proteínas integrales de membrana. [21]
Correlación con el cáncer
Se ha descubierto que las cadherinas y otros factores adicionales están relacionados con la formación y el crecimiento de algunos cánceres y con la forma en que un tumor continúa creciendo. Las cadherinas E, conocidas como cadherinas epiteliales, se encuentran en la superficie de una célula y pueden unirse con las del mismo tipo en otra para formar puentes. [22] La pérdida de las moléculas de adhesión celular, cadherinas E, está causalmente involucrada en la formación de tipos epiteliales de cánceres como los carcinomas. Los cambios en cualquier tipo de expresión de cadherinas no solo pueden controlar la adhesión de células tumorales, sino que también pueden afectar la transducción de señales, lo que lleva a que las células cancerosas crezcan sin control. [23]
En los cánceres de células epiteliales, la adhesión celular alterada puede conducir al desarrollo de crecimientos malignos secundarios; están distantes del sitio primario del cáncer y pueden ser resultado de anomalías en la expresión de E-cadherinas o sus cateninas asociadas . Las CAM, como las glicoproteínas cadherinas que normalmente funcionan como pegamento y mantienen unidas a las células, actúan como mediadores importantes de las interacciones entre células. Las E-cadherinas, en la superficie de todas las células epiteliales, están vinculadas al citoesqueleto de actina a través de interacciones con cateninas en el citoplasma. Por lo tanto, ancladas al citoesqueleto, las E-cadherinas en la superficie de una célula pueden unirse con las de otra para formar puentes. En los cánceres de células epiteliales, la adhesión celular alterada que puede conducir a metástasis puede ser resultado de anomalías en la expresión de E-cadherina o sus cateninas asociadas . [22]
Correlación con el endometrio y la embriogénesis
Esta familia de glicoproteínas es responsable del mecanismo de adhesión intracelular dependiente del calcio. Las E-cadherinas son cruciales en la embriogénesis durante varios procesos, incluyendo la gastrulación, la neurulación y la organogénesis. Además, la supresión de las E-cadherinas altera la adhesión intracelular. Los niveles de estas moléculas aumentan durante la fase lútea mientras que su expresión está regulada por la progesterona con calcitonina endometrial. [24]
Tipos
| Dominio de cadherina (repetición) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
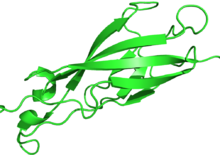 Representación en cinta de una unidad repetitiva en el ectodominio extracelular de la E-cadherina del ratón ( PDB : 3Q2V ) [25] | |||||||||
| Identificadores | |||||||||
| Símbolo | Cadherina | ||||||||
| Pfam | PF00028 | ||||||||
| Interprofesional | IPR002126 | ||||||||
| ELEGANTE | California | ||||||||
| PROSITIO | PDOC00205 | ||||||||
| SCOP2 | 1nci / ALCANCE / SUPFAM | ||||||||
| Membranoma | 114 | ||||||||
| |||||||||
| Consulte Pfam CL0159 para otras familias de Cadherinas. | |||||||||
Se dice que existen más de 100 tipos diferentes de cadherinas en los vertebrados, que se pueden clasificar en cuatro grupos: clásicas, desmosómicas, protocadherinas y no convencionales. [26] [27] Esta gran cantidad de diversidades se logra al tener múltiples genes codificadores de cadherinas combinados con mecanismos alternativos de empalme de ARN. Los invertebrados contienen menos de 20 tipos de cadherinas. [27]
Clásico
Diferentes miembros de la familia cadherina se encuentran en diferentes localizaciones.
- CDH1 – E-cadherina (epitelial): Las E-cadherinas se encuentran en el tejido epitelial; no deben confundirse con la proteína activadora APC/C CDH1 . Las E-cadherinas desempeñan un papel vital en la formación del cáncer, ya que la desregulación de las funciones de la E-cadherina es un paso crucial en la formación de tumores de cáncer de mama. [28]
- CDH2 – N-cadherina (neuronal): Las N-cadherinas se encuentran en las neuronas
- CDH12 – cadherina 12, tipo 2 (N-cadherina 2)
- CDH3 – P-cadherina (placentaria): Las P-cadherinas se encuentran en la placenta.
Desmosómico
- Desmogleína ( DSG1 , DSG2 , DSG3 , DSG4 )
- Desmocolina ( DSC1 , DSC2 , DSC3 )
Protocadherinas
Las protocadherinas son el subgrupo mamífero más grande de la superfamilia de cadherinas de proteínas de adhesión celular homofílicas.
- PCDH1
- PCDH7
- PCDH8
- PCDH9
- PCDH10
- PCDH11X / 11Y
- PCDH12
- PCDH15
- PCDH17
- PCDH18
- PCDH19
- PCDH20
- PCDHA1
- PCDHA2
- PCDHA3
- PCDHA4
- PCDHA5
- PCDHA6
- PCDHA7
- PCDHA8
- PCDHA9
- PCDHA10
- PCDHA11
- PCDHA12
- PCDHA13
- PCDHAC1
- PCDHAC2
- PCDHB1
- PCDHB2
- PCDHB3
- PCDHB4
- PCDHB5
- PCDHB6
- PCDHB7
- PCDHB8
- PCDHB9
- PCDHB10
- PCDHB11
- PCDHB12
- PCDHB13
- PCDHB14
- PCDHB15
- PCDHB16
- PCDHB17
- PCDHB18
- PCDHGA1
- PCDHGA2
- PCDHGA3
- PCDHGA4
- PCDHGA5
- PCDHGA6
- PCDHGA7
- PCDHGA8
- PCDHGA9
- PCDHGA10
- PCDHGA11
- PCDHGA12
- PCDHGB1
- PCDHGB2
- PCDHGB3
- PCDHGB4
- PCDHGB5
- PCDHGB6
- PCDHGB7
- PCDHGC3
- PCDHGC4
- PCDHGC5
- GORDO
- FAT2
- FAT4
No convencional/no agrupado
- CDH4 – R-cadherina (retinal)
- CDH5 – VE-cadherina (endotelial vascular)
- CDH6 – K-cadherina (riñón)
- CDH7 – cadherina 7, tipo 2
- CDH8 – cadherina 8, tipo 2
- CDH9 – cadherina 9, tipo 2 (cadherina T1)
- CDH10 – cadherina 10, tipo 2 (cadherina T2)
- CDH11 – OB-cadherina (osteoblasto)
- CDH13 – T-cadherina – H-cadherina (corazón)
- CDH15 – M-cadherina (miotúbulo)
- CDH16 – Cadherina KSP
- CDH17 – Cadherina LI (hígado-intestino)
- CDH18 – cadherina 18, tipo 2
- CDH19 – cadherina 19, tipo 2
- CDH20 – cadherina 20, tipo 2
- CDH23 – cadherina 23 (epitelio neurosensorial)
- CDH22, CDH24, CDH26, CDH28
- CELSR1 , CELSR2 , CELSR3
- CLST1 , CLST2, CLST3
- DCHS1 , DCHS2 ,
- LOC389118
- PCLKC
- RESDA1
- RETIRADO
Véase también
Referencias
- ^ ab Alimperti S, Andreadis ST (mayo de 2015). "CDH2 y CDH11 actúan como reguladores de las decisiones sobre el destino de las células madre". Investigación sobre células madre . 14 (3): 270–82. doi :10.1016/j.scr.2015.02.002. PMC 4439315. PMID 25771201 .
- ^ Hulpiau P, van Roy F (febrero de 2009). "Evolución molecular de la superfamilia de las cadherinas". Revista internacional de bioquímica y biología celular . 41 (2): 349–69. doi :10.1016/j.biocel.2008.09.027. PMID 18848899.
- ^ Angst BD, Marcozzi C, Magee AI (febrero de 2001). "La superfamilia de las cadherinas: diversidad en forma y función". Journal of Cell Science . 114 (Pt 4): 629–41. doi :10.1242/jcs.114.4.629. PMID 11171368.
- ^ abc Priest AV, Koirala R, Sivasankar S (diciembre de 2019). "Estudios de moléculas individuales de la adhesión clásica y desmosómica de cadherinas". Current Opinion in Biomedical Engineering . 12 : 43–50. doi :10.1016/j.cobme.2019.08.006. PMC 6859941 . PMID 31742239.
- ^ Butler MT, Wallingford JB (junio de 2017). "Polaridad celular plana en el desarrollo y la enfermedad". Nature Reviews Molecular Cell Biology . 18 (6): 375–388. doi :10.1038/nrm.2017.11. PMC 5826606 . PMID 28293032.
- ^ Bello SM, Millo H, Rajebhosale M, Price SR (enero de 2012). "La función de la cadherina dependiente de catenina impulsa la segregación divisional de las neuronas motoras espinales". The Journal of Neuroscience . 32 (2): 490–505. doi :10.1523/jneurosci.4382-11.2012. PMC 3292792 . PMID 22238085.
- ^ Duguay D, Foty RA, Steinberg MS (enero de 2003). "Adhesión celular y segregación tisular mediadas por cadherina: determinantes cualitativos y cuantitativos". Biología del desarrollo . 253 (2): 309–23. doi : 10.1016/S0012-1606(02)00016-7 . PMID 12645933.
- ^ Niessen CM, Gumbiner BM (enero de 2002). "La clasificación celular mediada por cadherina no está determinada por la especificidad de unión o adhesión". The Journal of Cell Biology . 156 (2): 389–399. doi :10.1083/jcb.200108040. PMC 2199232 . PMID 11790800.
- ^ Volk T, Cohen O, Geiger B (septiembre de 1987). "Formación de uniones heterotípicas de tipo adherente entre células hepáticas que contienen L-CAM y células del cristalino que contienen A-CAM". Cell . 50 (6): 987–94. doi :10.1016/0092-8674(87)90525-3. PMID 3621349. S2CID 21428349.
- ^ Bayas MV, Leung A, Evans E, Leckband D (febrero de 2006). "Las mediciones de la duración de la vida revelan diferencias cinéticas entre los enlaces de cadherina homofílicos". Biophysical Journal . 90 (4): 1385–95. Bibcode :2006BpJ....90.1385B. doi :10.1529/biophysj.105.069583. PMC 1367289 . PMID 16326909.
- ^ Harris TJ, Tepass U (julio de 2010). "Uniones adherentes: de las moléculas a la morfogénesis". Nature Reviews. Molecular Cell Biology . 11 (7): 502–14. doi :10.1038/nrm2927. PMID 20571587. S2CID 13638902.
- ^ abcd Marie PJ, Haÿ E, Modrowski D, Revollo L, Mbalaviele G, Civitelli R (enero de 2014). "Adhesión y señalización célula-célula mediada por cadherina en el esqueleto". Calcified Tissue International . 94 (1): 46–54. doi :10.1007/s00223-013-9733-7. PMC 4272239 . PMID 23657489.
- ^ ab Priest AV, Shafraz O, Sivasankar S (septiembre de 2017). "Base biofísica de la adhesión célula-célula mediada por cadherina". Experimental Cell Research . 358 (1): 10–13. doi : 10.1016/j.yexcr.2017.03.015 . PMID 28300566.
- ^ ab Tepass U, Truong K, Godt D, Ikura M, Peifer M (noviembre de 2000). "Cadherinas en la morfogénesis embrionaria y neural". Nature Reviews. Molecular Cell Biology . 1 (2): 91–100. doi :10.1038/35040042. PMID 11253370. S2CID 1632053.
- ^ Gumbiner BM (agosto de 2005). "Regulación de la adhesión mediada por cadherina en la morfogénesis". Nature Reviews. Molecular Cell Biology . 6 (8): 622–34. doi :10.1038/nrm1699. PMID 16025097. S2CID 25094246.
- ^ abc Taneyhill LA, Schiffmacher AT (junio de 2017). "¿Debería quedarme o debería irme? Función y regulación de la cadherina en la cresta neural". Genesis . 55 (6): e23028. doi :10.1002/dvg.23028. PMC 5468476 . PMID 28253541.
- ^ de Roy F (2013). La biología molecular de las cadherinas . Elsevier. págs. 264-274. ISBN 978-0-12-394311-8.
- ^ Reinhold WC, Reimers MA, Maunakea AK, Kim S, Lababidi S, Scherf U, et al. (febrero de 2007). "Perfiles detallados de metilación del ADN del promotor de la E-cadherina en las células cancerosas NCI-60". Molecular Cancer Therapeutics . 6 (2): 391–403. doi : 10.1158/1535-7163.MCT-06-0609 . PMID 17272646.
- ^ Beavon IR (agosto de 2000). "El complejo E-cadherina-catenina en la metástasis tumoral: estructura, función y regulación". Revista Europea del Cáncer . 36 (13 N.º de especificación): 1607–20. doi :10.1016/S0959-8049(00)00158-1. PMID 10959047.
- ^ Nives Pećina-Šlaus (2003). "El gen supresor de tumores E-cadherina y su papel en células normales y malignas". Cancer Cell Int . 3 (17): 17. doi : 10.1186/1475-2867-3-17 . PMC 270068 . PMID 14613514.
- ^ Casal JI, Bartolomé RA (9 de julio de 2019). "Más allá de la N-cadherina, relevancia de las cadherinas 5, 6 y 17 en la progresión del cáncer y la metástasis". Revista Internacional de Ciencias Moleculares . 20 (13): 3373. doi : 10.3390/ijms20133373 . ISSN 1422-0067.
- ^ ab Morales CP, Souza RF, Spechler SJ (noviembre de 2002). "Características distintivas de la progresión del cáncer en el esófago de Barrett". Lancet . 360 (9345): 1587–9. doi :10.1016/S0140-6736(02)11569-8. PMID 12443613. S2CID 22401564.
- ^ Cavallaro U, Schaffhauser B, Christofori G (febrero de 2002). "Cadherinas y progresión tumoral: ¿es todo un cambio?". Cancer Letters . 176 (2): 123–8. doi :10.1016/S0304-3835(01)00759-5. PMID 11804738.
- ^ Grigorian IY, Linkova NS, Polyakova VO, Paltseva EM, Kozlov KL (enero de 2016). "Moléculas de señalización del endometrio: aspectos gerontológicos y patológicos generales". Avances en gerontología . 6 (1): 36–43. doi :10.1134/S2079057016010045. S2CID 87472683.
- ^ Harrison OJ, Jin X, Hong S, Bahna F, Ahlsen G, Brasch J, et al. (febrero de 2011). "La arquitectura extracelular de las uniones adherentes revelada por las estructuras cristalinas de las cadherinas de tipo I". Structure . 19 (2): 244–56. doi :10.1016/j.str.2010.11.016. PMC 3070544 . PMID 21300292.
- ^ Offermanns S, Rosenthal W (2008). Enciclopedia de farmacología molecular. Springer. pp. 306–. ISBN 978-3-540-38916-3. Recuperado el 14 de diciembre de 2010 .
- ^ ab Lodish H, Berk A, Kaiser C, Krieger M, Bretscher A, Ploegh H, et al. (2013). Biología celular molecular (séptima edición). Nueva York: Worth Publ. p. 934. ISBN 978-1-4292-3413-9.
- ^ Corso G, Figueiredo J, De Angelis SP, Corso F, Girardi A, Pereira J, et al. (junio de 2020). "Desregulación de E-cadherina en el cáncer de mama". Revista de Medicina Celular y Molecular . 24 (11): 5930–5936. doi :10.1111/jcmm.15140. PMC 7294130 . PMID 32301282.
Lectura adicional
- Beavon IR (agosto de 2000). "El complejo E-cadherina-catenina en la metástasis tumoral: estructura, función y regulación". Revista Europea del Cáncer . 36 (13 N.º de especificación): 1607–20. doi :10.1016/S0959-8049(00)00158-1. PMID 10959047.
- Berx G, Becker KF, Höfler H, van Roy F (1998). "Mutaciones del gen humano E-cadherina (CDH1)". Human Mutation . 12 (4): 226–37. doi : 10.1002/(SICI)1098-1004(1998)12:4<226::AID-HUMU2>3.0.CO;2-D . PMID 9744472.
- Bryant DM, Stow JL (agosto de 2004). "Los entresijos del tráfico de E-cadherina". Tendencias en biología celular . 14 (8): 427–34. doi :10.1016/j.tcb.2004.07.007. PMID 15308209.
- Chun YS, Lindor NM, Smyrk TC, Petersen BT, Burgart LJ, Guilford PJ, et al. (julio de 2001). "Mutaciones del gen de la E-cadherina en la línea germinal: ¿está indicada la gastrectomía total profiláctica?". Cancer . 92 (1): 181–7. doi : 10.1002/1097-0142(20010701)92:1<181::AID-CNCR1307>3.0.CO;2-J . PMID 11443625. S2CID 11052015.
- Georgolios A, Batistatou A, Manolopoulos L, Charalabopoulos K (marzo de 2006). "Patrones de expresión y función de la E-cadherina en el carcinoma de células escamosas de cabeza y cuello (HNSCC)". Journal of Experimental & Clinical Cancer Research . 25 (1): 5–14. PMID 16761612.
- Hazan RB, Qiao R, Keren R, Badano I, Suyama K (abril de 2004). "Cambio de cadherina en la progresión tumoral". Anales de la Academia de Ciencias de Nueva York . 1014 (1): 155–63. Bibcode :2004NYASA1014..155H. doi :10.1196/annals.1294.016. PMID 15153430. S2CID 37486403.
- Moran CJ, Joyce M, McAnena OJ (abril de 2005). "Cáncer gástrico asociado a CDH1: informe de una familia y revisión de la literatura". Revista Europea de Oncología Quirúrgica . 31 (3): 259–64. doi :10.1016/j.ejso.2004.12.010. PMID 15780560.
- Reynolds AB, Carnahan RH (diciembre de 2004). "Regulación de la estabilidad y el recambio de cadherinas por p120ctn: implicaciones en la enfermedad y el cáncer". Seminarios en biología celular y del desarrollo . 15 (6): 657–63. doi :10.1016/j.semcdb.2004.09.003. PMID 15561585.
- Wang HD, Ren J, Zhang L (noviembre de 2004). "Mutación de la línea germinal CDH1 en el carcinoma gástrico hereditario". Revista Mundial de Gastroenterología . 10 (21): 3088–93. doi : 10.3748/wjg.v10.i21.3088 . PMC 4611247 . PMID 15457549.
- Wijnhoven BP, Dinjens WN, Pignatelli M (agosto de 2000). "Complejo de adhesión célula-célula E-cadherina-catenina y cáncer humano". The British Journal of Surgery . 87 (8): 992–1005. doi :10.1046/j.1365-2168.2000.01513.x. hdl : 1765/56571 . PMID 10931041. S2CID 3083613.
- Wilson PD (abril de 2001). "Policistina: nuevos aspectos de la estructura, función y regulación" (PDF) . Revista de la Sociedad Americana de Nefrología . 12 (4): 834–45. doi :10.1681/ASN.V124834. PMID 11274246.
- Renaud-Young M, Gallin WJ (octubre de 2002). "En el primer dominio extracelular de la E-cadherina, las interacciones heterófilas, pero no el motivo His-Ala-Val conservado, son necesarias para la adhesión". The Journal of Biological Chemistry . 277 (42): 39609–16. doi : 10.1074/jbc.M201256200 . PMID 12154084.
- Zaidel-Bar R (enero de 2013). "Adhesoma de cadherina de un vistazo". Journal of Cell Science . 126 (Pt 2): 373–8. doi : 10.1242/jcs.111559 . PMID 23547085.
- Chmelarova M, Baranova I, Ruszova E, Laco J, Hrochova K, Dvorakova E, et al. (octubre de 2019). "Importancia de la metilación de cadherinas en el cáncer de ovario: un enfoque de secuenciación de próxima generación". Pathology & Oncology Research . 25 (4): 1457–1465. doi :10.1007/s12253-018-0500-y. PMID 30368729. S2CID 53083365.
- Daw S, Law S (febrero de 2021). "La interacción funcional de los factores de transcripción y las moléculas de adhesión celular en la mielodisplasia experimental, incluido el compartimento de las células madre progenitoras hematopoyéticas". Bioquímica molecular y celular . 476 (2): 535–551. doi :10.1007/s11010-020-03920-6. PMID 33011884. S2CID 222153001.
- Priest AV, Koirala R, Sivasankar S (diciembre de 2019). "Estudios de moléculas individuales de la adhesión clásica y desmosómica de cadherinas". Current Opinion in Biomedical Engineering . 12 : 43–50. doi :10.1016/j.cobme.2019.08.006. PMC 6859941 . PMID 31742239.
- Adu-Gyamfi EA, Czika A, Gorleku PN, Ullah A, Panhwar Z, Ruan LL, et al. (febrero de 2021). "La participación de moléculas de adhesión celular, uniones estrechas y uniones en hueco en la placentación humana". Ciencias de la Reproducción (Thousand Oaks, California) . 28 (2): 305–320. doi : 10.1007/s43032-020-00364-7 . PMID 33146876.
Enlaces externos
- Proteopedia Cadherina : vea la estructura de la cadherina en 3D interactivo
- Dominio Cadherin en PROSITE
- La familia de las cadherinas
- El recurso Cadherin
- InterPro : IPR002126
- [1]


