Pérdida auditiva neurosensorial
| Pérdida auditiva neurosensorial | |
|---|---|
 | |
| Sección transversal de la cóclea. | |
| Especialidad | Otorrinolaringología |
La pérdida auditiva neurosensorial ( SNHL ) es un tipo de pérdida auditiva en la que la causa raíz se encuentra en el oído interno , el órgano sensorial ( cóclea y estructuras asociadas) o el nervio vestibulococlear ( par craneal VIII). La SNHL representa aproximadamente el 90% de la pérdida auditiva notificada. [ cita requerida ] La SNHL suele ser permanente y puede ser leve, moderada, grave, profunda o total. Se pueden utilizar otros descriptores según la forma del audiograma , como alta frecuencia, baja frecuencia, en forma de U, con muescas, en pico o plano.
La pérdida auditiva sensorial a menudo ocurre como consecuencia de células ciliadas cocleares dañadas o deficientes . [ disputado – discutir ] Las células ciliadas pueden ser anormales al nacer o dañarse durante la vida de un individuo. Existen causas externas de daño, incluidas infecciones y medicamentos ototóxicos , así como causas intrínsecas, incluidas mutaciones genéticas . Una causa común o factor agravante en la SNHL es la exposición prolongada al ruido ambiental o pérdida auditiva inducida por ruido . La exposición a un solo ruido muy fuerte, como un disparo de arma de fuego o la explosión de una bomba, puede causar pérdida auditiva inducida por ruido. El uso de auriculares a un volumen alto durante mucho tiempo o estar en entornos ruidosos con regularidad, como un lugar de trabajo ruidoso, eventos deportivos, conciertos y el uso de máquinas ruidosas también pueden ser un riesgo de pérdida auditiva inducida por ruido.
La pérdida auditiva neural o "retrococlear" se produce debido a un daño en el nervio coclear (CVIII). Este daño puede afectar el inicio del impulso nervioso en el nervio coclear o la transmisión del impulso nervioso a lo largo del nervio hasta el tronco encefálico .
La mayoría de los casos de pérdida auditiva neurosensorial se presentan con un deterioro gradual de los umbrales auditivos que se produce a lo largo de años o décadas. En algunos casos, la pérdida puede llegar a afectar a grandes porciones del rango de frecuencias . Puede estar acompañada de otros síntomas como zumbidos en los oídos ( tinnitus ) y mareos o aturdimiento ( vértigo ). El tipo más común de pérdida auditiva neurosensorial es la relacionada con la edad ( presbiacusia ), seguida de la pérdida auditiva inducida por ruido (NIHL).
Los síntomas frecuentes de la hipoacusia neurosensorial son la pérdida de agudeza para distinguir las voces en primer plano de los fondos ruidosos, dificultad para entender el teléfono, algunos tipos de sonidos que parecen excesivamente fuertes o estridentes, dificultad para entender algunas partes del discurso ( fricativas y sibilantes ), pérdida de la direccionalidad del sonido (especialmente con sonidos de alta frecuencia), percepción de que las personas murmuran cuando hablan y dificultad para entender el habla. Síntomas similares también se asocian con otros tipos de pérdida auditiva; la audiometría u otras pruebas diagnósticas son necesarias para distinguir la pérdida auditiva neurosensorial.
La identificación de la pérdida auditiva neurosensorial se realiza generalmente mediante una audiometría de tonos puros (un audiograma) en el que se miden los umbrales de conducción ósea. La timpanometría y la audiometría del habla pueden ser útiles. Las pruebas las realiza un audiólogo .
No existe un tratamiento o cura comprobados o recomendados para la pérdida auditiva neurosensorial; el manejo de la pérdida auditiva generalmente se realiza mediante estrategias auditivas y audífonos. En casos de sordera profunda o total, un implante coclear es un dispositivo especializado que puede restaurar un nivel funcional de audición. La pérdida auditiva neurosensorial se puede prevenir al menos parcialmente evitando el ruido ambiental, los productos químicos y medicamentos ototóxicos y los traumatismos craneales, y tratando o vacunando contra ciertas enfermedades y afecciones desencadenantes como la meningitis .
Signos y síntomas
Dado que el oído interno no es directamente accesible a los instrumentos, la identificación se realiza mediante el informe del paciente sobre los síntomas y la prueba audiométrica . De aquellos que acuden a su médico con pérdida auditiva neurosensorial, el 90 % informa tener una audición disminuida, el 57 % informa tener una sensación de taponamiento en el oído y el 49 % informa tener un zumbido en el oído ( tinnitus ). Aproximadamente la mitad informa problemas vestibulares (vértigo). [ cita requerida ]
Para una exposición detallada de los síntomas útiles para la detección, la Academia Estadounidense de Otorrinolaringología desarrolló un cuestionario de autoevaluación llamado Inventario de discapacidad auditiva para adultos (HHIA). Se trata de una encuesta de 25 preguntas sobre síntomas subjetivos. [1]
Causas
La pérdida auditiva neurosensorial puede ser genética o adquirida (es decir, como consecuencia de una enfermedad, ruido, trauma, etc.). Las personas pueden tener pérdida auditiva desde el nacimiento ( congénita ) o la pérdida auditiva puede aparecer más tarde. Muchos casos están relacionados con la vejez (relacionados con la edad). [ cita requerida ]
Genético
La pérdida de audición puede ser hereditaria. Se han implicado más de 40 genes en la causa de la sordera. [2] Existen 300 síndromes relacionados con la pérdida de audición, y cada uno de ellos puede tener genes causantes. [ cita requerida ]
Las mutaciones genéticas recesivas , dominantes , ligadas al cromosoma X o mitocondriales pueden afectar la estructura o el metabolismo del oído interno. Algunas pueden ser mutaciones puntuales únicas , mientras que otras se deben a anomalías cromosómicas . Algunas causas genéticas dan lugar a una pérdida auditiva de aparición tardía. Las mutaciones mitocondriales pueden causar pérdida auditiva neurosensorial iem1555A>G, lo que hace que el individuo sea sensible a los efectos ototóxicos de los antibióticos aminoglucósidos .
- La causa más común de pérdida auditiva congénita genética recesiva en los países desarrollados es la sordera DFNB1 , también conocida como sordera relacionada con conexina 26 o sordera relacionada con GJB2 .
- Las formas sindrómicas más comunes de pérdida auditiva incluyen el síndrome de Stickler (dominante) y el síndrome de Waardenburg , y el síndrome de Pendred (recesivo) y el síndrome de Usher .
- Las mutaciones mitocondriales que causan sordera son raras: las mutaciones MT-TL1 causan MIDD (sordera y diabetes hereditarias maternas) y otras afecciones que pueden incluir la sordera como parte del cuadro.
- El gen TMPRSS3 se identificó por su asociación con la sordera autosómica recesiva tanto congénita como de inicio en la infancia. Este gen se expresa en las cócleas fetales y en muchos otros tejidos, y se cree que está involucrado en el desarrollo y mantenimiento del oído interno o el contenido de la perilinfa y la endolinfa . También se identificó como un gen asociado a tumores que se sobreexpresa en tumores ováricos .
- Enfermedad de Charcot-Marie-Tooth [3]: trastorno neurológico hereditario de aparición tardía que puede afectar los oídos y otros órganos. La pérdida auditiva en esta afección suele ser una causa neural de pérdida auditiva, el trastorno del espectro de la neuropatía auditiva (ANSD).
- El síndrome de Muckle-Wells , un trastorno autoinflamatorio hereditario poco común , puede provocar pérdida de audición.
- Enfermedad autoinmune : aunque probablemente sea poco frecuente, es posible que los procesos autoinmunes afecten específicamente a la cóclea, sin que los síntomas afecten a otros órganos. La granulomatosis con poliangeítis , una enfermedad autoinmune, puede precipitar la pérdida de audición.
Congénito
- Infecciones: [ cita requerida ]
- El síndrome de rubéola congénita (SRC) es el resultado de la transmisión transplacentaria del virus de la rubéola durante el embarazo. El SRC se ha controlado mediante la vacunación universal ( vacuna MMR o MMRV ).
- La infección por citomegalovirus (CMV) es la causa más común de pérdida auditiva neurosensorial progresiva en niños. Se trata de una infección viral común que se contrae por contacto con fluidos corporales infectados, como la saliva o la orina, y se transmite fácilmente en las guarderías y, por lo tanto, de los niños pequeños a las futuras madres. La infección por CMV durante el embarazo puede afectar al feto en desarrollo y provocar dificultades de aprendizaje, así como pérdida auditiva.
- La toxoplasmosis , una enfermedad parasitaria que afecta al 23% de la población de Estados Unidos, puede causar sordera neurosensorial al feto en el útero.
- Nervios auditivos hipoplásicos o anomalías de la cóclea. El desarrollo anormal del oído interno puede ocurrir en algunos síndromes genéticos como el síndrome LAMM (aplasia laberíntica, microtia y microdoncia), el síndrome de Pendred , el síndrome branquio-oto-renal y el síndrome CHARGE.
- Deficiencia de GATA2 , una agrupación de varios trastornos causados por un defecto común, a saber, mutaciones inactivantes familiares o esporádicas en uno de los dos genes GATA2 parentales . Estas mutaciones autosómicas dominantes causan una reducción, es decir, una haploinsuficiencia , en los niveles celulares del producto del gen, GATA2 . La proteína GATA2 es un factor de transcripción crítico para el desarrollo embrionario , el mantenimiento y la funcionalidad de las células madre formadoras de sangre , linfáticas y de otros tejidos . Como consecuencia de estas mutaciones, los niveles celulares de GATA2 son deficientes y los individuos desarrollan con el tiempo trastornos hematológicos, inmunológicos, linfáticos y/o de otro tipo. Se propone que las anomalías inducidas por la deficiencia de GATA2 en el sistema linfático son responsables de una falla en la generación del espacio perilinfático alrededor de los canales semicirculares del oído interno , que a su vez subyace al desarrollo de la pérdida auditiva neurosensorial. [4] [5]
Presbiacusia
La pérdida progresiva de la agudeza o sensibilidad auditiva relacionada con la edad puede comenzar a los 18 años, afectando principalmente a las frecuencias altas, y a los hombres más que a las mujeres. [6] Estas pérdidas pueden no hacerse evidentes hasta mucho más tarde en la vida. La presbiacusia es, con diferencia, la causa principal de pérdida auditiva neurosensorial en las sociedades industrializadas. Un estudio realizado en Sudán, con una población libre de exposición a ruidos fuertes, encontró significativamente menos casos de pérdida auditiva en comparación con los casos de la misma edad de un país industrializado. [7] Hallazgos similares fueron reportados por un estudio realizado en una población de la Isla de Pascua, que informó una peor audición entre los que pasaron tiempo en países industrializados en comparación con los que nunca salieron de la isla. [8] Los investigadores han argumentado que otros factores además de las diferencias en la exposición al ruido, como la composición genética, también podrían haber contribuido a los hallazgos. [9] La pérdida auditiva que empeora con la edad pero es causada por factores distintos del envejecimiento normal, como la pérdida auditiva inducida por ruido, no es presbiacusia, aunque puede ser difícil diferenciar los efectos individuales de múltiples causas de pérdida auditiva. Una de cada tres personas tiene una pérdida auditiva significativa a los 65 años; a los 75, una de cada dos. La pérdida auditiva relacionada con la edad no es prevenible ni reversible.
Ruido
La mayoría de las personas que viven en la sociedad moderna tienen algún grado de pérdida auditiva neurosensorial progresiva (es decir, permanente) inducida por ruido (NIHL, por sus siglas en inglés) que resulta de la sobrecarga y el daño del aparato sensorial o neural de la audición en el oído interno. [ cita requerida ] La NIHL es típicamente una caída o muesca centrada en 4000 Hz. Tanto la intensidad (SPL) como la duración de la exposición, y la exposición repetida a niveles peligrosos de ruido contribuyen al daño coclear que resulta en pérdida auditiva. Cuanto más fuerte sea el ruido, más corta será la cantidad segura de exposición. La NIHL puede ser permanente o temporal, llamada cambio de umbral. Los niveles peligrosos de ruido pueden ser tan bajos como 70 dB (aproximadamente el doble de fuerte que una conversación normal) si hay una exposición prolongada (24 horas) o continua. 125 dB (un concierto de rock fuerte es ~120 dB) es el nivel de dolor; los sonidos por encima de este nivel causan daño auditivo instantáneo y permanente. [ cita requerida ]
El ruido y el envejecimiento son las principales causas de la presbiacusia , o pérdida de audición relacionada con la edad, el tipo más común de pérdida de audición en la sociedad industrial. [10] [ cita requerida ] Los peligros de la exposición al ruido ambiental y ocupacional son ampliamente reconocidos. Numerosas organizaciones nacionales e internacionales han establecido estándares para niveles seguros de exposición al ruido en la industria, el medio ambiente, el ejército, el transporte, la agricultura, la minería y otras áreas. [Nota 1] La intensidad del sonido o el nivel de presión sonora (SPL) se mide en decibelios (dB). Para referencia:
| Nivel db | Ejemplo |
|---|---|
| 45dB | Nivel de ruido ambiental en el hogar |
| 60dB | Oficina tranquila |
| 60–65 dB | Conversación normal |
| 70dB | Ruido de la calle de la ciudad a 25' [ aclaración necesaria ] o audio de TV promedio |
| 80dB | Oficina ruidosa |
| 95–104 dB | Pista de baile de discoteca |
| 120dB | Cerca de un trueno o de un concierto de rock ruidoso |
| 150–160 dB | Disparo de una pistola portátil |
Un aumento de 6 dB representa una duplicación del nivel de presión sonora (SPL), o energía de la onda sonora, y por lo tanto su propensión a causar daño auditivo. Debido a que los oídos humanos escuchan de manera logarítmica, no lineal, se necesita un aumento de 10 dB para producir un sonido que se percibe como el doble de fuerte. El daño auditivo debido al ruido es proporcional a la intensidad del sonido, no a la sonoridad percibida, por lo que es engañoso confiar en la percepción subjetiva de la sonoridad como una indicación del riesgo para la audición, es decir, puede subestimar significativamente el peligro.
Si bien las normas difieren moderadamente en cuanto a los niveles de intensidad y duración de la exposición que se consideran seguros, se pueden derivar algunas pautas. [Nota 2]
La cantidad segura de exposición se reduce en un factor de 2 por cada aumento de la tasa de cambio (3 dB para la norma NIOSH o 5 dB para la norma OSHA ) en el nivel de presión sonora. Por ejemplo, la cantidad segura de exposición diaria a 85 dB (90 dB para OSHA) es de 8 horas, mientras que la exposición segura a 94 dB(A) (nivel de discoteca) es de solo 1 hora. El traumatismo por ruido también puede causar una pérdida auditiva reversible, llamada cambio temporal del umbral. Esto suele ocurrir en personas que están expuestas a disparos o petardos y escuchan zumbidos en los oídos después del evento ( tinnitus ).
- Ruido ambiental : las poblaciones que viven cerca de aeropuertos, terminales de trenes y estaciones de tren, autopistas y áreas industriales están expuestas a niveles de ruido que suelen estar entre 65 y 75 dBA. Si los estilos de vida incluyen condiciones significativas al aire libre o con ventanas abiertas, estas exposiciones con el tiempo pueden degradar la audición. El Departamento de Vivienda y Desarrollo Urbano de los EE. UU. establece estándares para el impacto del ruido en zonas de construcción residencial y comercial. Los estándares de ruido del HUD se pueden encontrar en 24 CFR Parte 51, Subparte B. El ruido ambiental por encima de 65 dB define un área impactada por el ruido.
- Dispositivos electrónicos de audio personales : los equipos de audio personales, como los iPods (que suelen alcanzar 115 decibeles o más), pueden producir un sonido lo suficientemente potente como para causar una pérdida auditiva no auditiva significativa. [11]
- Trauma acústico: la exposición a un único evento de ruido extremadamente fuerte (como explosiones) también puede causar pérdida temporal o permanente de la audición. Una fuente típica de trauma acústico es un concierto de música a un volumen demasiado alto.
- Ruido en el lugar de trabajo: Las normas OSHA 1910.95 Exposición al ruido ocupacional en la industria general y 1926.52 Exposición al ruido ocupacional en la industria de la construcción identifican el nivel de 90 dB(A) para una exposición de 8 horas como el nivel necesario para proteger a los trabajadores de la pérdida auditiva.
Enfermedad o trastorno
- Inflamatorio
- Laberintitis supurativa u otitis interna (inflamación del oído interno)
- Diabetes mellitus Un estudio reciente descubrió que la pérdida de audición es dos veces más común en personas con diabetes que en aquellas que no padecen la enfermedad. Además, de los 86 millones de adultos en los EE. UU. que tienen prediabetes, la tasa de pérdida de audición es un 30 por ciento más alta que en aquellos con glucosa en sangre normal. No se ha establecido cómo se relaciona la diabetes con la pérdida de audición. Es posible que los altos niveles de glucosa en sangre asociados con la diabetes causen daño a los pequeños vasos sanguíneos en el oído interno, de manera similar a la forma en que la diabetes puede dañar los ojos y los riñones. Estudios similares han demostrado un posible vínculo entre esa pérdida de audición y la neuropatía (daño a los nervios).
- Tumor
- Tumor del ángulo pontocerebeloso (unión de la protuberancia y el cerebelo ): el ángulo pontocerebeloso es el sitio de salida tanto del nervio facial (CN7) como del nervio vestibulococlear (CN8). Los pacientes con estos tumores suelen presentar signos y síntomas correspondientes a la compresión de ambos nervios.
- Neurinoma acústico (schwannoma vestibular): neoplasia benigna de células de Schwann que afecta el nervio vestibulococlear
- Meningioma : tumor benigno de la piamadre y la aracnoides
- Tumor del ángulo pontocerebeloso (unión de la protuberancia y el cerebelo ): el ángulo pontocerebeloso es el sitio de salida tanto del nervio facial (CN7) como del nervio vestibulococlear (CN8). Los pacientes con estos tumores suelen presentar signos y síntomas correspondientes a la compresión de ambos nervios.
- Enfermedad de Ménière : causa pérdida auditiva neurosensorial en el rango de frecuencias bajas (125 Hz a 1000 Hz). La enfermedad de Ménière se caracteriza por ataques repentinos de vértigo que duran minutos u horas, precedidos por tinnitus , sensación de plenitud auditiva y pérdida auditiva fluctuante. Es relativamente rara y suele sobrediagnosticarse.
- La meningitis bacteriana , por ejemplo, la causada por neumococo, meningococo o Haemophilus influenzae, puede dañar la cóclea . La pérdida de audición es una de las secuelas más comunes de la meningitis bacteriana. Se ha estimado que el 30 % de los casos de meningitis bacteriana resultan en una pérdida auditiva de leve a profunda. Los niños son los que corren mayor riesgo: el setenta por ciento de todas las meningitis bacterianas se producen en niños pequeños menores de cinco años.
- Viral
- Los pacientes con SIDA y ARC frecuentemente experimentan anomalías del sistema auditivo.
- Las paperas (parotiditis epidémica) pueden provocar una pérdida auditiva neurosensorial profunda (90 dB o más), unilateral (un oído) o bilateral (ambos oídos).
- El sarampión puede provocar daño al nervio auditivo , pero más comúnmente produce una pérdida auditiva mixta (sensorial más conductiva) y puede ser bilateral.
- Síndrome de Ramsay Hunt tipo II (herpes zóster ótico)
- Bacteriano
- La sífilis se transmite comúnmente de mujeres embarazadas a sus fetos, y aproximadamente un tercio de los niños infectados eventualmente quedarán sordos.
Fármacos y productos químicos ototóxicos y neurotóxicos
Algunos medicamentos de venta libre y con receta, así como ciertas sustancias químicas industriales, son ototóxicas. La exposición a ellas puede provocar pérdida auditiva temporal o permanente.
Algunos medicamentos causan daños irreversibles en el oído, y por ello su uso está limitado. El grupo más importante es el de los aminoglucósidos (miembro principal, la gentamicina ). Una mutación mitocondrial rara, m.1555A>G, puede aumentar la susceptibilidad de un individuo al efecto ototóxico de los aminoglucósidos. Se sabe que el abuso a largo plazo de hidrocodona (Vicodin) causa pérdida auditiva neurosensorial de rápida progresión, generalmente sin síntomas vestibulares. También se sabe que el metotrexato , un agente quimioterapéutico, causa pérdida auditiva. En la mayoría de los casos, la pérdida auditiva no se recupera cuando se suspende el medicamento. Paradójicamente, el metotrexato también se usa en el tratamiento de la pérdida auditiva inflamatoria inducida por el sistema inmunitario. [ cita requerida ]
Otros medicamentos pueden degradar reversiblemente la audición. Entre ellos se encuentran los diuréticos de asa , el sildenafil (Viagra), las dosis altas o sostenidas de AINE ( aspirina , ibuprofeno , naproxeno y varios medicamentos recetados: celecoxib , etc.), la quinina y los antibióticos macrólidos ( eritromicina , etc.). Los agentes citotóxicos como el carboplatino, que se utilizan para tratar las neoplasias malignas, pueden dar lugar a una pérdida auditiva neurosensorial dependiente de la dosis, al igual que los medicamentos como la desferrioxamina, que se utilizan para trastornos hematológicos como la talasemia; los pacientes a los que se les prescriben estos medicamentos deben tener la audición monitoreada. [ cita requerida ]
La exposición prolongada o repetida a sustancias químicas ototóxicas en el entorno laboral o en el exterior también puede provocar pérdida auditiva neurosensorial. Algunas de estas sustancias químicas son:
- Nitrito de butilo : sustancia química utilizada con fines recreativos conocida como ' poppers '
- disulfuro de carbono : un disolvente utilizado como componente básico en muchas reacciones orgánicas
- estireno , un precursor químico industrial del poliestireno , un plástico
- Monóxido de carbono , un gas venenoso resultante de una combustión incompleta.
- metales pesados: estaño , plomo , manganeso , mercurio
- Hexano , un disolvente industrial y uno de los componentes importantes de la gasolina.
- etilbenceno , un disolvente industrial utilizado en la producción de estireno
- Tolueno y xileno , disolventes petroquímicos altamente tóxicos. El tolueno es un componente de la gasolina de alto octanaje; el xileno se utiliza en la producción de fibras y resinas de poliéster.
- Tricloroetileno , un disolvente desengrasante industrial
- Plaguicidas organofosforados
Traumatismo craneal
Puede haber daño en el oído mismo o en las vías auditivas centrales que procesan la información transmitida por los oídos. Las personas que sufren una lesión en la cabeza son susceptibles a la pérdida de audición o tinnitus, ya sea temporal o permanente. Los deportes de contacto como el fútbol americano (NFL de EE. UU.), el hockey y el cricket tienen una incidencia notable de lesiones en la cabeza (conmociones cerebrales). En una encuesta realizada a jugadores retirados de la NFL, todos los cuales informaron haber sufrido una o más conmociones cerebrales durante sus carreras como jugadores, el 25 % tenía pérdida de audición y el 50 % tenía tinnitus. [ cita requerida ]
Condiciones perinatales
Son mucho más frecuentes en los bebés prematuros, en particular en aquellos que pesan menos de 1500 g al nacer. El nacimiento prematuro puede estar asociado a problemas que resultan en pérdida auditiva neurosensorial, como anoxia o hipoxia (niveles bajos de oxígeno), ictericia, hemorragias intracraneales y meningitis. Se ha informado que el síndrome de alcoholismo fetal causa pérdida auditiva en hasta el 64% de los bebés nacidos de madres alcohólicas , debido al efecto ototóxico en el feto en desarrollo, además de la desnutrición durante el embarazo debido al consumo excesivo de alcohol .
Deficiencia de yodo / Hipotiroidismo
La deficiencia de yodo y el hipotiroidismo endémico están asociados con la pérdida de audición. [12] Si una madre embarazada tiene una ingesta insuficiente de yodo durante el embarazo, esto afecta el desarrollo del oído interno del feto y provoca sordera neurosensorial. Esto ocurre en ciertas áreas del mundo, como el Himalaya, donde el yodo es deficiente en el suelo y, por lo tanto, en la dieta. En estas áreas hay una alta incidencia de bocio endémico. Esta causa de sordera se previene añadiendo yodo a la sal.
Accidente cerebrovascular
Un accidente cerebrovascular en una región que afecta la función auditiva, como un infarto de la circulación posterior, se ha asociado con sordera.
Fisiopatología
La pérdida auditiva sensorial es causada por una estructura o función anormal de las células pilosas del órgano de Corti en la cóclea . [ disputado – discutir ] Las deficiencias auditivas neurales son consecuencia de un daño al octavo nervio craneal (el nervio vestibulococlear ) o a los tractos auditivos del tronco encefálico . Si se ven afectados los niveles superiores del tracto auditivo, esto se conoce como sordera central. La sordera central puede presentarse como sordera neurosensorial, pero debe distinguirse a partir de la historia y las pruebas audiológicas.
Regiones muertas cocleares en la pérdida auditiva sensorial
La pérdida de audición puede estar asociada a un daño en las células pilosas de la cóclea. A veces puede haber una pérdida completa de la función de las células pilosas internas (CCI) en una determinada región de la cóclea; esto se denomina "región muerta". La región se puede definir en términos del rango de frecuencias características (FC) de las CCI y/o neuronas inmediatamente adyacentes a la región muerta.
Células ciliadas cocleares

Las células pilosas externas (CCE) contribuyen a la estructura del órgano de Corti , que está situado entre la membrana basilar y la membrana tectorial dentro de la cóclea (véase la figura 3). El túnel de Corti, que atraviesa el órgano de Corti, divide las CCE y las células pilosas internas (CCI). Las CCE están conectadas a las células laminares reticulares y a las células de Deiters. Hay aproximadamente doce mil CCE en cada oído humano, y están dispuestas en hasta cinco filas. Cada CCE tiene pequeños mechones de "pelos", o cilios, en su superficie superior, conocidos como estereocilios , y estos también están dispuestos en filas que se gradúan en altura. Hay aproximadamente 140 estereocilios en cada CCE. [13]
El papel fundamental de las células ciliadas del oído medio y de las células ciliadas del oído interno es funcionar como receptores sensoriales . La función principal de las células ciliadas del oído interno es transmitir información sonora a través de neuronas aferentes . Lo hacen transduciendo movimientos o señales mecánicas en actividad neuronal. Cuando se estimulan, los estereocilios de las células ciliadas del oído interno se mueven, lo que provoca que un flujo de corriente eléctrica pase a través de las células ciliadas. Esta corriente eléctrica crea potenciales de acción dentro de las neuronas aferentes conectadas.
Las células OHC se diferencian en que contribuyen al mecanismo activo de la cóclea, ya que reciben señales mecánicas o vibraciones a lo largo de la membrana basilar y las transforman en señales electroquímicas. Los estereocilios que se encuentran en las células OHC están en contacto con la membrana tectorial, por lo que cuando la membrana basilar se mueve debido a las vibraciones, los estereocilios se doblan. La dirección en la que se doblan determina la frecuencia de disparo de las neuronas auditivas conectadas a las células OHC. [14]
La curvatura de los estereocilios hacia el cuerpo basal de la célula pilosa externa provoca la excitación de la célula pilosa. Por lo tanto, se produce un aumento en la tasa de disparo de las neuronas auditivas conectadas a la célula pilosa. Por otro lado, la curvatura de los estereocilios alejándose del cuerpo basal de la célula pilosa externa provoca la inhibición de la célula pilosa. Por lo tanto, se produce una disminución en la tasa de disparo de las neuronas auditivas conectadas a la célula pilosa. Las células pilosas externas son únicas en el sentido de que pueden contraerse y expandirse (electromovilidad). Por lo tanto, en respuesta a los estímulos eléctricos proporcionados por el suministro nervioso eferente, pueden alterar su longitud, forma y rigidez. Estos cambios influyen en la respuesta de la membrana basilar al sonido. [13] [14] Por lo tanto, está claro que las células pilosas externas desempeñan un papel importante en los procesos activos de la cóclea. [13] La función principal del mecanismo activo es afinar la membrana basilar y proporcionarle una alta sensibilidad a los sonidos suaves. El mecanismo activo depende de que la cóclea esté en buenas condiciones fisiológicas. Sin embargo, la cóclea es muy susceptible a sufrir daños. [14]
Daño a las células ciliadas
La pérdida auditiva neurosensorial es causada más comúnmente por daño a las células ciliadas del oído medio y las células ciliadas internas. [ disputado – discutir ] Hay dos métodos por los cuales pueden dañarse. En primer lugar, toda la célula ciliada puede morir. En segundo lugar, los estereocilios pueden distorsionarse o destruirse. El daño a la cóclea puede ocurrir de varias maneras, por ejemplo, por infección viral, exposición a sustancias químicas ototóxicas y exposición a ruidos intensos. El daño a las células ciliadas del oído medio da como resultado un mecanismo activo menos efectivo o puede que no funcione en absoluto. Las células ciliadas del oído medio contribuyen a proporcionar una alta sensibilidad a los sonidos suaves en un rango específico de frecuencias (aproximadamente 2-4 kHz). Por lo tanto, el daño a las células ciliadas del oído medio da como resultado la reducción de la sensibilidad de la membrana basilar a los sonidos débiles. Por lo tanto, se requiere la amplificación de estos sonidos para que la membrana basilar responda de manera eficiente. Las células ciliadas internas son menos susceptibles a daños en comparación con las células ciliadas del oído medio. Sin embargo, si se dañan, esto dará como resultado una pérdida general de sensibilidad. [14]
Curvas de sintonización neuronal
Selectividad de frecuencia
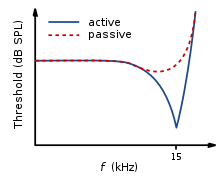
La onda que viaja a lo largo de la membrana basilar alcanza su pico en diferentes lugares a lo largo de ella, dependiendo de si el sonido es de baja o alta frecuencia. Debido a la masa y rigidez de la membrana basilar, las ondas de baja frecuencia alcanzan su pico en el ápice, mientras que los sonidos de alta frecuencia alcanzan su pico en el extremo basal de la cóclea. [13] Por lo tanto, cada posición a lo largo de la membrana basilar está finamente sintonizada a una frecuencia particular. Estas frecuencias específicamente sintonizadas se denominan frecuencias características (CF). [14]
Si un sonido que entra en el oído se desvía de la frecuencia característica, la fuerza de respuesta de la membrana basilar disminuirá progresivamente. El ajuste fino de la membrana basilar se crea mediante la entrada de dos mecanismos separados. El primer mecanismo es un mecanismo pasivo lineal, que depende de la estructura mecánica de la membrana basilar y sus estructuras circundantes. El segundo mecanismo es un mecanismo activo no lineal, que depende principalmente del funcionamiento de las células cócleas occipitales y también del estado fisiológico general de la propia cóclea. La base y el ápice de la membrana basilar difieren en rigidez y anchura, lo que hace que la membrana basilar responda a frecuencias variables de forma diferente a lo largo de su longitud. La base de la membrana basilar es estrecha y rígida, lo que hace que responda mejor a los sonidos de alta frecuencia. El ápice de la membrana basilar es más ancho y mucho menos rígido en comparación con la base, lo que hace que responda mejor a las frecuencias bajas. [14]
Esta selectividad a determinadas frecuencias se puede ilustrar mediante curvas de sintonización neuronal. Éstas demuestran las frecuencias a las que responde una fibra, mostrando los niveles de umbral (dB SPL) de las fibras del nervio auditivo en función de diferentes frecuencias. Esto demuestra que las fibras del nervio auditivo responden mejor y, por lo tanto, tienen mejores umbrales en la frecuencia característica de la fibra y las frecuencias que la rodean inmediatamente. Se dice que la membrana basilar está "afinada nítidamente" debido a la curva en forma de V pronunciada, con su "punta" centrada en la frecuencia característica de las fibras auditivas. Esta forma muestra a qué pocas frecuencias responde una fibra. Si tuviera una forma de "V" más amplia, respondería a más frecuencias (véase la Figura 4). [13]
Pérdida auditiva IHC vs OHC


Una curva de ajuste neuronal normal se caracteriza por una "cola" de baja frecuencia ampliamente ajustada, con una "punta" de frecuencia media finamente ajustada. Sin embargo, cuando hay daño parcial o total en las células OHC, pero con células IHC intactas, la curva de ajuste resultante mostraría la eliminación de la sensibilidad en los sonidos suaves. Es decir, donde la curva de ajuste neuronal normalmente sería más sensible (en la "punta") (ver Figura 5). [14]
Cuando tanto los OHC como los IHC están dañados, la curva de ajuste neuronal resultante mostraría la eliminación de la sensibilidad en la "punta". Sin embargo, debido al daño en el IHC, toda la curva de ajuste se eleva, lo que produce una pérdida de sensibilidad en todas las frecuencias (véase la Figura 6). Solo es necesario que la primera fila de OHC esté dañada para que se produzca la eliminación de la "punta" finamente ajustada. Esto respalda la idea de que la incidencia del daño en los OHC y, por lo tanto, la pérdida de sensibilidad a los sonidos suaves, ocurre con mayor frecuencia que la pérdida en el IHC. [14]
Cuando las células IHC o parte de la membrana basilar se dañan o destruyen, de modo que ya no funcionan como transductores, el resultado es una "región muerta". Las regiones muertas se pueden definir en términos de las frecuencias características de la IHC, relacionadas con el lugar específico a lo largo de la membrana basilar donde se encuentra la región muerta. Suponiendo que no ha habido ningún cambio en las frecuencias características relacionadas con ciertas regiones de la membrana basilar, debido al daño de las células OHC. Esto ocurre a menudo con el daño de la IHC. Las regiones muertas también se pueden definir por el lugar anatómico de la IHC que no funciona (como una "región muerta apical"), o por las frecuencias características de la IHC adyacente a la región muerta. [15]
Audiometría de la región muerta
Audiometría de tonos puros (PTA)
Las regiones muertas afectan los resultados audiométricos, pero quizás no de la manera esperada. Por ejemplo, se puede esperar que no se obtengan umbrales en las frecuencias dentro de la región muerta, sino en las frecuencias adyacentes a la región muerta. Por lo tanto, suponiendo que exista una audición normal alrededor de la región muerta, se produciría un audiograma con una pendiente drásticamente pronunciada entre la frecuencia en la que se obtiene un umbral y la frecuencia en la que no se puede obtener un umbral debido a la región muerta. [15]


Sin embargo, parece que este no es el caso. Las regiones muertas no se pueden encontrar claramente a través de audiogramas PTA . Esto puede deberse a que, aunque las neuronas que inervan la región muerta, no pueden reaccionar a la vibración en su frecuencia característica. Si la vibración de la membrana basilar es lo suficientemente grande, las neuronas sintonizadas a diferentes frecuencias características, como las adyacentes a la región muerta, se estimularán debido a la propagación de la excitación. Por lo tanto, se obtendrá una respuesta del paciente en la frecuencia de prueba. Esto se conoce como "escucha fuera de lugar", y también se conoce como "escucha fuera de frecuencia". Esto conducirá a que se encuentre un umbral falso. Por lo tanto, parece que una persona tiene mejor audición de la que realmente tiene, lo que resulta en que se pase por alto una región muerta. Por lo tanto, utilizando PTA solo, es imposible identificar la extensión de una región muerta (ver Figura 7 y 8). [15]
En consecuencia, ¿cuánto se ve afectado el umbral audiométrico por un tono cuya frecuencia se encuentra dentro de una región muerta? Esto depende de la ubicación de la región muerta. Los umbrales en regiones muertas de baja frecuencia son más imprecisos que aquellos en regiones muertas de frecuencia más alta. Esto se ha atribuido al hecho de que la excitación debida a la vibración de la membrana basilar se propaga hacia arriba desde las regiones apicales de la membrana basilar, más de lo que se propaga hacia abajo desde las regiones basales de frecuencia más alta de la cóclea. Este patrón de propagación de la excitación es similar al fenómeno de "propagación ascendente del enmascaramiento". Si el tono es lo suficientemente fuerte como para producir suficiente excitación en el área de la cóclea que funciona normalmente, de modo que esté por encima del umbral de esa área, el tono se detectará debido a la escucha fuera de frecuencia, lo que da como resultado un umbral engañoso. [15]
Para ayudar a superar el problema de que la PTA produzca umbrales inexactos dentro de las regiones muertas, se puede utilizar el enmascaramiento del área más allá de la región muerta que se está estimulando. Esto significa que el umbral del área de respuesta se eleva lo suficiente, de modo que no puede detectar la propagación de la excitación del tono. Esta técnica ha llevado a la sugerencia de que una región muerta de baja frecuencia puede estar relacionada con una pérdida de 40-50 dB. [16] [17] Sin embargo, como uno de los objetivos de la PTA es determinar si hay o no una región muerta, puede ser difícil evaluar qué frecuencias enmascarar sin el uso de otras pruebas. [15]
Según las investigaciones, se ha sugerido que una región muerta de baja frecuencia puede producir una pérdida relativamente plana o una pérdida con una pendiente muy gradual hacia las frecuencias más altas, ya que la región muerta será menos detectable debido a la propagación ascendente de la excitación. Mientras que, puede haber una pérdida con una pendiente más pronunciada a frecuencias altas para una región muerta de alta frecuencia. Aunque es probable que la pendiente represente la propagación descendente menos pronunciada de la excitación, en lugar de umbrales precisos para aquellas frecuencias con células ciliadas que no funcionan. Las regiones muertas de frecuencia media, con un rango pequeño, parecen tener menos efecto en la capacidad del paciente para escuchar en la vida cotidiana y pueden producir una muesca en los umbrales de PTA. [15] Aunque está claro que PTA no es la mejor prueba para identificar una región muerta. [18]
Pruebas de curvas de sintonización psicoacústica (PTC) y de ruido de ecualización de umbral (TEN)
Es posible que esta sección contenga predicciones sin fuentes , material especulativo o relatos de eventos que podrían no ocurrir . La información debe ser verificable y basarse en fuentes publicadas confiables . ( Noviembre de 2015 ) |

Aunque todavía hay cierto debate sobre la fiabilidad de estas pruebas, [19] se ha sugerido [ palabras ambiguas ] que las curvas de sintonización psicoacústica (PTC) y los resultados del ruido de ecualización de umbral (TEN) pueden ser útiles para detectar regiones muertas, en lugar de PTA. Las PTC son similares a las curvas de sintonización neuronal. Ilustran el nivel de un tono enmascarador (dB SPL) en el umbral, como una función de la desviación de la frecuencia central (Hz). [13] Se miden presentando un tono puro de baja intensidad fijo mientras se presenta también un enmascarador de banda estrecha, con una frecuencia central variable. El nivel del enmascarador se varía, de modo que el nivel de enmascarador necesario para enmascarar solo la señal de prueba se encuentra para el enmascarador en cada frecuencia central. La punta de la PTC es donde el nivel de enmascarador necesario para enmascarar solo la señal de prueba es el más bajo. Para las personas con audición normal, este es el momento en que la frecuencia central del enmascarador está más cerca de la frecuencia de la señal de prueba (consulte la Figura 9). [18]
En el caso de regiones muertas, cuando la señal de prueba se encuentra dentro de los límites de una región muerta, la punta del PTC se desplazará al borde de la región muerta, al área que todavía está funcionando y detectando la propagación de la excitación de la señal. En el caso de una región muerta de baja frecuencia, la punta se desplaza hacia arriba indicando una región muerta de baja frecuencia que comienza en la punta de la curva. Para una región muerta de alta frecuencia, la punta se desplaza hacia abajo desde la frecuencia de la señal hasta el área funcional debajo de la región muerta. [18] Sin embargo, el método tradicional de obtener PTC no es práctico para el uso clínico, y se ha argumentado [ palabras ambiguas ] que los TEN no son lo suficientemente precisos. [18] [19] Se ha desarrollado un método rápido para encontrar PTC y puede proporcionar la solución. Sin embargo, se requiere más investigación para validar este método, antes de que pueda aceptarse clínicamente.
Consecuencias perceptivas de una región muerta
Las configuraciones de audiogramas no son buenos indicadores de cómo una región muerta afectará funcionalmente a una persona, principalmente debido a diferencias individuales. [14] Por ejemplo, un audiograma inclinado a menudo está presente con una región muerta, debido a la propagación de la excitación. Sin embargo, el individuo puede verse afectado de manera diferente a alguien con un audiograma inclinado correspondiente causado por daño parcial a las células ciliadas en lugar de una región muerta. Percibirán los sonidos de manera diferente, pero el audiograma sugiere que tienen el mismo grado de pérdida. Huss y Moore investigaron cómo los pacientes con discapacidad auditiva perciben los tonos puros y descubrieron que perciben los tonos como ruidosos y distorsionados, más (en promedio) que una persona sin discapacidad auditiva. Sin embargo, también descubrieron que la percepción de los tonos como ruido no estaba directamente relacionada con las frecuencias dentro de las regiones muertas y, por lo tanto, no era un indicador de una región muerta. Por lo tanto, esto sugiere que los audiogramas y su mala representación de las regiones muertas son predictores inexactos de la percepción de un paciente de la calidad del tono puro. [20]
Las investigaciones de Kluk y Moore han demostrado que las regiones muertas también pueden afectar la percepción del paciente de frecuencias más allá de ellas. Se observa una mejora en la capacidad de distinguir entre tonos que difieren muy ligeramente en frecuencia, en regiones que se encuentran justo más allá de las regiones muertas, en comparación con tonos más alejados. Una explicación de esto puede ser que se ha producido un remapeo cortical, por el cual las neuronas que normalmente serían estimuladas por la región muerta, han sido reasignadas para responder a áreas funcionales cercanas a ella. Esto conduce a una sobrerrepresentación de estas áreas, lo que resulta en una mayor sensibilidad perceptiva a pequeñas diferencias de frecuencia en los tonos. [21]
Patología del nervio vestibulococlear
- deformidad congénita del conducto auditivo interno,
- Lesiones neoplásicas y pseudoneoplásicas, con especial énfasis en el schwannoma del octavo nervio craneal (neurinoma acústico),
- patología no neoplásica del conducto auditivo interno/ángulo pontocerebeloso, incluidas las asas vasculares,
Diagnóstico
Historia del caso
Antes del examen, una historia clínica proporciona orientación sobre el contexto de la pérdida auditiva.
- preocupación principal
- Información sobre el embarazo y el parto
- Historial médico
- Historial de desarrollo
- Historia familiar
Otoscopia
Examen directo del canal externo y la membrana timpánica (tímpano) con un otoscopio , un dispositivo médico que se inserta en el canal auditivo y que utiliza luz para examinar el estado del oído externo y la membrana timpánica, y el oído medio a través de la membrana semitranslúcida.
Prueba diferencial
Las pruebas diferenciales son más útiles cuando hay pérdida auditiva unilateral y permiten distinguir entre pérdida conductiva y neurosensorial. Se realizan con un diapasón de baja frecuencia, generalmente de 512 Hz, y mediciones de contraste de la transmisión del sonido por vía aérea y ósea.
- La prueba de Weber , en la que se toca un diapasón en la línea media de la frente, se localiza en el oído normal en personas con pérdida auditiva neurosensorial unilateral.
- La prueba de Rinne , que evalúa la conducción aérea frente a la conducción ósea, es positiva porque tanto la conducción ósea como la aérea se reducen por igual.
- Variantes menos comunes de la prueba de Rinne: Bing y Schwabach.
- prueba de conducción ósea absoluta (ABC).
Tabla 1. Tabla que compara la pérdida auditiva neurosensorial con la conductiva.
| Criterios | Pérdida auditiva neurosensorial | Pérdida auditiva conductiva |
| Sitio anatómico | Oído interno , nervio craneal VIII o centros centrales de procesamiento | Oído medio (cadena de huesecillos), membrana timpánica u oído externo |
| Prueba de Weber | El sonido se localiza en el oído normal en la hipoacusia neurosensorial unilateral | El sonido se localiza en el oído afectado (oído con pérdida conductiva) en casos unilaterales |
| Prueba de Rinne | Rinne positivo; conducción aérea > conducción ósea (tanto la conducción aérea como la ósea disminuyen por igual, pero la diferencia entre ellas no cambia). | Rinne negativo; conducción ósea > conducción aérea (hueso/espacio aéreo) |
Se requieren otras pruebas más complejas de la función auditiva para distinguir los diferentes tipos de pérdida auditiva. Los umbrales de conducción ósea pueden diferenciar la pérdida auditiva neurosensorial de la pérdida auditiva conductiva. Se necesitan otras pruebas, como las emisiones otoacústicas, los reflejos acústicos estapediales, la audiometría verbal y la audiometría de respuesta evocada para distinguir las deficiencias auditivas de procesamiento sensorial, neural y auditivo.
Timpanometría
Un timpanograma es el resultado de una prueba con un timpanómetro. Evalúa la función del oído medio y la movilidad del tímpano. Puede ayudar a identificar la pérdida auditiva conductiva debida a una enfermedad del oído medio o del tímpano, en comparación con otros tipos de pérdida auditiva, incluida la hipoacusia neurosensorial.
Audiometría
Un audiograma es el resultado de una prueba de audición. El tipo más común de prueba de audición es la audiometría de tonos puros (PTA). Grafica los umbrales de sensibilidad auditiva en una selección de frecuencias estándar entre 250 y 8000 Hz. También existe la audiometría de tonos puros de alta frecuencia que prueba frecuencias de 8000 a 20 000 Hz. La PTA se puede utilizar para diferenciar entre pérdida auditiva conductiva, pérdida auditiva neurosensorial y pérdida auditiva mixta. Una pérdida auditiva se puede describir por su grado, es decir, leve, moderada, severa o profunda, o por su forma, es decir, alta frecuencia o en pendiente, baja frecuencia o ascendente, con muescas, en forma de U o en "mordida de galleta", puntiaguda o plana.
También existen otros tipos de audiometría diseñados para evaluar la agudeza auditiva en lugar de la sensibilidad (audiometría del habla) o para evaluar la transmisión de las vías neuronales auditivas (audiometría de respuesta evocada).
Imágenes por resonancia magnética
Las exploraciones por resonancia magnética se pueden utilizar para identificar causas estructurales macroscópicas de pérdida auditiva. Se utilizan en casos de pérdida auditiva congénita, cuando los cambios en la forma del oído interno o del nervio auditivo pueden ayudar a diagnosticar la causa de la pérdida auditiva. También son útiles en casos en los que se sospecha la presencia de un tumor o para determinar el grado de daño en una pérdida auditiva causada por una infección bacteriana o una enfermedad autoinmune. La exploración no tiene ningún valor en la sordera relacionada con la edad.
Prevención
La presbiacusia es la principal causa de pérdida auditiva neurosensorial, es progresiva y no se puede prevenir. En este momento, no disponemos de terapias somáticas ni genéticas para contrarrestar la pérdida auditiva neurosensorial hereditaria. Sin embargo, otras causas de pérdida auditiva neurosensorial adquirida son en gran medida prevenibles, especialmente las causas de tipo nosocusio. Esto implicaría evitar el ruido ambiental y el ruido traumático, como los conciertos de rock y las discotecas con música alta. El uso de medidas de atenuación del ruido, como tapones para los oídos , es una alternativa, así como aprender sobre los niveles de ruido a los que uno está expuesto. Actualmente, existen varias aplicaciones precisas para medir el nivel de sonido. Reducir el tiempo de exposición también puede ayudar a controlar el riesgo de exposición a ruidos fuertes.

Tratamiento
Las modalidades de tratamiento se dividen en tres categorías: farmacológicas, quirúrgicas y de manejo. Como la hipoacusia neurosensorial es una degradación fisiológica y se considera permanente, hasta el momento no existen tratamientos aprobados ni recomendados.
Se han producido avances significativos en la identificación de los genes de la sordera humana y en la elucidación de sus mecanismos celulares, así como de su función fisiológica en ratones. [22] [23] Sin embargo, las opciones de tratamiento farmacológico son muy limitadas y no están clínicamente probadas. [24] Los tratamientos farmacéuticos que se emplean son paliativos más que curativos y están dirigidos a la causa subyacente, si se puede identificar una, para evitar un daño progresivo.
La pérdida auditiva profunda o total puede ser tratada con implantes cocleares , que estimulan directamente las terminaciones nerviosas cocleares . Un implante coclear es la implantación quirúrgica de un dispositivo médico electrónico alimentado por batería en el oído interno. A diferencia de los audífonos , que hacen que los sonidos sean más fuertes, los implantes cocleares hacen el trabajo de las partes dañadas del oído interno (cóclea) para proporcionar señales de sonido al cerebro. Estos consisten en electrodos e imanes implantados internamente y componentes externos. [25] La calidad del sonido es diferente a la audición natural, pero puede permitir al receptor reconocer mejor el habla y los sonidos ambientales. Debido al riesgo y al costo, este tipo de cirugía se reserva para casos de pérdida auditiva grave e incapacitante.
El tratamiento de la pérdida auditiva neurosensorial implica el empleo de estrategias para apoyar la audición existente, como la lectura de labios, la comunicación mejorada, etc. y la amplificación mediante audífonos . Los audífonos están específicamente ajustados a la pérdida auditiva individual para brindar el máximo beneficio.
Investigación
Productos farmacéuticos
- Vitaminas antioxidantes : los investigadores de la Universidad de Michigan informan que una combinación de altas dosis de vitaminas A, C y E, y magnesio, tomadas una hora antes de la exposición al ruido y continuadas como tratamiento una vez al día durante cinco días, fue muy eficaz para prevenir la pérdida auditiva permanente inducida por ruido en animales. [26]
- Tanakan : marca comercial de un medicamento internacional con receta que contiene extracto de Ginkgo biloba. Está clasificado como vasodilatador. Entre sus usos en investigación se encuentra el tratamiento de la sordera neurosensorial y el tinnitus, que se presume que son de origen vascular.
- Coenzima Q10 : sustancia similar a una vitamina, con propiedades antioxidantes. Se produce en el cuerpo, pero sus niveles disminuyen con la edad. [Nota 3]
- Ebselen , una molécula de fármaco sintético que imita la glutatión peroxidasa (GPx), una enzima fundamental en el oído interno que lo protege del daño causado por sonidos fuertes o ruidos [27]
Terapia génica y con células madre
La regeneración de células ciliadas mediante el uso de células madre y terapia genética aún está a años o décadas de ser clínicamente factible. [28] Sin embargo, actualmente se están realizando estudios sobre el tema, y el primer ensayo aprobado por la FDA comenzó en febrero de 2012. [29]
Pérdida auditiva neurosensorial repentina
La pérdida auditiva neurosensorial súbita (SSHL o SSNHL), comúnmente conocida como sordera súbita, se presenta como una pérdida rápida e inexplicable de la audición, generalmente en un oído, ya sea de una sola vez o en el transcurso de varios días. Nueve de cada diez personas con SSHL pierden la audición en un solo oído. Debe considerarse una emergencia médica. Retrasar el diagnóstico y el tratamiento puede hacer que el tratamiento sea menos efectivo o ineficaz.
Los expertos estiman que la SSHL afecta a una persona de cada 100 cada año, generalmente adultos de entre 40 y 50 años. La cantidad real de casos nuevos de SSHL cada año podría ser mucho mayor porque la afección a menudo no se diagnostica.
Presentación
Muchas personas se dan cuenta de que tienen sordera súbita cuando se despiertan por la mañana. Otras lo notan por primera vez cuando intentan usar el oído sordo, como cuando usan un teléfono. Y otras perciben un "pop" fuerte y alarmante justo antes de que desaparezca la audición. Las personas con sordera súbita a menudo se marean, tienen zumbidos en los oídos (tinnitus) o ambas cosas.
Diagnóstico
La SSHL se diagnostica mediante una audiometría de tonos puros. Si la prueba muestra una pérdida de al menos 30 dB en tres frecuencias adyacentes, la pérdida auditiva se diagnostica como SSHL. Por ejemplo, una pérdida auditiva de 30 dB haría que el habla conversacional sonara más como un susurro.
Causas
Solo entre el 10 y el 15 por ciento de los casos diagnosticados como SSHL tienen una causa identificable. La mayoría de los casos se clasifican como idiopáticos , también llamados pérdida auditiva idiopática súbita (SIHL) y pérdida auditiva neurosensorial súbita idiopática (ISSHL o ISSNHL) [30] [31] La mayoría de la evidencia apunta a algún tipo de inflamación en el oído interno como la causa más común de SSNHL.
- Se cree que la infección es la causa más común de hipoacusia neurosensorial, y representa aproximadamente el 13 % de los casos. Los virus que se han asociado con la hipoacusia neurosensorial incluyen el citomegalovirus, la rubéola, el sarampión, las paperas, el virus de la inmunodeficiencia humana (VIH), el virus del herpes simple (VHS), el virus de la varicela zóster (VVZ) y el virus del Nilo Occidental. [32] Los pacientes con COVID-19 también pueden tener un mayor riesgo de desarrollar hipoacusia neurosensorial. [33]
- Isquemia vascular del oído interno o del nervio craneal VIII (CN8)
- Fístula perilinfática , generalmente debida a una ruptura de las ventanas redonda u ovalada y la fuga de perilinfa . El paciente generalmente también experimentará vértigo o desequilibrio . Suele haber antecedentes de trauma y se producen cambios en la audición o vértigo con alteración de la presión intracraneal, como al hacer un esfuerzo, levantar objetos, soplar, etc.
- Autoinmune : puede deberse a una enfermedad autoinmune como el lupus eritematoso sistémico o la granulomatosis con poliangeítis.
Tratamiento
La pérdida auditiva se recupera completamente en alrededor del 35-39% de los pacientes con SSNHL, generalmente dentro de una a dos semanas desde el inicio. [34] El tratamiento con esteroides dentro de los siete días, una menor gravedad inicial de la pérdida auditiva, la ausencia de vértigo, una edad más joven del paciente y antecedentes de enfermedad cardiovascular se asocian con una recuperación auditiva completa. [35] El ochenta y cinco por ciento de los que reciben tratamiento de un otorrinolaringólogo (a veces llamado cirujano otorrinolaringólogo) recuperarán parte de su audición. [ cita requerida ]
- vitaminas y antioxidantes
- vasodilatadores
- Betahistina (Betaserc), un fármaco contra el vértigo
- oxígeno hiperbárico [36]
- Agentes reológicos que reducen la viscosidad sanguínea (como el hidroxietilalmidón , el dextrano y la pentoxifilina ) [37]
- Agentes antiinflamatorios , principalmente corticosteroides orales (como prednisona y dexametasona ) [38]
- Administración intratimpánica: se están investigando formulaciones en gel para proporcionar una administración más consistente del fármaco al oído interno. [39] La administración local del fármaco se puede lograr mediante la administración intratimpánica, un procedimiento mínimamente invasivo en el que se anestesia el tímpano y se administra un fármaco en el oído medio. Desde el oído medio, un fármaco puede difundirse a través de la membrana de la ventana redonda hacia el oído interno. [39] La administración intratimpánica de esteroides puede ser eficaz para la pérdida auditiva neurosensorial repentina en algunos pacientes, pero no se han generado datos clínicos de alta calidad. [40] La administración intratimpánica de un péptido antiapoptótico (inhibidor de JNK) se está evaluando actualmente en la última etapa del desarrollo clínico. [41]
Epidemiología
La pérdida auditiva generalizada afecta a cerca del 10% de la población mundial. [42] Solo en los Estados Unidos, se estima que 13,5 millones de estadounidenses padecen pérdida auditiva neurosensorial. De aquellos con pérdida auditiva neurosensorial, aproximadamente el 50% tiene una relación congénita . El otro 50% se debe a infecciones maternas o fetales, infecciones posnatales, infecciones virales por rubéola o citomegalovirus , fármacos ototóxicos , [43] exposición a sonidos fuertes, traumatismo craneal grave y nacimientos prematuros [44].
De los casos de pérdida auditiva neurosensorial relacionada con la genética, el 75 % son autosómicos recesivos , el 15-20 % autosómicos dominantes y el 1-3 % ligados al sexo. Si bien aún se desconoce el gen y la proteína específicos, se cree que las mutaciones en el gen de la conexina 26 cerca del locus DFNB1 del cromosoma 13 [45] son responsables de la mayoría de los casos de pérdida auditiva neurosensorial relacionada con la genética autosómica recesiva [44].
Al menos 8,5 de cada 1000 niños menores de 18 años tienen pérdida auditiva neurosensorial. La pérdida auditiva general está relacionada proporcionalmente con la edad. Al menos 314 de cada 1000 personas mayores de 65 años tienen pérdida auditiva. En la última década se han estudiado varios factores de riesgo de pérdida auditiva neurosensorial. La osteoporosis, la cirugía de estapedectomía , las vacunas antineumocócicas, los usuarios de teléfonos móviles y la hiperbilirrubinemia al nacer se encuentran entre algunos de los factores de riesgo conocidos.
Véase también
- Pérdida auditiva conductiva , pérdida auditiva causada principalmente por afecciones en el oído medio.
- Sordera cortical , otro tipo de sordera nerviosa
- Pérdida de audición
- Oído interno , la porción más interna del oído que contiene el aparato neurosensorial de la audición.
- Otosclerosis , una afección de pérdida auditiva conductiva del oído medio a veces asociada o predecesora
- Tinnitus , zumbido en los oídos, un acompañamiento común de la hipoacusia neurosensorial
Notas
- ^ Algunos de los más destacados son el American National Standards Institute (ANSI), la Organización Internacional de Normalización (ISO), el Deutsches Institut für Normung (DIN), el Swedish Standards Institute (SSI), la Canadian Standards Association (CSA), el British Standards Institute (BSI), la Austrian Standards International (ÖNORM) y, en los Estados Unidos, la Environmental Protection Agency (EPA), la Occupational Safety and Health Administration (OSHA) y numerosas agencias estatales, y el Departamento de Defensa (DOD), entre otros.
- ^ Las distintas normas cuantifican la exposición nasal con un conjunto de medidas específicas, normalmente con respecto a un tiempo de exposición de referencia de 8 horas, un día laboral típico. Las medidas incluyen una escala de ponderación (normalmente A) con un tiempo de muestra, un valor umbral en dB, un nivel de presión acústica criterio en dB con un tiempo de exposición normalmente en horas y una tasa de intercambio en dB. Un SPL ponderado se denota dB(X), donde X es una escala de ponderación, normalmente A, pero a veces C. (A) se refiere a la ponderación A del SPL, que es un ajuste al SPL medido para compensar la respuesta de frecuencia del oído humano, que es menos sensible a las frecuencias bajas. El nivel criterio es el nivel de presión acústica promedio permitido durante el tiempo de exposición. El nivel de presión acústica umbral es el nivel por encima del cual el sonido se integrará en el promedio. El tiempo de muestra (rápido, lento o impulso) es la velocidad de muestreo: un tiempo de muestra lento es de 1 segundo; un tiempo de muestra rápido es de 1/8 de segundo y un tiempo de muestra de impulso es de 35 milisegundos. El efecto de un tiempo de muestreo más lento significa que los sonidos de duración muy corta pueden no muestrearse completamente (o incluso muestrearse en absoluto en casos excepcionales), por lo que la exposición al ruido puede subestimarse. La tasa de intercambio es la cantidad en la que el nivel de sonido permitido puede aumentar si el tiempo de exposición se reduce a la mitad.
- ^ La coenzima Q10 (CoQ10) apoya la función mitocondrial y tiene importantes propiedades antioxidantes (Quinzii 2010). Estudios en animales han descubierto que la suplementación con CoQ10 redujo la pérdida de audición inducida por el ruido y la muerte de las células ciliadas (Hirose 2008; Fetoni 2009, 2012). Los estudios en humanos también han arrojado resultados prometedores, ya que se descubrió que 160-600 mg de CoQ10 al día reducían la pérdida de audición en personas con pérdida auditiva neurosensorial repentina y presbiacusia (Ahn 2010; Salami 2010; Guastini 2011). Además, un pequeño ensayo preliminar descubrió que la suplementación con CoQ10 aliviaba el tinnitus en aquellos cuyos niveles de CoQ10 en sangre eran inicialmente bajos (Khan 2007). Otro pequeño ensayo descubrió que la CoQ10 puede retrasar la progresión de la pérdida de audición asociada con una mutación genética mitocondrial (Angeli 2005).
Referencias
- ^ Newman CW, Weinstein BE, Jacobson GP, Hug GA (octubre de 1991). "Fiabilidad test-retest del inventario de discapacidad auditiva para adultos". Ear and Hearing . 12 (5): 355–7. doi :10.1097/00003446-199110000-00009. PMID 1783240.
- ^ Matsunaga T (diciembre de 2009). "Valor de las pruebas genéticas en el abordaje otológico de la pérdida auditiva neurosensorial". The Keio Journal of Medicine . 58 (4): 216–22. doi : 10.2302/kjm.58.216 . PMID 20037285.
- ^ Papadakis CE, Hajiioannou JK, Kyrmizakis DE, Bizakis JG (mayo de 2003). "Pérdida auditiva neurosensorial súbita bilateral causada por la enfermedad de Charcot-Marie-Tooth". Revista de laringología y otología . 117 (5): 399–401. doi :10.1258/002221503321626465. PMID 12803792.
- ^ Crispino JD, Horwitz MS (abril de 2017). "Mutaciones del factor GATA en enfermedades hematológicas". Blood . 129 (15): 2103–2110. doi :10.1182/blood-2016-09-687889. PMC 5391620 . PMID 28179280.
- ^ Hirabayashi S, Wlodarski MW, Kozyra E, Niemeyer CM (agosto de 2017). "Heterogeneidad de neoplasias mieloides relacionadas con GATA2". Revista Internacional de Hematología . 106 (2): 175–182. doi : 10.1007/s12185-017-2285-2 . PMID 28643018.
- ^ Mills JH, Going JA (abril de 1982). "Revisión de los factores ambientales que afectan la audición". Environmental Health Perspectives . 44 : 119–27. doi :10.1289/ehp.8244119. PMC 1568958 . PMID 7044773.
- ^ Rosen, S.; Bergman, M.; Plester, D.; El-Mofty, A.; Satti, MH (septiembre de 1962). "Estudio de la presbiacusia en una población relativamente libre de ruido en Sudán". Anales de otología, rinología y laringología . 71 (3): 727–743. doi :10.1177/000348946207100313. ISSN 0003-4894. PMID 13974856. S2CID 30150198.
- ^ Goycoolea, MV; Goycoolea, HG; Farfan, CR; Rodriguez, LG; Martinez, GC; Vidal, R. (diciembre de 1986). "Efecto de la vida en sociedades industrializadas sobre la audición en nativos de la Isla de Pascua". El Laringoscopio . 96 (12): 1391–1396. doi :10.1288/00005537-198612000-00015. ISSN 0023-852X. PMID 3784745. S2CID 23022009.
- ^ Salawati, Liza (2012). Le Prell, Colleen G.; Henderson, Donald; Fay, Richard R.; Popper, Arthur N. (eds.). Pérdida de audición inducida por ruido. Springer Handbook of Auditory Research. Vol. 40. págs. 45–49. doi :10.1007/978-1-4419-9523-0. ISBN 978-1-4419-9522-3.S2CID6752992 .
{{cite book}}:|journal=ignorado ( ayuda ) - ^ Gates GA, Mills JH (septiembre de 2005). "Presbiacusia". Lancet . 366 (9491): 1111–20. doi :10.1016/S0140-6736(05)67423-5. PMID 16182900.
La presbiacusia (o presbiacusia) es un término general que se refiere a la pérdida de audición en los ancianos y, como tal, representa las contribuciones de toda una vida de agresiones al sistema auditivo. De estos, el envejecimiento y el daño por ruido son los factores principales, además de la susceptibilidad genética, los trastornos otológicos y la exposición a agentes ototóxicos.
- ^ "Niveles de salida de sonido del iPod y otros reproductores MP3: ¿Existe un riesgo potencial para la audición?". Archivado desde el original el 30 de octubre de 2007. Consultado el 20 de noviembre de 2007 .
- ^ Kochupillai N, Pandav CS, Godbole MM, Mehta M, Ahuja MM (1986). "Deficiencia de yodo e hipotiroidismo neonatal". Boletín de la Organización Mundial de la Salud . 64 (4): 547–51. PMC 2490891 . PMID 3490923.
- ^ abcdef Gelfand SA. Audición: Introducción a la acústica psicológica y fisiológica. 4.ª ed. Nueva York: Marcel Dekker; 2004.
- ^ abcdefghijk Moore BCJ. Pérdida auditiva coclear. Londres: Whurr Publishers; 1998.
- ^ abcdef Moore BC (abril de 2004). "Regiones muertas en la cóclea: fundamentos conceptuales, diagnóstico y aplicaciones clínicas". Ear and Hearing . 25 (2): 98–116. doi :10.1097/01.aud.0000120359.49711.d7. PMID 15064655. S2CID 12200368.
- ^ Terkildsen K (1980). "Deficiencia auditiva y audiogramas". Escanear Audiol . 10 : 27–31.Citado en: Moore BC (marzo de 2001). "Regiones muertas en la cóclea: diagnóstico, consecuencias perceptivas e implicaciones para la adaptación de audífonos". Tendencias en amplificación . 5 (1): 1–34. doi :10.1177/108471380100500102. PMC 4168936 . PMID 25425895.
- ^ Thornton AR, Abbas PJ, Abbas PJ (febrero de 1980). "Pérdida de audición de baja frecuencia: percepción del habla filtrada, curvas de ajuste psicofísico y enmascaramiento". The Journal of the Acoustical Society of America . 67 (2): 638–43. Bibcode :1980ASAJ...67..638T. doi :10.1121/1.383888. PMID 7358904.Citado en: Moore BC (marzo de 2001). "Regiones muertas en la cóclea: diagnóstico, consecuencias perceptivas e implicaciones para la adaptación de audífonos". Tendencias en amplificación . 5 (1): 1–34. doi :10.1177/108471380100500102. PMC 4168936 . PMID 25425895.
- ^ abcd Sek A, Alcántara J, Moore BC, Kluk K, Wicher A (julio de 2005). "Desarrollo de un método rápido para determinar curvas de afinación psicofísica". Revista Internacional de Audiología . 44 (7): 408–20. doi :10.1080/14992020500060800. PMID 16136791. S2CID 144611882.
- ^ ab Summers V, Molis MR, Müsch H, Walden BE, Surr RK, Cord MT (abril de 2003). "Identificación de regiones muertas en la cóclea: curvas de ajuste psicofísico y detección de tonos en ruido de ecualización de umbral". Ear and Hearing . 24 (2): 133–42. doi :10.1097/01.AUD.0000058148.27540.D9. PMID 12677110. S2CID 35548604.
- ^ Huss M, Moore BC (octubre de 2005). "Regiones muertas y ruido de tonos puros". Revista Internacional de Audiología . 44 (10): 599–611. doi :10.1080/02640410500243962. PMID 16315451. S2CID 46489920.
- ^ Kluk K, Moore BC (diciembre de 2006). "Regiones muertas en la cóclea y mejora de la discriminación de frecuencias: efectos de la pendiente del audiograma, pérdida unilateral frente a bilateral y uso de audífonos". Hearing Research . 222 (1–2): 1–15. doi :10.1016/j.heares.2006.06.020. PMID 17071031. S2CID 31883892.
- ^ Safieddine S, El-Amraoui A, Petit C (2012). "La sinapsis en cinta de las células ciliadas auditivas: del ensamblaje a la función". Revisión anual de neurociencia . 35 : 509–28. doi :10.1146/annurev-neuro-061010-113705. PMID 22715884.
- ^ Wichmann C, Moser T (julio de 2015). "Relación entre la estructura y la función de las sinapsis en cinta de las células ciliadas internas". Cell and Tissue Research . 361 (1): 95–114. doi :10.1007/s00441-014-2102-7. PMC 4487357 . PMID 25874597.
- ^ Nakagawa T (2014). "Estrategias para el desarrollo de nuevas terapias para la pérdida auditiva neurosensorial". Frontiers in Pharmacology . 5 : 206. doi : 10.3389/fphar.2014.00206 . PMC 4165348 . PMID 25278894.
- ^ "Pérdida auditiva neurosensorial". HealthCentral . Consultado el 8 de junio de 2013 .
- ^ "Los nutrientes previenen la pérdida de audición inducida por el ruido". 8 de mayo de 2013. Archivado desde el original el 8 de mayo de 2013. Consultado el 25 de febrero de 2016 .
- ^ "Sound Pharmaceuticals presenta datos positivos de ensayos clínicos de fase 2 sobre SPI-1005 para... - SEATTLE, 18 de febrero de 2014 /PRNewswire/". Prnewswire.com . Consultado el 25 de febrero de 2016 .
- ^ Parker MA (diciembre de 2011). "Biotecnología en el tratamiento de la pérdida auditiva neurosensorial: fundamentos y futuro de la regeneración de células ciliadas". Journal of Speech, Language, and Hearing Research . 54 (6): 1709–31. doi :10.1044/1092-4388(2011/10-0149). PMC 3163053 . PMID 21386039.
- ^ "Estudio en marcha con células madre para tratar la pérdida auditiva neurosensorial". HealthyHearing. 2 de febrero de 2012. Consultado el 8 de junio de 2013 .
- ^ "Sordera súbita | Massachusetts Eye and Ear". Masseyeandear.org . Consultado el 25 de febrero de 2016 .
- ^ "H91.2". Versión CIE-10:2010 . apps.who.int. 2010.
- ^ Son HJ, Choi EJ, Jeong U, Choi YJ (abril de 2023). "Efecto del tratamiento del herpes zóster y la pérdida auditiva neurosensorial repentina utilizando datos de reclamaciones del seguro médico nacional de Corea del Sur". Medicina . 59 (4): 808. doi : 10.3390/medicina59040808 . PMC 10143438 . PMID 37109766.
- ^ Meng X, Wang J, Sun J, Zhu K (abril de 2022). "COVID-19 y pérdida auditiva neurosensorial súbita: una revisión sistemática". Frontiers in Neurology . 13 : 883749. doi : 10.3389/fneur.2022.883749 . PMC 9096262 . PMID 35572936.
- ^ Bayoumy, AB; van der Veen, EL; de Ru, JA (1 de agosto de 2018). "Evaluación de las tasas de recuperación espontánea en pacientes con pérdida auditiva neurosensorial súbita idiopática". JAMA Otolaryngology–Head & Neck Surgery . 144 (8): 655–656. doi :10.1001/jamaoto.2018.1072. PMID 29931029. S2CID 49330911.
- ^ Mandavia R, Joshi N, Hannink G, Ahmed MN, Parmar D, Di Bonaventura S, Gomes P, Iqbal I, Lyles J, Schilder AG, Mehta N (septiembre de 2024). "Un modelo pronóstico para predecir la recuperación auditiva en pacientes con pérdida auditiva neurosensorial de aparición súbita idiopática". JAMA Otolaryngology-- Head & Neck Surgery . doi :10.1001/jamaoto.2024.2598. PMID 39235820.
- ^ Bennett MH, Kertesz T, Perleth M, Yeung P, Lehm JP (octubre de 2012). "Oxígeno hiperbárico para la pérdida auditiva neurosensorial súbita idiopática y el tinnitus". Base de datos Cochrane de revisiones sistemáticas . 10 : CD004739. doi :10.1002/14651858.CD004739.pub4. PMID 23076907.
- ^ Li, Yike (15 de junio de 2017). "Intervenciones en el manejo de la viscosidad sanguínea para la pérdida auditiva neurosensorial súbita idiopática: un metaanálisis". Revista de investigación y revisiones en salud . 4 (2): 50–61. doi : 10.4103/jhrr.jhrr_125_16 (inactivo 2024-09-24). S2CID 79662388.
{{cite journal}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace ) - ^ Leung MA, Flaherty A, Zhang JA, Hara J, Barber W, Burgess L (junio de 2016). "Pérdida auditiva neurosensorial súbita: actualización de atención primaria". Hawai'i Journal of Medicine & Public Health . 75 (6): 172–4. PMC 4928516 . PMID 27413627.
- ^ ab McCall AA, Swan EE, Borenstein JT, Sewell WF, Kujawa SG, McKenna MJ (abril de 2010). "Administración de fármacos para el tratamiento de enfermedades del oído interno: estado actual del conocimiento". Ear and Hearing . 31 (2): 156–65. doi :10.1097/AUD.0b013e3181c351f2. PMC 2836414 . PMID 19952751.
- ^ Crane RA, Camilon M, Nguyen S, Meyer TA (enero de 2015). "Esteroides para el tratamiento de la pérdida auditiva neurosensorial repentina: un metaanálisis de ensayos controlados aleatorizados". The Laryngoscope . 125 (1): 209–17. doi :10.1002/lary.24834. PMID 25045896. S2CID 24312659.
- ^ Suckfuell M, Lisowska G, Domka W, Kabacinska A, Morawski K, Bodlaj R, Klimak P, Kostrica R, Meyer T (septiembre de 2014). "Eficacia y seguridad de AM-111 en el tratamiento de la pérdida auditiva neurosensorial aguda: un estudio de fase II doble ciego, aleatorizado y controlado con placebo". Otología y neurotología . 35 (8): 1317–26. doi : 10.1097/mao.0000000000000466 . PMID 24979398. S2CID 6445497.
- ^ Oishi, Naoki; Schacht, Jochen (2011). "Tratamientos emergentes para la pérdida de audición inducida por ruido". Opinión de expertos sobre fármacos emergentes . 16 (2): 235–245. doi :10.1517/14728214.2011.552427. ISSN 1472-8214. PMC 3102156 . PMID 21247358.
- ^ "Pérdida auditiva neurosensorial genética: antecedentes, fisiopatología, epidemiología". 2019-11-09.
{{cite journal}}: Requiere citar revista|journal=( ayuda ) - ^ de Antonio, Stephanie (12 de junio de 2018). "Presentación clínica de la pérdida auditiva neurosensorial genética". Medscape .
- ^ "Bienvenido a la página de inicio sobre pérdida auditiva hereditaria | Página de inicio sobre pérdida auditiva hereditaria". hereditaryhearingloss.org . Consultado el 3 de diciembre de 2019 .
- Ghazavi H, Kargoshaei AA, Jamshidi-Koohsari M, "Investigación de los niveles de vitamina D en pacientes con pérdida auditiva neurosensorial súbita y su efecto en el tratamiento", American journal of otolaryngology and head and neck medicine and surgery , noviembre de 2019 doi :10.1016/j.amjoto.2019.102327
Enlaces externos
- Pérdida de audición en la red

