Nomenclatura IUPAC de la química inorgánica 2005
La Nomenclatura de la química inorgánica, Recomendaciones IUPAC 2005 es la versión 2005 de la Nomenclatura de la química inorgánica (que informalmente se denomina Libro Rojo ). Es una colección de reglas para nombrar compuestos inorgánicos, según lo recomendado por la Unión Internacional de Química Pura y Aplicada (IUPAC).
Resumen
La edición de 2005 reemplaza sus recomendaciones anteriores Nomenclatura El Libro Rojo de Química Inorgánica, Recomendaciones IUPAC 1990 (Libro Rojo I) , y "cuando sea apropiado" (sic) Nomenclatura de Química Inorgánica II, Recomendaciones IUPAC 2000 (Libro Rojo II) .
Las recomendaciones ocupan más de 300 páginas [1] y el texto completo se puede descargar de la IUPAC. [2] Se han publicado correcciones. [3]
Además de una reorganización del contenido, hay una nueva sección sobre organometálicos y una lista formal de elementos que se utilizará en lugar de las listas de electronegatividad en la secuenciación de elementos en fórmulas y nombres. El concepto de un nombre IUPAC preferido (PIN), una parte del libro azul revisado para la denominación de compuestos orgánicos, aún no se ha adoptado para los compuestos inorgánicos. Sin embargo, existen pautas sobre qué método de denominación se debe adoptar.
Métodos de denominación
Las recomendaciones describen distintas formas de nombrar los compuestos, a saber:
- denominación compositiva (por ejemplo, cloruro de sodio)
- denominación sustitutiva basada en hidruros progenitores ( GeCl2Me2diclorodimetilgermano )
- denominación aditiva ([MnFO 3 ] fluorurotrioxidomanganeso)
Además hay recomendaciones para lo siguiente:
- denominación de compuestos de clúster
- nombres permitidos para ácidos inorgánicos y derivados
- denominación de fases sólidas, p. ej. fases no estequiométricas
Para un compuesto simple como AlCl 3 las diferentes convenciones de nomenclatura dan como resultado lo siguiente:
- composicional : tricloruro de aluminio ( estequiométricamente ) o hexacloruro de dialuminio ( dímero )
- sustitucional : tricloralumano
- aditivo : tricloruroaluminio; hexaclorurodialuminio (dímero sin información estructural); di-μ-cloruro-tetracloruro-1κ 2 Cl ,2κ 2 Cl -dialuminio (dímero con información estructural)
Elementos de secuenciación: la lista de "electronegatividad"
En las recomendaciones, el uso de la electronegatividad de los elementos para la secuenciación se ha sustituido por una lista formal que se basa vagamente en la electronegatividad. Las recomendaciones siguen utilizando los términos electropositivo y electronegativo para referirse a la posición relativa de un elemento en esta lista.
Una regla general simple para ignorar los lantánidos y actínidos es:
- Para dos elementos en grupos diferentes, entonces el elemento en el grupo con el número más alto tiene una "electronegatividad" más alta.
- Para dos elementos dentro del mismo grupo, el elemento con menor número atómico tiene mayor "electronegatividad".
- El hidrógeno es menos electronegativo que cualquier calcógeno y más electronegativo que cualquier pictógeno. Por lo tanto, las fórmulas del agua y del amoníaco se pueden escribir como H 2 O y NH 3 respectivamente.
La lista completa, de mayor a menor "electronegatividad" (con la adición de los elementos 112 a 118, que aún no habían sido nombrados en 2005, a sus respectivos grupos):
- Grupo 17 en la secuencia de números atómicos, es decir, F–Ts seguido de
- Grupo 16 en la secuencia de números atómicos, es decir, O–Lv seguido de
- H, hidrógeno , seguido de
- Grupo 15 en la secuencia de números atómicos, es decir, N–Mc seguido de
- Grupo 14 en la secuencia de números atómicos, es decir, C–Fl seguido de
- Grupo 13 en la secuencia de números atómicos, es decir, B–Nh seguido de
- Grupo 12 en la secuencia de números atómicos, es decir, Zn–Cn seguido de
- Grupo 11 en la secuencia de números atómicos, es decir, Cu–Rg seguido de
- Grupo 10 en la secuencia de números atómicos, es decir, Ni–Ds seguido de
- Grupo 9 en la secuencia de números atómicos, es decir, Co–Mt seguido de
- Grupo 8 en la secuencia de números atómicos, es decir, Fe–Hs seguido de
- Grupo 7 en la secuencia de números atómicos, es decir, Mn–Bh seguido de
- Grupo 6 en la secuencia de números atómicos, es decir, Cr–Sg seguido de
- Grupo 5 en la secuencia de números atómicos, es decir, V–Db seguido de
- Grupo 4 en la secuencia de números atómicos, es decir, Ti–Rf seguido de
- Grupo 3 en la secuencia de números atómicos, es decir, Sc–Y seguido de
- los lantánidos en secuencia de números atómicos, es decir La–Lu seguido de
- Los actínidos en secuencia de número atómico, es decir, Ac–Lr seguido de
- Grupo 2 en la secuencia de números atómicos, es decir, Be–Ra seguido de
- Grupo 1 (excluyendo H) en la secuencia de números atómicos, es decir, Li–Fr seguido de
- Grupo 18 en la secuencia de números atómicos, es decir, He–Og
Determinar la nomenclatura a utilizar
| Acción | ¿Compuesto de adición ? | ¿Estequiometría definitiva ? | ¿ monoatómico ? | ¿molecular ? | ¿metal presente? | ¿ Enlace al carbono ? | ¿Grupo de metales de transición 3–12? | ¿Grupos principales de metales 1, 2, 3–6? |
|---|---|---|---|---|---|---|---|---|
| Trate cada componente por separado y utilice técnicas compositivas. | Sí | |||||||
| Utilice nombres de sólidos | No | No | ||||||
| Nomenclatura de elementos o cationes/aniones/radicales monoatómicos | No | Sí | Sí | |||||
| Divida los componentes en "electropositivos"/"electronegativos". Trate cada componente por separado. Utilice una denominación estequiométrica generalizada. | No | Sí | No | No | ||||
| Utilice el Libro Azul ( Compuesto orgánico ) | No | Sí | No | Sí | No | Sí | ||
| Utilice nombres aditivos para los organometálicos del grupo 3 al 12 | No | Sí | No | Sí | Sí | Sí | Sí | |
| Utilice nombres sustitutivos para los organometálicos de los grupos 3 a 6. Utilice nombres composicionales para los organometálicos de los grupos 1 a 2. | No | Sí | No | Sí | Sí | Sí | No | Sí |
| Utilice nombres aditivos para los complejos de coordinación | No | Sí | No | Sí | Sí | No | Sí | |
| Elija entre sustitutivo o aditivo. | No | Sí | No | Sí | No | No |
Tenga en cuenta que "tratar por separado" significa utilizar la tabla de decisiones en cada componente.
Nombres de elementos
Muestra de estructura indeterminada
Una muestra indeterminada simplemente toma el nombre del elemento. Por ejemplo, una muestra de carbono (que podría ser diamante, grafito, etc. o una mezcla) se llamaría carbono.
Alótropo específico
Molecular
- O 2 dioxígeno (nombre aceptable oxígeno)
- O 3 trioxígeno (nombre aceptable ozono)
- P 4 tetrafósforo (nombre aceptable fósforo blanco)
- S 6 hexasulfuro (nombre aceptable ε-azufre)
- S 8 ciclo-octasulfuro (los nombres aceptables para las formas polimórficas son α-azufre, β-azufre, γ-azufre)
Forma cristalina
Esto se especifica mediante el símbolo del elemento seguido del símbolo de Pearson para la forma cristalina. (Tenga en cuenta que las recomendaciones ponen específicamente en cursiva el segundo carácter).
- C n carbono (c F 8) (nombre aceptable diamante)
- Sn n tin(t I 4) (nombre aceptable β- o estaño blanco)
- Mn n manganeso (c I 58) (nombre aceptable α-manganeso)
Alótropos amorfos reconocidos
Los ejemplos incluyen P n , fósforo rojo; As n , arsénico amorfo.
Compuestos
Los nombres composicionales proporcionan poca información estructural y se recomiendan para su uso cuando no se dispone de información estructural o no es necesario transmitirla. Los nombres estequiométricos son los más simples y reflejan la fórmula empírica o la fórmula molecular. El orden de los elementos sigue la lista formal de electronegatividad para compuestos binarios y la lista de electronegatividad para agrupar los elementos en dos clases que luego se ordenan alfabéticamente. Las proporciones se especifican mediante di-, tri-, etc. (Ver multiplicador numérico IUPAC ). Cuando se sabe que hay cationes o aniones complejos, estos se nombran por derecho propio y luego estos nombres se usan como parte del nombre del compuesto.
Compuestos binarios
En los compuestos binarios, el elemento más electropositivo se coloca primero en la fórmula. Se utiliza la lista formal. El nombre del elemento más electronegativo se modifica para que termine en -uro y el nombre del elemento más electropositivo se deja sin cambios.
Tomando el compuesto binario de sodio y cloro: el cloro se encuentra primero en la lista, por lo tanto, aparece último en el nombre. Otros ejemplos son
- Pentacloruro de fósforo PCl5
- Trifosfuro dicálcico Ca2P3
- Estanuro de níquel NiSn
- Hexacarburo de tricosacromo Cr 23 C 6
Compuestos ternarios y más allá
A continuación se ilustran los principios.
El compuesto cuaternario 1:1:1:1 entre bromo, cloro, yodo y fósforo:
- PBrClI cloruro de bromuro de fósforo y yoduro (el fósforo es el más electropositivo, los demás se designan como electronegativos y están ordenados alfabéticamente)
El compuesto ternario 2:1:5 de antimonio, cobre y potasio puede nombrarse de dos maneras dependiendo de qué elemento(s) se designen como electronegativos.
- Diantimonuro de pentapotasio y cobre CuK 5 Sb 2 (tanto el cobre como el potasio se designan como electropositivos y están ordenados alfabéticamente)
- Cupruro de diantimonuro de pentapotasio K 5 CuSb 2 (solo el potasio se designa como electropositivo y los dos elementos electronegativos están ordenados alfabéticamente) (Note que el libro rojo muestra este ejemplo incorrectamente)
Denominación de iones y radicales
Cationes
Los cationes monoatómicos se nombran tomando el nombre del elemento y a continuación la carga entre paréntesis, por ejemplo
- N / A+
sodio(1+) - Cr3+
cromo(3+)
A veces se debe tomar una forma abreviada del nombre del elemento, por ejemplo, germuro para germanio, ya que germanuro se refiere a GeH.−
3.
Los cationes poliatómicos del mismo elemento se nombran como el nombre del elemento precedido por di-, tri-, etc. , por ejemplo:
- Hg2+
2dimercurio(2+)
Los cationes poliatómicos formados por diferentes elementos se nombran de forma sustitutiva o aditiva, por ejemplo:
- Filipinas+
4fosfanio - SbF+
4tetrafluorostibanio (sustitutivo) o tetrafluoridoantimonio(1+) - Tenga en cuenta que amonio y oxonio son nombres aceptables para NH+
4y H
3Oh+
respectivamente. (Hidronio no es un nombre aceptable para H
3Oh+
[ cita necesaria ] )
Aniones
Los aniones monoatómicos se nombran como el elemento modificado con la terminación -uro. La carga va entre paréntesis (opcional para 1−), por ejemplo:
- Cl − cloruro(1−) o cloruro
- S 2− sulfuro(2−)
Algunos elementos toman su nombre en latín como raíz, por ejemplo
- plata, Ag, argenturo
- cobre, Cu, cupruro
- hierro, Fe, ferriuro
- estaño, Sn, estannuro
Los aniones poliatómicos del mismo elemento se nombran como el nombre del elemento precedido por di-, tri-, etc. , por ejemplo:
- Dióxido de O 2 2− (2−) (o peróxido como nombre aceptable)
- C 2 2− dicarburo(2−) (o acetiluro como nombre aceptable)
- S 2 2− disulfuro(2−)
o a veces como alternativa derivada de un nombre sustitutivo, por ejemplo
- S 2 2− disulfanediuro
Los aniones poliatómicos formados por diferentes elementos se nombran de forma sustitutiva o aditiva, las terminaciones del nombre son -uro y -ato respectivamente, por ejemplo:
- GeH 3 − germanuro (sustitutivo), o trihidridogermanato(1−) (aditivo)
- TeH 3 − sustitutivo de tellanuida donde -uida especifica un anión compuesto de hidruro adicional unido al hidruro original
- [PF 6 ] − hexafluoro-λ 5 -fosfanuida (sustitutiva), o hexafluoridofosfato(1−) (aditiva)
- SO 3 2− trioxidosulfato(2−) (aditivo), o sulfito (nombre no sistemático aceptable)
En las recomendaciones se incluye una lista completa de los nombres alternativos no sistemáticos aceptables para cationes y aniones. Muchos aniones tienen nombres derivados de ácidos inorgánicos, que se abordan más adelante.
Radicales
La presencia de electrones desapareados se puede indicar con un “ · ”. Por ejemplo:
- Él · + helio( · +)
- N 2 (2 · )2+ dinitrógeno(2 · 2+)
Denominación de hidratos y compuestos reticulares similares
El uso del término hidrato sigue siendo aceptable, por ejemplo, Na2SO4 · 10H2O , sulfato de sodio decahidratado. El método recomendado sería nombrarlo sulfato de sodio-agua (1/10). De manera similar, otros ejemplos de compuestos reticulares son:
- CaCl2 ·8NH3 , cloruro de calcio — amoniaco (1/8)
- 2Na2CO3 · 3H2O2 , carbonato de sodio — peróxido de hidrógeno ( 2/3)
- AlCl3 ·4EtOH, cloruro de aluminio — etanol (1/4)
Especificación de proporciones utilizando la carga o el estado de oxidación
Como alternativa a los prefijos di y tri, se puede utilizar tanto el prefijo de carga como el de estado de oxidación. Se recomienda el prefijo de carga, ya que el estado de oxidación puede ser ambiguo y estar abierto a debate.
Nomenclatura sustitutiva
Este método de denominación generalmente sigue la nomenclatura orgánica establecida por la IUPAC. Los hidruros de los elementos del grupo principal (grupos 13-17) reciben nombres de base -ano , p. ej., borano, BH 3 . Los nombres alternativos aceptables para algunos de los hidruros progenitores son agua en lugar de oxidano y amoníaco en lugar de azano. En estos casos, el nombre de la base se utiliza para los derivados sustituidos.
Esta sección de las recomendaciones cubre la denominación de compuestos que contienen anillos y cadenas.
Hidruros de base
| BH3 | borano | Capítulo 4 | metano | NH3 | azano ( amoniaco ) | H2O | oxidano ( agua ) | alta frecuencia | fluorano ( fluoruro de hidrógeno ) |
| AlH3 | alumano | SiH4 | silano | PH 3 | fosfano ( fosfina ) | H2S | sulfano ( sulfuro de hidrógeno o sulfuro de dihidrógeno) | Clorhidrato | clorano ( cloruro de hidrógeno ) |
| GaH3 | galano | GeH4 | relacionado | AsH 3 | arsane ( arsina ) | H2Se | selano ( seleniuro de hidrógeno o seleniuro de dihidrógeno) | HBr | bromano ( bromuro de hidrógeno ) |
| InH 3 | Indigana | SnH4 | estanno | sbh 3 | estibano ( estibina ) | H2Te | tellano ( telururo de hidrógeno o telururo de dihidrógeno) | HOLA | Yodano ( yoduro de hidrógeno ) |
| TLH3 | Talano | PbH4 | plomada | Bosnia y Herzegovina 3 | Bismuto ( bismutina ) | H2Po | Polano ( polónido de hidrógeno o polonido de dihidrógeno) | Sombrero | astato ( astaturo de hidrógeno ) |
Hidruros con enlace no estándar: convención lambda
Cuando un compuesto tiene un enlace no estándar en comparación con el hidruro original, por ejemplo PCl5 , se utiliza la convención lambda. Por ejemplo:
- PCl 5 pentacloro-λ 5 -fosfano
- SF6hexafluoro - λ6 - sulfano
Hidruros polinucleares
Se añade un prefijo di-, tri-, etc. al nombre del hidruro original. Algunos ejemplos son:
- HOOH, dioxidano (peróxido de hidrógeno es un nombre aceptable)
- H 2 PPH 2 , difosfano
- H 3 SiSiH 2 SiH 2 SiH 3 , tetrasilano
Anillos y cadenas
Las recomendaciones describen tres formas de asignar nombres "principales" a los hidruros monocíclicos homonucleares (es decir, anillos individuales que constan de un elemento):
- la nomenclatura Hantzsch-Widman (el método preferido para anillos de tamaño 3 a 10)
- "nomenclatura de reemplazo esquelético": especifica el reemplazo de átomos de carbono en el compuesto de carbono correspondiente con átomos de otro elemento (por ejemplo, el silicio se convierte en sila, germanio, germa) y un prefijo multiplicativo tri, tetra, penta, etc.) (el método preferido para anillos mayores de 10)
- añadiendo el prefijo ciclo al nombre de la cadena correspondiente no ramificada y no sustituida
Hidruros de boro
El nombre estequiométrico va seguido del número de átomos de hidrógeno entre paréntesis. Por ejemplo, B 2 H 6 , diborano(6). Se puede transmitir más información estructural añadiendo los prefijos "descriptores estructurales" closo -, nido -, arachno -, hypho -, klado -.
Existe un método totalmente sistemático para numerar los átomos en los grupos de hidruro de boro y un método para describir la posición de los átomos de hidrógeno que forman puentes utilizando el símbolo μ.
Grupo principal de compuestos organometálicos
Se recomienda el uso de la nomenclatura sustitutiva para los compuestos organometálicos del grupo principal de los grupos 13 a 16. Algunos ejemplos son:
- AlH2Me llamado metilalumano
- BiI 2 Ph llamado diyodo(fenil)bismutano
Para los compuestos organometálicos de los grupos 1 y 2 se puede utilizar una denominación aditiva (que indica un agregado molecular) o compositiva. Algunos ejemplos son:
- [BeEtH] llamado etilhidridoberilio o etanidohidridoberilio
- [Mg(η 5 -C 5 H 5 ) 2 ] llamado bis(η 5 -ciclopentadienil)magnesio, o bis(η 5 -ciclopentadienido)magnesio
- Na(CHCH 2 ) etenuro de sodio (nombre compositivo)
Sin embargo, la recomendación señala que los futuros proyectos de nomenclatura abordarán estos compuestos.
Nomenclatura aditiva
Esta denominación se ha desarrollado principalmente para compuestos de coordinación, aunque puede aplicarse de forma más amplia. Algunos ejemplos son:
- Si(OH) 4 tetrahidroxisilicio (aditivo) o silanotetrol (sustituto) (nótese que ácido silícico es un nombre aceptable; se ha descartado el ortosilícico).
- Cloruro de pentaaminocloruro de cobalto(2+) [CoCl(NH 3 ) 5 ]Cl 2
Procedimiento recomendado para nombrar compuestos mononucleares
Las recomendaciones incluyen un diagrama de flujo que puede resumirse muy brevemente:
- identificar el átomo central,
- identificar y nombrar los ligandos,
- Especificar el modo de coordinación de los ligandos, es decir, utilizando las convenciones kappa y/o eta.
- secuenciar los ligandos
- especificar geometría de coordinación, es decir, símbolo poliédrico, índice de configuración (utilizando reglas CIP y configuración absoluta para compuestos ópticamente activos).
Nombres de ligandos
Ligandos aniónicos
Si el nombre del anión termina en -uro, entonces, como ligando, su nombre se cambia para que termine en -o. Por ejemplo, el anión cloruro, Cl −, se convierte en cloruro. Esta es una diferencia con la denominación de compuestos orgánicos y la denominación sustitutiva, donde el cloro se trata como neutro y se convierte en cloro, como en PCl 3 , que se puede nombrar de forma sustitutiva o aditiva como triclorofosfano o triclorurofósforo respectivamente.
De manera similar, si los nombres de los aniones terminan en -ito, -ato, entonces los nombres de los ligandos son -ito, -ato.
Ligandos neutros
Los ligandos neutros no cambian de nombre con la excepción de lo siguiente:
- Agua, "aqua"
- Amoniaco, "amina"
- Monóxido de carbono unido a través del carbono, "carbonilo"
- Monóxido de nitrógeno unido a través del nitrógeno, "nitrosilo"
Ejemplos de nombres de ligandos
| Fórmula | nombre |
|---|---|
| Cl − | Cloruro |
| CN − | cianuro |
| Yo − | hidrido |
| D − o 2 H − | deuterido o [ 2 H]hidrido |
| PhCH2CH2Se − | 2-feniletano-1-selenolato |
| Director de operaciones de Me | acetato o etanoato |
| Yo 2 como − | dimetilarsanido |
| MePH − | metilfosfanido |
| MeCONH2 | acetamida (no acetamido) |
| MeCONH − | acetilazanido o acetilamido (no acetamido) |
| MeNH2 | metanamina |
| MeNH − | metilazanido, o metilamido, o metanaminido |
| MePH 2 | metilfosfano |
| CO | carbonilo |
Secuencia y posición de ligandos y átomos centrales
Los ligandos se ordenan alfabéticamente por nombre y preceden al nombre del átomo central. El número de ligandos que coordinan se indica con los prefijos di-, tri-, tetra-, penta-, etc. para ligandos simples o bis-, tris-, tetrakis-, etc. para ligandos complejos. Por ejemplo:
- Cloruro de pentaaminocloruro de cobalto(3+) [CoCl(NH 3 ) 5 ]Cl 2 donde el amino (NH 3 ) precede al cloruro. El nombre del átomo central aparece después de los ligandos. Cuando hay más de un átomo central, se antepone a di-, tri-, tetra-, etc.
- Os 3 (CO) 12 , dodecacarboniltriosmio
Cuando hay diferentes átomos centrales se secuencian utilizando la lista de electronegatividad.
- [ReCo(CO) 9 ] nonacarbonilreniocobalto
Ligandos puente: uso del símbolo μ
Los ligandos pueden formar puentes entre dos o más centros. El prefijo μ se utiliza para especificar un ligando puente tanto en la fórmula como en el nombre. Por ejemplo, la forma dimérica del tricloruro de aluminio :
- Al2Cl4 ( μ - Cl ) 2
- di-μ-clorido-tetraclorido-1κ 2 Cl , 2κ 2 Cl -dialuminio
Este ejemplo ilustra el orden de los ligandos puente y no puente del mismo tipo. En la fórmula, los ligandos puente siguen a los no puente, mientras que en el nombre, los ligandos puente preceden a los no puente. Observe el uso de la convención kappa para especificar que hay dos cloruros terminales en cada aluminio.
Índice de puentes
Cuando hay más de dos centros que están unidos, se añade un índice de unión como subíndice. Por ejemplo, en el acetato de berilio básico , que puede visualizarse como una disposición tetraédrica de átomos de Be unidos por 6 iones de acetato que forman una jaula con un anión de óxido central, la fórmula y el nombre son los siguientes:
- [Be 4 (μ 4 -O)(μ-O 2 CMe) 6 ]
- hexakis(μ-acetato-κ O :κ O ′ )-μ 4 -oxido- tetrahedro -tetraberilio
El μ 4 describe la formación de puentes del ion óxido central. (Obsérvese el uso de la convención kappa para describir la formación de puentes del ion acetato donde están involucrados ambos átomos de oxígeno). En el nombre, cuando un ligando está involucrado en diferentes modos de formación de puentes, los puentes múltiples se enumeran en orden decreciente de complejidad, por ejemplo, la formación de puentes μ 3 antes de la formación de puentes μ 2 .
Convención kappa, κ
La convención kappa se utiliza para especificar qué átomos del ligando se unen al átomo central y, en especies polinucleares, qué átomos, tanto con puente como sin puente, se unen a qué átomo central. En el caso de los ligandos monodentados, no existe ninguna ambigüedad en cuanto a qué átomo forma el enlace con el átomo central. Sin embargo, cuando un ligando tiene más de un átomo que puede unirse a un átomo central, se utiliza la convención kappa para especificar qué átomos de un ligando forman un enlace. El símbolo atómico del elemento está en cursiva y precedido por kappa, κ. Estos símbolos se colocan después de la parte del nombre del ligando que representa el anillo, la cadena, etc. donde se encuentra el ligando. Por ejemplo:
- pentaamminenitrito-κ O -cobalto(III) especifica que el ligando nitrito se une a través del átomo de oxígeno.
Cuando hay más de un enlace formado a partir de un ligando por un elemento en particular, un superíndice numérico indica el recuento. Por ejemplo:
- aqua[(etano-1,2-diildinitrilo-κ 2 N , N ′ )tris(acetato-κ O )acetato]cobaltato(1-), el anión cobalto formado con agua y edta pentadentado , que se une a través de dos átomos de nitrógeno y tres átomos de oxígeno. Hay dos enlaces de átomos de nitrógeno en edta que se especifican por -κ 2 N , N ′ . Los tres enlaces de oxígeno se especifican por tris(acetato-κ O ), donde hay una ligadura por acetato.
En los complejos polinucleares, el uso del símbolo kappa se extiende de dos maneras relacionadas. En primer lugar, para especificar qué átomos ligantes se unen a qué átomo central y, en segundo lugar, para especificar, en el caso de un ligando puente, qué átomos centrales están implicados. Los átomos centrales deben identificarse, es decir, asignándoles números (esto se aborda formalmente en las recomendaciones). Para especificar qué átomos ligantes de un ligando se unen a qué átomo central, los números de los átomos centrales preceden al símbolo kappa, y el superíndice numérico especifica el número de ligaduras, seguido del símbolo atómico. Las apariciones múltiples se separan con comas.
Ejemplos:
- dic-μ-clorido-tetraclorido-1κ2Cl , 2κ2Cl - dialuminio, ( tricloruro de aluminio ).
- tetracloruro-1κ 2 Cl,2κ 2 Cl especifica que hay dos ligandos de cloruro en cada átomo de aluminio.
- decacarbonil-1κ 3 C ,2κ 3 C ,3κ 4 C -di-μ-hidrido-1:2κ 2 H ;1:2κ 2 H - triangulo -(3 Os — Os ), ( Decacarbonildihidridotriosmio ).
- decacarbonil-1κ 3 C ,2κ 3 C ,3κ 4 C muestra que hay tres grupos carbonilo en dos átomos de osmio y cuatro en el tercero.
- di-μ-hidrido-1:2κ 2 H ;1:2κ 2 H especifica que el puente de dos hidruros está entre el átomo de osmio 1 y el átomo de osmio 2.
Convención eta, η
El uso de η para denotar hapticidad está sistematizado. No se recomienda el uso de η 1. Cuando la especificación de los átomos involucrados es ambigua, se debe especificar la posición de los átomos. Esto se ilustra con los ejemplos:
- Cr(η 6 -C 6 H 6 ) 2 , denominado bis(η 6 -benceno)cromo, ya que todos los átomos (contiguos) en los ligandos de benceno están involucrados; no es necesario especificar su posición.
- [(1,2,5,6-η)-cicloocta-1,3,5,7-tetraeno](η 5 -ciclopentadienil)cobalto en este solo dos (en las posiciones 1 y 5) de los cuatro enlaces dobles están unidos al átomo central.
Geometría de coordinación
Para cualquier número de coordinación superior a 2, es posible más de una geometría de coordinación. Por ejemplo, los compuestos de coordinación de cuatro coordenadas pueden ser tetraédricos, cuadriplanares, cuadripiramidales o con forma de balancín. El símbolo poliédrico se utiliza para describir la geometría. Se determina un índice de configuración a partir de las posiciones de los ligandos y, junto con el símbolo poliédrico , se coloca al principio del nombre. Por ejemplo, en el complejo ( SP -4-3)-(acetonitrilo)dicloruro(piridina)platino(II), el ( SP -4-3) al principio del nombre describe una geometría cuadriplanar, coordenada 4 con un índice de configuración de 3 que indica la posición de los ligandos alrededor del átomo central. Para obtener más detalles, consulte el símbolo poliédrico .
Grupos organometálicos 3–12
Generalmente se recomienda la nomenclatura aditiva para los compuestos organometálicos de los grupos 3-12 (metales de transición y zinc, cadmio y mercurio).
Metalocenos
Siguiendo el ejemplo del ferroceno (el primer compuesto sándwich con un átomo central de Fe coordinado a dos anillos de ciclopentadienilo paralelos), los nombres para compuestos con estructuras similares, como osmoceno y vanadoceno, son de uso común. La recomendación es que el nombre oceno , que termina en oceno , se restrinja a compuestos donde hay moléculas discretas de bis(η 5 -ciclopentadienil)metal (y análogos sustituidos en el anillo), donde los anillos de ciclopentadienilo son esencialmente paralelos y el metal está en el bloque d. La terminología NO se aplica a compuestos de elementos del bloque s o p, como Ba(C 5 H 5 ) 2 o Sn(C 5 H 5 ) 2 .
Ejemplos de compuestos que cumplen los criterios son:
- vanadoceno , [V(η 5 -C 5 H 5 ) 2 ]
- cromoceno , [Cr(η 5 -C 5 H 5 ) 2 ]
- cobaltoceno , [Co(η 5 -C 5 H 5 ) 2 ]
- rodoceno , [Rh(η 5 -C 5 H 5 ) 2 ]
- niqueloceno , [Ni(η 5 -C 5 H 5 ) 2 ]
- rutenoceno , [Ru(η 5 -C 5 H 5 ) 2 ]
- osmoceno , [Os(η 5 -C 5 H 5 ) 2 ]
- manganoceno , [Mn(η 5 -C 5 H 5 ) 2 ]
- renoceno , [Re(η 5 -C 5 H 5 ) 2 ].
Ejemplos de compuestos que no deben nombrarse como metalocenos son:
- C10H10Ti
- [Ti(η 5 -C 5 H 5 ) 2 Cl 2 ] se llama correctamente diclorurobis(η 5 -ciclopentadienil)titanio, NO dicloruro de titanoceno.
Compuestos de cúmulos polinucleares
Enlaces metal-metal
En los compuestos polinucleares con enlaces metal-metal, estos se muestran después del nombre del elemento de la siguiente manera: (3 Os — Os ) en Decacarbonyldihydridotriosmium . Un par de corchetes contiene un recuento de los enlaces formados (si son mayores que 1), seguido de los símbolos atómicos del elemento en cursiva separados por un "guión largo".
Geometría de cúmulos polinucleares
Las geometrías de los cúmulos polinucleares pueden variar en complejidad. Se puede utilizar un descriptor, por ejemplo, tetrahedro, o el descriptor CEP, por ejemplo, Td -(13)-Δ 4 - closo ]. Esto se determina por la complejidad del cúmulo. A continuación se muestran algunos ejemplos de descriptores y equivalentes CEP. (Los descriptores CEP reciben su nombre de Casey, Evans y Powell, quienes describieron el sistema. [4]
| Número de átomos | Descriptor | Descriptor CEP |
|---|---|---|
| 3 | triángulo | |
| 4 | cuadro | |
| 4 | tetraedro | [ Td -(13)-Δ 4 - cerrado ] |
| 5 | [ D 3h -(131)-Δ 6 - cerrado ] | |
| 6 | octaedro | [ O h -(141)-Δ 8 - cerrado ] |
| 6 | triprismo | |
| 8 | antiprisma | |
| 8 | dodecaedro | [ D 2d -(2222)-Δ 6 - cerrado ] |
| 12 | icosaedro | [ I h -(1551)-Δ 20 - cerrado ] |
Ejemplos:
decacarbonildimanganeso bis(pentacarbonilmanganeso) ( Mn — Mn )
bis(pentacarbonilmanganeso) ( Mn — Mn )
dodecacarboniltetrarodio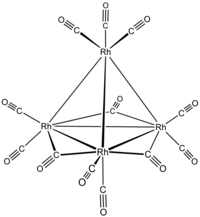 tri-μ-carbonil-1:2κ 2 C ;1:3κ 2 C ;2:3κ 2 C -nonacarbonil- 1κ 2 C ,2κ 2 C ,3κ 2 C ,4κ 3 C -[ T d -(13)- Δ 4 - closo ]-tetrarodio(6 Rh — Rh )
tri-μ-carbonil-1:2κ 2 C ;1:3κ 2 C ;2:3κ 2 C -nonacarbonil- 1κ 2 C ,2κ 2 C ,3κ 2 C ,4κ 3 C -[ T d -(13)- Δ 4 - closo ]-tetrarodio(6 Rh — Rh )
o tri-μ-carbonil-1:2κ 2 C ;1:3κ 2 C ;2:3κ 2 C -nonacarbonil- 1κ 2 C ,2κ 2 C ,3κ 2 C ,4κ 3 C -tetraedro-tetrarodio(6 Rh — Rh )
Ácidos inorgánicos
Nombres del hidrógeno
Las recomendaciones incluyen una descripción de los nombres de los hidrógenos para los ácidos. Los siguientes ejemplos ilustran el método:
- HNO3 hidrógeno (nitrato)
- H 2 SO 4 dihidrógeno(sulfato)
- HSO−4hidrógeno(sulfato) (2−)
- H 2 S dihidrógeno (sulfuro)
Tenga en cuenta que la diferencia con el método de denominación compositiva (sulfuro de hidrógeno) es que en la denominación del hidrógeno NO hay espacio entre los componentes electropositivos y electronegativos.
Este método no proporciona información estructural sobre la posición de los hidrones (átomos de hidrógeno). Si se desea transmitir esta información, se debe utilizar el nombre aditivo (consulte la lista a continuación para ver ejemplos).
Lista de nombres aceptables
Las recomendaciones ofrecen una lista completa de nombres aceptables para los ácidos comunes y los aniones relacionados. A continuación se muestra una selección de esta lista.
| nombre aceptable de ácido | Aniones relacionados: nombres aceptables y nombres de aditivos | ||
|---|---|---|---|
| ácido bórico , [B(OH) 3 ] | dihidrogenoborato, [BO(OH) 2 ] − dihidroxioxidoborato(1—) | hidrogenoborato, [BO 2 (OH)] 2 − hidroxidioxidoborato(2—) | borato, [BO 3 ] 3 − trioxidoborato(3—) |
| ácido carbónico , [CO(OH) 2 ] | hidrogenocarbonato, [CO 2 (OH)] − hidroxidioxidocarbonato(1−) | carbonato, [CO 3 ] 2 − trioxidocarbonato(2−) | |
| ácido clórico , [ClO 2 (OH)] hidroxidodioxidocloro | clorato, [ClO 3 ] − trioxidoclorato(1−) | ||
| ácido cloroso , [ClO(OH)] hidroxidooxidocloro | clorito, [ClO 2 ] − dioxidoclorato(1−) | ||
| ácido nítrico , [NO 2 (OH)] hidroxidioxidonitrógeno | nitrato, [NO−3] trioxidonitrato(1−) | ||
| ácido nitroso , [NO(OH)] hidroxidooxidonitrógeno | nitrito, [NO 2 ] − dioxidonitrato(1−) | ||
| ácido perclórico , [ClO 3 (OH)] hidroxidotrioxidocloro | perclorato, [ClO 4 ] − tetraoxiclorato(1−) | ||
| ácido fosfórico , [PO(OH) 3 ] trihidroxioxidofosforo | dihidrogenofosfato, [PO 2 (OH) 2 ] − dihidroxidodioxidofosfato(1−) | hidrogenofosfato, [PO 3 (OH)] 2 − hidroxitrioxidofosfato(2−) | fosfato, [PO 4 ] 3 − tetraoxidofosfato(3—) |
| ácido fosfónico , [PHO(OH) 2 ] hidridodihidroxidooxidofosforo | hidrogenofosfonato, [PHO 2 (OH)] − hidridohidroxidioxidofosfato(1−) | fosfonato, [PHO 3 ] 2 − hidridotrioxidofosfato(2−) | |
| ácido fosforoso, H 3 PO 3 trihidroxifosforo | dihidrogenofosfito [PO(OH) 2 ] − dihidroxioxidofosfato(1−)) | hidrogenofosfito, [PO 2 (OH)] 2 − hidroxidioxidofosfato(2−) | fosfito, [PO 3 ] 3 − trioxidofosfato(3−) |
| ácido sulfúrico, [SO 2 (OH) 2 ] dihidroxidióxidosulfuro | hidrogenosulfato, [SO 3 (OH)] − hidroxitrioxidosulfato(1−) | sulfato, [SO 4 ] 2 − tetraoxidosulfato(2−) | |
Sólidos
Las fases estequiométricas se nombran según su composición. Las fases no estequiométricas son más difíciles. Siempre que sea posible, se deben utilizar fórmulas, pero cuando sea necesario, se pueden utilizar denominaciones como las siguientes:
- sulfuro de hierro (II) (deficiente en hierro)
- dicarburo de molibdeno (exceso de carbono)
Nombres de minerales
En general, no se deben utilizar los nombres de los minerales para especificar la composición química. Sin embargo, se puede utilizar un nombre de mineral para especificar el tipo de estructura en una fórmula, por ejemplo:
- BaTiO 3 (tipo perovskita)
Fórmulas aproximadas y composición variable
Se puede utilizar una notación simple cuando hay poca información disponible sobre el mecanismo de variabilidad o no es necesario transmitirla:
- ~ FeS (circa o aproximadamente)
Cuando hay un rango continuo de composición, esto se puede escribir, por ejemplo, K(Br,Cl) para una mezcla de KBr y KCl y (Li 2 ,Mg)Cl 2 para una mezcla de LiCl y MgCl 2 . La recomendación es utilizar el siguiente método generalizado, por ejemplo
- Cu x Ni 1−x para (Cu,Ni)
- KBr x Cl 1−x para K(Br,Cl)
Nótese que las vacantes de cationes en CoO podrían describirse mediante CoO 1−x
Notación de defectos puntuales (Kröger-Vink)
Los defectos puntuales, la simetría del sitio y la ocupación del sitio se pueden describir utilizando la notación Kröger-Vink ; tenga en cuenta que la preferencia de la IUPAC es que las vacantes se especifiquen mediante V en lugar de V (el elemento vanadio).
Nomenclatura de fases
Para especificar la forma cristalina de un compuesto o elemento se puede utilizar el símbolo de Pearson . No se acepta el uso de Strukturbericht (p. ej. A1, etc.) ni letras griegas. El símbolo de Pearson puede ir seguido del grupo espacial y de la fórmula del prototipo. Algunos ejemplos son:
- carbono (c F 8 ) , diamante
- RuAl (C P2 2, Pm3m) ( tipo CsCl )
Polimorfismo
Se recomienda que los polimorfos se identifiquen (por ejemplo, para ZnS donde las dos formas son zincblenda (cúbica) y wurtzita (hexagonal)), como ZnS( c ) y ZnS( h ) respectivamente.
Notas y referencias
- ^ Nomenclatura de la química inorgánica Recomendaciones de la IUPAC , edición de 2005. NG Connelly et al. RSC Publishing https://iupac.org/what-we-do/books/redbook/
- ^ Nomenclatura de la química inorgánica Recomendaciones de la IUPAC 2005 - Texto completo (PDF)
- ^ Correcciones a la nomenclatura de la química inorgánica: Recomendaciones de la IUPAC 2005
- ^ "Un sistema de descripción y principios para numerar poliedros de boro cerrados con al menos un eje de simetría rotacional y un plano de simetría". Casey JB, Evans WJ, Powell WH Inorg. Chem. , 20, 5,(1981), 1333–1341 doi :10.1021/ic50219a001
