Molibdeno
El molibdeno es un elemento químico ; su símbolo es Mo (del neolatín molybdaenum ) y su número atómico es 42. El nombre deriva del griego antiguo Μόλυβδος molybdos , que significa plomo , ya que sus minerales se confundían con los minerales de plomo. [10] Los minerales de molibdeno se conocen desde hace mucho tiempo, pero el elemento fue descubierto (en el sentido de diferenciarlo como una nueva entidad de las sales minerales de otros metales) en 1778 por Carl Wilhelm Scheele . El metal fue aislado por primera vez en 1781 por Peter Jacob Hjelm . [11]
El molibdeno no se encuentra de forma natural como metal libre en la Tierra; en sus minerales, solo se encuentra en estado oxidado . El elemento libre, un metal plateado con un tono grisáceo, tiene el sexto punto de fusión más alto de todos los elementos. Forma fácilmente carburos duros y estables en aleaciones y, por este motivo, la mayor parte de la producción mundial del elemento (alrededor del 80 %) se utiliza en aleaciones de acero , incluidas aleaciones de alta resistencia y superaleaciones .
La mayoría de los compuestos de molibdeno tienen una baja solubilidad en agua. Calentar minerales que contienen molibdeno bajo oxígeno y agua produce iones de molibdato MoO2−
4, que forma sales bastante solubles. En la industria, los compuestos de molibdeno (alrededor del 14% de la producción mundial del elemento) se utilizan como pigmentos y catalizadores .
Las enzimas que contienen molibdeno son, con diferencia, los catalizadores bacterianos más comunes para romper el enlace químico en el nitrógeno molecular atmosférico en el proceso de fijación biológica del nitrógeno . En la actualidad se conocen al menos 50 enzimas de molibdeno en bacterias, plantas y animales, aunque solo las enzimas bacterianas y cianobacterianas participan en la fijación del nitrógeno. La mayoría de las nitrogenasas contienen un cofactor de hierro-molibdeno FeMoco , que se cree que contiene Mo(III) o Mo(IV). [12] [13] Por el contrario, Mo(VI) y Mo(IV) forman complejos con molibdopterina en todas las demás enzimas que contienen molibdeno. [14] El molibdeno es un elemento esencial para todos los organismos eucariotas superiores , incluidos los humanos. Una especie de esponja , Theonella conica , es conocida por la hiperacumulación de molibdeno. [15]
Características
Propiedades físicas
En su forma pura, el molibdeno es un metal gris plateado con una dureza Mohs de 5,5 y un peso atómico estándar de 95,95 g/mol. [16] [17] Tiene un punto de fusión de 2623 °C (4753 °F), el sexto más alto de los elementos naturales; solo el tántalo , el osmio , el renio , el tungsteno y el carbono tienen puntos de fusión más altos. [10] Tiene uno de los coeficientes de expansión térmica más bajos entre los metales utilizados comercialmente. [18]
Propiedades químicas
El molibdeno es un metal de transición con una electronegatividad de 2,16 en la escala de Pauling. No reacciona visiblemente con el oxígeno o el agua a temperatura ambiente, pero es atacado por halógenos y peróxido de hidrógeno. La oxidación débil del molibdeno comienza a 300 °C (572 °F); la oxidación en masa ocurre a temperaturas superiores a 600 °C, lo que da como resultado trióxido de molibdeno . Al igual que muchos metales de transición más pesados, el molibdeno muestra poca inclinación a formar un catión en solución acuosa, aunque se sabe que el catión Mo 3+ se forma en condiciones cuidadosamente controladas. [19]
El molibdeno gaseoso está formado por la especie diatómica Mo 2 . Esa molécula es un singlete , con dos electrones desapareados en orbitales de enlace, además de 5 enlaces convencionales. El resultado es un enlace séxtuple . [20] [21]
Isótopos
Se conocen 39 isótopos de molibdeno, cuya masa atómica oscila entre 81 y 119, así como 13 isómeros nucleares metaestables . Siete isótopos se encuentran en la naturaleza, con masas atómicas de 92, 94, 95, 96, 97, 98 y 100. De estos isótopos naturales, solo el molibdeno-100 es inestable. [8]
El molibdeno-98 es el isótopo más abundante , ya que representa el 24,14 % de todo el molibdeno. El molibdeno-100 tiene una vida media de aproximadamente 10 19 y y sufre una doble desintegración beta en rutenio-100. Todos los isótopos inestables del molibdeno se desintegran en isótopos de niobio , tecnecio y rutenio . De los radioisótopos sintéticos , el más estable es el 93 Mo, con una vida media de 4.839 años. [9]
La aplicación isotópica más común del molibdeno es el molibdeno-99 , que es un producto de fisión . Es un radioisótopo progenitor del radioisótopo emisor de rayos gamma de vida corta tecnecio-99m , un isómero nuclear utilizado en diversas aplicaciones de imágenes en medicina. [22] En 2008, la Universidad Tecnológica de Delft solicitó una patente para la producción de molibdeno-99 a partir de molibdeno-98. [23]
Compuestos
El molibdeno forma compuestos químicos en estados de oxidación −4 y de −2 a +6. Los estados de oxidación más altos son más relevantes para su ocurrencia terrestre y sus roles biológicos, los estados de oxidación de nivel medio a menudo se asocian con cúmulos metálicos , y los estados de oxidación muy bajos se asocian típicamente con compuestos de organomolibdeno . La química del molibdeno y el tungsteno muestra fuertes similitudes. La relativa rareza del molibdeno (III), por ejemplo, contrasta con la omnipresencia de los compuestos de cromo (III). El estado de oxidación más alto se observa en el óxido de molibdeno (VI) (MoO 3 ), mientras que el compuesto de azufre normal es el disulfuro de molibdeno MoS 2 . [24]
Estado de oxidación | Ejemplo [25] [26] |
|---|---|
| -4 | N / A 4[Mo(CO2)] 4] |
| -2 | [Mo(CO2)] 5]2− [27] |
| -1 | N / A 2[Mes 2(CO) 10] |
| 0 | Mo(CO) 6 |
| +1 | do 5yo 5Mo(CO) 3 |
| +2 | MoCl 2 |
| +3 | MoBr 3 |
| +4 | Ministerio de Estado 2 |
| +5 | MoCl 5 |
| +6 | Ministerio de Finanzas 6 |

Desde la perspectiva comercial, los compuestos más importantes son el disulfuro de molibdeno ( MoS
2) y trióxido de molibdeno ( MoO
3). El disulfuro negro es el mineral principal. Se tuesta al aire para dar el trióxido: [24]
- 2 meses
2+ 7 O
2→ 2 MoO
3+ 4 SO
2
El trióxido, que es volátil a altas temperaturas, es el precursor de prácticamente todos los demás compuestos de Mo, así como de las aleaciones. El molibdeno tiene varios estados de oxidación , siendo los más estables +4 y +6 (en negrita en la tabla de la izquierda).
El óxido de molibdeno (VI) es soluble en agua alcalina fuerte, formando molibdatos (MoO 4 2− ). Los molibdatos son oxidantes más débiles que los cromatos . Tienden a formar oxianiones estructuralmente complejos por condensación a valores de pH más bajos , como [Mo 7 O 24 ] 6− y [Mo 8 O 26 ] 4− . Los polimolibdatos pueden incorporar otros iones, formando polioxometalatos . [28] El heteropolimolibdato azul oscuro que contiene fósforo P[Mo 12 O 40 ] 3− se utiliza para la detección espectroscópica de fósforo. [29]
La amplia gama de estados de oxidación del molibdeno se refleja en varios cloruros de molibdeno: [24]
- Cloruro de molibdeno (II) MoCl 2 , que existe como hexámero Mo 6 Cl 12 y el dianión relacionado [Mo 6 Cl 14 ] 2- .
- Cloruro de molibdeno (III) MoCl 3 , un sólido rojo oscuro, que se convierte en el complejo aniónico trianiónico [MoCl 6 ] 3- .
- Cloruro de molibdeno (IV) MoCl 4 , un sólido negro, que adopta una estructura polimérica.
- Cloruro de molibdeno (V) MoCl 5, sólido verde oscuro, que adopta una estructura dimérica.
- El cloruro de molibdeno (VI) MoCl 6 es un sólido negro, monomérico y que se descompone lentamente en MoCl 5 y Cl 2 a temperatura ambiente. [30]
La accesibilidad de estos estados de oxidación depende en gran medida del contraión haluro: aunque el fluoruro de molibdeno (VI) es estable, el molibdeno no forma un hexacloruro, pentabromuro o tetrayoduro estables. [31]
Al igual que el cromo y algunos otros metales de transición, el molibdeno forma enlaces cuádruples , como en Mo 2 (CH 3 COO) 4 y [Mo 2 Cl 8 ] 4− . [24] [32] Se han informado las propiedades de ácido de Lewis de los dímeros de butirato y perfluorobutirato, Mo 2 (O 2 CR) 4 y Rh 2 (O 2 CR) 4 . [33]
El estado de oxidación 0 y menores son posibles con monóxido de carbono como ligando, como en el hexacarbonilo de molibdeno , Mo(CO) 6 . [24] [26]
Historia
La molibdenita , el principal mineral del que se extrae actualmente el molibdeno, se conocía anteriormente como molibdena. La molibdena se confundía con el grafito y a menudo se utilizaba como si fuera grafito . Al igual que el grafito, la molibdenita se puede utilizar para ennegrecer una superficie o como lubricante sólido. [34] Incluso cuando la molibdena se distinguía del grafito, todavía se confundía con el mineral de plomo común PbS (ahora llamado galena ); el nombre proviene del griego antiguo Μόλυβδος molybdos , que significa plomo . [18] (La palabra griega en sí misma se ha propuesto como un préstamo lingüístico de las lenguas luvianas y lidias de Anatolia ). [35]
Aunque (según se dice) el molibdeno se aleaba deliberadamente con acero en una espada japonesa del siglo XIV (fabricada alrededor de 1330 ), ese arte nunca se empleó ampliamente y luego se perdió. [36] [37] En Occidente, en 1754, Bengt Andersson Qvist examinó una muestra de molibdenita y determinó que no contenía plomo y, por lo tanto, no era galena. [38]
En 1778, el químico sueco Carl Wilhelm Scheele afirmó firmemente que el molibdeno no era (de hecho) ni galena ni grafito. [39] [40] En cambio, Scheele propuso correctamente que el molibdeno era un mineral de un nuevo elemento distinto, llamado molibdeno por el mineral en el que residía y del que podría aislarse. Peter Jacob Hjelm aisló con éxito el molibdeno utilizando carbón y aceite de linaza en 1781. [18] [41]
Durante el siglo siguiente, el molibdeno no tuvo uso industrial. Era relativamente escaso, el metal puro era difícil de extraer y las técnicas necesarias de metalurgia eran inmaduras. [42] [43] [44] Las primeras aleaciones de acero de molibdeno mostraron una gran promesa de mayor dureza, pero los esfuerzos para fabricar las aleaciones a gran escala se vieron obstaculizados por resultados inconsistentes, una tendencia a la fragilidad y la recristalización. En 1906, William D. Coolidge presentó una patente para hacer que el molibdeno fuera dúctil , lo que llevó a aplicaciones como elemento de calentamiento para hornos de alta temperatura y como soporte para bombillas de filamento de tungsteno; la formación y degradación de óxido requieren que el molibdeno esté físicamente sellado o mantenido en un gas inerte. [45] En 1913, Frank E. Elmore desarrolló un proceso de flotación por espuma para recuperar molibdenita de los minerales; la flotación sigue siendo el proceso de aislamiento principal. [46]
Durante la Primera Guerra Mundial , la demanda de molibdeno se disparó; se utilizó tanto en blindaje como sustituto del tungsteno en aceros de alta velocidad . Algunos tanques británicos estaban protegidos por placas de acero al manganeso de 75 mm (3 pulgadas) , pero esto resultó ser ineficaz. Las placas de acero al manganeso se reemplazaron por placas de acero al molibdeno mucho más ligeras de 25 mm (1,0 pulgadas), lo que permitió una mayor velocidad, mayor maniobrabilidad y mejor protección. [18] Los alemanes también utilizaron acero dopado con molibdeno para artillería pesada, como en el obús superpesado Big Bertha , [47] porque el acero tradicional se funde a las temperaturas producidas por el propulsor del proyectil de una tonelada . [48] Después de la guerra, la demanda se desplomó hasta que los avances metalúrgicos permitieron un amplio desarrollo de aplicaciones en tiempos de paz. En la Segunda Guerra Mundial , el molibdeno volvió a tener importancia estratégica como sustituto del tungsteno en aleaciones de acero. [49]
Ocurrencia y producción

El molibdeno es el 54.º elemento más abundante en la corteza terrestre , con un promedio de 1,5 partes por millón, y el 25.º elemento más abundante en los océanos, con un promedio de 10 partes por mil millones; es el 42.º elemento más abundante en el Universo. [18] [50] La misión soviética Luna 24 descubrió un grano que contenía molibdeno (1 × 0,6 μm) en un fragmento de piroxeno tomado del Mare Crisium en la Luna . [51] La rareza comparativa del molibdeno en la corteza terrestre se compensa con su concentración en varios minerales insolubles en agua, a menudo combinados con azufre de la misma manera que el cobre, con el que a menudo se encuentra. Aunque el molibdeno se encuentra en minerales como la wulfenita (PbMoO 4 ) y la powellita (CaMoO 4 ), la principal fuente comercial es la molibdenita (Mo S 2 ). El molibdeno se extrae como mineral principal y también se recupera como subproducto de la minería de cobre y tungsteno. [10]
La producción mundial de molibdeno fue de 250.000 toneladas en 2011, siendo los mayores productores China (94.000 t), Estados Unidos (64.000 t), Chile (38.000 t), Perú (18.000 t) y México (12.000 t). Las reservas totales se estiman en 10 millones de toneladas, y se concentran principalmente en China (4,3 Mt), Estados Unidos (2,7 Mt) y Chile (1,2 Mt). Por continente, el 93% de la producción mundial de molibdeno se reparte de forma más o menos uniforme entre América del Norte, América del Sur (principalmente en Chile) y China. Europa y el resto de Asia (principalmente Armenia, Rusia, Irán y Mongolia) producen el resto. [52]

En el procesamiento de la molibdenita, el mineral se tuesta primero al aire a una temperatura de 700 °C (1292 °F). El proceso produce dióxido de azufre gaseoso y óxido de molibdeno (VI) : [24]
El óxido resultante se suele extraer luego con amoníaco acuoso para dar molibdato de amonio:
El cobre, una impureza de la molibdenita, se separa en esta etapa mediante un tratamiento con sulfuro de hidrógeno . [24] El molibdato de amonio se convierte en dimolibdato de amonio , que se aísla en forma sólida. Al calentar este sólido se obtiene trióxido de molibdeno: [53]
El trióxido crudo se puede purificar aún más mediante sublimación a 1100 °C (2010 °F).
El molibdeno metálico se produce por reducción del óxido con hidrógeno:
El molibdeno para la producción de acero se reduce mediante la reacción aluminotérmica con adición de hierro para producir ferromolibdeno . Una forma común de ferromolibdeno contiene un 60 % de molibdeno. [24] [54]
El molibdeno tenía un valor de aproximadamente 30.000 dólares por tonelada en agosto de 2009. Mantuvo un precio cercano a los 10.000 dólares por tonelada desde 1997 hasta 2003, y alcanzó un máximo de 103.000 dólares por tonelada en junio de 2005. [55] En 2008, la Bolsa de Metales de Londres anunció que el molibdeno se comercializaría como una materia prima. [56]
Minería
La mina Knaben , en el sur de Noruega, inaugurada en 1885, fue la primera mina dedicada exclusivamente al molibdeno. Cerrada en 1973 pero reabierta en 2007, [57] ahora produce 100.000 kilogramos (98 toneladas largas; 110 toneladas cortas) de disulfuro de molibdeno por año. Las grandes minas en Colorado (como la mina Henderson y la mina Climax ) [58] y en Columbia Británica producen molibdenita como su producto principal, mientras que muchos depósitos de pórfido de cobre como la mina Bingham Canyon en Utah y la mina Chuquicamata en el norte de Chile producen molibdeno como subproducto de la minería del cobre.
Aplicaciones
Aleaciones

Alrededor del 86% del molibdeno producido se utiliza en metalurgia , y el resto se utiliza en aplicaciones químicas. El uso mundial estimado es el siguiente: acero estructural (35%), acero inoxidable (25%), productos químicos (14%), aceros para herramientas y de alta velocidad (9%), hierro fundido (6%), metal elemental molibdeno (6%) y superaleaciones (5%). [59]
El molibdeno puede soportar temperaturas extremas sin expandirse o ablandarse significativamente, lo que lo hace útil en entornos de calor intenso, incluidos blindajes militares, piezas de aeronaves, contactos eléctricos, motores industriales y soportes para filamentos en bombillas . [18] [60]
La mayoría de las aleaciones de acero de alta resistencia (por ejemplo, los aceros 41xx ) contienen entre un 0,25% y un 8% de molibdeno. [10] Incluso en estas pequeñas porciones, cada año se utilizan más de 43.000 toneladas de molibdeno en aceros inoxidables , aceros para herramientas , fundiciones y superaleaciones de alta temperatura . [50]
El molibdeno también se utiliza en aleaciones de acero por su alta resistencia a la corrosión y soldabilidad . [50] [52] El molibdeno contribuye a la resistencia a la corrosión de los aceros inoxidables tipo 300 (específicamente el tipo 316) y especialmente en los llamados aceros inoxidables superausteníticos (como la aleación AL-6XN , 254SMO y 1925hMo). El molibdeno aumenta la deformación reticular, aumentando así la energía necesaria para disolver los átomos de hierro de la superficie. [ contradictorio ] El molibdeno también se utiliza para mejorar la resistencia a la corrosión de los aceros inoxidables ferríticos (por ejemplo, grado 444) [61] y martensíticos (por ejemplo, 1.4122 y 1.4418). [ cita requerida ]
Debido a su menor densidad y precio más estable, el molibdeno se utiliza a veces en lugar del tungsteno. [50] Un ejemplo es la serie 'M' de aceros de alta velocidad como M2, M4 y M42 como sustitución de la serie de acero 'T', que contiene tungsteno. El molibdeno también se puede utilizar como revestimiento resistente al fuego para otros metales. Aunque su punto de fusión es de 2.623 °C (4.753 °F), el molibdeno se oxida rápidamente a temperaturas superiores a 760 °C (1.400 °F), lo que lo hace más adecuado para su uso en entornos de vacío. [60]
El TZM (Mo (~99 %), Ti (~0,5 %), Zr (~0,08 %) y algo de C) es una superaleación de molibdeno resistente a la corrosión que resiste las sales de fluoruro fundidas a temperaturas superiores a 1300 °C (2370 °F). Tiene aproximadamente el doble de resistencia que el Mo puro, y es más dúctil y más soldable, pero en pruebas resistió la corrosión de una sal eutéctica estándar ( FLiBe ) y vapores de sal utilizados en reactores de sal fundida durante 1100 horas con tan poca corrosión que fue difícil de medir. [62] [63] Debido a sus excelentes propiedades mecánicas a alta temperatura y alta presión, las aleaciones TZM se aplican ampliamente en la industria militar. [64] Se utiliza como cuerpo de válvula de motores de torpedos , toberas de cohetes y gasoductos, donde puede soportar tensiones térmicas y mecánicas extremas. [65] [66] También se utiliza como escudos de radiación en aplicaciones nucleares. [67]
Otras aleaciones a base de molibdeno que no contienen hierro tienen aplicaciones limitadas. Por ejemplo, debido a su resistencia al zinc fundido, tanto el molibdeno puro como las aleaciones de molibdeno- tungsteno (70%/30%) se utilizan para tuberías, agitadores e impulsores de bombas que entran en contacto con el zinc fundido. [68]
Aplicaciones de elementos puros
- El polvo de molibdeno se utiliza como fertilizante para algunas plantas, como la coliflor . [50]
- El molibdeno elemental se utiliza en los analizadores de NO, NO 2 , NO x de las centrales eléctricas para controlar la contaminación. A 350 °C (662 °F), el elemento actúa como catalizador para que el NO 2 /NO x forme moléculas de NO que se pueden detectar mediante luz infrarroja. [69]
- Los ánodos de molibdeno reemplazan al tungsteno en ciertas fuentes de rayos X de bajo voltaje para usos especializados como la mamografía . [70]
- El isótopo radiactivo molibdeno-99 se utiliza para generar tecnecio-99m , que se utiliza para imágenes médicas [71]. El isótopo se manipula y almacena como molibdato. [72]
Aplicaciones compuestas
- El disulfuro de molibdeno (MoS 2 ) se utiliza como lubricante sólido y agente antidesgaste para altas presiones y altas temperaturas (HPHT). Forma películas resistentes sobre superficies metálicas y es un aditivo común en las grasas HPHT: en caso de una falla catastrófica de la grasa, una fina capa de molibdeno evita el contacto de las piezas lubricadas. [73]
- Cuando se combina con pequeñas cantidades de cobalto, el MoS2 también se utiliza como catalizador en la hidrodesulfuración (HDS) del petróleo. En presencia de hidrógeno, este catalizador facilita la eliminación de nitrógeno y, especialmente, azufre de la materia prima, que de otro modo envenenarían los catalizadores posteriores. La HDS es una de las aplicaciones de catálisis a mayor escala en la industria. [74]
- Los óxidos de molibdeno son catalizadores importantes para la oxidación selectiva de compuestos orgánicos. La producción de productos químicos básicos como el acrilonitrilo y el formaldehído depende de catalizadores basados en MoO x [53] .
- El disiliciuro de molibdeno (MoSi 2 ) es una cerámica conductora de electricidad cuyo uso principal es en elementos de calefacción que funcionan a temperaturas superiores a 1500 °C en el aire. [75]
- El trióxido de molibdeno (MoO 3 ) se utiliza como adhesivo entre esmaltes y metales. [39]
- El molibdato de plomo (wulfenita) coprecipitado con cromato de plomo y sulfato de plomo es un pigmento de color naranja brillante que se utiliza con cerámicas y plásticos. [76]
- Los óxidos mixtos a base de molibdeno son catalizadores versátiles en la industria química. Algunos ejemplos son los catalizadores para la oxidación de monóxido de carbono, propileno a acroleína y ácido acrílico, y la amoxidación de propileno a acrilonitrilo. [77] [78]
- Los carburos, nitruros y fosfuros de molibdeno se pueden utilizar para el hidrotratamiento del aceite de colza. [79]
- El heptamolibdato de amonio se utiliza en tinción biológica. [80]
- El vidrio sódico-cálcico recubierto de molibdeno se utiliza en células solares CIGS ( cobre, indio, galio seleniuro ) , llamadas células solares CIGS .
- El ácido fosfomolíbdico es un colorante utilizado en cromatografía de capa fina [81] y tinción tricrómica en histoquímica . [82]
Papel biológico
Enzimas que contienen Mo
El molibdeno es un elemento esencial en la mayoría de los organismos; un artículo de investigación de 2008 especuló que la escasez de molibdeno en los primeros océanos de la Tierra puede haber influido fuertemente en la evolución de la vida eucariota (que incluye todas las plantas y animales). [83]
Se han identificado al menos 50 enzimas que contienen molibdeno, principalmente en bacterias. [84] [85] Esas enzimas incluyen la aldehído oxidasa , la sulfito oxidasa y la xantina oxidasa . [18] Con una excepción, el Mo en las proteínas se une a la molibdopterina para dar el cofactor molibdeno. La única excepción conocida es la nitrogenasa , que utiliza el cofactor FeMoco , que tiene la fórmula Fe 7 MoS 9 C. [86]
En términos de función, las molibdoenzimas catalizan la oxidación y, a veces, la reducción de ciertas moléculas pequeñas en el proceso de regulación del nitrógeno , el azufre y el carbono . [87] En algunos animales y en los seres humanos, la oxidación de la xantina a ácido úrico , un proceso de catabolismo de las purinas , es catalizada por la xantina oxidasa , una enzima que contiene molibdeno. La actividad de la xantina oxidasa es directamente proporcional a la cantidad de molibdeno en el cuerpo. Una concentración extremadamente alta de molibdeno revierte la tendencia y puede inhibir el catabolismo de las purinas y otros procesos. La concentración de molibdeno también afecta la síntesis de proteínas , el metabolismo y el crecimiento. [88]
El Mo es un componente de la mayoría de las nitrogenasas . Entre las molibdoenzimas, las nitrogenasas son las únicas que carecen de molibdopterina. [89] [90] Las nitrogenasas catalizan la producción de amoníaco a partir del nitrógeno atmosférico:
La biosíntesis del sitio activo de FeMoco es altamente compleja. [91]

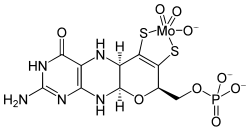
El molibdato se transporta en el cuerpo como MoO 4 2− . [88]
Metabolismo humano y deficiencia
El molibdeno es un oligoelemento dietético esencial . [92] Se conocen cuatro enzimas dependientes de Mo en mamíferos, todas ellas albergando un cofactor de molibdeno basado en pterina (Moco) en su sitio activo: sulfito oxidasa , xantina oxidorreductasa , aldehído oxidasa y amidoxima reductasa mitocondrial . [93] Las personas con deficiencia grave de molibdeno tienen una sulfito oxidasa que funciona mal y son propensas a reacciones tóxicas a los sulfitos en los alimentos. [94] [95] El cuerpo humano contiene alrededor de 0,07 mg de molibdeno por kilogramo de peso corporal, [96] con concentraciones más altas en el hígado y los riñones y más bajas en las vértebras. [50] El molibdeno también está presente en el esmalte dental humano y puede ayudar a prevenir su caries. [97]
No se ha observado toxicidad aguda en humanos, y la toxicidad depende en gran medida del estado químico. Los estudios en ratas muestran una dosis letal media ( LD50 ) tan baja como 180 mg/kg para algunos compuestos de Mo. [98] Aunque no hay datos de toxicidad humana disponibles, los estudios en animales han demostrado que la ingestión crónica de más de 10 mg/día de molibdeno puede causar diarrea, retraso del crecimiento, infertilidad , bajo peso al nacer y gota ; también puede afectar los pulmones, los riñones y el hígado. [99] [100] El tungstato de sodio es un inhibidor competitivo del molibdeno. El tungsteno dietético reduce la concentración de molibdeno en los tejidos. [50]
La baja concentración de molibdeno en el suelo en una franja geográfica que va desde el norte de China hasta Irán da lugar a una deficiencia general de molibdeno en la dieta y está asociada a mayores tasas de cáncer de esófago . [101] [102] [103] En comparación con Estados Unidos, que tiene un mayor suministro de molibdeno en el suelo, las personas que viven en esas zonas tienen un riesgo aproximadamente 16 veces mayor de padecer carcinoma de células escamosas de esófago . [104]
También se ha informado de una deficiencia de molibdeno como consecuencia de una nutrición parenteral total sin suplementos de molibdeno (alimentación intravenosa completa) durante largos períodos de tiempo. Esto produce niveles elevados de sulfito y urato en sangre , de forma muy similar a la deficiencia del cofactor de molibdeno . Dado que la deficiencia pura de molibdeno por esta causa se produce principalmente en adultos, las consecuencias neurológicas no son tan marcadas como en los casos de deficiencia congénita del cofactor. [105]
Una enfermedad congénita por deficiencia del cofactor de molibdeno , que se observa en los bebés, es una incapacidad para sintetizar el cofactor de molibdeno , la molécula heterocíclica analizada anteriormente que se une al molibdeno en el sitio activo de todas las enzimas humanas conocidas que utilizan molibdeno. La deficiencia resultante da como resultado niveles elevados de sulfito y urato y daño neurológico. [106] [107]
Excreción
La mayor parte del molibdeno se excreta del cuerpo humano en forma de molibdato en la orina. Además, la excreción urinaria de molibdeno aumenta a medida que aumenta la ingesta de molibdeno en la dieta. Pequeñas cantidades de molibdeno se excretan del cuerpo en las heces a través de la bilis; también se pueden perder pequeñas cantidades en el sudor y en el cabello. [108] [109]
Exceso y antagonismo del cobre
Los altos niveles de molibdeno pueden interferir con la absorción de cobre por parte del cuerpo , produciendo deficiencia de cobre . El molibdeno impide que las proteínas plasmáticas se unan al cobre y también aumenta la cantidad de cobre que se excreta en la orina . Los rumiantes que consumen altos niveles de molibdeno sufren diarrea , retraso del crecimiento, anemia y acromotriquia (pérdida de pigmento del pelaje). Estos síntomas pueden aliviarse con suplementos de cobre, ya sea dietéticos o inyectables. [110] La deficiencia efectiva de cobre puede verse agravada por el exceso de azufre . [50] [111]
La reducción o deficiencia de cobre también puede ser inducida deliberadamente con fines terapéuticos por el compuesto tetratiomolibdato de amonio , en el que el anión rojo brillante tetratiomolibdato es el agente quelante del cobre. El tetratiomolibdato se utilizó por primera vez terapéuticamente en el tratamiento de la toxicosis por cobre en animales. Luego se introdujo como tratamiento en la enfermedad de Wilson , un trastorno hereditario del metabolismo del cobre en humanos; actúa tanto compitiendo con la absorción de cobre en el intestino como aumentando la excreción. También se ha descubierto que tiene un efecto inhibidor sobre la angiogénesis , potencialmente al inhibir el proceso de translocación de membrana que depende de los iones de cobre. [112] Esta es una vía prometedora para la investigación de tratamientos para el cáncer , la degeneración macular relacionada con la edad y otras enfermedades que implican una proliferación patológica de los vasos sanguíneos. [113] [114]
En algunos animales de pastoreo, especialmente en el ganado vacuno, el exceso de molibdeno en el suelo del pastizal puede producir diarrea si el pH del suelo es de neutro a alcalino; ver diarrea.
Mamografía
Los objetivos de molibdeno se utilizan en mamografía porque producen rayos X en el rango de energía de 17-20 keV, que es óptimo para obtener imágenes de tejidos blandos como la mama. [115] [116] Los rayos X característicos emitidos por el molibdeno proporcionan un alto contraste entre diferentes tipos de tejidos, lo que permite la visualización efectiva de microcalcificaciones y otras anomalías sutiles en el tejido mamario. [117] Este rango de energía también minimiza la dosis de radiación al tiempo que maximiza la calidad de la imagen, lo que hace que los objetivos de molibdeno sean particularmente adecuados para la detección del cáncer de mama. [118]
Recomendaciones dietéticas
En el año 2000, el Instituto de Medicina de los Estados Unidos (hoy Academia Nacional de Medicina , NAM) actualizó sus Requerimientos Promedio Estimados (EAR) y las Ingestas Dietéticas Recomendadas (RDA) de molibdeno. Si no hay suficiente información para establecer EAR y RDA, se utiliza en su lugar una estimación denominada Ingesta Adecuada (AI).
Se estableció una IAD de 2 microgramos (μg) de molibdeno por día para lactantes de hasta 6 meses de edad, y 3 μg/día de 7 a 12 meses de edad, tanto para varones como para mujeres. Para niños mayores y adultos, se han establecido las siguientes IDR diarias de molibdeno: 17 μg de 1 a 3 años de edad, 22 μg de 4 a 8 años, 34 μg de 9 a 13 años, 43 μg de 14 a 18 años y 45 μg para personas de 19 años y más. Todas estas IDR son válidas para ambos sexos. Las mujeres embarazadas o lactantes de 14 a 50 años de edad tienen una IDR diaria más alta de 50 μg de molibdeno.
En cuanto a la seguridad, la NAM establece niveles máximos de ingesta tolerables (UL) para vitaminas y minerales cuando la evidencia es suficiente. En el caso del molibdeno, el UL es de 2000 μg/día. En conjunto, las EAR, RDA, AI y UL se denominan Ingestas Dietéticas de Referencia (DRI). [119]
La Autoridad Europea de Seguridad Alimentaria (AESA) se refiere al conjunto colectivo de información como Valores Dietéticos de Referencia, con Ingesta de Referencia Poblacional (PRI) en lugar de RDA, y Requerimiento Promedio en lugar de EAR. La IA y el UL se definen de la misma manera que en los Estados Unidos. Para mujeres y hombres de 15 años o más, la IA se establece en 65 μg/día. Las mujeres embarazadas y lactantes tienen la misma IA. Para los niños de 1 a 14 años, las IA aumentan con la edad de 15 a 45 μg/día. Las IA para adultos son más altas que las RDA de EE. UU. [120], pero, por otro lado, la Autoridad Europea de Seguridad Alimentaria revisó la misma cuestión de seguridad y estableció su UL en 600 μg/día, que es mucho más bajo que el valor de EE. UU. [121].
Etiquetado
Para los fines del etiquetado de alimentos y suplementos dietéticos en los EE. UU., la cantidad en una porción se expresa como un porcentaje del valor diario (% VD). Para los fines del etiquetado del molibdeno, el 100 % del valor diario era 75 μg, pero a partir del 27 de mayo de 2016 se revisó a 45 μg. [122] [123] Se proporciona una tabla de los valores diarios antiguos y nuevos para adultos en Ingesta diaria de referencia .
Fuentes de alimentación
La ingesta diaria promedio varía entre 120 y 240 μg/día, lo que es superior a las recomendaciones dietéticas. [99] El hígado de cerdo, cordero y res tiene aproximadamente 1,5 partes por millón de molibdeno cada uno. Otras fuentes dietéticas importantes incluyen judías verdes, huevos, semillas de girasol, harina de trigo, lentejas, pepinos y cereales. [18]
Precauciones
Los polvos y humos de molibdeno, generados por la minería o la metalurgia, pueden ser tóxicos, especialmente si se ingieren (incluido el polvo atrapado en los senos nasales y luego ingerido). [98] Los niveles bajos de exposición prolongada pueden causar irritación en los ojos y la piel. Se debe evitar la inhalación o ingestión directa de molibdeno y sus óxidos. [124] [125] Las regulaciones de OSHA especifican la exposición máxima permisible al molibdeno en una jornada de 8 horas en 5 mg/m 3 . La exposición crónica a 60 a 600 mg/m 3 puede causar síntomas que incluyen fatiga, dolores de cabeza y dolores articulares. [126] A niveles de 5000 mg/m 3 , el molibdeno es inmediatamente peligroso para la vida y la salud . [127]
Véase también
Referencias
- ^ "Pesos atómicos estándar: molibdeno". CIAAW . 2013.
- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip JH; Gröning, Manfred; Holden, Norman E.; Meijer, Harro AJ (4 de mayo de 2022). "Pesos atómicos estándar de los elementos 2021 (Informe técnico de la IUPAC)". Química pura y aplicada . doi :10.1515/pac-2019-0603. ISSN 1365-3075.
- ^ abc Arblaster, John W. (2018). Valores seleccionados de las propiedades cristalográficas de los elementos . Materials Park, Ohio: ASM International. ISBN 978-1-62708-155-9.
- ^ abcdef Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . pág. 28. ISBN 978-0-08-037941-8.
- ^ Lindemann, A.; Blumm, J. (2009). Medición de las propiedades termofísicas del molibdeno puro . Vol. 3. 17.° Seminario Plansee .
- ^ Lide, DR, ed. (2005). "Susceptibilidad magnética de los elementos y compuestos inorgánicos". Manual de química y física del CRC (PDF) (86.ª ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ^ Weast, Robert (1984). CRC, Manual de química y física . Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN. 0-8493-0464-4.
- ^ abc Kondev, FG; Wang, M.; Huang, WJ; Naimi, S.; Audi, G. (2021). "La evaluación NUBASE2020 de las propiedades nucleares" (PDF) . Chinese Physics C . 45 (3): 030001. doi :10.1088/1674-1137/abddae.
- ^ ab Kajan, I.; Heinitz, S.; Kossert, K.; Sprung, P.; Dressler, R.; Schumann, D. (5 de octubre de 2021). "Primera determinación directa de la vida media del 93Mo". Scientific Reports . 11 (1). doi :10.1038/s41598-021-99253-5. ISSN 2045-2322. PMC 8492754 . PMID 34611245.
- ^ abcd Lide, David R., ed. (1994). "Molibdeno". Manual de química y física de la CRC . Vol. 4. Chemical Rubber Publishing Company. pág. 18. ISBN 978-0-8493-0474-3.
- ^ "Es elemental: el elemento molibdeno". Educación científica en el Laboratorio Jefferson . Archivado desde el original el 4 de julio de 2018. Consultado el 3 de julio de 2018 .
- ^ Bjornsson, Ragnar; Neese, Frank; Schrock, Richard R.; Einsle, Oliver; DeBeer, Serena (2015). "El descubrimiento de Mo(III) en FeMoco: reuniendo la enzima y la química modelo". Journal of Biological Inorganic Chemistry . 20 (2): 447–460. doi : 10.1007/s00775-014-1230-6 . ISSN 0949-8257. PMC 4334110 . PMID 25549604.
- ^ Van Stappen, Casey; Davydov, Roman; Yang, Zhi-Yong; Fan, Ruixi; Guo, Yisong; Bill, Eckhard; Seefeldt, Lance C.; Hoffman, Brian M.; DeBeer, Serena (16 de septiembre de 2019). "Descripción espectroscópica del estado E1 de la nitrogenasa de Mo basada en la absorción de rayos X de Mo y Fe y estudios de Mössbauer". Química inorgánica . 58 (18): 12365–12376. doi : 10.1021/acs.inorgchem.9b01951 . ISSN 0020-1669. PMC 6751781 . PMID 31441651.
- ^ Leimkühler, Silke (2020). "La biosíntesis de los cofactores de molibdeno en Escherichia coli". Microbiología ambiental . 22 (6): 2007–2026. Bibcode : 2020EnvMi..22.2007L . doi : 10.1111/1462-2920.15003 . ISSN 1462-2920. PMID 32239579.
- ^ Shoham, Shani; Keren, Ray; Lavy, Adi; Polishchuk, Iryna; Pokroy, Booz; Ilan, Micha (19 de julio de 2024). "De la nada: hiperacumulación de molibdeno en la esponja del Indo-Pacífico Theonella conica". Avances científicos . 10 (29): eadn3923. Código Bib : 2024SciA...10N3923S. doi :10.1126/sciadv.adn3923. ISSN 2375-2548. PMC 466961 . PMID 39018411.
- ^ Wieser, ME; Berglund, M. (2009). "Pesos atómicos de los elementos 2007 (Informe técnico de la IUPAC)" (PDF) . Química pura y aplicada . 81 (11): 2131–2156. doi : 10.1351/PAC-REP-09-08-03 . S2CID 98084907 . Archivado desde el original (PDF) el 2012-03-11 . Consultado el 2012-02-13 .
- ^ Meija, Juris; et al. (2013). "Tabla actual de pesos atómicos estándar en orden alfabético: pesos atómicos estándar de los elementos". Comisión de Abundancias Isotópicas y Pesos Atómicos. Archivado desde el original el 29 de abril de 2014.
- ^ abcdefgh Emsley, John (2001). Los bloques de construcción de la naturaleza. Oxford: Oxford University Press. pp. 262–266. ISBN 978-0-19-850341-5.
- ^ Parish, RV (1977). Los elementos metálicos . Nueva York: Longman. pp. 112, 133. ISBN. 978-0-582-44278-8.
- ^ Merino, Gabriel; Donald, Kelling J.; D'Acchioli, Jason S.; Hoffmann, Roald (2007). "Las muchas maneras de tener un enlace quíntuple". J. Am. Chem. Soc. 129 (49): 15295–15302. doi :10.1021/ja075454b. PMID 18004851.
- ^ Roos, Björn O.; Borin, Antonio C.; Laura Gagliardi (2007). "Alcanzar la multiplicidad máxima del enlace químico covalente". Angew. Chem. Int. Ed. 46 (9): 1469–1472. doi :10.1002/anie.200603600. PMID 17225237.
- ^ Armstrong, John T. (2003). "Tecnecio". Chemical & Engineering News . Archivado desde el original el 2008-10-06 . Consultado el 2009-07-07 .
- ^ Wolterbeek, Hubert Theodoor; Bode, Peter "Un proceso para la producción de 99Mo sin portador añadido". Patente europea EP2301041 (A1) ― 2011-03-30. Consultado el 2012-06-27.
- ^ abcdefgh Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils (1985). Lehrbuch der Anorganischen Chemie (91-100 ed.). Walter de Gruyter. págs. 1096-1104. ISBN 978-3-11-007511-3.
- ^ Hofmann, Karl A. (1973). "VI. Nebengruppe". En Hofmann, Karl A.; Hofmann, Ulrich; Rüdorff, Walter (eds.). Anorganische Chemie (en alemán). Wiesbaden: Vieweg+Teubner Verlag. págs. 627–641. doi :10.1007/978-3-663-14240-9_31. ISBN 978-3-663-14240-9.
- ^ de Werner, Helmut (2008). Puntos de referencia en la química de los metales de transición orgánica: una visión personal. Springer Science & Business Media. ISBN 978-0-387-09848-7.
- ^ Ellis, JE (2003). "Aniones de carbonilo metálico: de [Fe(CO) 4 ] 2− a [Hf(CO) 6 ] 2− y más allá". Organometallics . 22 (17): 3322–3338. doi :10.1021/om030105l.
- ^ Pope, Michael T.; Müller, Achim (1997). "Química de polioxometalatos: un campo antiguo con nuevas dimensiones en varias disciplinas". Angewandte Chemie International Edition . 30 : 34–48. doi :10.1002/anie.199100341.
- ^ Nollet, Leo ML, ed. (2000). Manual de análisis del agua. Nueva York, NY: Marcel Dekker. pp. 280–288. ISBN 978-0-8247-8433-1.
- ^ Tamadon, Farhad; Seppelt, Konrad (7 de enero de 2013). "Los esquivos haluros VCl 5, MoCl 6 y ReCl 6". Angewandte Chemie International Edition . 52 (2): 767–769. doi :10.1002/anie.201207552. PMID 23172658.
- ^ Stiefel, Edward I., "Compuestos de molibdeno", Kirk-Othmer Encyclopedia of Chemical Technology , Nueva York: John Wiley, doi :10.1002/0471238961.1315122519200905.a01.pub3, ISBN 9780471238966
- ^ Walton, Richard A.; Fanwick, Phillip E.; Girolami, Gregory S.; Murillo, Carlos A.; Johnstone, Erik V. (2014). Girolami, Gregory S.; Sattelberger, Alfred P. (eds.). Síntesis inorgánica: volumen 36. John Wiley & Sons. págs. 78–81. doi :10.1002/9781118744994.ch16. ISBN 978-1118744994.
- ^ Drago, Russell S.; Long, John R.; Cosmano, Richard (1 de junio de 1982). "Comparación de la química de coordinación y la transferencia inductiva a través del enlace metal-metal en aductos de carboxilatos de dirodio y dimolibdeno". Química inorgánica . 21 (6): 2196–2202. doi :10.1021/ic00136a013. ISSN 0020-1669.
- ^ Lansdown, AR (1999). Lubricación con disulfuro de molibdeno . Tribología e ingeniería de interfase. Vol. 35. Elsevier. ISBN 978-0-444-50032-8.
- ^ Melchert, Craig. "El griego mólybdos como palabra prestada del lidio" (PDF) . Universidad de Carolina del Norte en Chapel Hill . Archivado (PDF) desde el original el 2013-12-31 . Consultado el 2011-04-23 .
- ^ "Historia del molibdeno". Asociación Internacional del Molibdeno. Archivado desde el original el 22 de julio de 2013.
- ^ El uso accidental de molibdeno en una espada antigua dio lugar a una nueva aleación. Instituto Americano del Hierro y el Acero. 1948.
- ^ Van der Krogt, Peter (10 de enero de 2006). "Molibdeno". Elementymology & Elements Multidict . Archivado desde el original el 23 de enero de 2010 . Consultado el 20 de mayo de 2007 .
- ^ ab Gagnon, Steve. "Molibdeno". Jefferson Science Associates, LLC. Archivado desde el original el 26 de abril de 2007. Consultado el 6 de mayo de 2007 .
- ^ Scheele, CWK (1779). "Versuche mit Wasserbley; Molibdaena". Svenská Vetensk. Academia. Manejo . 40 : 238.
- ^ Hjelm, PJ (1788). "Versuche mit Molybdäna, und Reduction der selben Erde". Svenská Vetensk. Academia. Manejo . 49 : 268.
- ^ Hoyt, Samuel Leslie (1921). Metalografía . Vol. 2. McGraw-Hill.
- ^ Krupp, Alfred; Wildberger, Andreas (1888). Las aleaciones metálicas: Una guía práctica para la fabricación de todo tipo de aleaciones, amalgamas y soldaduras, utilizadas por los trabajadores del metal... con un apéndice sobre la coloración de las aleaciones . HC Baird & Co. pág. 60.
- ^ Gupta, CK (1992). Metalurgia extractiva del molibdeno . CRC Press. ISBN 978-0-8493-4758-0.
- ^ Reich, Leonard S. (22 de agosto de 2002). La creación de la investigación industrial estadounidense: ciencia y negocios en GE y Bell, 1876-1926. Cambridge University Press. pág. 117. ISBN 978-0521522373Archivado desde el original el 9 de julio de 2014. Consultado el 7 de abril de 2016 .
- ^ Vokes, Frank Marcus (1963). Yacimientos de molibdeno de Canadá. pág. 3.
- ^ Propiedades químicas del molibdeno – Efectos del molibdeno sobre la salud – Efectos ambientales del molibdeno Archivado el 20 de enero de 2016 en Wayback Machine . lenntech.com
- ^ Kean, Sam (6 de junio de 2011). La cuchara que desaparece: y otros cuentos reales de locura, amor e historia del mundo a partir de la tabla periódica de los elementos (edición ilustrada). Back Bay Books. págs. 88-89. ISBN 978-0-316-05163-7.
- ^ Millholland, Ray (agosto de 1941). «La batalla de los miles de millones: la industria estadounidense moviliza máquinas, materiales y hombres para un trabajo tan grande como cavar 40 canales de Panamá en un año». Popular Science : 61. Archivado desde el original el 9 de julio de 2014. Consultado el 7 de abril de 2016 .
- ^ abcdefgh Considina, Glenn D., ed. (2005). "Molibdeno". Van Nostrand's Encyclopedia of Chemistry . Nueva York: Wiley-Interscience. págs. 1038–1040. ISBN 978-0-471-61525-5.
- ^ Jambor, JL; et al. (2002). "Nuevos nombres minerales" (PDF) . American Mineralogist . 87 : 181. Archivado (PDF) desde el original el 2007-07-10 . Consultado el 2007-04-09 .
- ^ ab "Estadísticas e información sobre el molibdeno". Servicio Geológico de Estados Unidos. 10 de mayo de 2007. Archivado desde el original el 19 de mayo de 2007. Consultado el 10 de mayo de 2007 .
- ^ ab Sebenik, Roger F.; Burkin, A. Richard; Dorfler, Robert R.; Laferty, John M.; Leichtfried, Gerhard; Meyer-Grünow, Hartmut; Mitchell, Philip CH; Vukasovich, Mark S.; Church, Douglas A.; Van Riper, Gary G.; Gilliland, James C.; Thielke, Stanley A. (2000). "Molibdeno y compuestos de molibdeno". Enciclopedia de química industrial de Ullmann . doi :10.1002/14356007.a16_655. ISBN 3527306730.S2CID 98762721 .
- ^ Gupta, CK (1992). Metalurgia extractiva del molibdeno . CRC Press. págs. 1–2. ISBN 978-0-8493-4758-0.
- ^ "Precios dinámicos y gráficos del molibdeno". InfoMine Inc. 2007. Archivado desde el original el 8 de octubre de 2009. Consultado el 7 de mayo de 2007 .
- ^ "LME lanzará contratos de metales menores en el segundo semestre de 2009". Bolsa de Metales de Londres. 4 de septiembre de 2008. Archivado desde el original el 22 de julio de 2012. Consultado el 28 de julio de 2009 .
- ^ Langedal, M. (1997). "Dispersión de relaves en la cuenca de drenaje Knabena—Kvina, Noruega, 1: Evaluación de sedimentos de desbordamiento como medio de muestreo para el mapeo geoquímico regional". Journal of Geochemical Exploration . 58 (2–3): 157–172. Bibcode :1997JCExp..58..157L. doi :10.1016/S0375-6742(96)00069-6.
- ^ Coffman, Paul B. (1937). "El auge de un nuevo metal: el crecimiento y el éxito de la Climax Molybdenum Company". The Journal of Business de la Universidad de Chicago . 10 : 30. doi :10.1086/232443.
- ^ "Molibdeno". Usos industriales . Bolsa de Metales de Londres. Archivado desde el original el 10 de marzo de 2012.
- ^ ab "Molibdeno". AZoM.com Pty. Limited. 2007. Archivado desde el original el 14 de junio de 2011. Consultado el 6 de mayo de 2007 .
- ^ (2023) Grados y propiedades del acero inoxidable. Asociación Internacional del Molibdeno. https://www.imoa.info/molybdenum-uses/molybdenum-grade-stainless-steels/steel-grades.php?m=1683978651&
- ^ Smallwood, Robert E. (1984). "Aleación de molibdeno TZM". Publicación técnica especial ASTM 849: Metales refractarios y sus aplicaciones industriales: un simposio . ASTM International. pág. 9. ISBN 978-0803102033.
- ^ "Compatibilidad de la aleación TZM a base de molibdeno con LiF-BeF2-ThF4-UF4". Informe del Laboratorio Nacional de Oak Ridge. Diciembre de 1969. Archivado desde el original el 10 de julio de 2011. Consultado el 2 de septiembre de 2010 .
- ^ Levy, M. (1965). "Un sistema de revestimiento protector para un vehículo de reentrada de aleación TZM" (PDF) . Ejército de EE. UU . . Consultado el 3 de junio de 2024 .
- ^ Yang, Zhi; Hu, Ke (2018). "Unión por difusión entre aleación TZM y aleación WRe mediante sinterización por plasma de chispa". Revista de aleaciones y compuestos . 764 : 582–590. doi :10.1016/j.jallcom.2018.06.111.
- ^ Patente CN 109590476B
- ^ Trento, Chin (27 de diciembre de 2023). "Preparación y aplicación de la aleación TZM". Stanford Advanced Materials . Consultado el 3 de junio de 2024 .
- ^ Cubberly, WH; Bakerjian, Ramon (1989). Manual de ingenieros de fabricación y herramientas. Sociedad de Ingenieros de Fabricación. p. 421. ISBN 978-0-87263-351-3.
- ^ Lal, S.; Patil, RS (2001). "Monitoreo del comportamiento atmosférico de NO x proveniente del tráfico vehicular". Monitoreo y evaluación ambiental . 68 (1): 37–50. Bibcode :2001EMnAs..68...37L. doi :10.1023/A:1010730821844. PMID 11336410. S2CID 20441999.
- ^ Lancaster, Jack L. "Cap. 4: Determinantes físicos del contraste" (PDF) . Física de la obtención de imágenes médicas por rayos X. Centro de Ciencias de la Salud de la Universidad de Texas. Archivado desde el original (PDF) el 10 de octubre de 2015.
- ^ Gray, Theodore (2009). Los elementos . Black Dog & Leventhal. págs. 105-107. ISBN 1-57912-814-9 .
- ^ Gottschalk, A. (1969). "Tecnecio-99m en medicina nuclear clínica". Revista Anual de Medicina . 20 (1): 131–40. doi :10.1146/annurev.me.20.020169.001023. PMID 4894500.
- ^ Winer, W. (1967). "El disulfuro de molibdeno como lubricante: una revisión de los conocimientos fundamentales" (PDF) . Wear . 10 (6): 422–452. doi :10.1016/0043-1648(67)90187-1. hdl : 2027.42/33266 .
- ^ Topsøe, H.; Clausen, BS; Massoth, FE (1996). Catálisis de hidrotratamiento, ciencia y tecnología . Berlín: Springer-Verlag.
- ^ Moulson, AJ; Herbert, JM (2003). Electrocerámica: materiales, propiedades, aplicaciones. John Wiley and Sons. pág. 141. ISBN 978-0-471-49748-6.
- ^ Asociación Internacional del Molibdeno Archivado el 9 de marzo de 2008 en Wayback Machine . imoa.info.
- ^ Fierro, JGL, ed. (2006). Óxidos metálicos, química y aplicaciones . CRC Press. págs. 414–455.
- ^ Centi, G.; Cavani, F.; Trifiro, F. (2001). Oxidación selectiva por catálisis heterogénea . Kluwer Academic/Plenum Publishers. págs. 363–384.
- ^ Horáček, enero; Akhmetzyanova, Uliana; Skuhrovcová, Lenka; Tišler, Zdeněk; de Paz Carmona, Héctor (1 de abril de 2020). "Catalizadores MoNx, MoCx y MoPx soportados en alúmina para el hidrotratamiento de aceite de colza". Catálisis Aplicada B: Ambiental . 263 : 118328. Código bibliográfico : 2020AppCB.26318328H. doi : 10.1016/j.apcatb.2019.118328 . ISSN 0926-3373. S2CID 208758175.
- ^ De Carlo, Sacha; Harris, J. Robin (2011). "Tinción negativa y tinción crionegativa de macromoléculas y virus para TEM". Micron . 42 (2): 117–131. doi :10.1016/j.micron.2010.06.003. PMC 2978762 . PMID 20634082.
- ^ "Coloraciones para el desarrollo de placas de TLC" (PDF) . Universidad McMaster.
- ^ Everett, MM; Miller, WA (1974). "El papel de los ácidos fosfotúngstico y fosfomolíbdico en la tinción del tejido conectivo I. Estudios histoquímicos". The Histochemical Journal . 6 (1): 25–34. doi :10.1007/BF01011535. PMID 4130630.
- ^ Scott, C.; Lyons, T. W.; Bekker, A.; Shen, Y.; Poulton, SW; Chu, X.; Anbar, AD (2008). "Rastreando la oxigenación escalonada del océano Proterozoico". Nature . 452 (7186): 456–460. Bibcode :2008Natur.452..456S. doi :10.1038/nature06811. PMID 18368114. S2CID 205212619.
- ^ Enemark, John H.; Cooney, J. Jon A.; Wang, Jun-Jieh; Holm, RH (2004). "Análogos sintéticos y sistemas de reacción relevantes para las oxotransferasas de molibdeno y tungsteno". Chem. Rev. 104 ( 2): 1175–1200. doi :10.1021/cr020609d. PMID 14871153.
- ^ Mendel, Ralf R.; Bittner, Florián (2006). "Biología celular del molibdeno". Biochimica et Biophysica Acta (BBA) - Investigación de células moleculares . 1763 (7): 621–635. doi :10.1016/j.bbamcr.2006.03.013. PMID 16784786.
- ^ Russ Hille; James Hall; Partha Basu (2014). "Las enzimas mononucleares del molibdeno". Chem. Rev. 114 ( 7): 3963–4038. doi :10.1021/cr400443z. PMC 4080432. PMID 24467397 .
- ^ Kisker, C.; Schindelin, H.; Baas, D.; Rétey, J.; Meckenstock, RU; Kroneck, PMH (1999). "Una comparación estructural de enzimas que contienen cofactor de molibdeno" (PDF) . FEMS Microbiol. Rev . 22 (5): 503–521. doi : 10.1111/j.1574-6976.1998.tb00384.x . PMID 9990727. Archivado (PDF) desde el original el 2017-08-10 . Consultado el 2017-10-25 .
- ^ ab Mitchell, Phillip CH (2003). "Descripción general de la base de datos medioambiental". Asociación Internacional del Molibdeno. Archivado desde el original el 18 de octubre de 2007. Consultado el 5 de mayo de 2007 .
- ^ Mendel, Ralf R. (2013). "Capítulo 15 Metabolismo del molibdeno". En Banci, Lucia (ed.). Metalómica y la célula . Iones metálicos en las ciencias de la vida. Vol. 12. Springer. doi :10.1007/978-94-007-5561-10_15 (inactivo 2024-09-02). ISBN 978-94-007-5560-4.
{{cite book}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace )libro electrónico ISBN 978-94-007-5561-1 ISSN 1559-0836 ISSN electrónico 1868-0402 - ^ Chi Chung, Lee; Markus W., Ribbe; Yilin, Hu (2014). "Bioquímica de la metil-coenzima M reductasa: la metaloenzima de níquel que cataliza el paso final en la síntesis y el primer paso en la oxidación anaeróbica del gas de efecto invernadero metano". En Peter MH Kroneck; Martha E. Sosa Torres (eds.). La biogeoquímica impulsada por metales de compuestos gaseosos en el medio ambiente . Iones metálicos en las ciencias de la vida. Vol. 14. Springer. págs. 147–174. doi :10.1007/978-94-017-9269-1_6. ISBN 978-94-017-9268-4. Número de identificación personal 25416393.
- ^ Dos Santos, Patricia C.; Dean, Dennis R. (2008). "Un nuevo descubrimiento del papel de los cúmulos de hierro y azufre". PNAS . 105 (33): 11589–11590. Bibcode :2008PNAS..10511589D. doi : 10.1073/pnas.0805713105 . PMC 2575256 . PMID 18697949.
- ^ Schwarz, Guenter; Belaidi, Abdel A. (2013). "El molibdeno en la salud y la enfermedad humanas". En Astrid Sigel; Helmut Sigel; Roland KO Sigel (eds.). Interrelaciones entre iones metálicos esenciales y enfermedades humanas . Iones metálicos en las ciencias de la vida. Vol. 13. Springer. págs. 415–450. doi :10.1007/978-94-007-7500-8_13. ISBN 978-94-007-7499-5. Número de identificación personal 24470099.
- ^ Mendel, Ralf R. (2009). "Biología celular del molibdeno". BioFactors . 35 (5): 429–34. doi :10.1002/biof.55. PMID 19623604. S2CID 205487570.
- ^ Informe de bienestar de Blaylock , febrero de 2010, página 3.
- ^ Cohen, HJ; Drew, RT; Johnson, JL; Rajagopalan, KV (1973). "Base molecular de la función biológica del molibdeno. La relación entre la sulfito oxidasa y la toxicidad aguda del bisulfito y el SO2". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 70 (12 Pt 1–2): 3655–3659. Bibcode :1973PNAS...70.3655C. doi : 10.1073/pnas.70.12.3655 . PMC 427300 . PMID 4519654.
- ^ Holleman, Arnold F.; Wiberg, Egon (2001). Química inorgánica. Academic Press. pág. 1384. ISBN 978-0-12-352651-9.
- ^ Curzon, MEJ; Kubota, J.; Bibby, BG (1971). "Efectos ambientales del molibdeno en la caries". Revista de investigación dental . 50 (1): 74–77. doi :10.1177/00220345710500013401. S2CID 72386871.
- ^ ab "Sistema de información de evaluación de riesgos: Resumen de toxicidad del molibdeno". Laboratorio Nacional de Oak Ridge. Archivado desde el original el 19 de septiembre de 2007. Consultado el 23 de abril de 2008 .
- ^ ab Coughlan, MP (1983). "El papel del molibdeno en la biología humana". Revista de enfermedades metabólicas hereditarias . 6 (S1): 70–77. doi :10.1007/BF01811327. PMID 6312191. S2CID 10114173.
- ^ Barceloux, Donald G.; Barceloux, Donald (1999). "Molibdeno". Toxicología clínica . 37 (2): 231–237. doi :10.1081/CLT-100102422. PMID 10382558.
- ^ Yang, Chung S. (1980). "Investigación sobre el cáncer de esófago en China: una revisión" (PDF) . Cancer Research . 40 (8 Pt 1): 2633–44. PMID 6992989. Archivado (PDF) desde el original el 23 de noviembre de 2015 . Consultado el 30 de diciembre de 2011 .
- ^ Nouri, Mohsen; Chalian, Hamid; Bahman, Atiyeh; Mollahajian, Hamid; et al. (2008). "Contenido de molibdeno y zinc en las uñas en poblaciones con incidencia baja y moderada de cáncer de esófago" (PDF) . Archivos de Medicina Iraní . 11 (4): 392–6. PMID 18588371. Archivado desde el original (PDF) el 2011-07-19 . Consultado el 2009-03-23 .
- ^ Zheng, Liu; et al. (1982). "Distribución geográfica de suelos deficientes en oligoelementos en China". Acta Ped. Sin . 19 : 209–223. Archivado desde el original el 2021-02-05 . Consultado el 2020-07-25 .
- ^ Taylor, Philip R.; Li, Bing; Dawsey, Sanford M.; Li, Jun-Yao; Yang, Chung S.; Guo, Wande; Blot, William J. (1994). "Prevención del cáncer de esófago: ensayos de intervención nutricional en Linxian, China" (PDF) . Cancer Research . 54 (7 Suppl): 2029s–2031s. PMID 8137333. Archivado (PDF) desde el original el 17 de septiembre de 2016 . Consultado el 1 de julio de 2016 .
- ^ Abumrad, NN (1984). "Molibdeno: ¿es un metal traza esencial?". Boletín de la Academia de Medicina de Nueva York . 60 (2): 163–71. PMC 1911702 . PMID 6426561.
- ^ Smolinsky, B; Eichler, SA; Buchmeier, S.; Meier, JC; Schwarz, G. (2008). "Funciones específicas de empalme de la gefirina en la biosíntesis del cofactor de molibdeno". Journal of Biological Chemistry . 283 (25): 17370–9. doi : 10.1074/jbc.M800985200 . PMID 18411266.
- ^ Reiss, J. (2000). "Genética de la deficiencia del cofactor de molibdeno". Human Genetics . 106 (2): 157–63. doi :10.1007/s004390051023 (inactivo 2024-09-02). PMID 10746556.
{{cite journal}}: CS1 maint: DOI inactivo a partir de septiembre de 2024 ( enlace ) - ^ Gropper, Sareen S.; Smith, Jack L.; Carr, Timothy P. (5 de octubre de 2016). Nutrición avanzada y metabolismo humano. Cengage Learning. ISBN 978-1-337-51421-7.
- ^ Turnlund, JR; Keyes, WR; Peiffer, GL (octubre de 1995). "Absorción, excreción y retención de molibdeno estudiadas con isótopos estables en hombres jóvenes con cinco ingestas de molibdeno en la dieta". The American Journal of Clinical Nutrition . 62 (4): 790–796. doi : 10.1093/ajcn/62.4.790 . ISSN 0002-9165. PMID 7572711.
- ^ Suttle, NF (1974). "Estudios recientes del antagonismo cobre-molibdeno". Actas de la Sociedad de Nutrición . 33 (3): 299–305. doi : 10.1079/PNS19740053 . PMID: 4617883.
- ^ Hauer, Gerald Deficiencia de cobre en el ganado. Archivado el 10 de septiembre de 2011 en Wayback Machine . Productores de bisontes de Alberta. Consultado el 16 de diciembre de 2010.
- ^ Nickel, W (2003). "El misterio de la secreción de proteínas no clásicas, una visión actual de las proteínas de carga y las posibles rutas de exportación". Eur. J. Biochem. 270 (10): 2109–2119. doi : 10.1046/j.1432-1033.2003.03577.x . PMID 12752430.
- ^ Brewer GJ; Hedera, P.; Kluin, KJ; Carlson, M.; Askari, F.; Dick, RB; Sitterly, J.; Fink, JK (2003). "Tratamiento de la enfermedad de Wilson con tetratiomolibdato de amonio: III. Terapia inicial en un total de 55 pacientes con afectación neurológica y seguimiento con terapia con zinc". Arch Neurol . 60 (3): 379–85. doi :10.1001/archneur.60.3.379. PMID 12633149.
- ^ Brewer, GJ; Dick, RD; Grover, DK; Leclaire, V.; Tseng, M.; Wicha, M.; Pienta, K.; Redman, BG; Jahan, T.; Sondak, VK; Strawderman, M.; LeCarpentier, G.; Merajver, SD (2000). "Tratamiento del cáncer metastásico con tetratiomolibdato, un agente anticobre y antiangiogénico: estudio de fase I". Investigación clínica del cáncer . 6 (1): 1–10. PMID 10656425.
- ^ Green, Julissa. "¿Por qué se utiliza el objetivo de molibdeno en la mamografía para el cáncer de mama?". Sputter Targets . Consultado el 2 de agosto de 2024 .
- ^ "2. Técnicas de cribado". Grupo de trabajo del IARC sobre la evaluación de intervenciones preventivas del cáncer: cribado del cáncer de mama. Lyon (FR): Agencia Internacional para la Investigación sobre el Cáncer. 2016. Consultado el 2 de septiembre de 2024 .
- ^ Su, Qi-Hang; Zhang, Yan (2020). "Aplicación de la fotografía de rayos X con objetivo de molibdeno en el análisis de imágenes de la degeneración del disco intervertebral caudal en ratas". World J Clin Cases . 8 (6): 3431–3439. doi : 10.12998/wjcc.v8.i16.3431 . PMC 7457105 . PMID 32913849.
- ^ Alkhalifah, Khaled; Asbeutah, Akram (2020). "Calidad de imagen y dosis de radiación para mamas fibroadiposas utilizando combinaciones de objetivo/filtro en dos sistemas de mamografía digital". J Clin Imaging Sci . 10 (56): 56. doi :10.25259/JCIS_30_2020. PMC 7533093 . PMID 33024611.
- ^ Instituto de Medicina (2000). "Molibdeno". Ingesta dietética de referencia para vitamina A, vitamina K, arsénico, boro, cromo, cobre, yodo, hierro, manganeso, molibdeno, níquel, silicio, vanadio y zinc . Washington, DC: The National Academies Press. págs. 420–441. doi :10.17226/10026. ISBN . 978-0-309-07279-3. Número de identificación personal 25057538. Número de identificación personal 44243659.
- ^ "Resumen de los valores de referencia dietéticos para la población de la UE elaborados por el Panel de Productos Dietéticos, Nutrición y Alergias de la EFSA" (PDF) . 2017. Archivado desde el original (PDF) el 28 de agosto de 2017 . Consultado el 10 de septiembre de 2017 .
- ^ Niveles máximos tolerables de ingesta de vitaminas y minerales (PDF) , Autoridad Europea de Seguridad Alimentaria, 2006, archivado desde el original (PDF) el 2016-03-16 , consultado el 2017-09-10
- ^ "Registro Federal 27 de mayo de 2016 Etiquetado de alimentos: Revisión de las etiquetas de información nutricional y de suplementos. Página 33982 del FR" (PDF) . Archivado (PDF) del original el 8 de agosto de 2016. Consultado el 10 de septiembre de 2017 .
- ^ "Daily Value Reference of the Dietary Supplement Label Database (DSLD)" ( Base de datos de etiquetas de suplementos dietéticos (DSLD)) . Archivado desde el original el 7 de abril de 2020. Consultado el 16 de mayo de 2020 .
- ^ "Hoja de datos de seguridad del material: molibdeno". The REMBAR Company, Inc. 19 de septiembre de 2000. Archivado desde el original el 23 de marzo de 2007. Consultado el 13 de mayo de 2007 .
- ^ "Hoja de datos de seguridad del material: polvo de molibdeno". CERAC, Inc. 23 de febrero de 1994. Archivado desde el original el 8 de julio de 2011. Consultado el 19 de octubre de 2007 .
- ^ "Documentación del NIOSH sobre molibdeno que entraña peligro inmediato para la vida y la salud". Instituto Nacional de Seguridad y Salud Ocupacional. 16 de agosto de 1996. Archivado desde el original el 7 de agosto de 2007. Consultado el 31 de mayo de 2007 .
- ^ "CDC – NIOSH Pocket Guide to Chemical Hazards – Molybdenum" (Guía de bolsillo de los CDC y NIOSH sobre los peligros químicos del molibdeno). www.cdc.gov . Archivado desde el original el 20 de noviembre de 2015. Consultado el 20 de noviembre de 2015 .
Bibliografía
- Lettera di Giulio Candida al signor Vincenzo Petagna – Sulla formazione del molibdeno. Nápoles: Giuseppe Maria Porcelli. 1785.
Enlaces externos
- Molibdeno en la Tabla Periódica de Videos (Universidad de Nottingham)
- Minerales y exploración: Mapa de productores mundiales de molibdeno 2009
- "Explotando una montaña" Popular Mechanics, julio de 1935, págs. 63-64
- Sitio con información global sobre molibdeno
- CDC – Guía de bolsillo de NIOSH sobre peligros químicos










