Molibdato


En química , un molibdato es un compuesto que contiene un oxianión con molibdeno en su estado de oxidación más alto de +6: O − −Mo(=O) 2 −O − . El molibdeno puede formar una amplia gama de tales oxianiones , que pueden ser estructuras discretas o estructuras extendidas poliméricas , aunque estas últimas solo se encuentran en estado sólido . Los oxianiones más grandes son miembros del grupo de compuestos denominados polioxometalatos , y debido a que contienen solo un tipo de átomo de metal, a menudo se denominan isopolimetalatos . [1] Los oxianiones discretos de molibdeno varían en tamaño desde el más simple MoO2−
4, que se encuentra en el molibdato de potasio hasta estructuras extremadamente grandes que se encuentran en los azules de isopoli-molibdeno que contienen, por ejemplo, 154 átomos de Mo. El comportamiento del molibdeno es diferente al de los demás elementos del grupo 6. El cromo solo forma los cromatos , CrO2−
4, Cr
2Oh2−
7, Cr
3Oh2−
10 y Cr
4Oh2−
13iones que se basan en cromo tetraédrico. El tungsteno es similar al molibdeno y forma muchos tungstatos que contienen tungsteno de 6 coordenadas. [2]
Ejemplos de aniones molibdato
Ejemplos de oxianiones de molibdato son:
- Mugir2−
4, por ejemplo en Na 2 MoO 4 y el mineral powellita , CaMoO 4 ; - Mes
2Oh2−
7, como dimolibdato de amonio hidratado . La sal de tetrabutilamonio anhidra de Mo
2Oh2−
7También se conoce como; [3] - Mes
3Oh2−
10en la sal de etilendiamina ; [4] - Mes
4Oh2−
13en la sal de potasio; [5] - Mes
5Oh2−
16en el anilinio ( C
6yo
5NUEVA HAMPSHIRE+
3) sal; [6] - Mes
6Oh2−
19(hexa-molibdato) en la sal de tetrametilamonio; [7] - Mes
7Oh6−
24en heptamolibdato de amonio , (NH 4 ) 6 Mo 7 O 24 ·4H 2 O; [8] - Mes
8Oh4−26
en sal de trimetilamonio . [1]
La denominación de los molibdatos generalmente sigue la convención de un prefijo para mostrar el número de átomos de Mo presentes. Por ejemplo, dimolibdato para 2 átomos de molibdeno; trimolibdato para 3 átomos de molibdeno, etc. A veces se añade el estado de oxidación como sufijo, como en el caso del pentamolibdato(VI) . El ion heptamolibdato, Mo
7Oh6−
24, a menudo se le llama "paramolibdato".
Estructura de los aniones molibdato
Los aniones más pequeños, MoO2−
4y Mo
2Oh2−
7presentan centros tetraédricos. En MoO2−
4Los cuatro oxígenos son equivalentes como en el sulfato y el cromato , con longitudes de enlace y ángulos iguales .
2Oh2−
7Se puede considerar que son dos tetraedros que comparten un vértice, es decir, con un solo átomo de O puente. [1] En los aniones más grandes, el molibdeno generalmente, pero no exclusivamente, tiene 6 coordenadas y comparte 6 aristas o vértices de los octaedros MoO . Los octaedros están distorsionados, las longitudes de enlace típicas de MO son:
- en M–O terminal sin puente aproximadamente 1,7 Å
- En unidades puente M–O–M aproximadamente 1,9 Å
El Mo
8Oh4−26
El anión contiene molibdeno octaédrico y tetraédrico y se puede aislar en dos formas isoméricas , alfa y beta. [2]
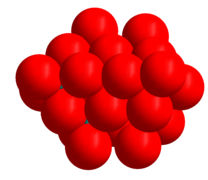
La imagen del hexamolibdato que se muestra a continuación muestra los poliedros de coordinación. El modelo de relleno del espacio de la imagen del heptamolibdato muestra la naturaleza compacta de los átomos de oxígeno en la estructura. El ion óxido tiene un radio iónico de 1,40 Å, el molibdeno (VI) es mucho más pequeño, 0,59 Å. [1] Existen fuertes similitudes entre las estructuras de los molibdatos y los óxidos de molibdeno ( MoO 3 , MoO 2 y los óxidos de "cizallamiento cristalográfico", Mo 9 O 26 y Mo 10 O 29 ), cuyas estructuras contienen iones de óxido compactados. [9]
- (a) Hexamolibdato [Mo 6 O 19 ] 2− (b) Heptamolibdato [Mo 7 O 24 ] 6−
- Modelo de bolas y varillas de heptamolibdato
- Heptamolibdato con átomos de oxígeno que llenan el espacio
Equilibrio en solución acuosa
Cuando MoO 3 , trióxido de molibdeno se disuelve en una solución alcalina , el simple MoO2−4 El anión se produce:
A medida que se reduce el pH , se producen condensaciones, con pérdida de agua y formación de enlaces Mo-O-Mo. Se muestra la estequiometría que conduce a hexa-, hepta- y octamolibdatos: [1] [10]
- [2]
- [2]
Peroxomolibdatos
Se conocen muchos peroxomolibdatos. Suelen formarse al tratar las sales de molibdato con peróxido de hidrógeno. Cabe destacar el equilibrio monómero-dímero:
También conocido pero inestable como [Mo(O 2 ) 4 ] 2− (ver tetraperoxocromato de potasio(V) ). Algunos compuestos relacionados se utilizan como oxidantes en la síntesis orgánica . [11]
Tetratiomolibdato
El anión tetratiomolibdato rojo se forma cuando las soluciones de molibdato se tratan con sulfuro de hidrógeno :
Al igual que el propio molibdato, el MoS2−4sufre condensación en presencia de ácidos, pero estas condensaciones van acompañadas de procesos redox .
Usos industriales
Catálisis
Los molibdatos se utilizan ampliamente en catálisis . En términos de escala, el mayor consumidor de molibdato es como precursor de catalizadores para hidrodesulfuración , el proceso por el cual se elimina el azufre del petróleo. Los molibdatos de bismuto, nominalmente de la composición Bi 9 PMo 12 O 52 , catalizan la amoxidación de propileno a acrilonitrilo . Los molibdatos férricos se utilizan industrialmente para catalizar la oxidación de metanol a formaldehído . [12]
Inhibidores de corrosión
El molibdato de sodio se ha utilizado en el tratamiento de aguas industriales como inhibidor de la corrosión . Inicialmente se pensó que sería un buen sustituto del cromato , cuando el cromato se prohibió por su toxicidad. Sin embargo, el molibdato requiere altas concentraciones cuando se utiliza solo, por lo que generalmente se añaden inhibidores de corrosión complementarios [13] y se utiliza principalmente en circuitos de refrigeración de circuito cerrado de alta temperatura. [14] Según un estudio experimental, se ha informado que el molibdato es un biocida eficaz contra la corrosión inducida microbiológicamente (MIC), donde la adición de 1,5 mM de MoO2−
4/día resultó en una disminución del 50 % en la tasa de corrosión . [15]
Supercondensadores
Los molibdatos (especialmente FeMoO 4 , Fe 2 (MoO 4 ) 3 , NiMoO 4 , CoMoO 4 y MnMoO 4 ) se han utilizado como materiales de ánodo o cátodo en condensadores acuosos. [16] [17] [18] [19] Debido al almacenamiento de carga pseudocapacitiva , se ha observado una capacitancia específica de hasta 1500 F g −1 . [17]
Medicamento
El molibdeno-99 radiactivo en forma de molibdato se utiliza como isótopo original en los generadores de tecnecio-99m para imágenes de medicina nuclear . [20]
Otro
La fijación del nitrógeno requiere molibdenoenzimas presentes en las legumbres (por ejemplo, soja, acacia, etc.). Por este motivo, los fertilizantes suelen contener pequeñas cantidades de sales de molibdato. La cobertura suele ser inferior a un kilogramo por acre. [12]
Los pigmentos de cromo molibdato son pigmentos especiales pero disponibles comercialmente. [12] El molibdato (generalmente en forma de molibdato de potasio) también se utiliza en las pruebas colorimétricas analíticas para la concentración de sílice en solución, llamado método azul de molibdeno . [21] Además, se utiliza en el análisis colorimétrico de la concentración de fosfato en asociación con el tinte verde malaquita .
Gemas naturales
Cristales de molibdato recolectados por entusiastas de las gemas, siendo las mejores muestras del mundo de molibdato cristalizado las procedentes de la mina Madawaska en Ontario (Canadá). [22]
Referencias
- ^ abcde Greenwood, Norman N. ; Earnshaw, Alan (1997). Química de los elementos (2.ª ed.). Butterworth-Heinemann . ISBN 978-0-08-037941-8.
- ^ abcd Cotton, F. Albert ; Wilkinson, Geoffrey ; Murillo, Carlos A.; Bochmann, Manfred (1999), Química inorgánica avanzada (6.ª ed.), Nueva York: Wiley-Interscience, ISBN 0-471-19957-5
- ^ VW Day; MF Fredrich; WG Klemperer ; W. Shum (1977). "Síntesis y caracterización del ion dimolibdato, Mo
2Oh2−
7". Revista de la Sociedad Química Americana . 99 (18): 6146. doi :10.1021/ja00460a074. - ^ Guillou N.; Ferey G. (agosto de 1997). "Síntesis hidrotermal y estructura cristalina del trimolibdato de etilendiamina anhidro (C
2yo
10norte
2)[Mes
3Oh
10] ". Revista de química del estado sólido . 132 (1): 224–227(4). Código Bibliográfico :1997JSSCh.132..224G. doi :10.1006/jssc.1997.7502. - ^ BM Gatehouse; P. Leverett (1971). "Estructura cristalina del tetramolibdato de potasio, K
2Mes
4Oh
13, y su relación con las estructuras de otros polimolibdatos de metales univalentes". J. Chem. Soc. A : 2107–2112. doi :10.1039/J19710002107. - ^ W. Lasocha; H. Schenk (1997). "Estructura cristalina del pentamolibdato de anilinio a partir de datos de difracción de polvo. Solución de la estructura cristalina mediante el paquete de métodos directos POWSIM". J. Appl. Crystallogr . 30 (6): 909–913. doi :10.1107/S0021889897003105.
- ^ S. Ghammami (2003). "La estructura cristalina y molecular del hexamolibdato de bis(tetrametilamonio)(VI)". Investigación y tecnología de cristales . 38 (913): 913–917. doi :10.1002/crat.200310112. S2CID 95078211.
- ^ Howard T. Evans Jr.; Bryan M. Gatehouse; Peter Leverett (1975). "Estructura cristalina del ion heptamolibdato(VI)(paramolibdato), [Mo 7 O 24 ] 6− , en las sales tetrahidratadas de amonio y potasio". J. Chem. Soc., Dalton Trans. (6): 505–514. doi :10.1039/DT9750000505.
- ^ "Óxidos: química del estado sólido" WH McCarroll, Enciclopedia de química inorgánica Ed. R. Bruce King, John Wiley and Sons (1994) ISBN 0-471-93620-0
- ^ Klemperer, WG (1990). "Isopolioxometalatos de tetrabutilamonio". Síntesis inorgánicas . Síntesis inorgánicas. Vol. 27. págs. 74–85. doi :10.1002/9780470132586.ch15. ISBN 9780470132586.
- ^ Dickman, Michael H.; Pope, Michael T. (1994). "Complejos peroxo y superoxo de cromo, molibdeno y tungsteno". Chem. Rev. 94 ( 3): 569–584. doi :10.1021/cr00027a002.
- ^ abc Roger F. Sebenik et al. "Molibdeno y compuestos de molibdeno" en Ullmann's Encyclopedia of Chemical Technology 2005; Wiley-VCH, Weinheim. doi :10.1002/14356007.a16_655
- ^ "Sistemas de enfriamiento de recirculación abiertos - GE Water". gewater.com .
- ^ "Sistemas de enfriamiento de recirculación cerrados - GE Water". gewater.com .
- ^ "Corrosión influenciada microbiológicamente en la industria upstream de petróleo y gas".
- ^ Purushothaman, KK; Cuba, M.; Muralidharan, G. (1 de noviembre de 2012). "Comportamiento del supercondensador de nanobarras de α-MnMoO 4 en diferentes electrolitos". Boletín de investigación de materiales . 47 (11): 3348–3351. doi :10.1016/j.materresbull.2012.07.027.
- ^ ab Senthilkumar, Baskar; Sankar, Kalimuthu Vijaya; Selvan, Ramakrishnan Kalai; Danielle, Meyrick; Manickam, Minakshi (5 de diciembre de 2012). "Nano α-NiMoO 4 como nuevo electrodo para supercondensadores electroquímicos". RSC Avanzado . 3 (2): 352–357. doi :10.1039/c2ra22743f. ISSN 2046-2069.
- ^ Cai, Daoping; Wang, Dandan; Liu, Bin; Wang, Yanrong; Liu, Yuan; Wang, Lingling; Li, Han; Huang, Hui; Li, Qiuhong (26 de diciembre de 2013). "Comparación del rendimiento electroquímico de nanobarras de NiMoO4 y nanoesferas jerárquicas para aplicaciones de supercondensadores". ACS Applied Materials & Interfaces . 5 (24): 12905–12910. doi :10.1021/am403444v. ISSN 1944-8244. PMID 24274769.
- ^ Xia, Xifeng; Lei, Wu; Hao, Qingli; Wang, Wenjuan; Wang, Xin (1 de junio de 2013). "Síntesis en un solo paso de compuestos de CoMoO 4 /grafeno con propiedades electroquímicas mejoradas para supercondensadores". Electrochimica Acta . 99 : 253–261. doi :10.1016/j.electacta.2013.03.131.
- ^ Comité del Consejo Nacional de Investigación (EE. UU.) sobre producción de isótopos médicos sin uranio altamente enriquecido. (2009). "Producción y uso de molibdeno-99/tecnecio-99m". Producción de isótopos médicos sin uranio altamente enriquecido . Washington DC: National Academies Press.
- ^ "ASTM D7126 – 15 Método de prueba estándar para medición colorimétrica en línea de sílice". astm.org .
- ^ McDougall, Raymond (3 de septiembre de 2019). "Aspectos minerales destacados del área de Bancroft, Ontario, Canadá". Rocas y minerales . 94 (5): 408–419. doi :10.1080/00357529.2019.1619134. ISSN 0035-7529. S2CID 201298402.
![(a) Hexamolibdato [Mo6O19]2− (b) Heptamolibdato [Mo7O24]6−](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9c/Polyederstrukturen_Molybd%C3%A4n.png/417px-Polyederstrukturen_Molybd%C3%A4n.png)


![{\displaystyle {\ce {6[MoO4]^2- + 10 HCl -> [Mo6O19]^2- + 10 Cl- + 5 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6c7e460523b6c3300811b23faa0595a372be2c04)


![{\displaystyle {\ce {[Mo2O3(O2)2(H2O)2]^2- <=> [Mo2O3(O2)4(H2O)2]^2-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/75670ef6b00c8c1655975c07b5436ee08ec092fe)
![{\displaystyle {\ce {[NH4]2[MoO4] + 4 H2S -> [NH4]2[MoS4] + 4 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9249a8f52bb6630839661353c724fc6650781ae4)