Micobacteria
| Micobacteria | |
|---|---|
 | |
| Micrografía TEM de M. tuberculosis | |
| Clasificación científica | |
| Dominio: | Bacteria |
| Filo: | Actinomicetos |
| Clase: | Actinomicetos |
| Orden: | Micobacterias |
| Familia: | Micobacterias |
| Género: | Micobacteria Lehmann y Neumann 1896 [1] |
| Especies | |
Más de 190 especies, ver LPSN | |
| Sinónimos [2] | |
| |
Mycobacterium es un género de más de 190 especies en el filo Actinomycetota , al que se le ha asignado su propia familia, Mycobacteriaceae . Este género incluye patógenos que se sabe que causan enfermedades graves en los mamíferos, incluida la tuberculosis ( M. tuberculosis ) y la lepra ( M. leprae ) en humanos. Elprefijo griego myco- significa 'hongo', en alusión alas superficies de las colonias de este género similares a moho . [3] Dado que este género tiene paredes celulares con una capa externa cerosa rica en lípidos que contiene altas concentraciones de ácido micólico, [4] se utiliza la tinción ácido-alcohol resistente para enfatizar su resistencia a los ácidos, en comparación con otros tipos de células. [5]
Las especies de micobacterias son generalmente aeróbicas, inmóviles y capaces de crecer con un mínimo de nutrientes. El género se divide en función de la producción de pigmentos y la tasa de crecimiento de cada especie. [6] Si bien la mayoría de las especies de Mycobacterium no son patógenas, la pared celular compleja característica del género contribuye a la evasión de las defensas del huésped. [7]
Microbiología
Morfología

Las micobacterias son aeróbicas con formas de varilla de 0,2-0,6 μm de ancho y 1,0-10 μm de largo . Generalmente no son móviles , excepto la especie Mycobacterium marinum , que ha demostrado ser móvil dentro de los macrófagos . [8] Las micobacterias poseen cápsulas y la mayoría no forma endosporas . Se ha demostrado que M. marinum y quizás M. bovis esporulan ; [9] sin embargo, esto ha sido cuestionado por investigaciones posteriores. [10] La característica distintiva de todas las especies de Mycobacterium es una pared celular gruesa, hidrófoba y rica en ácido micólico hecha de peptidoglicano y arabinogalactano , con estos componentes únicos que ofrecen objetivos para nuevos medicamentos contra la tuberculosis. [11]
Fisiología
Muchas especies de Mycobacterium crecen fácilmente con nutrientes mínimos, utilizando amoníaco y/o aminoácidos como fuentes de nitrógeno y glicerol como fuente de carbono en presencia de sales minerales. Las temperaturas para un crecimiento óptimo varían entre las especies y las condiciones del medio, y van desde los 25 a los 45 °C. [6]
La mayoría de las especies de Mycobacterium , incluidas la mayoría de las especies clínicamente relevantes, se pueden cultivar en agar sangre . [12] Sin embargo, algunas especies crecen muy lentamente debido a ciclos reproductivos extremadamente largos, como M. leprae que requiere 12 días por ciclo de división en comparación con los 20 minutos de algunas cepas de E. coli . [13]
Ecología
Si bien Mycobacterium tuberculosis y M. leprae son patógenos, la mayoría de las micobacterias no causan enfermedades a menos que entren en las lesiones cutáneas de personas con disfunción pulmonar o inmunológica, a pesar de estar ampliamente distribuidas en entornos acuáticos y terrestres. A través de la formación de biopelículas , la resistencia de la pared celular al cloro y la asociación con amebas , las micobacterias pueden sobrevivir a una variedad de factores estresantes ambientales. El medio de agar utilizado para la mayoría de las pruebas de agua no favorece el crecimiento de las micobacterias, lo que permite que pasen desapercibidas en los sistemas municipales y hospitalarios. [14]
Genómica
Se han secuenciado completamente cientos de genomas de Mycobacterium . [15]
Los tamaños del genoma de las micobacterias varían desde los relativamente pequeños (por ejemplo, en M. leprae ) hasta los bastante grandes, como el de M. vulneris, que codifica 6.653 proteínas, más grandes que las ~6000 proteínas de la levadura eucariota . [16]
| Organismo | Número de genes codificadores de proteínas |
|---|---|
| M. intracelular | 5.289 [17] |
| M. colombiana | 5.084 [18] |
| M. leprae | 1.603 [19] |
| M. tuberculosis | 3.995 [19] |
| M. esmegmatis | 6.602 [20] |
| M. chelonae | 4.948 [21] |
Patogenicidad
Micobacteria tuberculosiscomplejo
Mycobacterium tuberculosis puede permanecer latente en huéspedes humanos durante décadas después de una infección inicial, lo que le permite seguir infectando a otros. Se ha estimado que un tercio de la población mundial tiene tuberculosis (TB) latente. [22] M. tuberculosis tiene muchos factores de virulencia , que pueden dividirse entre el metabolismo de lípidos y ácidos grasos, proteínas de la envoltura celular,inhibidores de macrófagos , proteínas quinasas , proteasas , proteínas transportadoras de metales y reguladores de la expresión génica. [23] Varios linajes como M. t. var. bovis (TB bovina) se consideraron especies separadas en el complejo M. tuberculosis hasta que finalmente se fusionaron en la especie principal en 2018. [24]
Lepra
El desarrollo de la lepra es causado por la infección con Mycobacterium leprae o Mycobacterium lepromatosis , dos bacterias estrechamente relacionadas. Se informan aproximadamente 200.000 nuevos casos de infección cada año, y el 80% de los nuevos casos se informan en Brasil, India e Indonesia. [25] La infección por M. leprae se localiza dentro de los macrófagos de la piel y las células de Schwann que se encuentran en el tejido nervioso periférico.
No tuberculosisMicobacterias
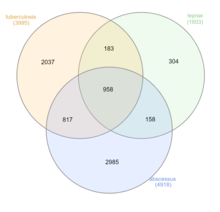
Las micobacterias no tuberculosas (MNT), que excluyen M. tuberculosis , M. leprae y M. lepromatosis, pueden infectar a huéspedes mamíferos. Estas bacterias se conocen como "micobacterias atípicas". Aunque la transmisión de persona a persona es rara, se ha observado la transmisión de M. abscessus entre pacientes con fibrosis quística . [26] Las cuatro enfermedades principales observadas en humanos son la enfermedad pulmonar crónica, la enfermedad diseminada en pacientes inmunodeprimidos, las infecciones de la piel y los tejidos blandos y la linfadenitis superficial. Entre el 80 y el 90 % de las infecciones por MNT registradas se manifiestan como enfermedades pulmonares. [27]
M. abscessus es la micobacteria de crecimiento rápido (MGR) más virulenta, así como la principal causa de infecciones pulmonares basadas en MGR. Aunque tradicionalmente se la ha considerado un patógeno oportunista como otras MNT, el análisis de diversos factores de virulencia (FV) ha cambiado esta visión a la de un verdadero patógeno. Esto se debe a la presencia de FV micobacterianos conocidos y otros FV no micobacterianos encontrados en otros patógenos procariotas. [27]
Factores de virulencia
Las micobacterias tienen paredes celulares con peptidoglicano , arabinogalactano y ácido micólico ; una micomembrana externa cerosa de ácido micólico; y una cápsula más externa de glucanos y proteínas secretadas para la virulencia. Constantemente remodela estas capas para sobrevivir en ambientes estresantes y evitar las defensas inmunes del huésped. Esta estructura de pared celular da como resultado superficies de colonias que se asemejan a hongos, lo que lleva al uso del prefijo griego myco- en el género . [28] Esta estructura única hace que las penicilinas sean ineficaces, requiriendo en su lugar un tratamiento antibiótico con múltiples fármacos: isoniazida para inhibir la síntesis de ácido micólico, rifampicina para interferir con la transcripción, etambutol para obstaculizar la síntesis de arabinogalactano y pirazinamida para impedir la síntesis de coenzima A. [7]
| Organismo | Síntomas comunes de infección | Tratamientos conocidos | Casos reportados (Región, Año) |
|---|---|---|---|
| M. tuberculosis | Fatiga, pérdida de peso, fiebre, hemoptisis, dolor en el pecho. [29] | isoniazida INH, rifampicina, pirazinamida, etambutol. [30] | 1,6 millones (global, 2021) [31] |
| M. leprae M. lepromatosis | Decoloración de la piel, desarrollo de nódulos, piel seca, pérdida de cejas y/o pestañas, entumecimiento, hemorragias nasales, parálisis, ceguera, dolor nervioso. [32] | dapson, rifampicina, clofazimina. [32] | 133.802 (global, 2021) [33] |
| Complejo M. avium | Piel sensible, desarrollo de forúnculos o vesículas llenas de pus, fiebre, escalofríos, dolores musculares. [34] | claritromicina, azitromicina, amikacina, cefoxitina, imipenem. [35] | 3000 (EE.UU., estimación anual ) [36] |
| Complejo M. abscessus | Tos, hemoptisis, fiebre, lesiones cavitarias. [37] | claritromicina, amikacina, cefoxitina, imipenem. [37] | Desconocido |
Historia
| Cladograma de especies clave |
Históricamente, las micobacterias se han categorizado a través de pruebas fenotípicas , como la clasificación de Runyon para analizar la tasa de crecimiento y la producción de pigmentos carotenoides amarillos/anaranjados . El grupo I contiene fotocromógenos (producción de pigmentos inducida por la luz), el grupo II comprende escotocromógenos (producción de pigmentos constitutivos) y los no cromógenos de los grupos III y IV tienen un pigmento amarillo pálido/canela, independientemente de la exposición a la luz. Las especies del grupo IV son micobacterias de "crecimiento rápido" en comparación con las especies del grupo III de "crecimiento lento" porque las muestras se convierten en colonias visibles en menos de siete días. [6]
Debido a que el Código Internacional de Nomenclatura de Procariotas (ICNP) actualmente reconoce 195 especies de Mycobacterium , los sistemas de clasificación e identificación ahora se basan en la secuenciación de ADN y la filogenética computacional . Los principales grupos causantes de enfermedades son el complejo M. tuberculosis ( tuberculosis ), el complejo M. avium ( infección por mycobacterium avium-intracellulare ), M. leprae y M. lepromatosis ( lepra ) y M. abscessus ( infección pulmonar crónica ). [3]
El microbiólogo Enrico Tortoli ha construido un árbol filogenético de las especies clave del género basándose en la secuenciación genética anterior de Rogall et al. (1990), junto con nuevos árboles filogenéticos basados en la secuenciación de Tortoli de 2017 de 148 especies de Mycobacterium : [38]
- Árbol filogenético de los miembros de crecimiento lento del género Mycobacterium
- Árbol filogenético de los miembros de rápido crecimiento del género Mycobacterium , junto con el complejo M. terrae. [39]
Propuesta de división del género
Gupta et al. propusieron dividir Mycobacterium en cinco géneros, basándose en un análisis de 150 especies de este género. Debido a la controversia sobre la complicación de los diagnósticos clínicos y el tratamiento, todas las especies renombradas conservaron su identidad original en el género Mycobacterium como sinónimo taxonómico válido: [40] [41]
- Micobacteria basada en el clado Tuberculosis-Simiae de crecimiento lento
- Mycobacteroides basado en el clado Abscessus-Chelonae de rápido crecimiento
- Mycolicibacillus basado en el clado Triviale de crecimiento lento
- Mycolicibacter basado en el clado Terrae de crecimiento lento
- Mycolicibacterium basado en el clado Fortuitum-Vaccae de rápido crecimiento
Diagnóstico
Los dos métodos más comunes para visualizar estos bacilos acidorresistentes como rojo brillante contra un fondo azul son la tinción de Ziehl-Neelsen y la tinción de Kinyoun modificada . La tinción de Fite se utiliza para colorear las células de M. leprae de rosa contra un fondo azul. La tinción fluorescente de auramina O modificada rápida tiene una unión específica con las micobacterias de crecimiento lento para la tinción amarilla contra un fondo oscuro. Los métodos más nuevos incluyen la tinción de plata Gomori-Metenamina y la tinción de Schiff con ácido perioídico para colorear las células del complejo Mycobacterium avium (MAC) de negro y rosa, respectivamente. [5]
Si bien algunas micobacterias pueden tardar hasta ocho semanas en generar colonias visibles a partir de una muestra cultivada, la mayoría de las especies clínicamente relevantes crecerán dentro de las primeras cuatro semanas, lo que permite a los médicos considerar causas alternativas si las lecturas negativas continúan después del primer mes. [42] Los medios de crecimiento incluyen el medio de Löwenstein-Jensen y el tubo indicador de crecimiento de micobacterias (MGIT).
- Mycobacterium tuberculosis en la tinción de Ziehl-Neelsen
- Tubos inclinados de medio Löwenstein-Jensen. [nota 1]
- Muestras de MGIT que emiten fluorescencia en luz ultravioleta
Micobacteriófagos
Las micobacterias pueden ser infectadas por micobacteriófagos , una clase de virus con alta especificidad para sus objetivos. Al secuestrar la maquinaria celular de las micobacterias para producir fagos adicionales, dichos virus pueden usarse en la terapia con fagos para huéspedes eucariotas, ya que morirían junto con las micobacterias. Dado que solo algunos micobacteriófagos son capaces de penetrar la membrana de M. tuberculosis , el ADN viral puede administrarse a través de liposomas artificiales porque las bacterias absorben, transcriben y traducen el ADN extraño en proteínas. [43]
Micósidos
Los micosidos son glicolípidos aislados de especies de Mycobacterium . El micosido A se encuentra en cepas fotocromogénicas, el micosido B en cepas bovinas y el micosido C en cepas aviares. [44] Diferentes formas del micosido C tienen un éxito variable como receptor para inactivar micobacteriófagos . [45] El reemplazo del gen que codifica la sintasa del ácido micocerósico en M. bovis previene la formación de micosidos. [46]
Notas
- ^ De izquierda a derecha en la imagen de tubos inclinados de medio Löwenstein-Jensen:
- Control negativo
- M. tuberculosis : Colonias de apariencia seca
- Complejo Mycobacterium avium : Colonias de apariencia húmeda
- M. gordonae : Colonias amarillentas
Referencias
- ^ Lehmann KB, Neumann R (1896). Atlas und Grundriss der Bakteriologie und Lehrbuch der speziellen bakteriologischen Diagnostik [ Atlas y esquema de bacteriología y libro de texto de diagnóstico bacteriológico especial ] (1ª ed.). Múnich: JF Lehmann.
- ^ Euzéby JP, Parte AC. "Mycobacterium". Lista de nombres procariotas con posición en la nomenclatura (LPSN) . Consultado el 16 de junio de 2021 .[ enlace muerto permanente ]
- ^ ab Mycobacteria: Health Advisory (PDF) . Agencia de Protección Ambiental (informe). Agosto de 1999.
- ^ Batt SM, Minnikin DE, Besra GS (mayo de 2020). "La gruesa capa cerosa de las micobacterias, una capa protectora contra los antibióticos y el sistema inmunológico del huésped". The Biochemical Journal . 477 (10): 1983–2006. doi :10.1042/BCJ20200194. PMC 7261415 . PMID 32470138.
- ^ ab Pennington KM, Vu A, Challener D, Rivera CG, Shweta FN, Zeuli JD, Temesgen Z (agosto de 2021). "Enfoque para el diagnóstico y tratamiento de la enfermedad micobacteriana no tuberculosa". Revista de tuberculosis clínica y otras enfermedades micobacterianas . 24 : 100244. doi :10.1016/j.jctube.2021.100244. PMC 8135042. PMID 34036184 .
- ^ abc Forbes BA, Hall GS, Miller MB, Novak SM, Rowlinson MC, Salfinger M, et al. (abril de 2018). "Orientación práctica para laboratorios de microbiología clínica: micobacterias". Clinical Microbiology Reviews . 31 (2): e00038–17. doi :10.1128/CMR.00038-17. PMC 5967691 . PMID 29386234.
- ^ ab Dulberger CL, Rubin EJ, Boutte CC (enero de 2020). "La envoltura celular micobacteriana: un objetivo en movimiento". Nature Reviews. Microbiología . 18 (1): 47–59. doi :10.1038/s41579-019-0273-7. PMID 31728063. S2CID 208020338.
- ^ Stamm LM, Morisaki JH, Gao LY, Jeng RL, McDonald KL, Roth R, et al. (noviembre de 2003). "Mycobacterium marinum escapa de los fagosomas y es impulsado por la motilidad basada en actina". The Journal of Experimental Medicine . 198 (9): 1361–1368. doi :10.1084/jem.20031072. PMC 2194249 . PMID 14597736.
- ^ Ghosh J, Larsson P, Singh B, Pettersson BM, Islam NM, Sarkar SN, et al. (junio de 2009). "Esporulación en micobacterias". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 106 (26): 10781–10786. Bibcode :2009PNAS..10610781G. doi : 10.1073/pnas.0904104106 . PMC 2705590 . PMID 19541637.
- ^ Traag BA, Driks A, Stragier P, Bitter W, Broussard G, Hatfull G, et al. (enero de 2010). "¿Las micobacterias producen endosporas?". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 107 (2): 878–881. Bibcode :2010PNAS..107..878T. doi : 10.1073/pnas.0911299107 . PMC 2818926. PMID 20080769 .
- ^ Bhamidi S (2009). "Arabinogalactano de la pared celular micobacteriana". Polisacáridos bacterianos: innovaciones actuales y tendencias futuras . Caister Academic Press. ISBN 978-1-904455-45-5.
- ^ Lagier JC, Edouard S, Pagnier I, Mediannikov O, Drancourt M, Raoult D (enero de 2015). "Estrategias actuales y pasadas para el cultivo bacteriano en microbiología clínica". Clinical Microbiology Reviews . 28 (1): 208–236. doi :10.1128/CMR.00110-14. PMC 4284306 . PMID 25567228.
- ^ Shepard CC, Mcrae DH (febrero de 1965). "Mycobacterium leprae en ratones: dosis infecciosa mínima, relación entre la calidad de la tinción y la infectividad, y efecto de la cortisona". Journal of Bacteriology . 89 (2): 365–372. doi :10.1128/jb.89.2.365-372.1965. PMC 305516 . PMID 14255702.
- ^ Vaerewijck MJ, Huys G, Palomino JC, Swings J, Portaels F (noviembre de 2005). "Micobacterias en sistemas de distribución de agua potable: ecología y significado para la salud humana". FEMS Microbiology Reviews . 29 (5): 911–934. doi : 10.1016/j.femsre.2005.02.001 . PMID 16219512.
- ^ "JGI GOLD | Proyectos". gold.jgi.doe.gov . Consultado el 13 de mayo de 2023 .
- ^ Croce O, Robert C, Raoult D, Drancourt M (mayo de 2014). "Borrador de la secuencia del genoma de Mycobacterium vulneris DSM 45247T". Anuncios del genoma . 2 (3). doi :10.1128/genomeA.00370-14. PMC 4014686 . PMID 24812218.
- ^ "UniProt". www.uniprot.org . Consultado el 7 de mayo de 2023 .
- ^ "UniProt". www.uniprot.org . Consultado el 7 de mayo de 2023 .
- ^ ab "UniProt". www.uniprot.org . Consultado el 7 de mayo de 2023 .
- ^ "UniProt". www.uniprot.org . Consultado el 7 de mayo de 2023 .
- ^ "UniProt". www.uniprot.org . Consultado el 7 de mayo de 2023 .
- ^ Getahun H, Matteelli A, Chaisson RE, Raviglione M (mayo de 2015). "Infección latente por Mycobacterium tuberculosis". La Revista de Medicina de Nueva Inglaterra . 372 (22): 2127–2135. doi :10.1056/NEJMra1405427. PMID 26017823.
- ^ Forrellad MA, Klepp LI, Gioffré A, Sabio y García J, Morbidoni HR, de la Paz Santangelo M, et al. (Enero de 2013). "Factores de virulencia del complejo Mycobacterium tuberculosis". Virulencia . 4 (1): 3–66. doi :10.4161/viru.22329. PMC 3544749 . PMID 23076359.
- ^ Riojas, Marco A.; McGough, Katya J.; Rider-Riojas, Cristin J.; Rastogi, Nalin; Hazbón, Manzour Hernando (1 de enero de 2018). "El análisis filogenómico de las especies del complejo Mycobacterium tuberculosis demuestra que Mycobacterium africanum, Mycobacterium bovis, Mycobacterium caprae, Mycobacterium microti y Mycobacterium pinnipedii son sinónimos heterotípicos posteriores de Mycobacterium tuberculosis". Revista Internacional de Microbiología Sistemática y Evolutiva . 68 (1): 324–332. doi : 10.1099/ijsem.0.002507 . PMID 29205127.
- ^ Sugawara-Mikami M, Tanigawa K, Kawashima A, Kiriya M, Nakamura Y, Fujiwara Y, Suzuki K (diciembre de 2022). "Patogenicidad y virulencia de Mycobacterium leprae". Virulencia . 13 (1): 1985-2011. doi :10.1080/21505594.2022.2141987. PMC 9635560 . PMID 36326715.
- ^ "Infecciones por micobacterias no tuberculosas (MNT) | HAI | CDC". www.cdc.gov . 2019-08-12 . Consultado el 2023-04-28 .
- ^ ab To K, Cao R, Yegiazaryan A, Owens J, Venketaraman V (agosto de 2020). "Descripción general de los patógenos oportunistas de micobacterias no tuberculosas: Mycobacterium avium y Mycobacterium abscessus". Revista de medicina clínica . 9 (8): 2541. doi : 10.3390/jcm9082541 . PMC 7463534 . PMID 32781595.
- ^ "Mycobacteria: Health Advisory EPA-822-B-01-007" (PDF) . epa.gov . Agencia de Protección Ambiental de los Estados Unidos (EPA). Agosto de 1999. p. 2 . Consultado el 10 de marzo de 2023 .
- ^ "Hojas informativas | General | Tuberculosis: Información general | TB | CDC". www.cdc.gov . 2022-08-17 . Consultado el 2023-04-25 .
- ^ "Diagnóstico y tratamiento de la tuberculosis". Asociación Estadounidense del Pulmón . Consultado el 25 de abril de 2023 .
- ^ "Informe mundial sobre la tuberculosis 2022". www.who.int . Consultado el 7 de mayo de 2023 .
- ^ ab "Signos y síntomas | Enfermedad de Hansen (lepra) | CDC". www.cdc.gov . 2018-10-22 . Consultado el 2023-04-25 .
- ^ "Actualización mundial sobre la lepra (enfermedad de Hansen), 2021: hacia la interrupción de la transmisión". www.who.int . Consultado el 7 de mayo de 2023 .
- ^ "Mycobacterium abscessus en entornos de atención médica | HAI | CDC". www.cdc.gov . 2021-11-15 . Consultado el 2023-04-27 .
- ^ Weng YW, Huang CK, Sy CL, Wu KS, Tsai HC, Lee SS (junio de 2020). "Tratamiento de la enfermedad pulmonar causada por el complejo Mycobacterium abscessus". Revista de la Asociación Médica de Formosa = Taiwan Yi Zhi . Declaración de consenso sobre la enfermedad pulmonar causada por micobacterias no tuberculosas en Taiwán. 119 (Supl. 1): S58–S66. doi : 10.1016/j.jfma.2020.05.028 . PMID 32527504. S2CID 219604813.
- ^ Scholar E (1 de enero de 2007), Enna SJ, Bylund DB (eds.), "Infecciones por Mycobacterium avium-Intracellulare", xPharm: The Comprehensive Pharmacology Reference , Nueva York: Elsevier, págs. 1-5, doi :10.1016/b978-008055232-3.60891-8, ISBN 978-0-08-055232-3, consultado el 7 de mayo de 2023
- ^ ab Huang YC, Liu MF, Shen GH, Lin CF, Kao CC, Liu PY, Shi ZY (octubre de 2010). "Resultado clínico de la infección por Mycobacterium abscessus y pruebas de susceptibilidad a los antimicrobianos". Revista de microbiología, inmunología e infecciones = Wei Mian Yu Gan Ran Za Zhi . 43 (5): 401–406. doi :10.1016/S1684-1182(10)60063-1. PMID 21075707.
- ^ Tortoli E (10 de enero de 2019). "Capítulo 1 - La taxonomía del género Mycobacterium". En Velayati AA, Farnia P (eds.). Micobacterias no tuberculosas (MNT) . Academic Press. págs. 1–10. doi :10.1016/B978-0-12-814692-7.00001-2. ISBN 978-0-12-814692-7.S2CID 92810288 .
- ^ Tortoli E, Fedrizzi T, Meehan CJ, Trovato A, Grottola A, Giacobazzi E, et al. (diciembre de 2017). "La nueva filogenia del género Mycobacterium: lo antiguo y lo nuevo". Infección, genética y evolución . 56 : 19–25. Bibcode :2017InfGE..56...19T. doi :10.1016/j.meegid.2017.10.013. PMID 29030295.
- ^ Gupta RS, Lo B, Son J (2018). "La filogenómica y los estudios genómicos comparativos respaldan firmemente la división del género Mycobacterium en un género Mycobacterium modificado y cuatro géneros nuevos". Frontiers in Microbiology . 9 : 67. doi : 10.3389/fmicb.2018.00067 . PMC 5819568 . PMID 29497402.
- ^ Tortoli E, Brown-Elliott BA, Chalmers JD, Cirillo DM, Daley CL, Emler S, et al. (julio de 2019). "La misma carne, diferente salsa: ignore los nuevos nombres de las micobacterias". The European Respiratory Journal . 54 (1): 1900795. doi : 10.1183/13993003.00795-2019 . PMID 31296783.
- ^ Ogwang S, Mubiri P, Bark CM, Joloba ML, Boom WH, Johnson JL (octubre de 2015). "Tiempo de incubación de cultivos de esputo del complejo Mycobacterium tuberculosis en BACTEC MGIT 960: 4 semanas de cultivo negativo son suficientes para que los médicos consideren diagnósticos alternativos". Microbiología diagnóstica y enfermedades infecciosas . 83 (2): 162–164. doi :10.1016/j.diagmicrobio.2015.07.002. PMC 4573350 . PMID 26239846.
- ^ Azimi T, Mosadegh M, Nasiri MJ, Sabour S, Karimaei S, Nasser A (17 de septiembre de 2019). "La terapia con fagos como un enfoque terapéutico renovado para las infecciones por micobacterias: una revisión exhaustiva". Infección y resistencia a fármacos . 12 : 2943–2959. doi : 10.2147/IDR.S218638 . PMC 6756577 . PMID 31571947.
- ^ Smith DW, Randall HM, Maclennan AP, Lederer E (junio de 1960). "Micósidos: una nueva clase de glicolípidos específicos de tipo de micobacterias". Nature . 186 (4728): 887–888. Bibcode :1960Natur.186..887S. doi :10.1038/186887a0. PMID 13831939. S2CID 4149360.
- ^ Goren MB, McClatchy JK, Martens B, Brokl O (junio de 1972). "Micósidos C: comportamiento como sustancia del sitio receptor para el micobacteriófago D4". Journal of Virology . 9 (6): 999–1003. doi :10.1128/jvi.9.6.999-1003.1972. PMC 356406 . PMID 4113889.
- ^ Azad AK, Sirakova TD, Rogers LM, Kolattukudy PE (mayo de 1996). "El reemplazo dirigido del gen de la sintetasa del ácido micocerósico en Mycobacterium bovis BCG produce un mutante que carece de micosidos". Actas de la Academia Nacional de Ciencias de los Estados Unidos de América . 93 (10): 4787–4792. Bibcode :1996PNAS...93.4787A. doi : 10.1073/pnas.93.10.4787 . PMC 39357 . PMID 8643481.
Enlaces externos
- Centro de recursos de bioinformática bacteriana y viral: genomas, proteínas, epítopos y vías de las micobacterias
- Manual Merck - Micobacterias
- Mycobrowser: base de datos genómica y proteómica de micobacterias patógenas
- CDC - Infecciones por micobacterias no tuberculosas (MNT)
- PRASITE: Identificación de micobacterias
- Consorcio de Genómica Estructural de la Tuberculosis

![Árbol filogenético de los miembros de rápido crecimiento del género Mycobacterium, junto con el complejo M. terrae.[39]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/b5/Phylogentic_Tree_of_Rapidly-Growing_Mycobacterium_Tortoli_2017.png/291px-Phylogentic_Tree_of_Rapidly-Growing_Mycobacterium_Tortoli_2017.png)

![Tubos inclinados de medio Löwenstein-Jensen.[nota 1]](http://upload.wikimedia.org/wikipedia/commons/thumb/4/4a/Slant_tubes_of_Löwenstein-Jensen_medium_with_control,_M_tuberculosis,_M_avium_and_M_gordonae.jpg/440px-Slant_tubes_of_Löwenstein-Jensen_medium_with_control,_M_tuberculosis,_M_avium_and_M_gordonae.jpg)
_samples_in_ultraviolet_light.jpg/440px-Mycobacteria_Growth_Indicator_Tube_(MGIT)_samples_in_ultraviolet_light.jpg)