2-Metilpiridina
| |||
| Nombres | |||
|---|---|---|---|
| Nombre IUPAC preferido 2-Metilpiridina | |||
| Otros nombres 2-Picolina | |||
| Identificadores | |||
Modelo 3D ( JSmol ) |
| ||
| EBICh | |||
| Araña química | |||
| Tarjeta informativa de la ECHA | 100.003.313 | ||
Identificador de centro de PubChem |
| ||
| UNIVERSIDAD | |||
Panel de control CompTox ( EPA ) |
| ||
| |||
| Propiedades | |||
| C6H7N | |||
| Masa molar | 93,13 g/mol | ||
| Apariencia | Líquido transparente de color verde amarillento pálido | ||
| Densidad | 0,943 g/ml | ||
| Punto de fusión | -70 °C (-94 °F; 203 K) | ||
| Punto de ebullición | 128 a 129 °C (262 a 264 °F; 401 a 402 K) | ||
| Miscible | |||
| -60,3·10 −6 cm3 / mol | |||
Salvo que se indique lo contrario, los datos se proporcionan para los materiales en su estado estándar (a 25 °C [77 °F], 100 kPa). | |||
La 2-metilpiridina , o 2-picolina , es un compuesto descrito con la fórmula C6H7N . La 2 - picolina es un líquido incoloro que tiene un olor desagradable similar al de la piridina . Se utiliza principalmente para fabricar vinilpiridina y el agroquímico nitrapirina . [1]
Síntesis
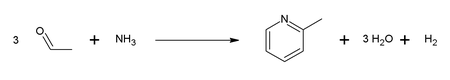
La 2-picolina fue el primer compuesto de piridina aislado en forma pura. Fue aislada del alquitrán de hulla en 1846 por T. Anderson. [2] Esta química fue practicada por Reilly Industries. [3] Actualmente se produce principalmente por dos vías principales. Un método implica la condensación de acetaldehído y amoníaco en presencia de un catalizador de óxido. Este método produce una mezcla de 2- y 4-picolinas:
Otro método consiste en la condensación de acetona y acrilonitrilo para formar 5-oxohexanonitrilo, que luego se cicla para formar 2-picolina. En 1989 se produjeron aproximadamente 8000 t/a en todo el mundo. [1]
Reacciones
La mayoría de las reacciones de la picolina se centran en el grupo metilo. Por ejemplo, el uso principal de la 2-picolina es como precursor de la 2-vinilpiridina . La conversión se logra por condensación con formaldehído :
El copolímero de 2-vinilpiridina, butadieno y estireno se utiliza como adhesivo para cordones textiles para neumáticos. La 2-picolina también es un precursor del agroquímico nitrapirina , que evita la pérdida de amoníaco de los fertilizantes. La oxidación con permanganato de potasio produce ácido picolínico : [1]
El tratamiento de 2-metilpiridina con butillitio da como resultado la desprotonación del grupo metilo: [4]
- H 3 CC 5 H 4 N + BuLi → LiH 2 CC 5 H 4 N + BuH
Biodegradación
Al igual que otros derivados de piridina, la 2-metilpiridina suele ser considerada un contaminante ambiental asociado con instalaciones que procesan esquisto bituminoso o carbón, y también se ha encontrado en sitios de tratamiento de madera antiguos. El compuesto es fácilmente degradable por ciertos microorganismos, como la cepa R1 de Arthrobacter sp. (cepa número 49987 de la ATTC), que se aisló de un acuífero contaminado con una mezcla compleja de derivados de piridina. [5] Arthrobacter y Actinomycetota , estrechamente relacionados, se encuentran a menudo asociados con la degradación de derivados de piridina y otros compuestos heterocíclicos de nitrógeno. La 2-metilpiridina y la 4-metilpiridina se degradan más fácilmente y exhiben una menor pérdida por volatilización de las muestras ambientales que la 3-metilpiridina. [6]
Usos
La 2-metilpiridina es un intermedio utilizado en la producción de algunos medicamentos farmacéuticos, incluidos amprolio , picoplatino , dimetindeno y encainida . [1]
Toxicidad
Como la mayoría de las alquilpiridinas, la DL50 de la 2-metilpiridina es modesta, siendo 790 mg/kg (oral, rata).
Referencias
- ^ abcd Shimizu, S.; Watanabe, N.; Kataoka, T.; Shoji, T.; Abe, N.; Morishita, S.; Ichimura, H. "Piridina y derivados de piridina". Ullmann's Encyclopedia of Industrial Chemistry . Weinheim: Wiley-VCH. doi :10.1002/14356007.a22_399. ISBN 978-3527306732.
- ^ Anderson, T. (1846). "Sobre la constitución y propiedades de la picolina, una nueva base orgánica a partir del alquitrán de hulla" (Texto completo gratuito en Google Books ) . Edinburgh New Phil. J. XLI : 146–156, 291–300.
- ^ Beck, Bill (1996). Buena química: la historia de PC Reilly y Reilly Industries . Indianápolis, EE. UU.: Design Printing Company.
- ^ Stephanie Ganss; Julia Pedronl; Alexandre Lumbroso; Günther Leonhardt-Lutterbeck; Antje Meißner; Siping Wei; Hans-Joachim Drexler; Detlef Heller; Bernhard Breit (2016). "Adición catalizada por rodio de ácidos carboxílicos a alquinos terminales hacia ésteres Z-enólicos". Org. Synth . 93 : 367–384. doi : 10.15227/orgsyn.093.0367 .
- ^ O'Loughlin, EJ, GK Sims y SJ Traina. 1999. Biodegradación de 2-metil, 2-etil y 2-hidroxipiridina por una especie de Arthrobacter aislada de sedimentos subterráneos. Biodegradación 10:93-104.
- ^ Sims, GK; LE Sommers (1985). "Biodegradación de derivados de piridina en suspensiones de suelo". Toxicología y química ambiental . 5 (6): 503–509. doi :10.1002/etc.5620050601.